Похожие презентации:
Предельные одноатомные спирты
1.
Раздел: Кислородсодержащие соединенияТема: Предельные одноатомные спирты
2.
3.
1. Состав, строение молекулыH
H
H
C
C
H
OH
H
C2 H5 OH
C2 H6
2. Определение
Предельные одноатомные спирты –
производные предельных углеводородов,
в молекулах которых один атом водорода
замещён на гидроксильную группу.
Запомните! Атомность спиртов определяется числом групп – ОН
4.
Гидроксильная группаявляется функциональной группой спиртов!
Функциональная группа – группа атомов,
которая обусловливает характерные
химические свойства вещества
5.
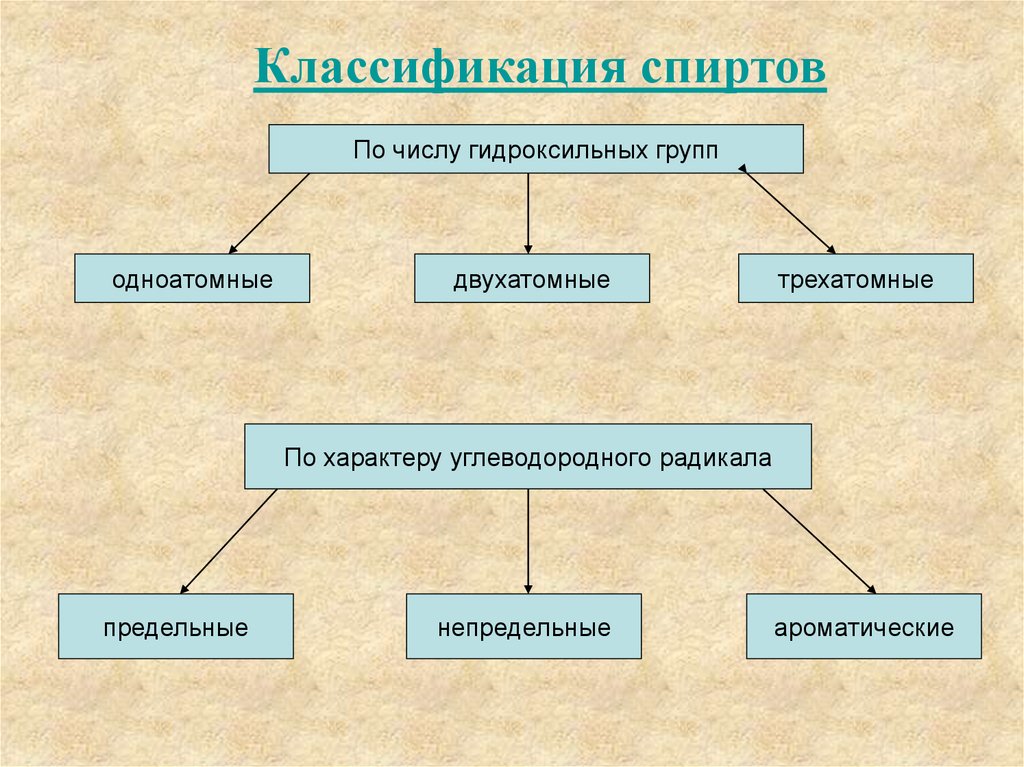
Классификация спиртовПо числу гидроксильных групп
одноатомные
двухатомные
трехатомные
По характеру углеводородного радикала
предельные
непредельные
ароматические
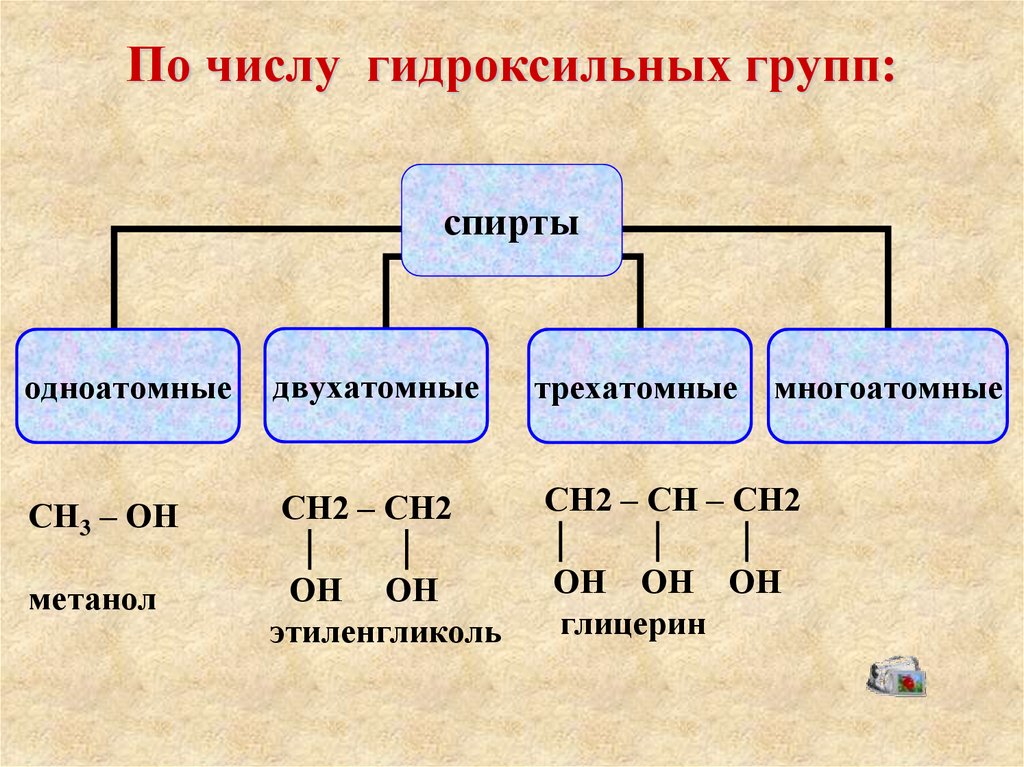
6. По числу гидроксильных групп:
спиртыодноатомные
двухатомные
СН3 – ОН
СН2 – СН2
метанол
ОН ОН
этиленгликоль
трехатомные
многоатомные
СН2 – СН – СН2
ОН ОН ОН
глицерин
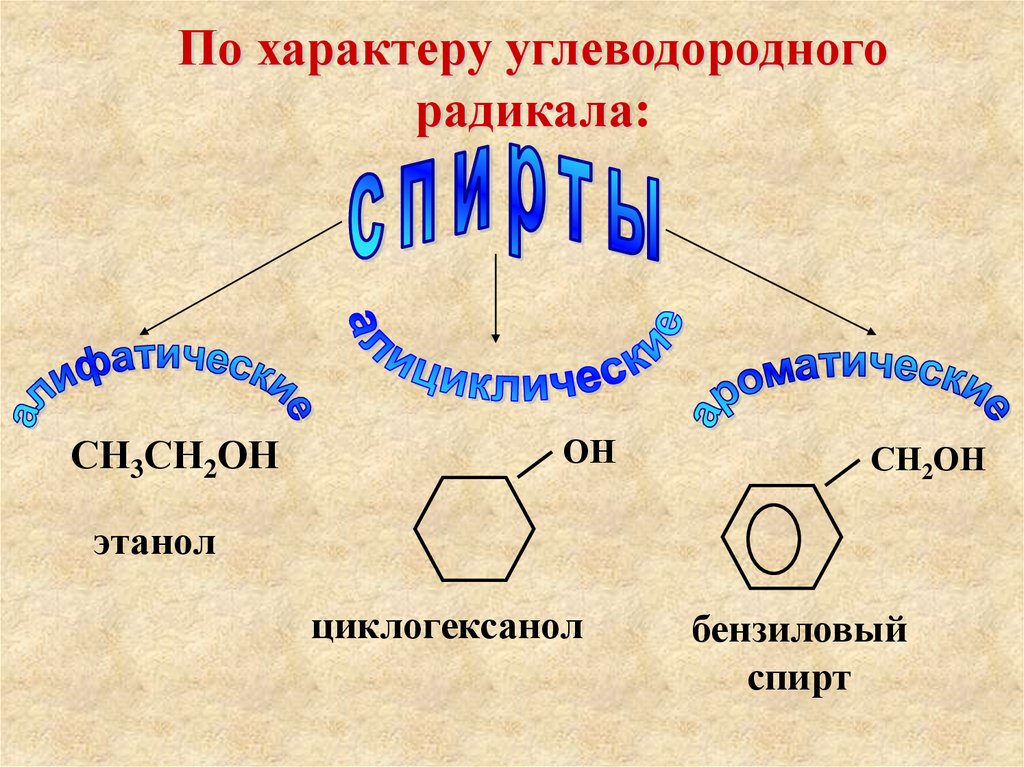
7. По характеру углеводородного радикала:
СН3СН2ОНОН
СН2ОН
этанол
циклогексанол
бензиловый
спирт
8.
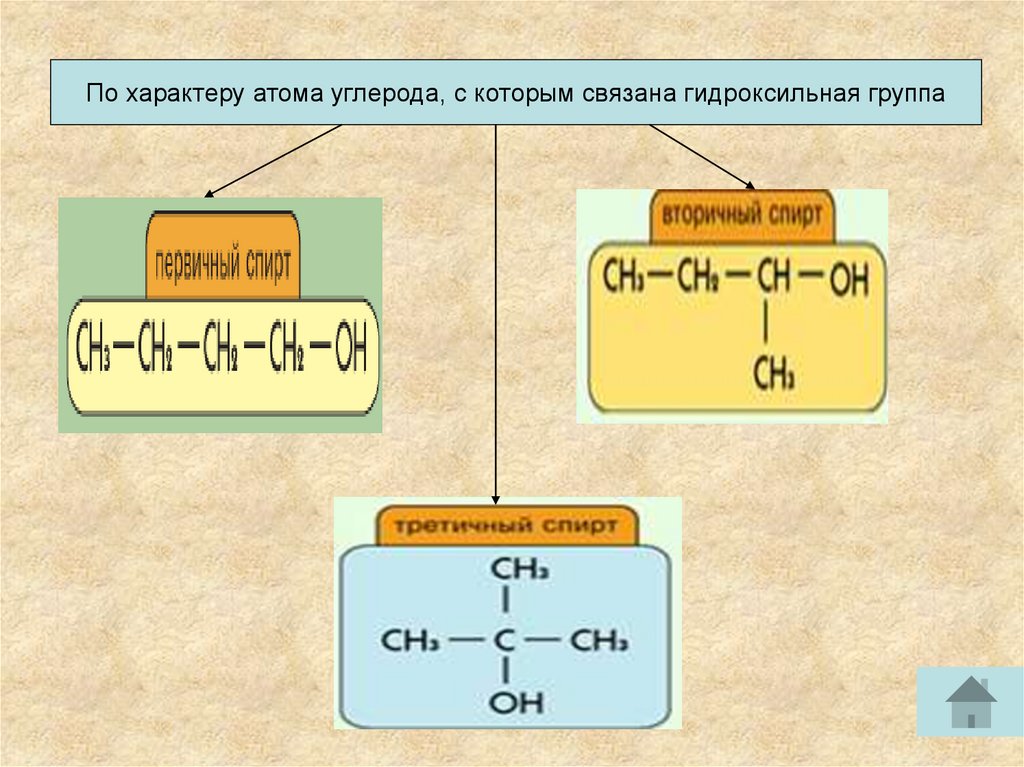
По характеру атома углерода, с которым связана гидроксильная группа9.
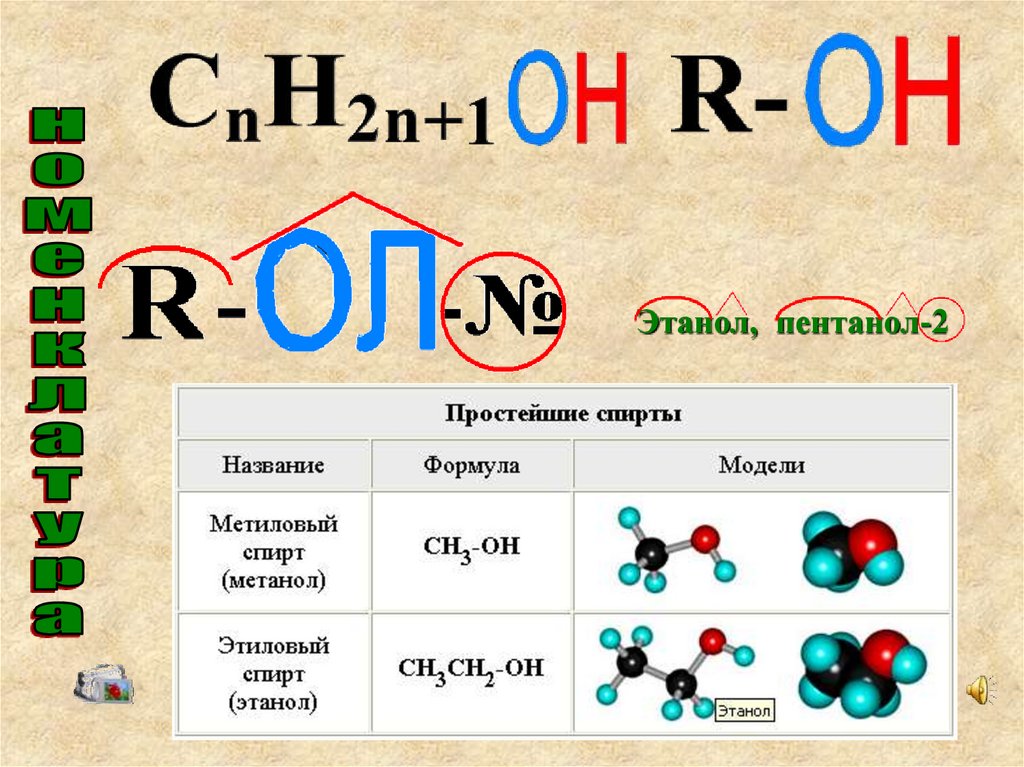
4. Гомологический ряд спиртовОбщая формула ряда: СnH2n+1OH,
CH3OH
метанол
C2H5OH
этанол
C3H7OH
пропанол
C4H9OH
бутанол
C5H11OH
пентанол
R – OH
10.
Этанол, пентанол-211.
3. НоменклатураНазвания спиртов образуют от соответствующих алканов
добавлением суффикса – ол.
Например: метан
– метанол, пропан - пропанол
Нумерацию атомов углерода начинают с того конца
молекулы, где ближе функциональная группа, в конце
цифрой указывают положение функциональной
группы
3
2
1
СН3 – СН – СН2 ОН
СН3
2-метил пропанол -1
12.
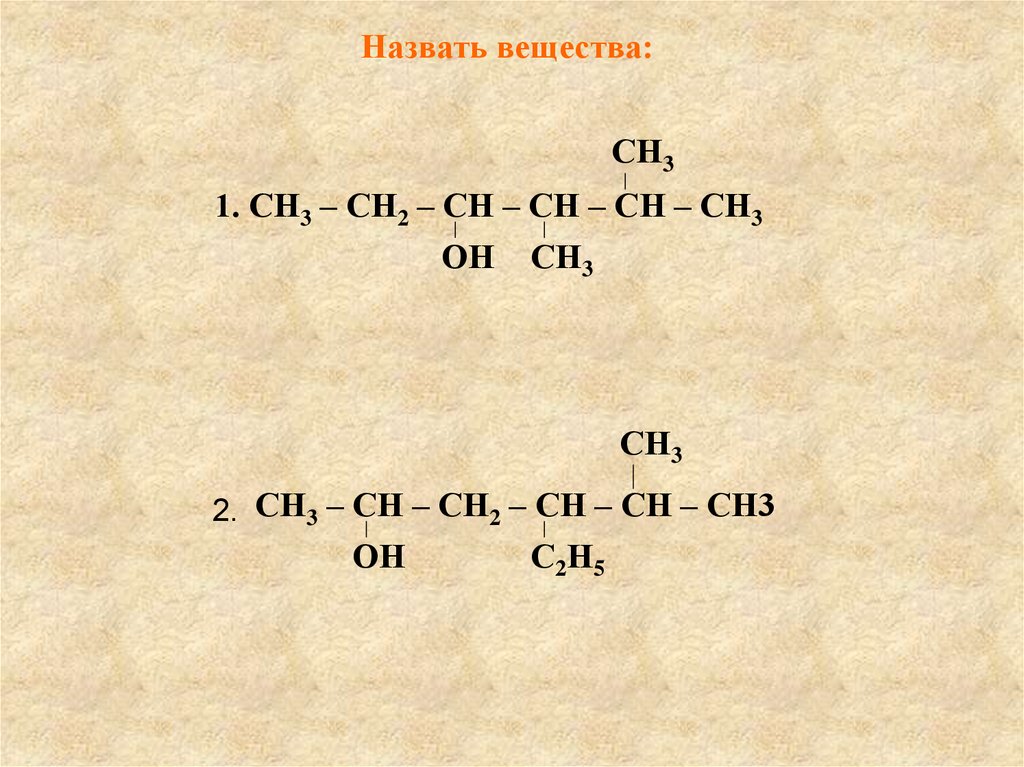
Назвать вещества:СН3
1. СН3 – СН2 – СН – СН – СН – СН3
ОН СН3
СН3
2. СН3 – СН – СН2 – СН – СН – СН3
ОН
С2Н5
13.
Назвать вещество:СН3
C2H5
1. CH3 – CH – CH – C – CH2 – CH – CH – CН – CH – CH3
OH CH3 C2H5
С4Н9 С3Н7
СН3
14.
Составить формулу:2-метил-3-этилпентанола-2
1
С Н3–
СН3
2
С –
СН –
ОН
С2Н5
3
4
СН2–
Составить формулу:
1). 2,4-диметил-3-этилгексанола-2
2). 2, 2-диметил-3-этилбутанола-1
5
СН3
15.
5. ИзомерияДля спиртов характерна структурная изомерия:
1. изомерия
1
1.
положения ОН-группы (начиная с С3);
2
3
СН2 – СН2 – СН3
ОН
пропанол - 1
1
2.
2
3
СН3 – СН – СН3
ОН
пропанол-2
16.
2. Изомерия углеродной цепи (начиная с С4)1
2
3
4
СН3 – СН – СН2 – СН3
ОН
бутанол - 2
СН3
1
2
3
СН3 – СН – СН3
ОН
2-метилпропанол-2
Составить 3 изомера гексанола-2
17.
6. Физические свойстваС1 –С11 – при
обычных условиях жидкости,
с резким запахом, хорошо растворимы в
воде,
С12 – твёрдые вещества, без запаха, не
растворимы в воде.
Среди спиртов нет газообразных веществ,
благодаря наличию между их молекулами
водородных связей
18.
Физические свойства гомологического рядаC1 C3
Имеют специфический алкогольный
запах, хорошо растворимы в воде
C4 C5
C6 C11
Имеют сладковатый, удушливый
запах, плохо растворимы в воде
c
Имеют неприятный запах
C8 Не растворяются в воде
c C12 Спирты являются твердыми, без
запаха, нерастворимы
19.
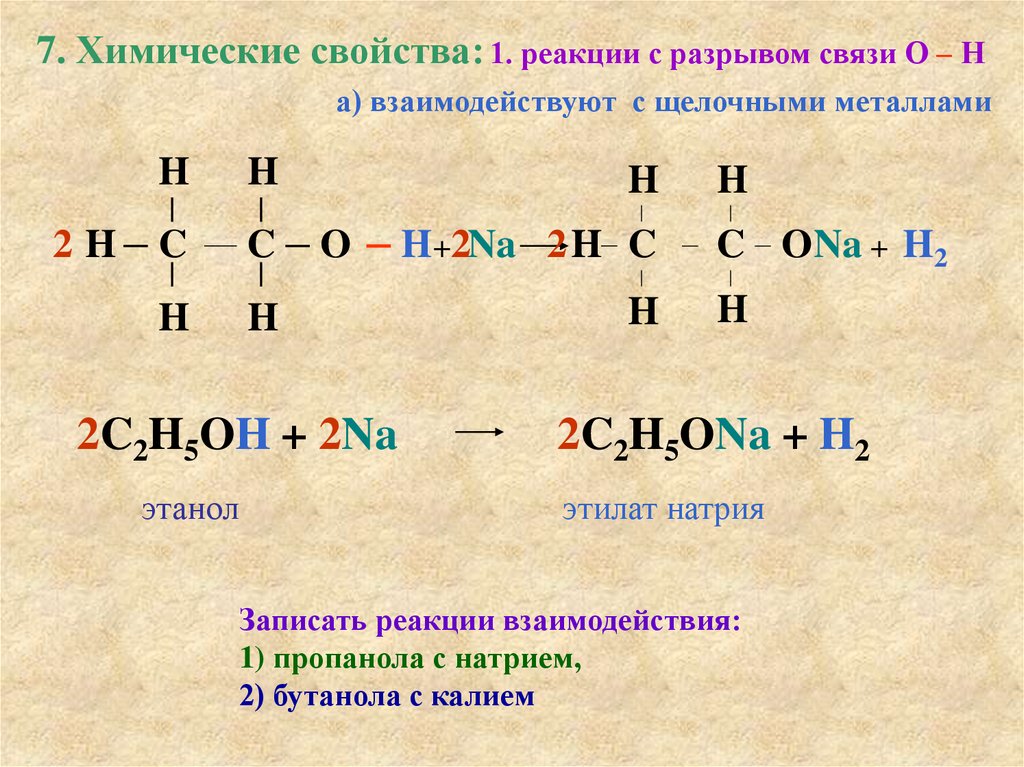
7. Химические свойства: 1. реакции с разрывом связи О – На) взаимодействуют с щелочными металлами
2H
H
H
C
C
H
H
H
O
2C2H5OH + 2Na
этанол
H +2Na 2 H C
H
H
C ONa + H2
H
2C2H5ONa + H2
этилат натрия
Записать реакции взаимодействия:
1) пропанола с натрием,
2) бутанола с калием
20.
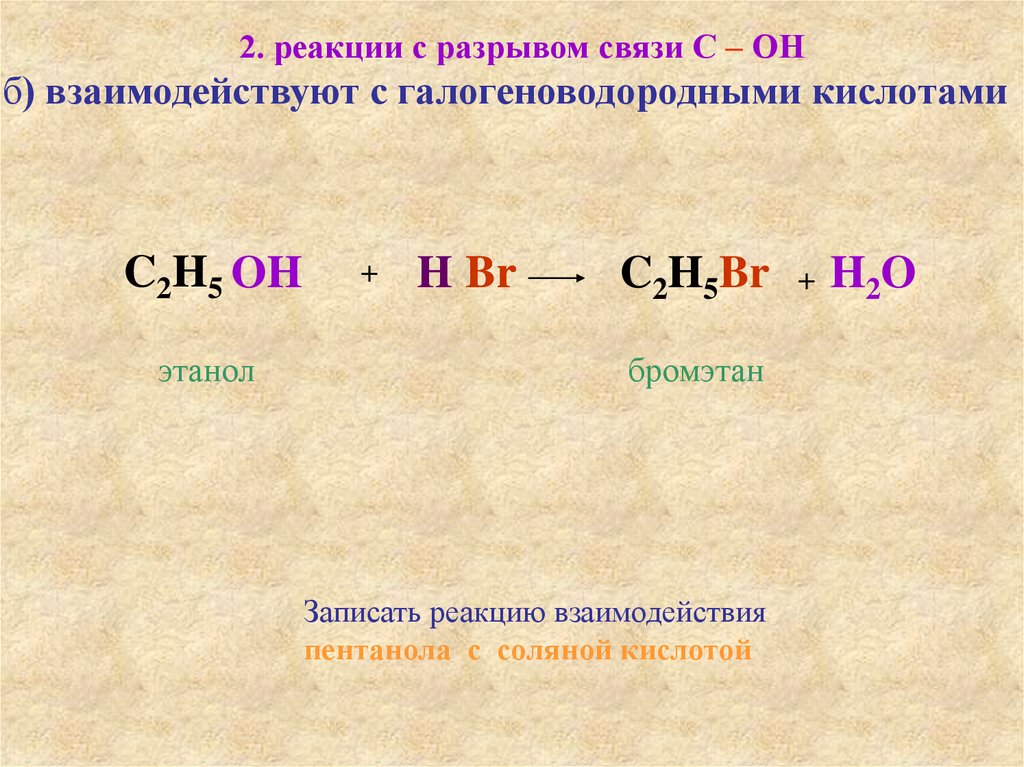
2. реакции с разрывом связи С – ОНб) взаимодействуют с галогеноводородными кислотами
C2H5 OH
этанол
+
H Br
C2H5Br
бромэтан
Записать реакцию взаимодействия
пентанола с соляной кислотой
+
H2O
21.
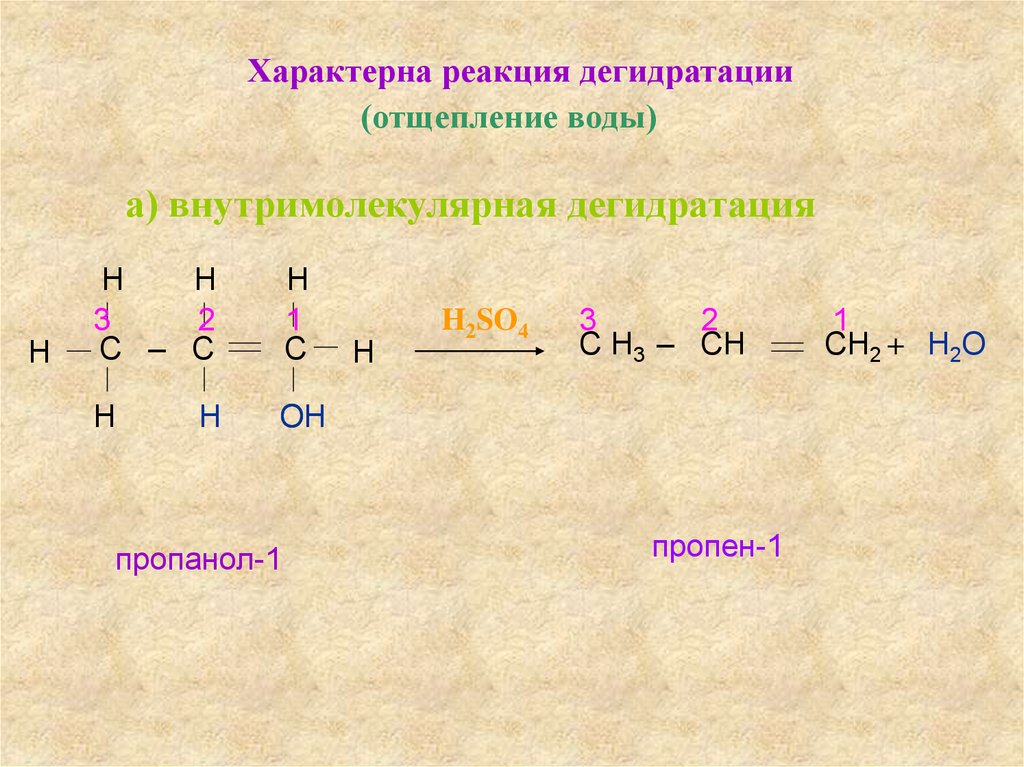
Характерна реакция дегидратации(отщепление воды)
а) внутримолекулярная дегидратация
Н
Н
Н
3
2
С – С
Н
1
С
Н
ОН
Н
пропанол-1
Н
H2SO4
3
2
С Н3 – СН
пропен-1
1
СН2 + Н2О
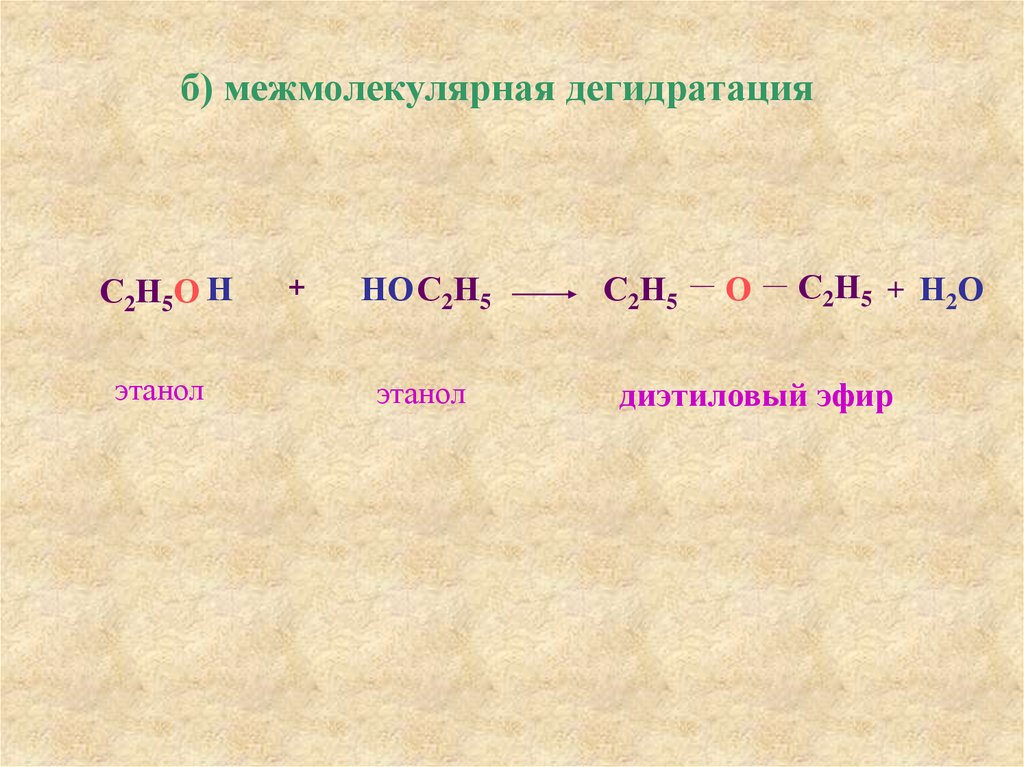
22.
б) межмолекулярная дегидратацияС2Н5О Н
этанол
+
НОС2Н5
этанол
С2Н5
О
С2Н5 + Н2О
диэтиловый эфир
23.
Характерна реакция окисления (горения)С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374кДж
24.
Взаимодействие спирта с оксидом меди(II)t
C2H5OH + CuO
Этанол
CH3 – C
O
+ Cu + H2O
H
Уксусный альдегид
25.
Реакция этерификации(от лат. ester –эфир) – образование сложных эфиров.
O
t,H2SO4
R - OH + HO - C – R|
О
H2O + R - O - C – R|
сложный эфир
26.
Получение спиртов1. Гидратацией алкенов:
СН2 = СН2 + Н2О
СН3 – СН2 – ОН
2. В результате брожения сахаристых веществ
С6Н12О6
С2Н5ОН
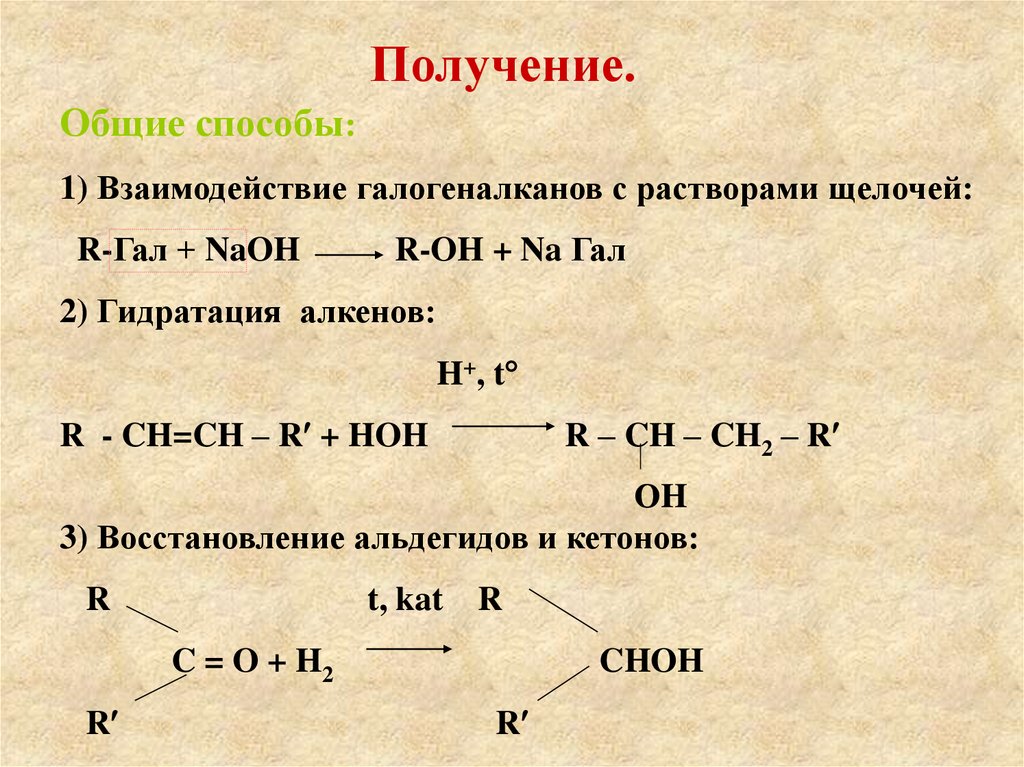
27. Получение.
Общие способы:1) Взаимодействие галогеналканов с растворами щелочей:
R-Гал + NaOH
R-OH + Na Гал
2) Гидратация алкенов:
H+, t
R - CH=CH – R + HOH
R – CH – CH2 – R
ОH
3) Восстановление альдегидов и кетонов:
R
t, kat
R
C = O + H2
R
CHOH
R
28. Получение
Частные способы.Метанол получают из синтез – газа.
t, P, ZnO
CO + 2H2
CH3OH
29.
8. Применение стр.120Метанол (метиловый спирт) CH3OH
В производстве формальдегида, муравьиной кислоты;
как растворитель.
Этанол (этиловый спирт) С2Н5ОН
В производстве ацетальдегида, уксусной кислоты,
бутадиена, простых и сложных эфиров;
как растворитель для красителей, лекарственных и
парфюмерных средств;
в производстве ликеро-водочных изделий;
как дезинфицирующее средство в медицине;
горючее для двигателей, добавка к моторным топливам
30. Применение
CH3OHПроизводство формальдегида,
медикаментов.
C2H5OH
Получение уксусной кислоты,
медикаментов, красителей,
растворителей, горючего для
двигателей и т.д.
C5H11OH
В парфюмерии ; как реагент для
определения жирности молочных
продуктов.
C16 – C20
Антикоррозийные смазки
C18 – C20
Медицинские препараты
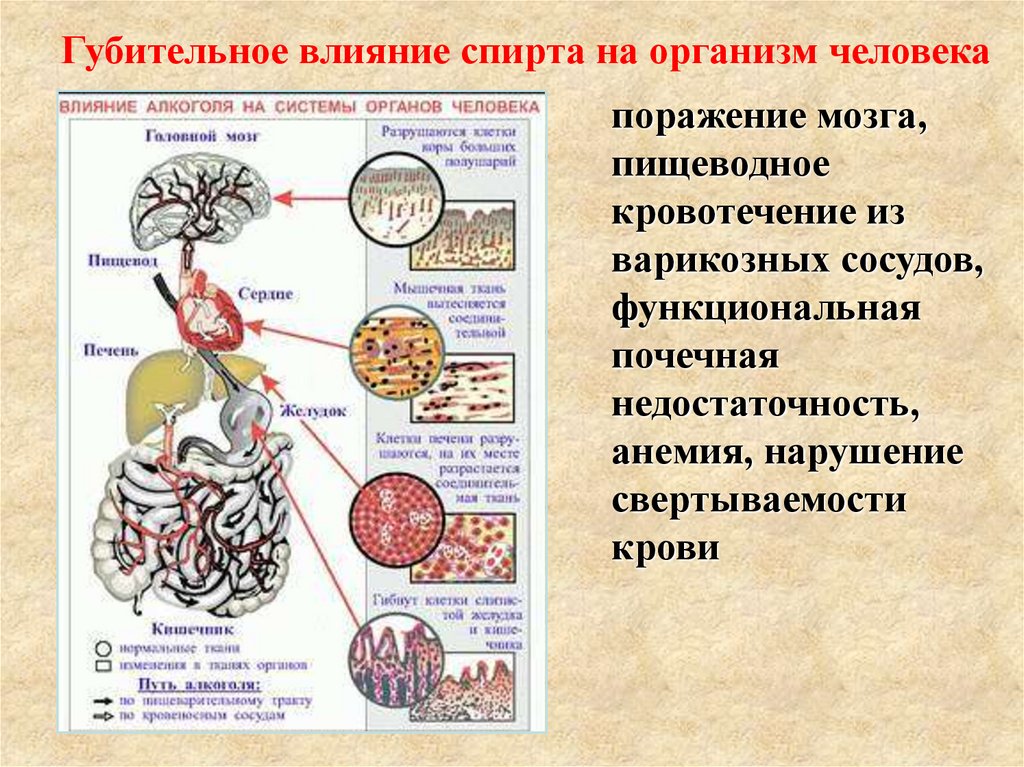
31.
Губительное влияние спирта на организм человекапоражение мозга,
пищеводное
кровотечение из
варикозных сосудов,
функциональная
почечная
недостаточность,
анемия, нарушение
свертываемости
крови
32.
1 вариант1. Назвать вещество:
СН2 – СН – СН2 – СН3
ОН СН3
2 вариант
1. Назвать вещество:
СН3 – СН – СН – СН –СН3
ОН СН3 СН3
2. Составить формулу
2. Составить формулу
2,2- диметилбутанола-1 2-метил-3-этилпентанола-2
3. Записать реакции:
а)гептанола с калием,
б) деканола с HCl
4. Записать 2 изомера
гексанола-2
3. Записать реакции:
а) гексанола с литием
б) октанола с HBr
4. Записать 2 изомера
гептанола -3




















 Химия
Химия








