Похожие презентации:
Электропроводность. Влияние температуры, концентрации и силы электролита на электропроводность
1.
Электропроводность. Влияние температуры,концентрации и силы электролита на
электропроводность
1
2.
Основные понятияЭлектрохимия- область химии, изучающая процессы, которые
либо сопровождаются возникновением электрического тока, либо
вызваны электрическим током.
Проводники – вещества, проводящие электрический ток
благодаря наличию в них большого количества зарядов,
способных свободно перемещаться (в отличие от изоляторов).
проводники I рода
перенос тока не сопровождается
химическими
процессами,
электропроводность
обусловлена электронами.
проводники II рода перенос тока осуществляется ионами
(электролиты)
2
3.
Законы электролизаЭлектролизом называют процессы, протекающие на электродах под
действием электрического тока, подаваемого от внешнего источника
тока через электролиты.
Первый закон Фарадея: масса вещества m, выделяемая на
электроде электрическим током, пропорциональная количеству
электричества Q, прошедшему через электролит
Второй закон Фарадея: массы различных веществ, выделенных
одним и тем же количеством электричества, пропорциональных их
химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется
пропустить через электролит одно и тоже количество электричества,
равное приблизительно 96500 Кл (число Фарадея)
3
4.
Правила электролиза в водных растворахНа катоде:
1. Катионы, расположенные в ряду напряжений металлов от лития до
алюминия (включительно), а также катионы NН4+ не восстанавливаются,
вместо них восстанавливаются молекулы воды:
2Н2О + 2е → Н2 + 2ОН-
2. Катионы, расположенные в ряду напряжений после алюминия до водорода,
могут восстанавливаться вместе с молекулами воды:
2Н2О + 2е → Н2 + 2ОНZn2+ + 2e → Zn0
3. Катионы, расположенные в ряду напряжений после водорода, полностью
восстанавливаются:
Аg+ + 1е → Аg 0
4. В растворах кислот восстанавливаются ионы водорода:
2Н+ + 2е → Н20
4
5.
На аноде:1. Кислородосодержащие анионы и F- – не окисляются, вместо них окисляются
молекулы воды:
2Н2О – 4е → О2 + 4Н+
2. Анионы серы, йода, брома, хлора (в этой последовательности) окисляются до
простых веществ:
2Сl- – 2е → Сl20
S2- - 2е → S 0
3. В растворах щелочей окисляются гидроксид-ионы:
4ОН- - 4е → О2 + 2Н2О
4. В растворах солей карбоновых кислот окисляются анионы:
2 R - СОО- - 2е → R - R + 2СО2
5. При использовании растворимых анодов электроны во внешнюю цепь
посылает сам анод за счёт окисления атомов металла, из которого сделан анод:
Сu0 - 2е → Сu2+
5
6.
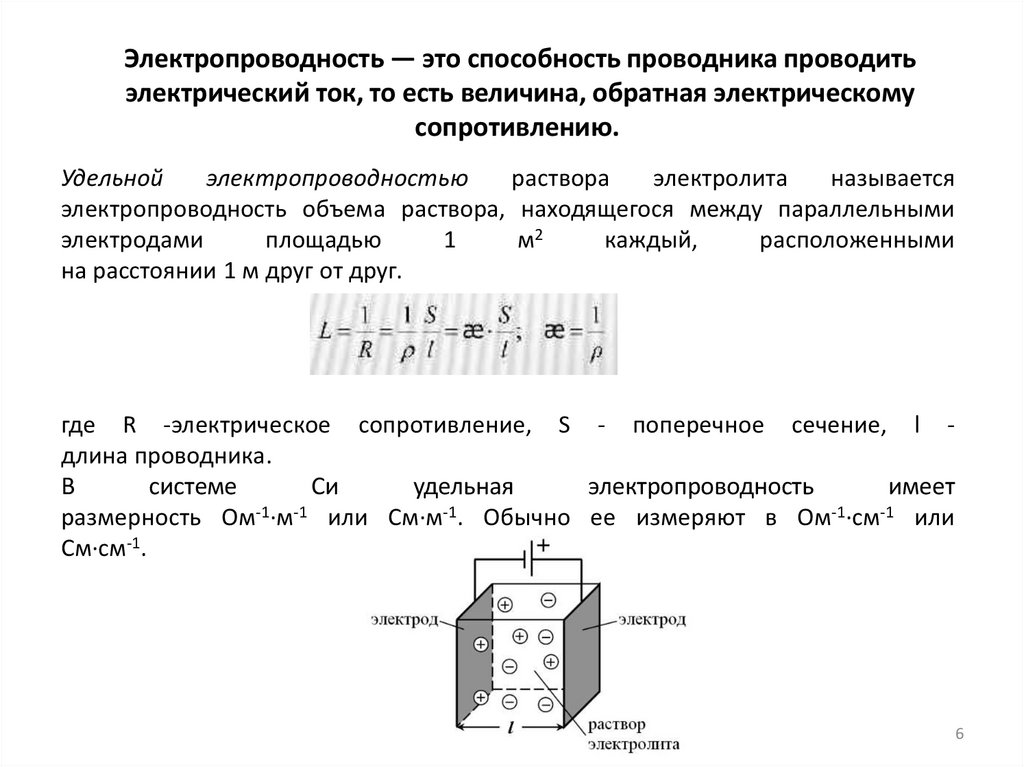
Электропроводность — это способность проводника проводитьэлектрический ток, то есть величина, обратная электрическому
сопротивлению.
Удельной
электропроводностью
раствора
электролита
называется
электропроводность объема раствора, находящегося между параллельными
электродами
площадью
1
м2
каждый,
расположенными
на расстоянии 1 м друг от друг.
где R -электрическое сопротивление, S - поперечное сечение, l длина проводника.
В
системе
Си
удельная
электропроводность
имеет
размерность Ом-1·м-1 или См·м-1. Обычно ее измеряют в Ом-1·см-1 или
См·см-1.
6
7.
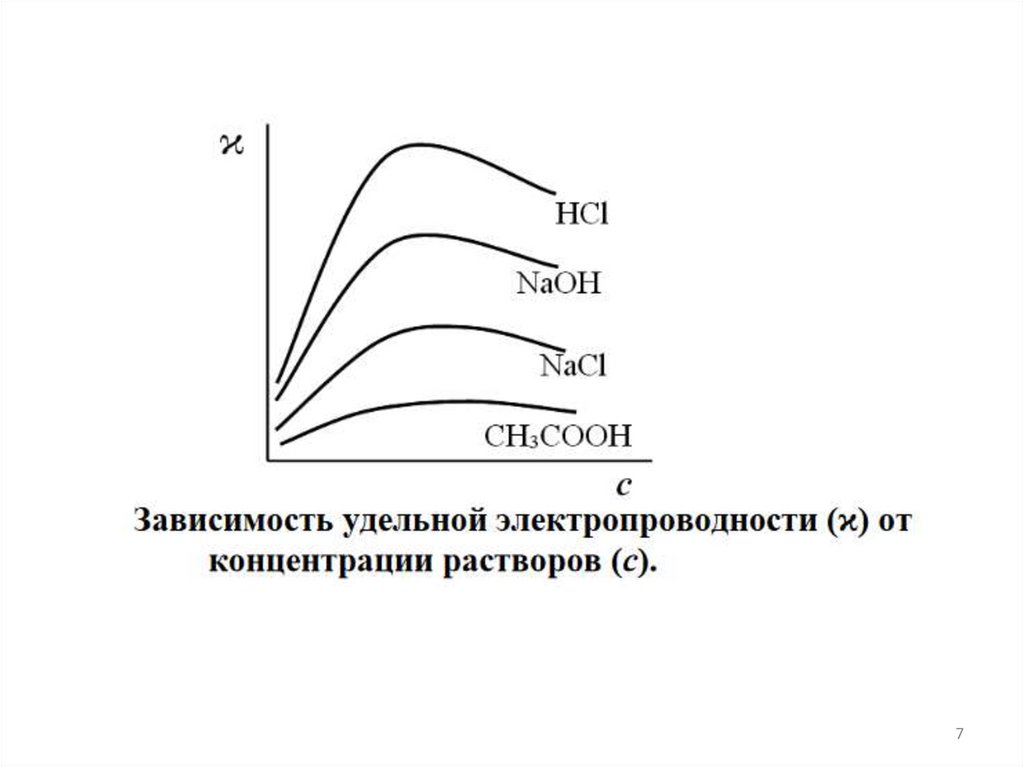
78.
Молярной электропроводностью называется электропроводностьстолба раствора, содержащего 1 моль растворенного вещества,
заключенного между электродами площадью 1м2, находящимися на
расстоянии 1 м.
Эквивалентной электропроводностью называется электропроводность
столба раствора, содержащего 1 моль эквивалентов растворенного
вещества, заключенного между электродами площадью 1м2,
находящимися на расстоянии 1 м.
Размерность эквивалентной электропроводности [Ом-1·см2·моль-1].
8
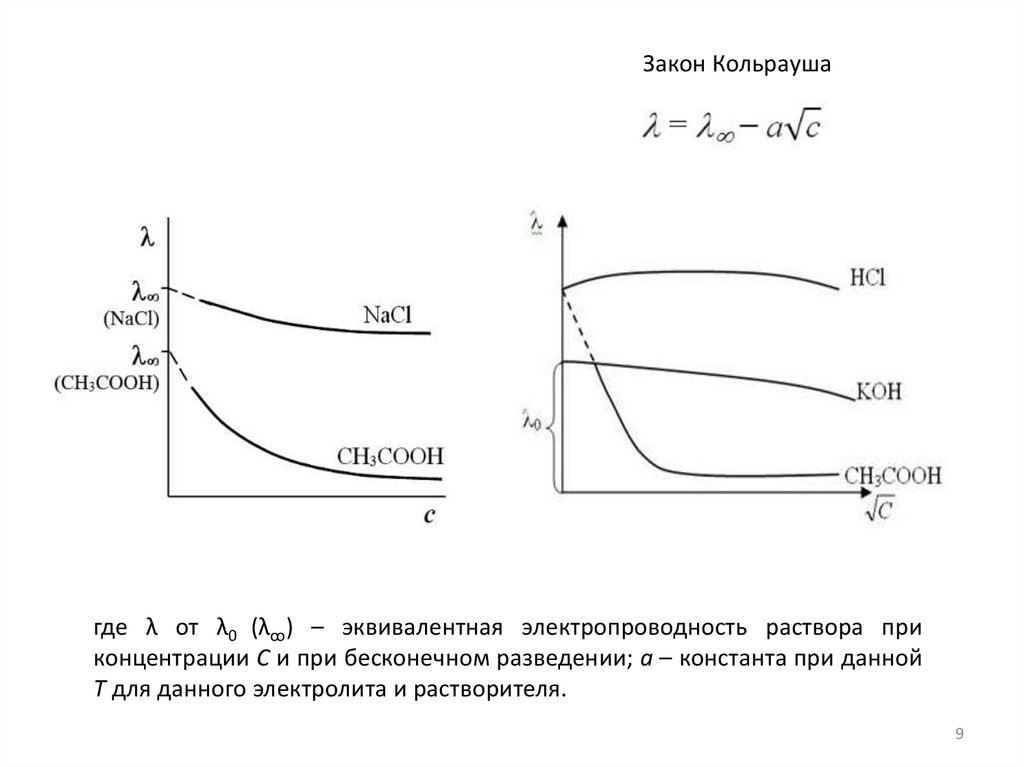
9.
Закон Кольраушагде λ от λ0 (λꚙ) – эквивалентная электропроводность раствора при
концентрации С и при бесконечном разведении; а – константа при данной
Т для данного электролита и растворителя.
9
10.
1011.
1112.
Повышение температуры для растворов сильных электролитов невлияет на параметры с и α.
При увеличении температуры у растворов слабых электролитов
растёт их степень диссоциации, так как активируются связи в
молекулах электролита. Связи становятся более подвижными, они
легче ионизируются, и как следствие, растёт концентрация ионов в
растворе.
С повышением температуры возрастает скорость движения ионов
как для сильных, так и слабых электролитов.
æ
æ
где α и β – температурные коэффициенты электрической проводимости.
Коэффициент α зависят от природы электролита: для сильных кислот α =
0,0164, для сильных оснований α = 0,0190, для солей α= 0,0220
12









 Химия
Химия








