Похожие презентации:
Аналитическая химия
1.
АНАЛИТИЧЕСКАЯХИМИЯ
2.
Литература• Основы аналитической химии. В 2-х кн. Учеб. Для вузов/
Ю.А.Золотов, Е.Н. Дорохова, В.И.Фадеева и др.; Под ред.
Ю.А.Золотова. -М.: Высш. шк., 2012. - 383 с. (И другие годы
издания)
• Основы аналитической химии. Практическое руководство: Учеб.
Пособие для вузов/ В.И.Фадеева, Т.Н.Шеховцова, В.М.Иванов и
др. Под ред. Ю.А.Золотова. – М.: Высш. Шк., 2003. – 463 с.
• Основы аналитической химии. Задачи и вопросы./Под ред.
Ю.А.Золотова. М.: Высш. Шк. 2004.
• Кристиан Г. Аналитическая химия. В двух томах. М.: Бином, 2013
• Вершинин В.И. Аналитическая химия : учебник [для вузов] / В. И.
Вершинин, И. В. Власова, И. А. Никифорова .— М. : Академия,
2011 .— 442 с.
3.
Литература• Крешков А.П. Бессероводороные методы качественного
полумикроанализа. М., 1979
• Алексеев В.Н. Курс качественного химического
полумикроанализа. М., 1973
• Скуг Д., Уэст Д. Основы аналитической химии. В 2 т. М., 1979
• Петерс Д., Хайес Дж., Хифтье Г. Химическое разделение и
измерение. В 2 т. М., 1978
• Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2 т. М.,
1990
• Лурье Ю.Ю. Справочник по аналитической химии. М., 1979 (и
другие годы издания)
4.
Литература• Алексеев В.Н. Количественный анализ. М., 1972
• Бабко А.К., Пятницкий И.В. Количественный анализ. М., 1968
• Фритц Дж., Шенк Г. Количественный анализ. М., 1978
• Дорохова Е.Н., Прохорова Г.В. Задачи и вопросы по
аналитической химии. М., 1984
• Толстоусов В.Н., Эфрос С.М. Задачник по количественному
анализу. Л., 1986
5.
Аналитическая химия –это наука, развивающая теоретические
основы химического анализа веществ и
материалов и разрабатывающая
методы определения химического
состава вещества и его структуры
(строения)
6.
Краткая история аналитической химииДонаучный период: 2000 г до н.э. – XVII век
Роберт Бойль, 1661 год – термин «анализ», понятие хим. анализа
XVIII – первая половина XIX века: оформились химические методы
анализа. Торберн Бергман, Луи Жак Тенар – качественный анализ;
Ломоносов – один из создателей количественного химического
анализа как научной дисциплины, открыл закон сохранения массы;
Гей-Люссак – титриметрический анализ; Юстус Либих –
элементарный органический анализ
1871 г. опубликован первый учебник по аналитической химии
(Меншуткин Николай Александрович)
Вторая половина XIX века: физико-химические методы. Роберт
Бунзен, Константин Кирхгоф – атомно-эмиссионный анализ;
Вальтер Нернст – основы потенциометрии; Фридрих Кольрауш –
кондуктометрия; Уолкот Гиббс – электрогравиметрическое
определение металлов
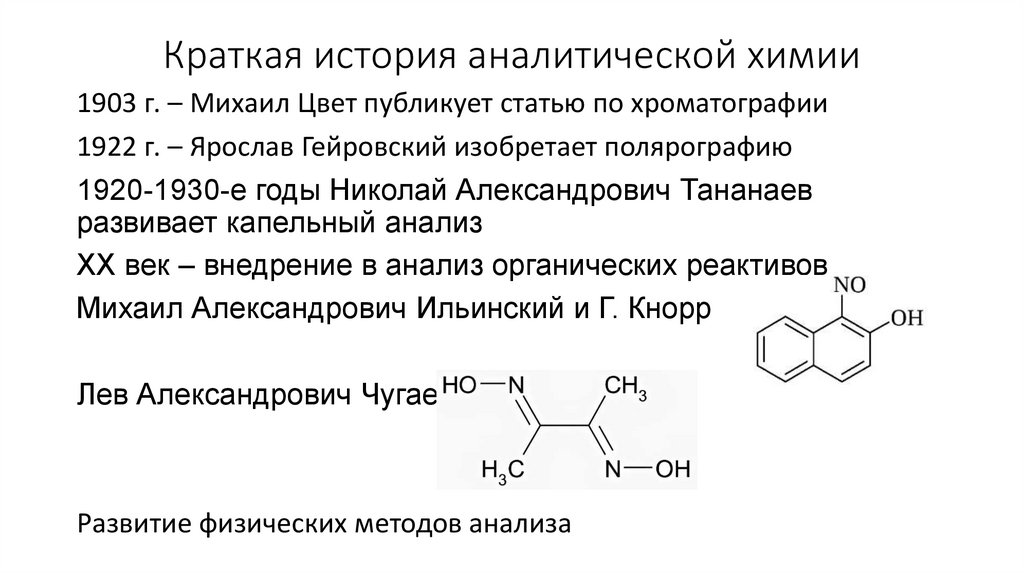
7.
Краткая история аналитической химии1903 г. – Михаил Цвет публикует статью по хроматографии
1922 г. – Ярослав Гейровский изобретает полярографию
1920-1930-е годы Николай Александрович Тананаев
развивает капельный анализ
XX век – внедрение в анализ органических реактивов
Михаил Александрович Ильинский и Г. Кнорр
Лев Александрович Чугаев
Развитие физических методов анализа
8.
Химический анализ –совокупность действий, позволяющих
идентифицировать качественный и
количественный состав анализируемого
объекта
9.
АНАЛИТИЧЕСКАЯ ХИМИЯ• Качественный анализ
• Количественный анализ
• Методы разделения и концентрирования
10.
• Аналитический эффект - это видимое изменение системы,которое дает нам информацию о химическом составе
исследуемого вещества
• Образование осадка
BaCl2 + H2SO4 = BaSO4 + 2HCl
• Выделение газа
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
• Появление запаха
NH4Cl + NaOH = NH3 + NaCl + H2O
• Изменение окраски раствора
FeCl3 + 6NH4SCN = (NH4)3[Fe(SCN)6] + 3NH4Cl
• Окрашивание пламени
11.
• Аналитический сигнал – изменение физического свойстваанализируемой системы и его численное значение,
функционально связанное с составом объекта
12.
Значение аналитической химииФундаментальное открытие новых
элементов, веществ,
химических и
физических законов
Прикладное установление
качественного и
количественного
состава различных
объектов
13.
Прикладные аналитические службы• Технический анализ (руды, металлы, сырье и продукция)
• Сельскохозяйственный анализ (почвы, удобрения, корма)
• Пищевой анализ (продукты питания)
• Биохимический анализ (кровь, моча и т.д.)
• Санитарно-химический анализ (воздух, вода, почвы)
• Фармацевтический анализ (фармпрепараты)
• Токсикологический анализ (токсины, наркотики)
• Судебно-химический анализ (объекты, интересующие
следствие)
• Искусствоведческий анализ (объекты живописи, архитектуры)
• Космохимический анализ (космические объекты)
14.
Виды химического анализа по природеопределяемых частиц
• Элементный анализ (определение различных элементов C, H, O...)
• Ионный анализ (определение атомов элементов в данной
степени окисления Fe3+, Cr3+, Ni2+, Mn2+)
• Вещественный или молекулярный анализ (определение молекул
с заданным составом и структурой C2H5OH, глюкоза...)
• Изотопный анализ (определение изотопов 206Pb, 207Pb, 208Pb)
• Структурно-групповой или функциональный анализ (определение
совокупности молекул с общими структурными
характеристиками, например углеводы, спирты и т.д.)
• Фазовый анализ (определение фаз в сложных объектах цементит в стали, воздух в гидравлической жидкости и т.д.)
15.
Классификация методов анализа подиапазону определяемых концентраций
• Макроанализ - 1-100 %
гравиметрия
титриметрия
• Полумикроанализ - 0,1-1 %
• Микроанализ - 10-6-10-1 %
спектрофотометрия, кулонометрия
• Ультрамикроанализ - 10-9-10-6 %
атомная спектроскопия, хроматография
• Субультрамикроанализ - 10-16-10-9 %
радиоизотопный анализ, масс-спектроскопия
16.
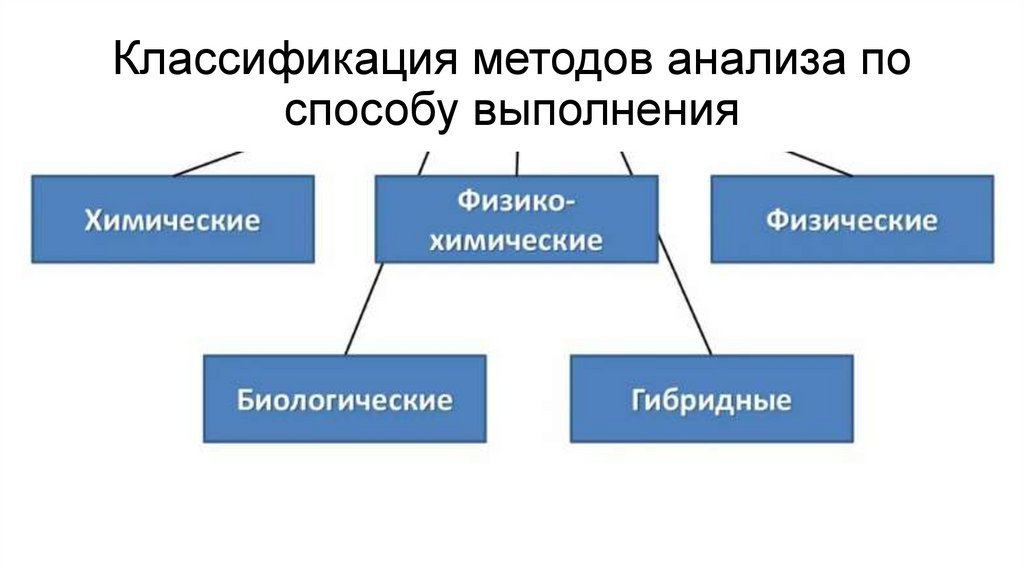
Классификация методов анализа поспособу выполнения
17.
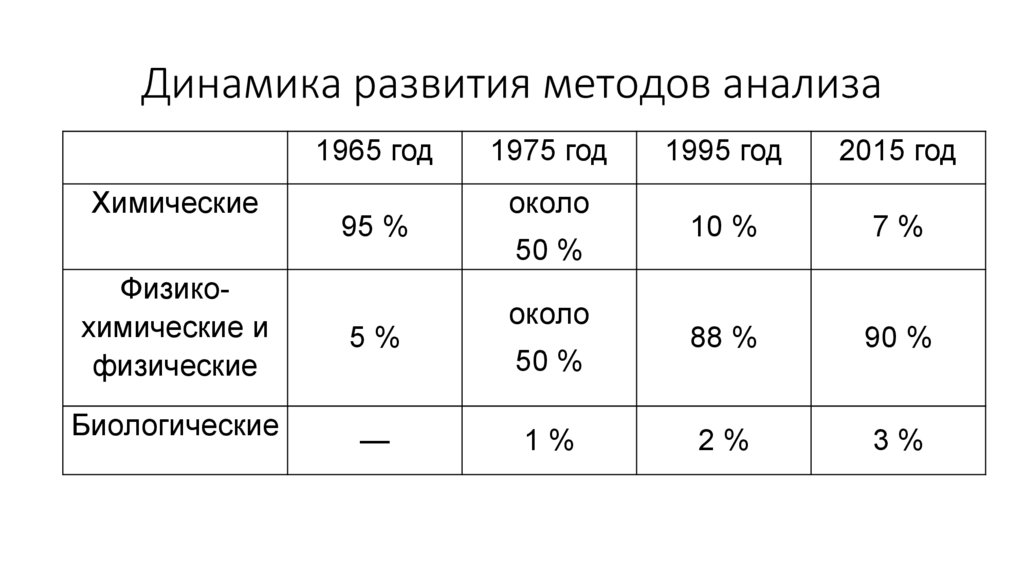
Динамика развития методов анализа1965 год
Химические
Физикохимические и
физические
Биологические
95 %
5%
—
1975 год
около
50 %
около
50 %
1%
1995 год
2015 год
10 %
7%
88 %
90 %
2%
3%
18.
Типы реакций, используемых ваналитической химии
• Реакции обмена
• HCl + NaOH = NaCl + H2O
• NH4Cl + KOH = NH3 + KCl + H2O (запах аммиака)
• CdCl2 + Na2S = CdS + 2NaCl (образование желтого осадка)
• Реакции комплексообразования
• FeCl3 + 6NH4SCN = (NH4)3[Fe(SCN)6] + 3NH4Cl (кроваво-красный)
• FeCl3 + 6NaF = Na3[FeF6] + 3NaF (бесцветный; маскирование)
• Окислительно-восстановительные реакции
• 2Mn(NO3)2 + 5NaBiO3 + 14HNO3 = 5Bi(NO3)3 + 2NaMnO4 + 3NaNO3 + 7H2O
19.
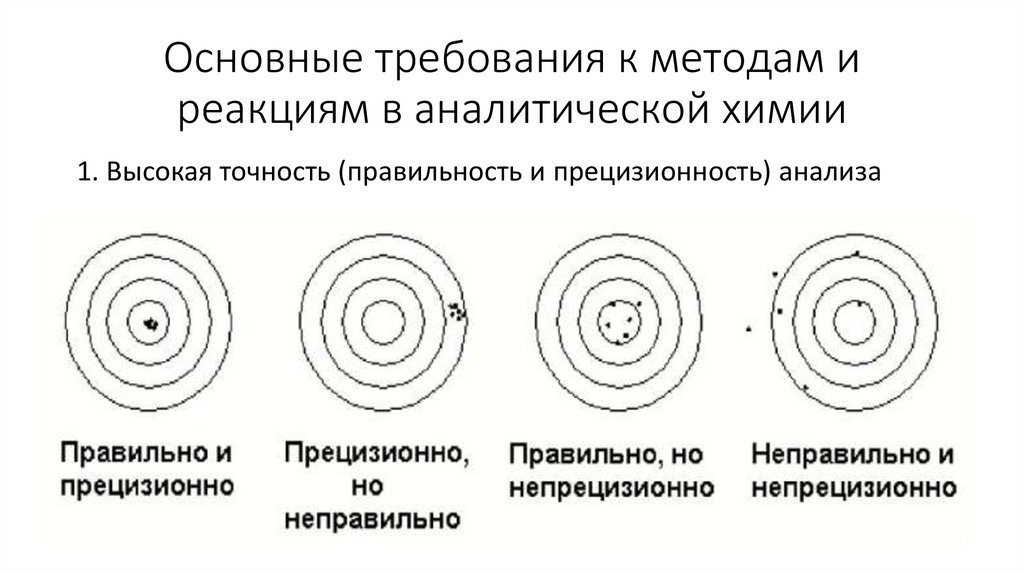
Основные требования к методам иреакциям в аналитической химии
1. Высокая точность (правильность и прецизионность) анализа
20.
Правильность – это степень близостисреднеарифметического результата измерений к
истинному значению измеряемой величины или
принятому опорному значению
Прецизионность – степень близости друг к другу
независимых результатов измерений, которые
были получены в конкретных
регламентрированных условиях
сходимость (повторяемость)
воспроизводимость
21.
Сходимость (повторяемость) – это степень близости друг кдругу независимых результатов измерений, полученных в
условиях повторяемости: одним и тем же методом, на
одних и тех же объектах, в одной и той же лаборатории,
одним и тем же оператором, с использованием одного и
того же оборудования, в пределах короткого промежутка
времени
Воспроизводимость – это степень близости друг к другу
независимых результатов измерений, полученных в
условиях воспроизводимости: один и тот же объект, но в
разных лабораториях, разными исполнителями, на разном
оборудовании, различными методами
22.
Основные требования к методам иреакциям в аналитической химии
2. Низкий предел обнаружения (ПО)
Пути понижения ПО:
а) Правильный выбор химической реакции
CuCl2 + 6NH3 = [Cu(NH3)6]Cl2 30 мкг/мл
CuCl2 + K4[Fe(CN)6] = CuK2[Fe(CN)6] + 2KCl 0,1 мкг/мл
б) Чистота реактивов
техн. – более 70 %; ч. – более 98 %; ч.д.а. – более 99 %;
х.ч. – высшая степень чистоты препарата
высокочистые вещества (ос.ч., сп.ч., в.э.ч.)
23.
Основные требования к методам иреакциям в аналитической химии
Пути понижения ПО:
в) Состав растворителя
CoCl2 + 4NH4SCN = (NH4)2[Co(SCN)4] + 2NH4Cl
г) Регулирование кислотности среды
NiCl2 + 2H2Dm = Ni(HDm)2 + 2HCl
NiCl2 + 2H2Dm + 2NH3 = Ni(HDm)2 + 2NH4Cl
д) Регулирование температуры
Pb(NO3)2 + 2KCl = PbCl2 + 2KNO3
24.
Основные требования к методам иреакциям в аналитической химии
3. Экспрессность анализа
4. Избирательность методов и реакций
I2 + крахмал = синий комплекс
NH4Cl + KOH = NH3 + KCl + H2O
Пути повышения избирательности:
а) Изменение степени окисления мешающего компонента
б) Выделение мешающего компонента в другую фазу
в) Маскирование мешающего компонента
(Fe3+, Co2+) + SCN- = Fe(SCN)3 + [Co(SCN)4]2FeCl3 + 6NaF = Na3[FeF6] + 3NaF
25.
Основные требования к методам иреакциям в аналитической химии
5. Высокая чувствительность
Аналит.
сигнал
1
2
С
26.
Основные требования к методам иреакциям в аналитической химии
6. Возможность автоматизации и компьютеризации анализа
7. Недеструктивность анализа
8. Возможность проведения локального анализа
9. Возможность проведения дистанционного анализа
10. Стоимость
27.
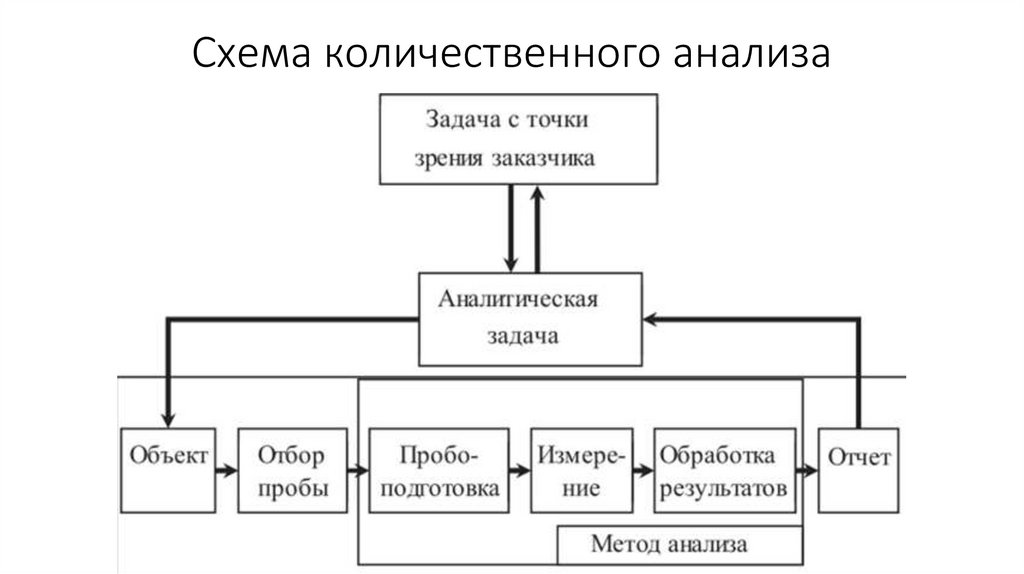
Схема количественного анализа28.
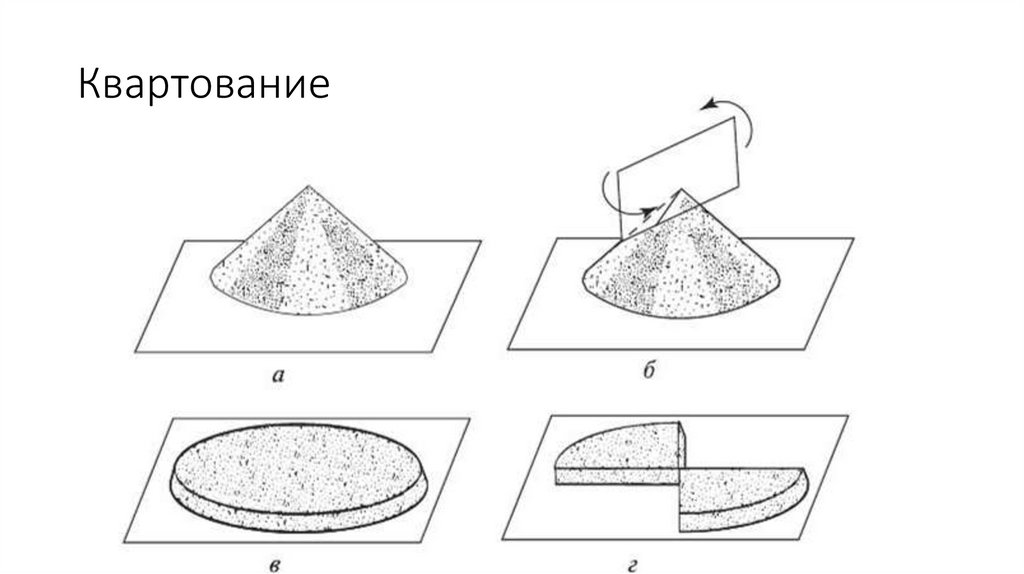
Квартование29.
Основные этапы пробоподготовки1. Учет влаги в пробе
а) Стехиометрическая (кристаллизационная) вода
б) Конституционная вода
в) Адсорбированная (неконтролируемая) вода
2. Вскрытие пробы
Растворители:
Вода
Неорганические кислоты (HCl, H2SO4, HNO3, HClO4, HF, HCl+HNO3)
Органические растворители (ацетон, эфиры, спирты, кислоты)
Плавни:
Na2CO3, NaOH, KOH, K2S2O7, B2O3, Na2B4O7
30.
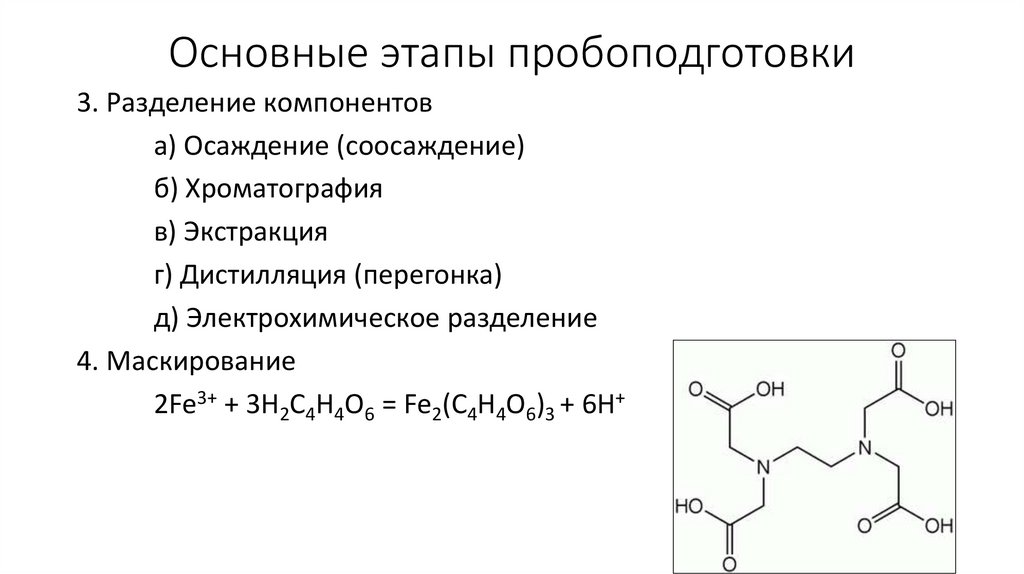
Основные этапы пробоподготовки3. Разделение компонентов
а) Осаждение (соосаждение)
б) Хроматография
в) Экстракция
г) Дистилляция (перегонка)
д) Электрохимическое разделение
4. Маскирование
2Fe3+ + 3H2C4H4O6 = Fe2(C4H4O6)3 + 6H+
31.
Основные этапы пробоподготовки5. Концентрирование
Pb2+ + Ca(OH)2 + 2Na2CO3 = CaCO3 + PbCO3 + 2NaOH + 2Na+
32.
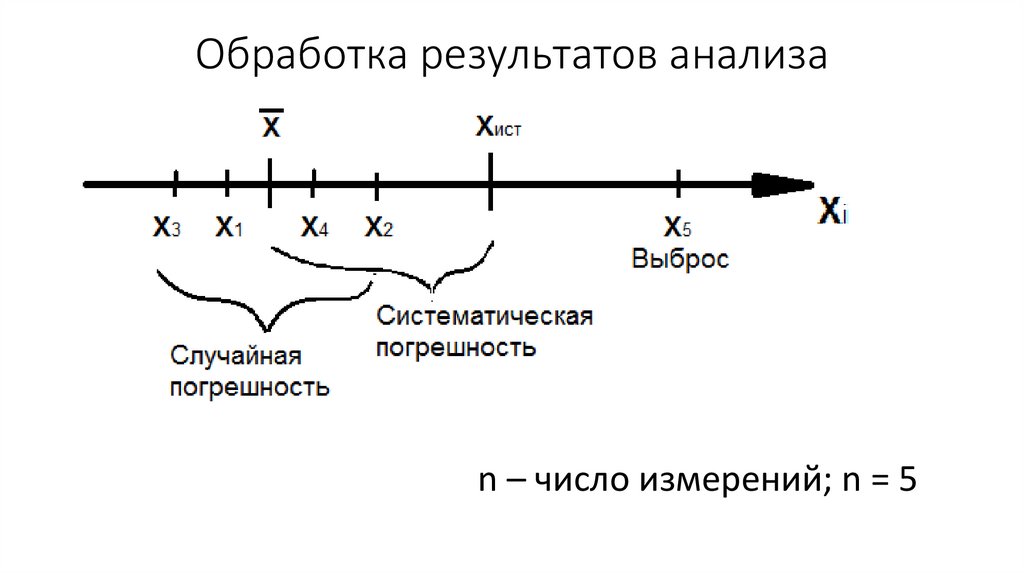
Обработка результатов анализа33.
Обработка результатов анализаn – число измерений; n = 5
34.
Первичные характеристики выборкиx1, x2, x3, x4, …, xn – выборка



























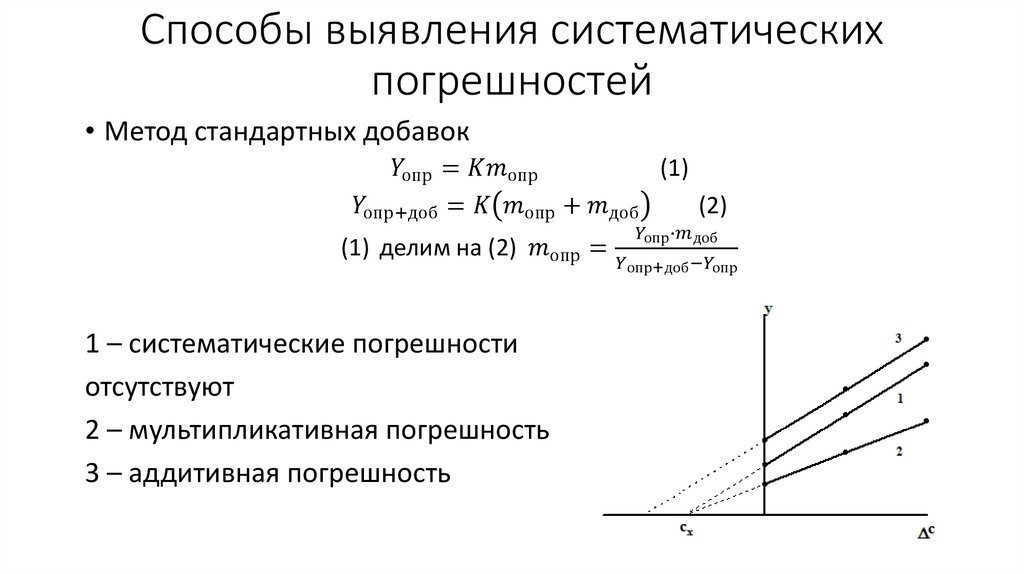


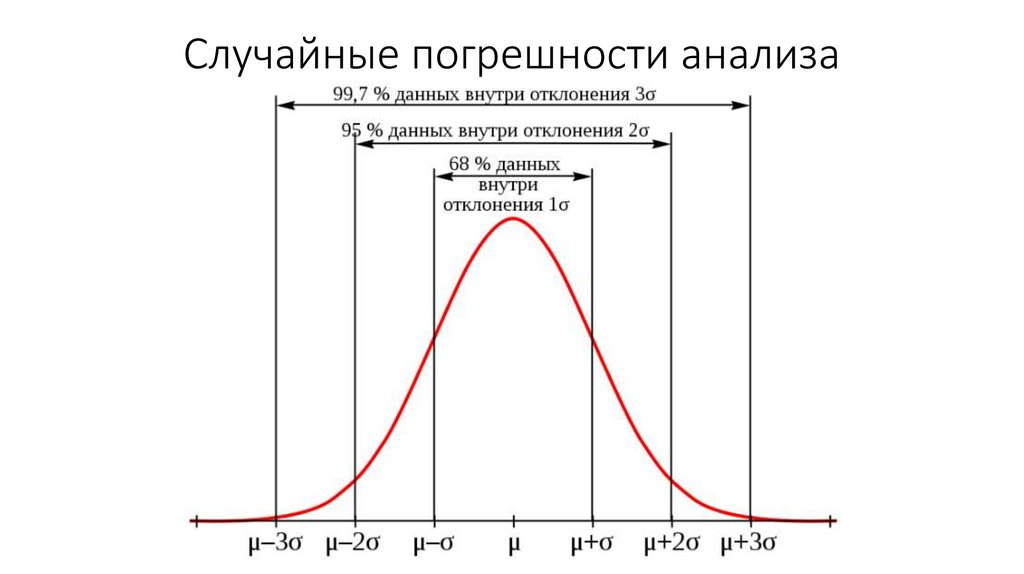
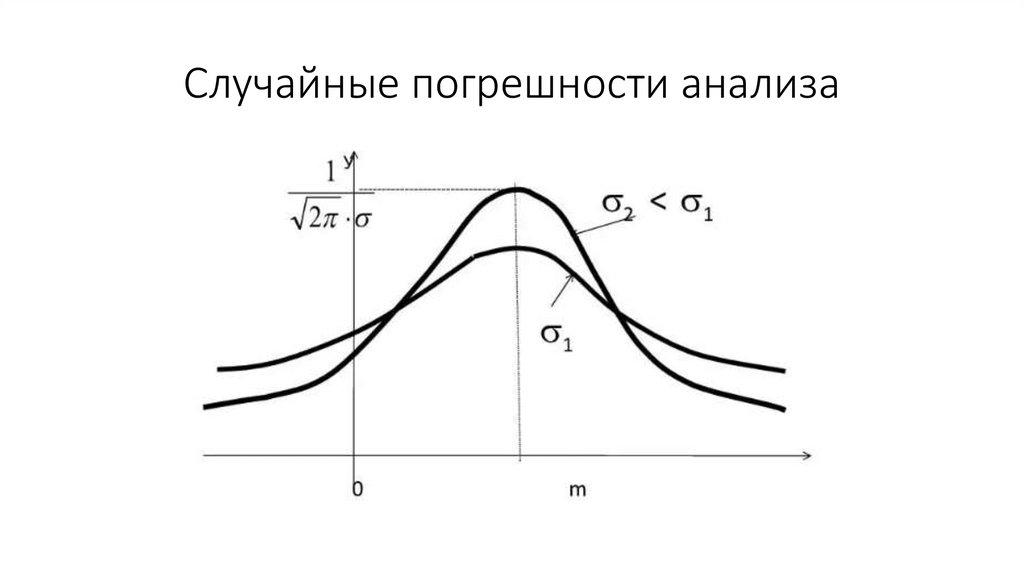


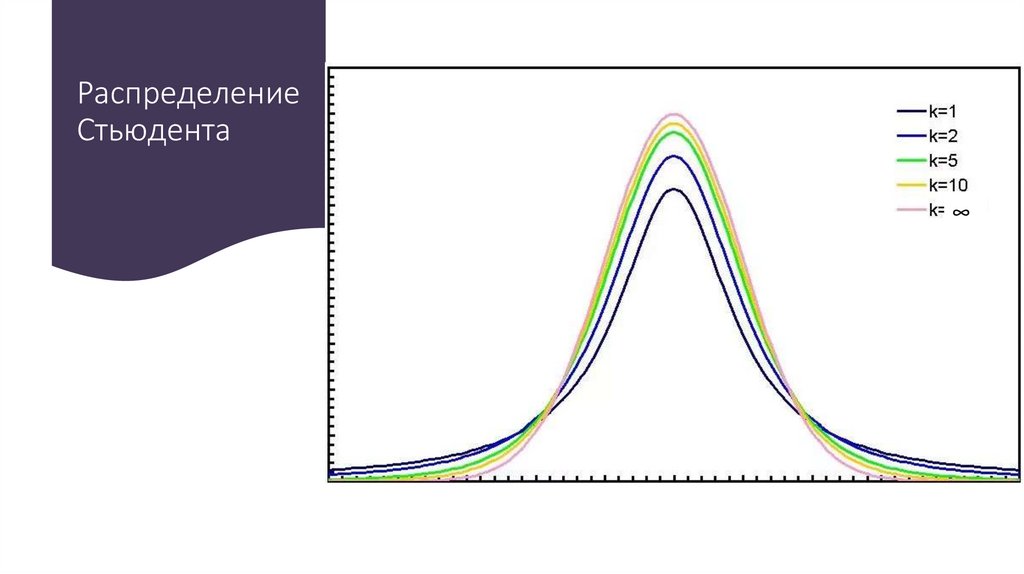



















 Химия
Химия








