Похожие презентации:
Распределение электронов по энергетическим уровням
1.
Распределениеэлектронов по
энергетическим
уровням
Выполнила:
Мавтиевская
Саглара
2.
Вспомним!Атом – сложная частица,
которая состоит из атомного
ядра и электронной оболочки
(совокупности всех
электронов в атоме)
3.
• Каждый электрон имеет своютраекторию движения и запас
энергии
• Электроны расположены на
различном расстоянии от ядра: чем
ближе электрон к ядру, тем он
прочнее с ним связан, его труднее
вырвать из электронной оболочки
• По мере удаления от ядра запас
энергии электрона увеличивается, а
связь с ядром становится слабее
4.
Цель:-понимать, что электроны в атомах
распределяются последовательно по
энергетическим уровням на возрастающем
расстоянии от ядра
-понимать, что число электронов на каждом
энергетическом уровне не превышает
определенного максимального значения
5.
Электронная оболочка – совокупностьэлектронов в данном атоме
Орбиталь – часть атомного пространства, в
котором нахождение электрона наиболее
вероятно (90%)
Электроны распределяются по
энергетическим уровням. Количество
уровней в атоме = номеру периода, в
котором находится элемент (Н – 1 уровень,
Na – 3 уровня).
Максимальное число электронов на уровне =
2n2, где n – это номер уровня. ( 1 уровень – 2
электрона, 2 уровень – 8 электронов, 3
уровень – 18 электронов, 4 уровень – 32
электрона)
6.
На каждом энергетическом уровнерасполагается определенное
ограниченное количество электронов.
На одном энергетическом уровне
располагаются электроны,
обладающие близкими значениями
энергий.
Важно!!! Количество энергетических
уровней соответствует номеру
периода.
7.
Необходимозапомнить!
Номер периода = число
энергетических уровней
Максимальное количество электронов
на одном энергетическом уровне
рассчитывается по формуле
N = 2n2
где n – номер энергетического уровня
Номер группы = число электронов на
последнем энергетическом уровне
8.
Количество орбиталей наподуровнях
s – подуровень – одна s – орбиталь
p – подуровень – три р - орбитали
d – подуровень – пять d - орбиталей
f – подуровень – семь f – орбиталей
Орбиталь при записи обозначается
квадратом
9.
Алгоритмсоставления
электронных формул
Записываем знак химического элемента и
заряд ядра его атома – он равен
порядковому номеру элемента.
Определяем количество энергетических
уровней (оно равно номеру периода) и
количество электронов на каждом
уровне.
Составляем электронную формулу,
учитывая порядок заполнения каждого
уровня – сначала s-электроны, затем – рэлектроны: номер уровня, вид орбитали и
количество электронов на ней.
10.
1 период - однаоболочка
Максимум 2*12=2 e2 период - две
оболочки
Максимум 2*22=8 e3 период - три
оболочки
Максимум 2*32=18 e-
)
+Z ))
+Z )))
+Z ))))
+Z
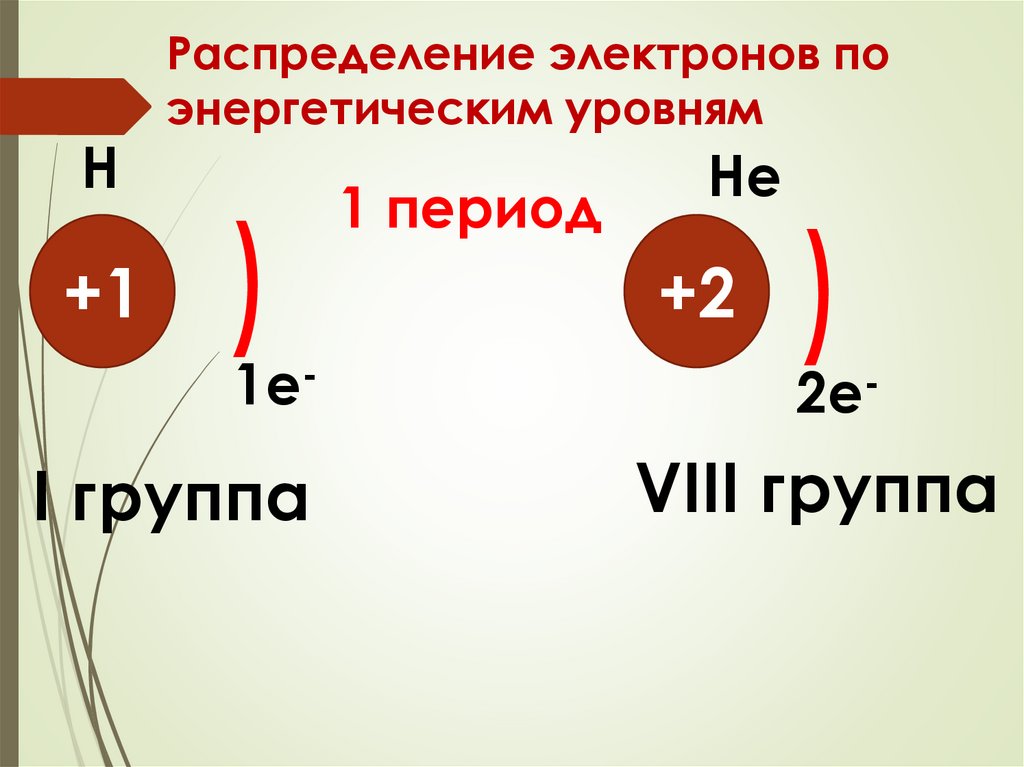
11.
Н+1
Распределение электронов по
энергетическим уровням
)
1e-
I группа
1 период
Не
+2
)
2e-
VIII группа
12.
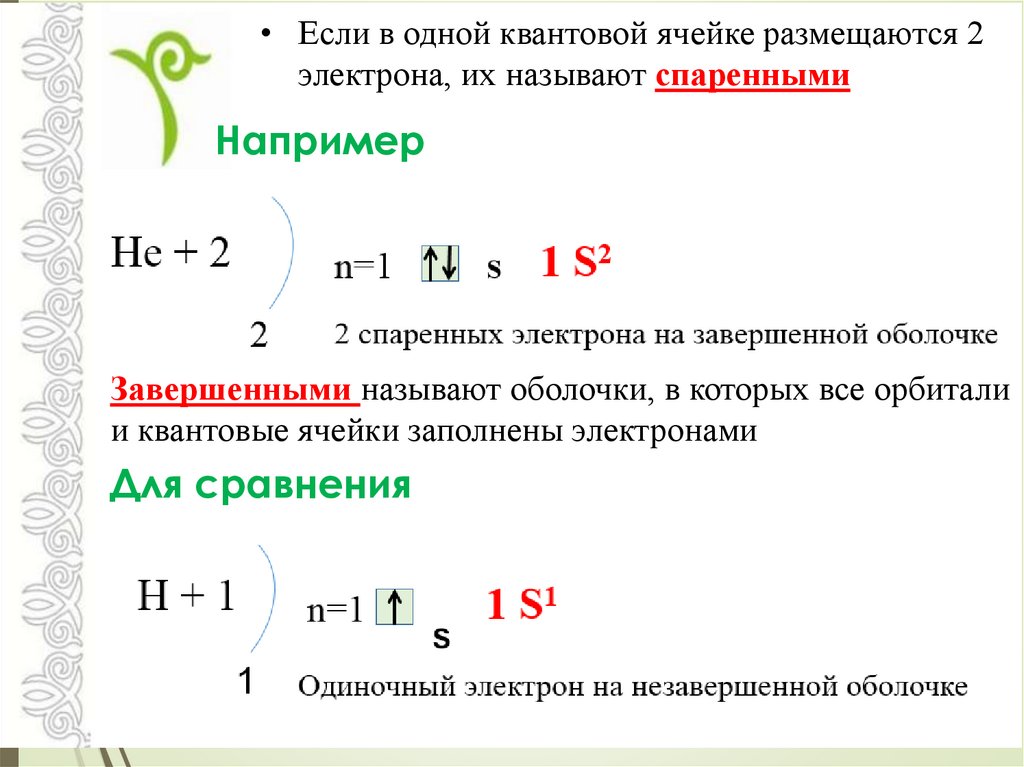
• Если в одной квантовой ячейке размещаются 2электрона, их называют спаренными
Например
Завершенными называют оболочки, в которых все орбитали
и квантовые ячейки заполнены электронами
Для сравнения
13.
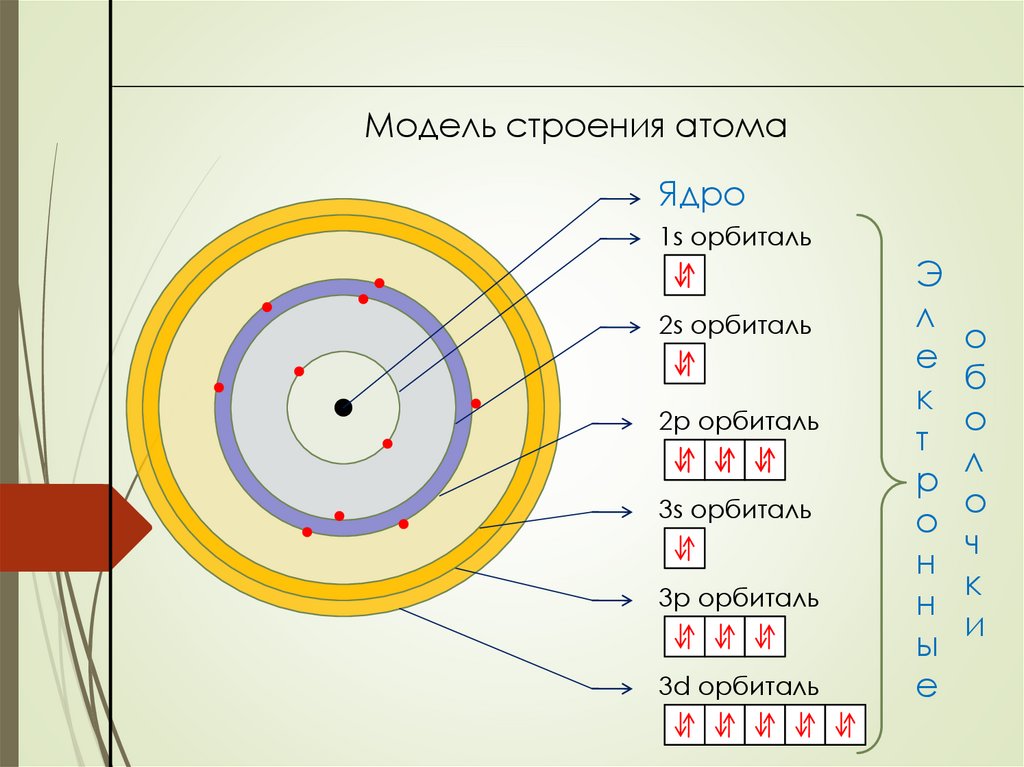
Модель строения атомаЯдро
1s орбиталь
2s орбиталь
2p орбиталь
3s орбиталь
3p орбиталь
3d орбиталь
Э
л
о
е
б
к
о
т
л
р
о
о
ч
н
к
н
и
ы
е
14.
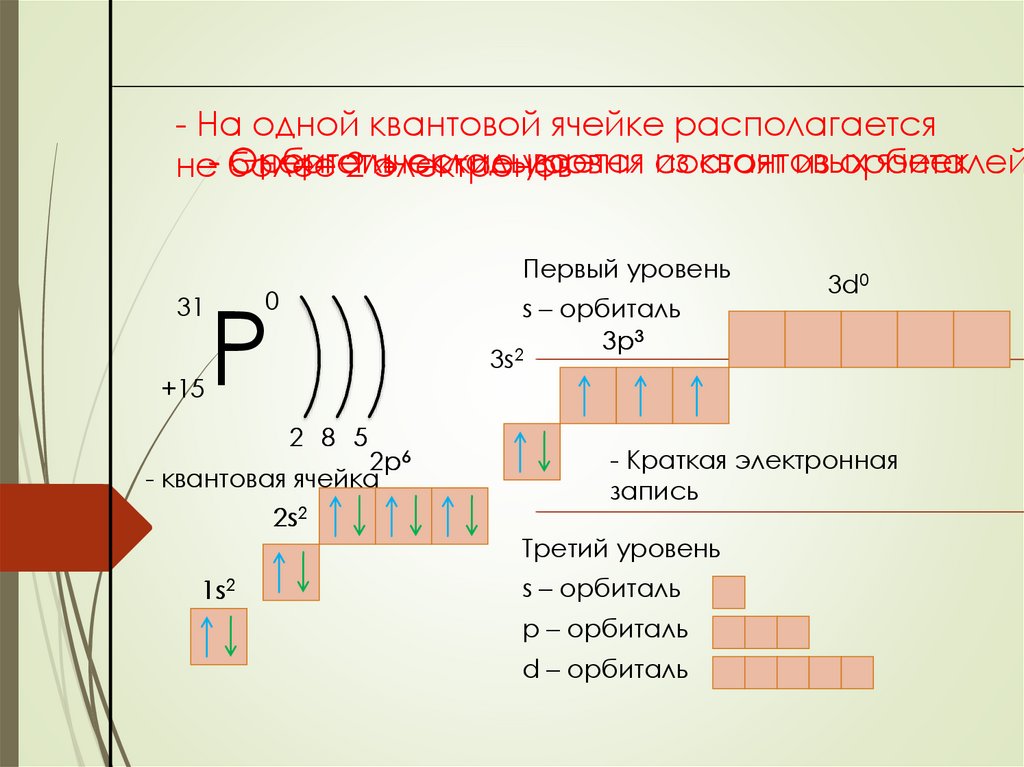
- На одной квантовой ячейке располагаетсяОрбиталь
складывается
квантовых
ячеек
Энергетические
уровни из
состоят
из орбиталей
не- более
2 электронов
31
+15
Первый уровень
Р
0
s – орбиталь
3p3
2
3s
2 8 5
2p6
- квантовая ячейка
2s2
1s2
3d0
- Краткая электронная
запись
Третий уровень
s – орбиталь
p – орбиталь
d – орбиталь
15.
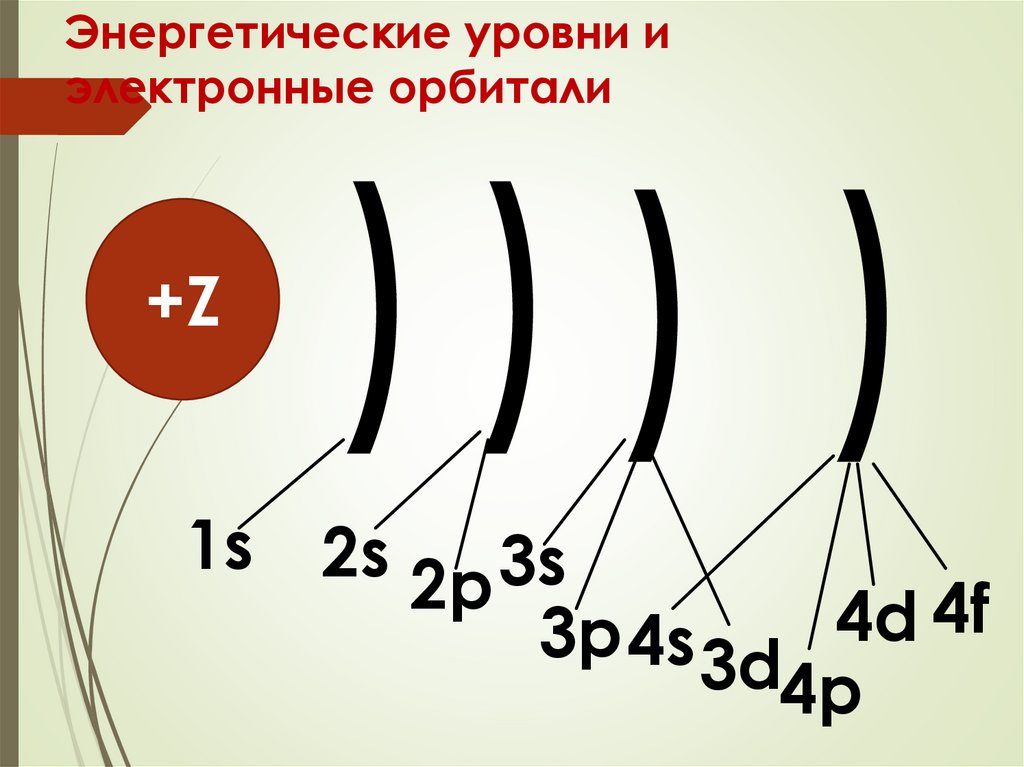
Энергетические уровни иэлектронные орбитали
+Z
))) )
1s 2s
3s
2p
4f
4d
3p 4s 3d
4p
16.
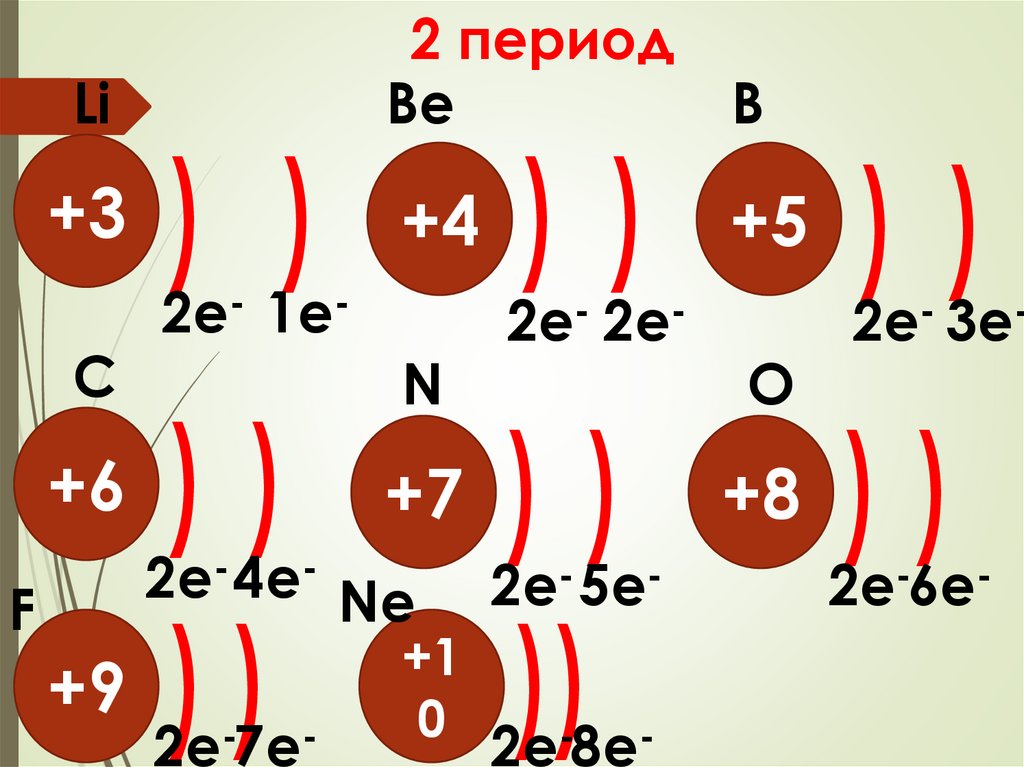
Li+3
C
2 период
Bе
B
) ) +4 ) ) +5 ) )
2e- 1e-
N
2e- 2e-
O
2e- 3e-
) ) +7 ) ) +8 ) )
+9 ))
))
+6
F
2e- 4e- Ne
2e- 5e-
2e-7e-
2e-8e-
+1
0
2e-6e-
17.
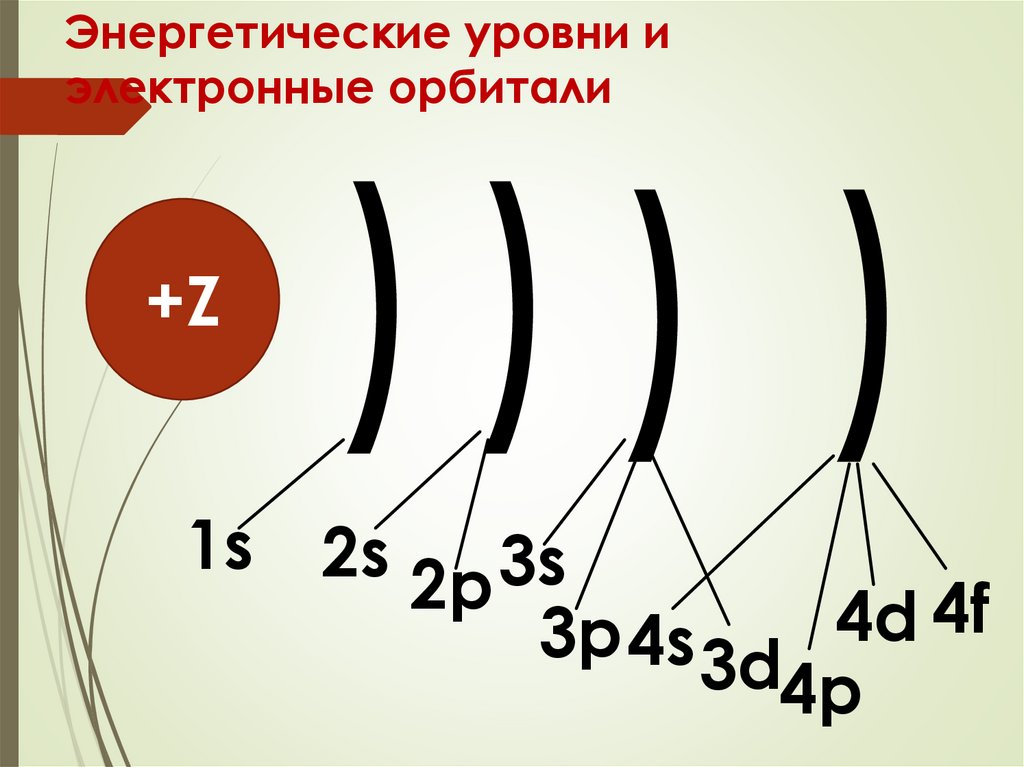
Энергетические уровни иэлектронные орбитали
+Z
))) )
1s 2s
3s
2p
4f
4d
3p 4s 3d
4p
18.
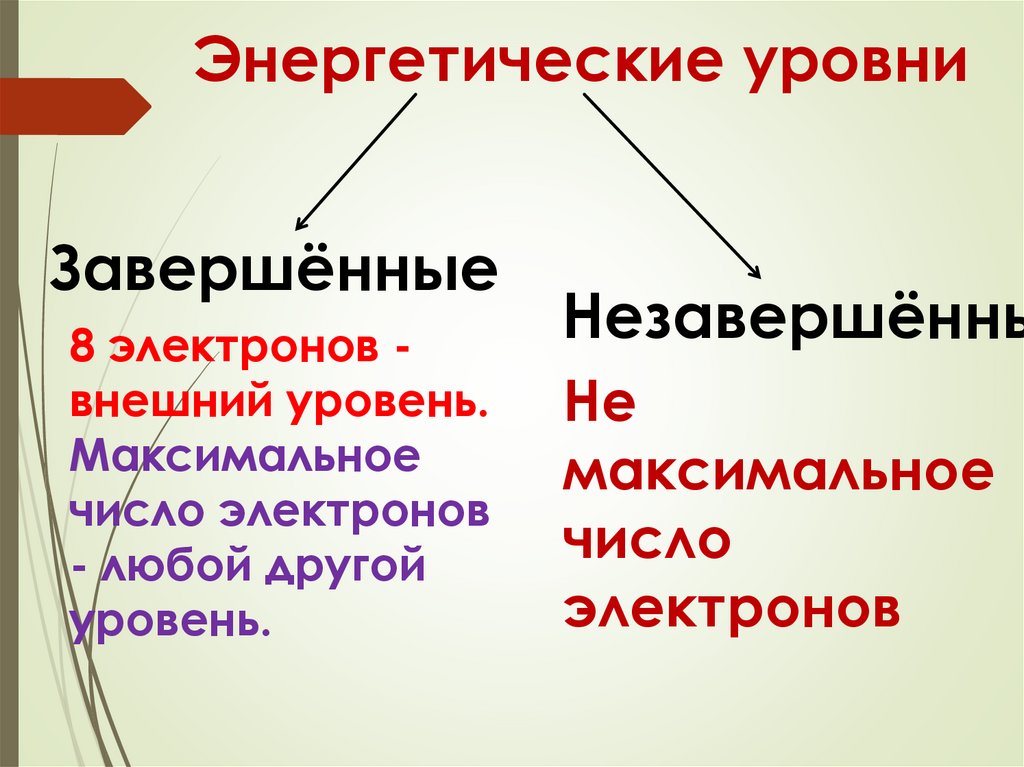
Энергетические уровниЗавершённые
8 электронов внешний уровень.
Максимальное
число электронов
- любой другой
уровень.
Незавершённы
Не
максимальное
число
электронов
19.
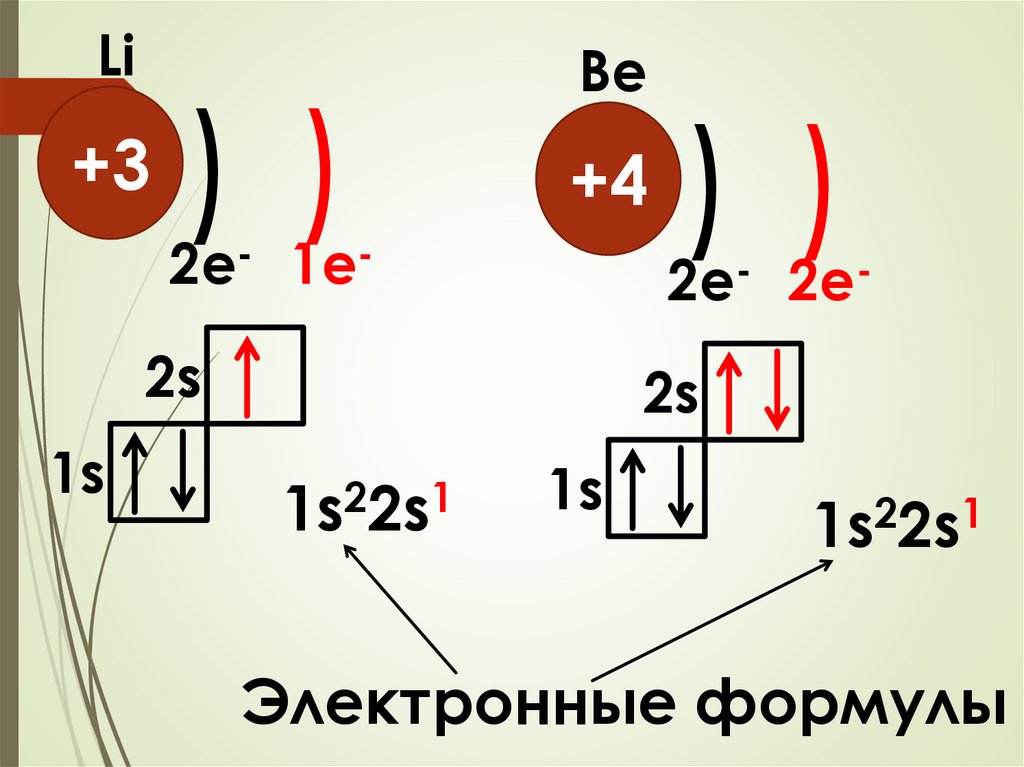
Li+3
1s
) )
Be
+4
) )
2e- 1e-
2e- 2e-
2s
2s
2
1
1s 2s
1s
2
1
1s 2s
Электронные формулы
20.
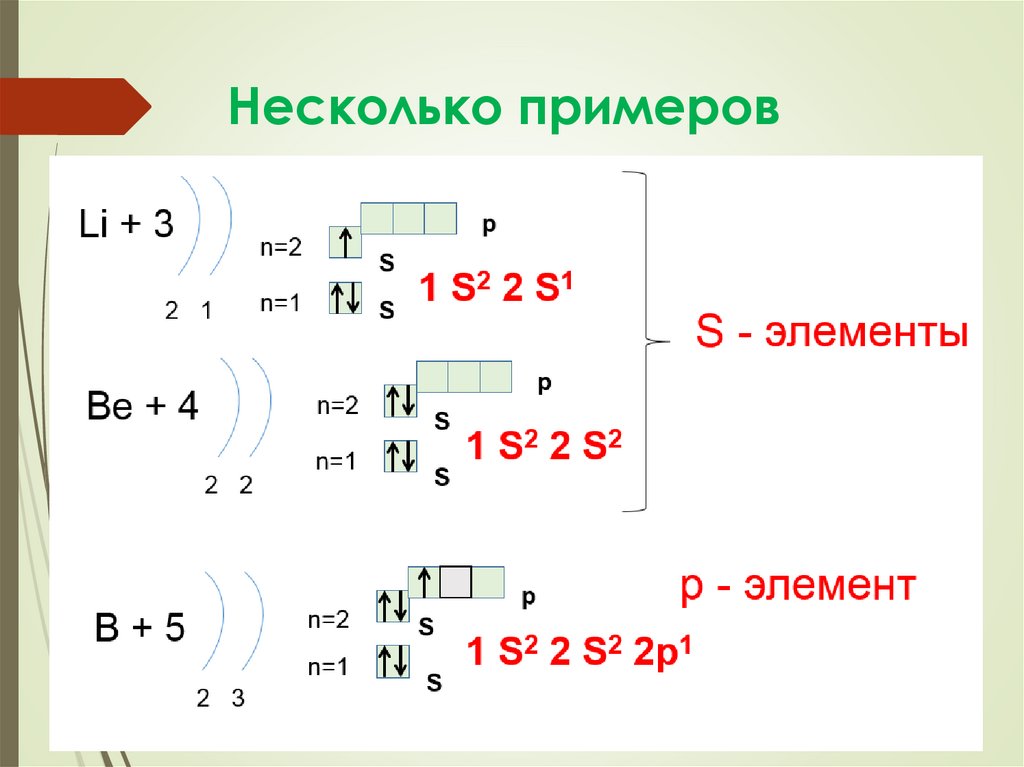
Несколько примеров21.
Ответьте на вопросыУ меня 7 электронов, кто я?
Мой символ Si - кто я?
Моя подруга живет в квартире №16, ее имя?
У меня 20 нейтронов и 20 электронов, меня зовут?
Я – фосфор, подскажите сколько у меня
электронов?
22.
Задание :Определите количество
энергетических уровней у
следующих элементов
He,Be, Si, Ca












 Физика
Физика








