Похожие презентации:
Атом. Ядро атома, изотопы
1.
ТЕМА:Химический элемент. Атом. Ядро атома, изотопы.
Электронная оболочка. Энергетические уровни, подуровни.
Атомные орбитали, s-, p-, d- элементы. Особенности
распределения электронов по орбиталям в атомах элементов
первых четырёх периодов. Электронная конфигурация атомов.
Основные химические законы
2.
3.
4.
5.
Электронная оболочка атома — этосовокупность всех электронов в данном
атоме. Электроны движутся вокруг ядра,
образуя электронное облако. Число
электронов в электронной оболочке
нейтрального атома равно числу
протонов в его ядре.
6.
На каждом энергетическом уровнерасполагается определенное
ограниченное количество электронов.
На одном энергетическом уровне
располагаются электроны,
обладающие близкими значениями
энергий.
Важно!!! Количество энергетических
уровней соответствует номеру
периода.
7.
Необходимо запомнить!• Номер периода = число энергетических
уровней
• Максимальное количество электронов
на одном энергетическом уровне
рассчитывается по формуле
N = 2n2
где n – номер энергетического уровня
• Номер группы = число электронов на
последнем энергетическом уровне
8. Количество орбиталей на подуровнях
• s – подуровень – одна s – орбиталь• p – подуровень – три р - орбитали
• d – подуровень – пять d - орбиталей
• f – подуровень – семь f – орбиталей
• Орбиталь при записи обозначается квадратом
9.
Алгоритм составленияэлектронных формул
Записываем знак химического элемента и заряд
ядра его атома – он равен порядковому номеру
элемента.
Определяем количество энергетических уровней
(оно равно номеру периода) и количество
электронов на каждом уровне.
Составляем электронную формулу, учитывая
порядок заполнения каждого уровня – сначала sэлектроны, затем – р-электроны: номер уровня,
вид орбитали и количество электронов на ней.
10.
1 период - одна оболочкаМаксимум 2*12=2 e2 период - две оболочки
Максимум 2*22=8 e-
3 период - три оболочки
Максимум 2*32=18 e4 период - четыре оболочки
Максимум 2*42=32 e-
)
+Z ))
+Z )))
+Z ))))
+Z
11.
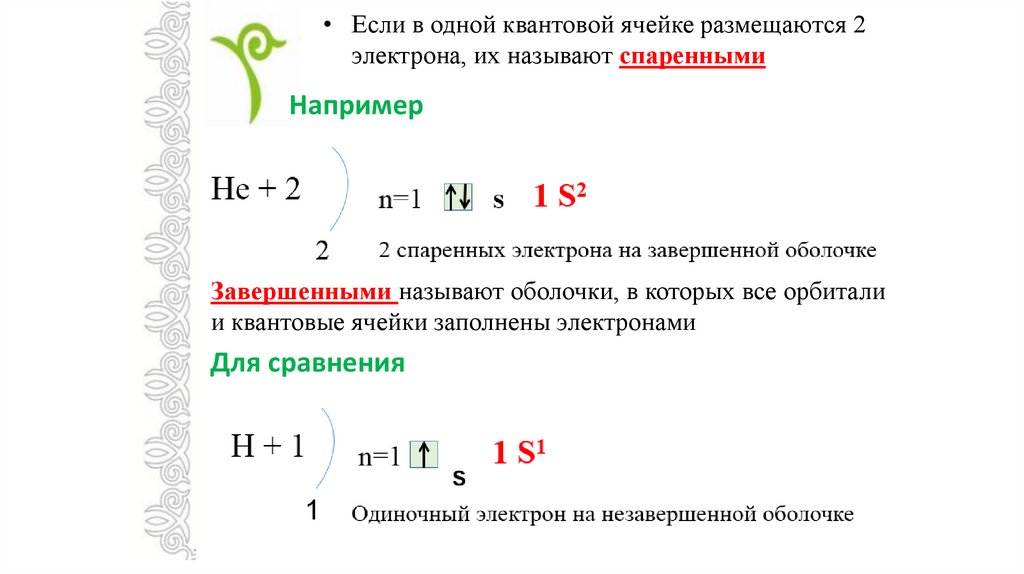
• Если в одной квантовой ячейке размещаются 2электрона, их называют спаренными
Например
Завершенными называют оболочки, в которых все орбитали
и квантовые ячейки заполнены электронами
Для сравнения
12.
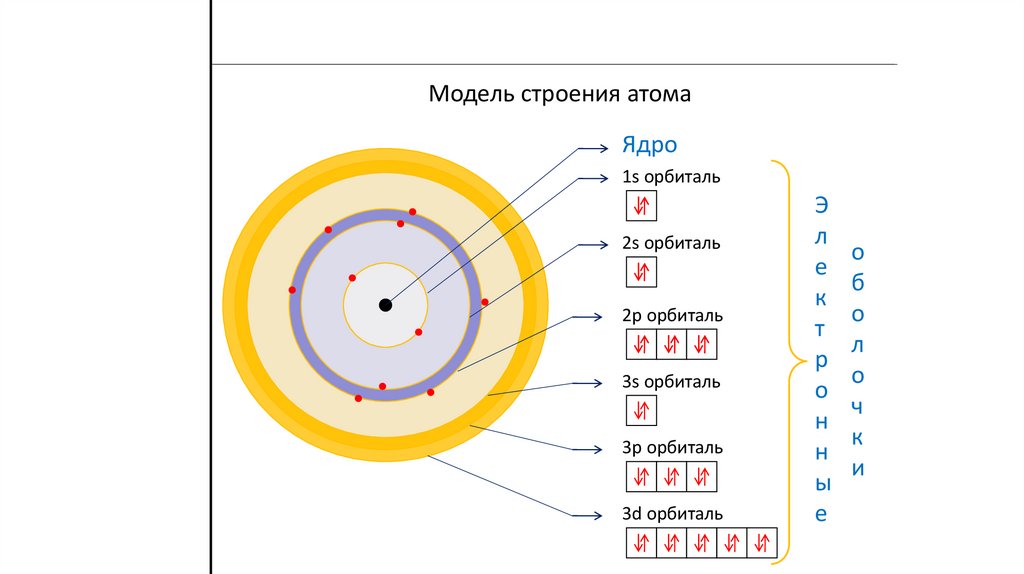
Модель строения атомаЯдро
1s орбиталь
2s орбиталь
2p орбиталь
3s орбиталь
3p орбиталь
3d орбиталь
Э
л
е
к
т
р
о
н
н
ы
е
о
б
о
л
о
ч
к
и
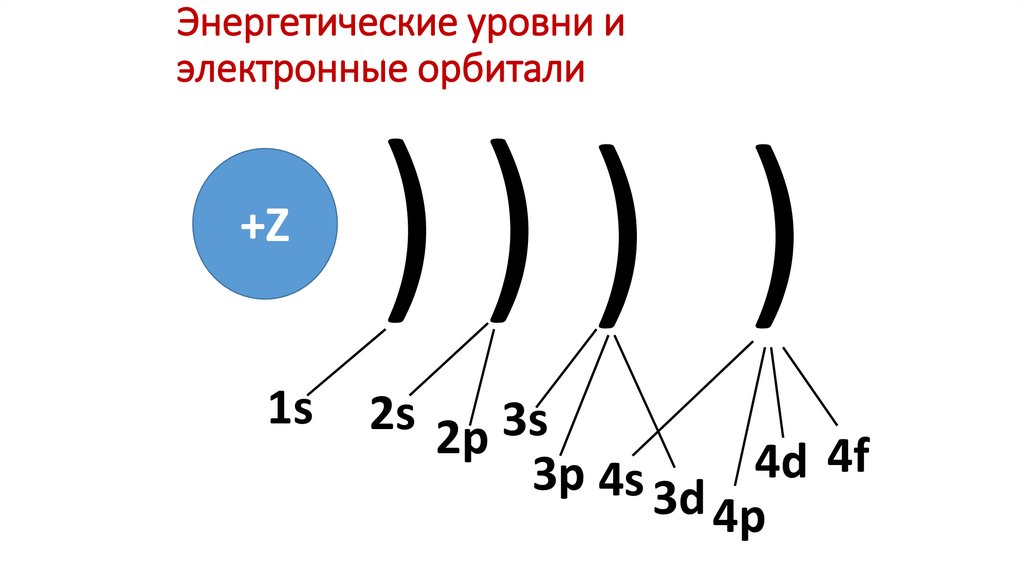
13. Энергетические уровни и электронные орбитали
+Z1s
))) )
2s 2p 3s
4f
4d
3p 4s 3d
4p
14.
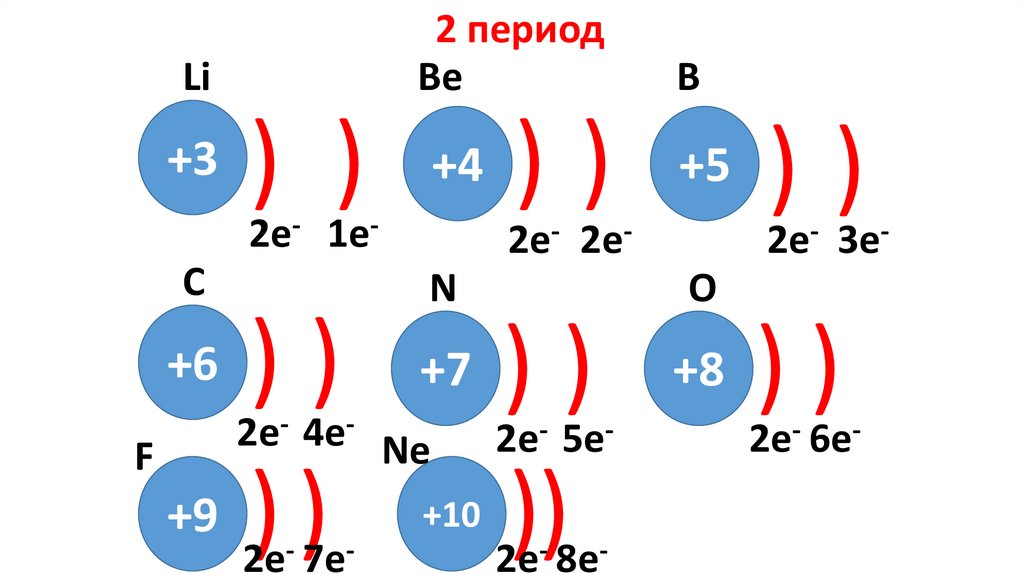
2 периодBе
Li
+3
) ) +4 ) ) +5 ) )
2e- 1e-
C
))
+9 ) )
+6
F
B
2e- 2e-
N
+7
2e- 4e- Ne
2e- 7e-
+10
2e- 3e-
O
))
))
2e- 5e-
2e- 8e-
+8
))
2e- 6e-
15.
16. Ответьте на вопросы
• У меня 7 электронов, кто я?• Мой символ Si - кто я?
• Моя подруга живет в квартире №16, ее имя?
• У меня 20 нейтронов и 20 электронов, меня зовут?
• Я – фосфор, подскажите сколько у меня электронов?
17.
Задание :Определите количество
энергетических уровней у
следующих элементов
He,Be, Si, Ca













 Физика
Физика








