Похожие презентации:
Амфотерные гидроксиды
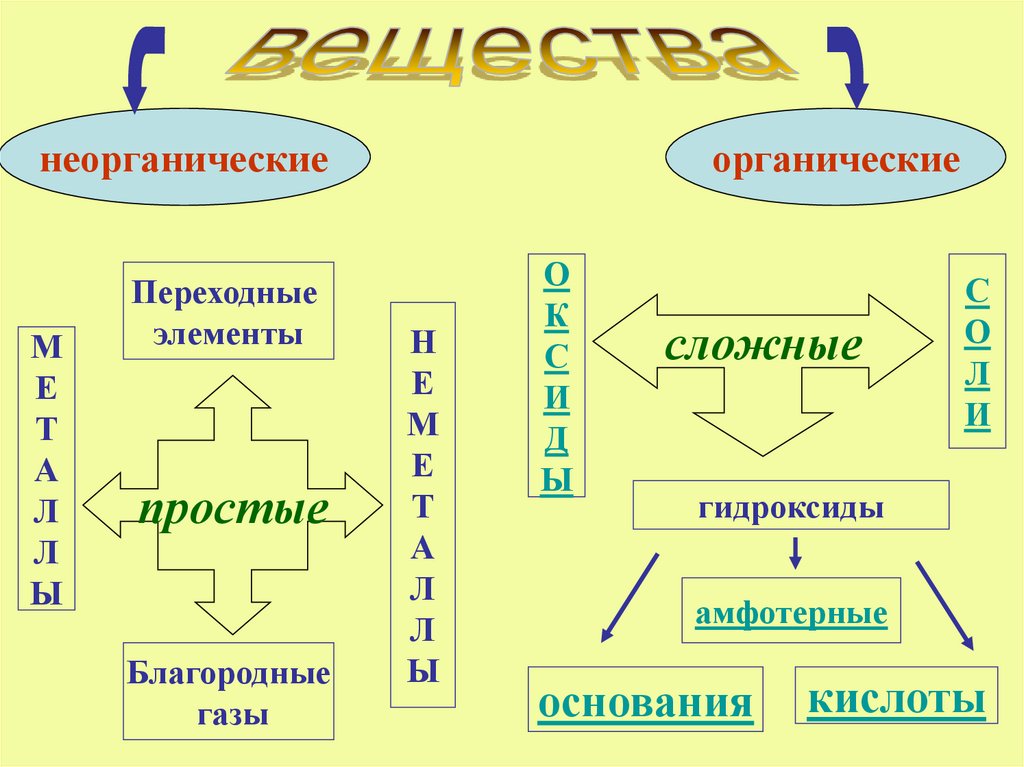
1.
неорганическиеМ
Е
Т
А
Л
Л
Ы
Переходные
элементы
простые
Благородные
газы
органические
Н
Е
М
Е
Т
А
Л
Л
Ы
О
К
С
И
Д
Ы
сложные
С
О
Л
И
гидроксиды
амфотерные
основания
кислоты
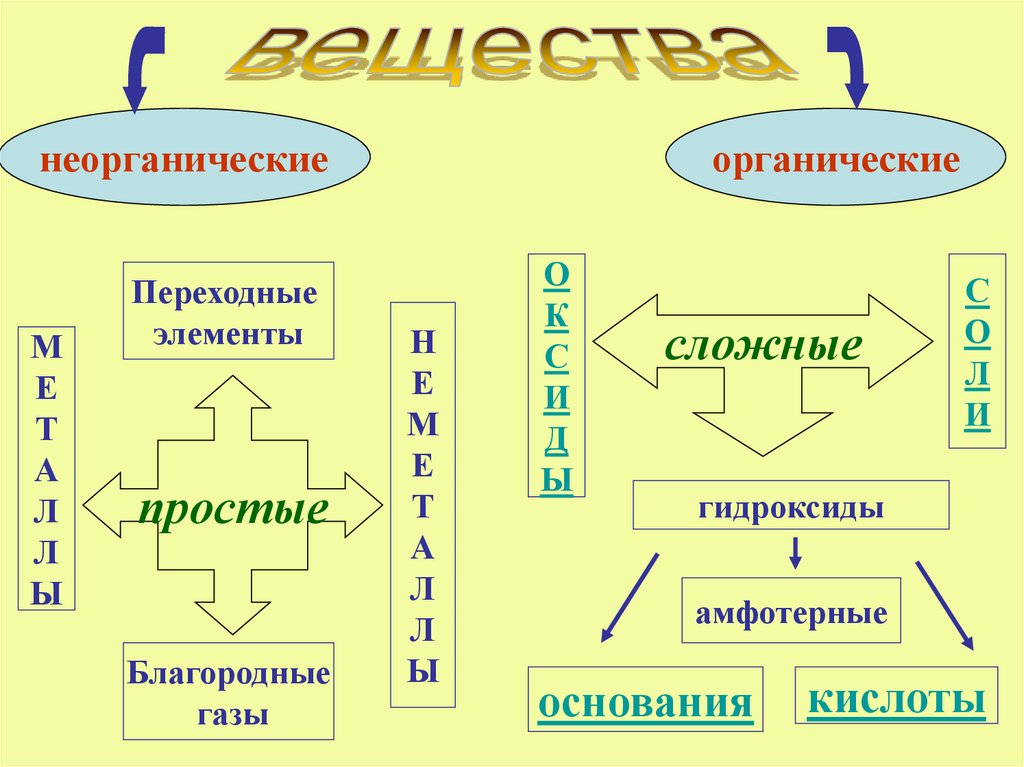
2.
неорганическиеМ
Е
Т
А
Л
Л
Ы
Переходные
элементы
простые
Благородные
газы
органические
Н
Е
М
Е
Т
А
Л
Л
Ы
О
К
С
И
Д
Ы
сложные
С
О
Л
И
гидроксиды
амфотерные
основания
кислоты
3.
1. Сложные вещества2. Два элемента
3. С. О. у кислорода -2
-2
ЭnOm
Солеобразующие несолеобразующие
CO, NO, SiO, N2O
Основные
основания
Na2O, CaO, CuO…
Амфотерные
амфотерные основания
BeO, Al2O3, ZnO…
Кислотные
кислоты
P2O5, SO3, SO2, CO2…
4.
1.Определите ряд формул, состоящих толькоиз:
а) кислотных оксидов
б) основных оксидов:
а) K2O, Nа2O, CuO;
b) CO2, P2O3, Cl2O;
c) MgO, BaO, ZnO;
d) Li2O, CaO, CO.
5.
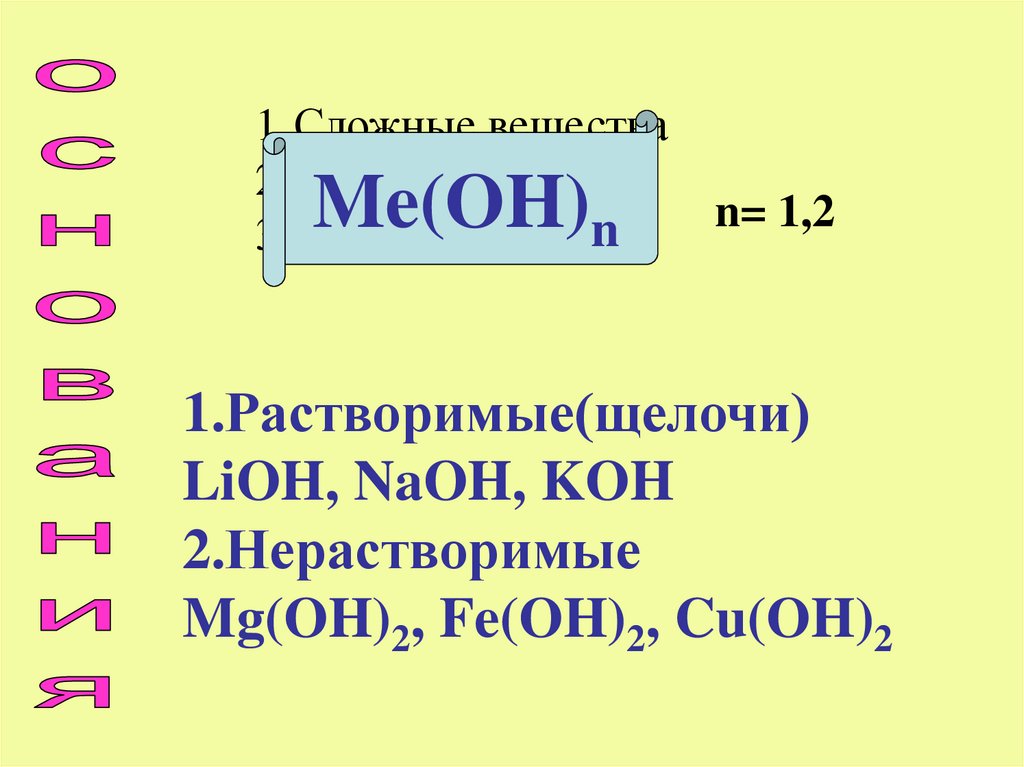
1.Сложные вещества2.Катион металла
n
3.Гидроксид - ионы
Me(OH)
n= 1,2
1.Растворимые(щелочи)
LiOH, NaOH, KOH
2.Нерастворимые
Mg(OH)2, Fe(OH)2, Cu(OH)2
6.
1.Сложные вещества2.Свойства кислот
3.Свойства оснований
AL2O3
Al(OH)3
с.о +3, +4
H3AlO3
с.о +2
ZnO
Zn(OH)2
H2ZnO2
7.
Различают:по кислотности
однокислотные
многокислотные
NaOH, LiOH,KOH Fe(OH)3, Cu(OH)2
по силе
сильные (α
100%)
основания щелочных и
щелочноземельных
металлов
слабые (α
основания других
металлов
и гидрат аммиака
0)
8.
2. ряд формул, в котором всевещества – основания:
a) Zn(OH)2 ZnCI2 H2O
б) Ca(OH)2 NaOH KOH
в) SO3 Mg(OH)2 CuO
г) KOH K2O
MgO
9.
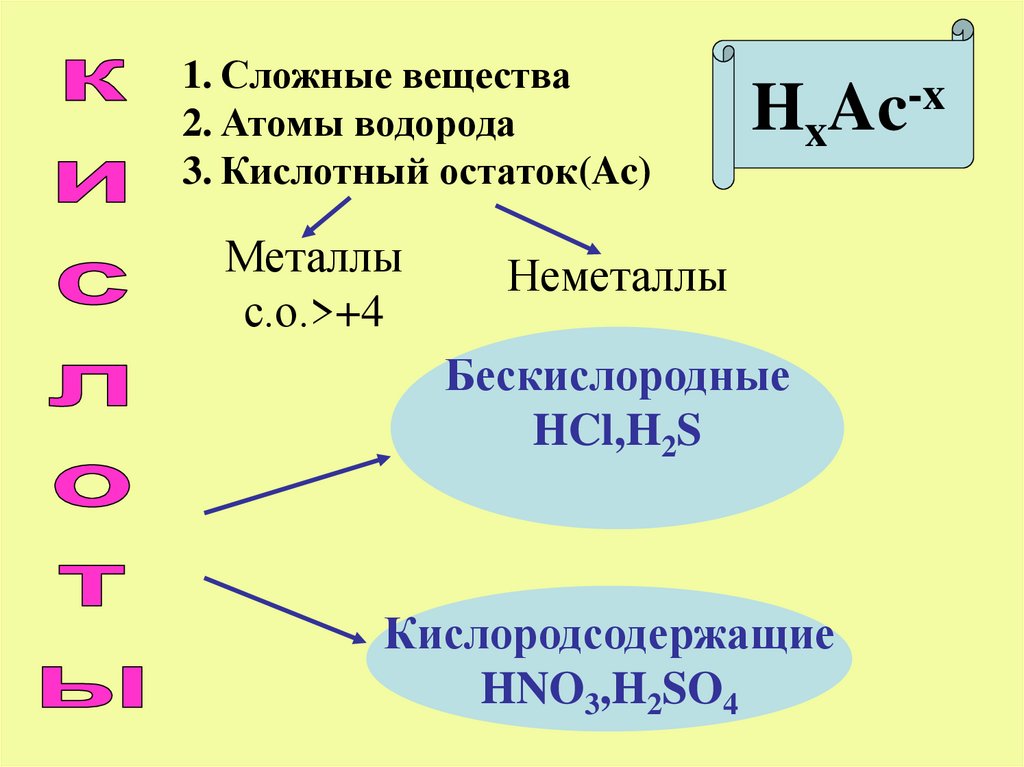
1. Сложные вещества2. Атомы водорода
3. Кислотный остаток(Ac)
Металлы
с.о.>+4
HxAc-x
Неметаллы
Бескислородные
HCl,H2S
Кислородсодержащие
HNO3,H2SO4
10.
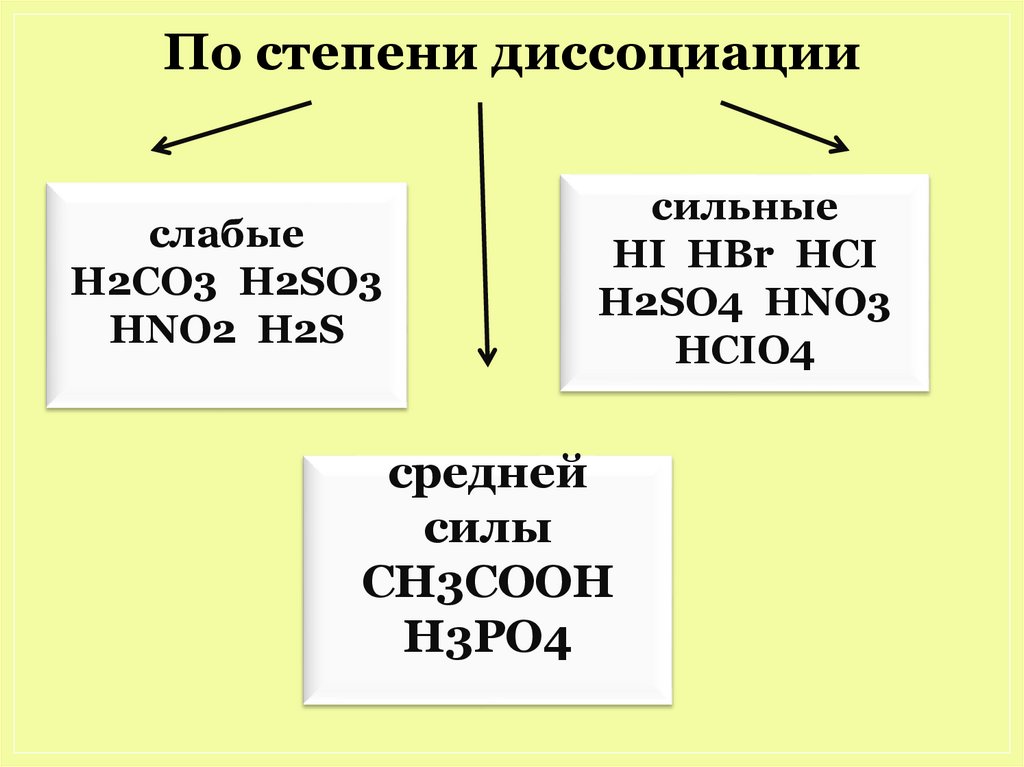
По степени диссоциациислабые
H2CO3 H2SO3
HNO2 H2S
cильные
HI HBr HCI
H2SO4 HNO3
HCIO4
средней
силы
CH3COOH
H3PO4
11.
3. Только кислоты расположеныв ряду:
а) HNO3, NO2 , NaNO3
б) HNO2, HNO3, HCOOH
в) Ba(HSO4)2, KHCO3, Zn(OH)CI
г) H2S, H2SO3, CH3COONa
12.
4. Ряд формул, в котором всевещества – кислоты:
А. HCI CaCI2 H2SO4
Б. HCI CuO HNO3
В. H2CO3 H2SO3 H3PO4
Г. NaOH H2S HI
13. 6.Соотнесите:
Названиекислот:
1.Серная
2.Угольная
3.Сернистая
4.Азотная
Формулы:
А) H2S
Б) H2CO3
В) H2SO4
Г) H2SO3
Д) HNO2
Е) HNO3
14.
7. Число формул кислот вследующем списке:
CaO
H2SO4
HCI
Cu(OH)2
HNO3
Na2CO3
SO3
H3PO4
NaOH H2S
AI2O3
Равно: а. 2 б. 3
в. 4 г. 5
15.
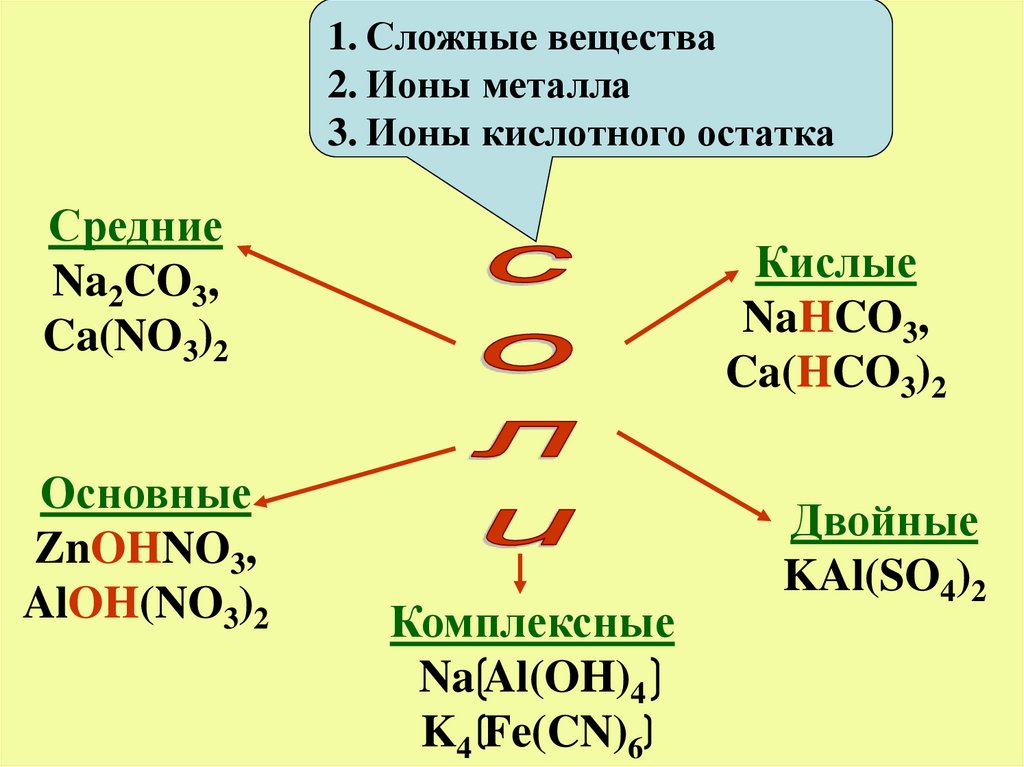
1. Сложные вещества2. Ионы металла
3. Ионы кислотного остатка
Средние
Na2CO3,
Ca(NO3)2
Основные
ZnOHNO3,
AlOH(NO3)2
Кислые
NaHCO3,
Ca(HCO3)2
Комплексные
Na Al(OH)4
K4 Fe(CN)6
Двойные
KAl(SO4)2
16.
средние17.
18.
основные19.
комплексные20.
8. Ряд формул, в котором всевещества – соли:
А. HCI CaCI2 H2SO4
Б. HCI CuSO4 HNO3
В. Na2CO3 K2SO3 H3PO4
Г. Na2S CaSO4 Cu(NO3)2
21.
9.Последовательность:основание, кислота, оксид,
соль:
А) N2O5, BaCO3, HNO3, Fe(OH)3
Б) Mg(OH)2, HCI, CO2, Na2CO3
В) CuO, NaOH, H3PO4, CaCO3
Г) P2O5, K3PO4, KOH, HNO3
22. 10. Провести классификацию веществ и дать названия
Ca, Cr(OH)3, H2SiO3, CO,K2O, N2O5, HBr, Cu(OH)2,
FeSO4, H3PO4, KHCO3,
Ca(OH)2, AlOHCl2, ZnO
















 Химия
Химия








