Похожие презентации:
Гидроксиды. Основания: способы получения
1. Гидроксиды. Основания: способы получения.
2. Цель урока:
Углубить знания о важнейших классах веществнеорганической химии
3. Формулы только оксидов приведены в ряду:
1.2.
3.
4.
H2SO3, BeO, CuCl2
Na2CO3, Na2O, Cl2O7
CO2, Li2O, CrO3
KOH, K2O, BaO
4. Не характеризует свойство основных оксидов:
1.2.
3.
4.
CaO + H2O → Ca(OH)2
SO3 + Na2O → Na2SO4
K2O + 2HCl → 2KCl + H2O
Zn(OH)2 → ZnO + H2O
5. Назовите вещества:
CONa2O
6. Гидроксиды. Основания: способы получения.
7.
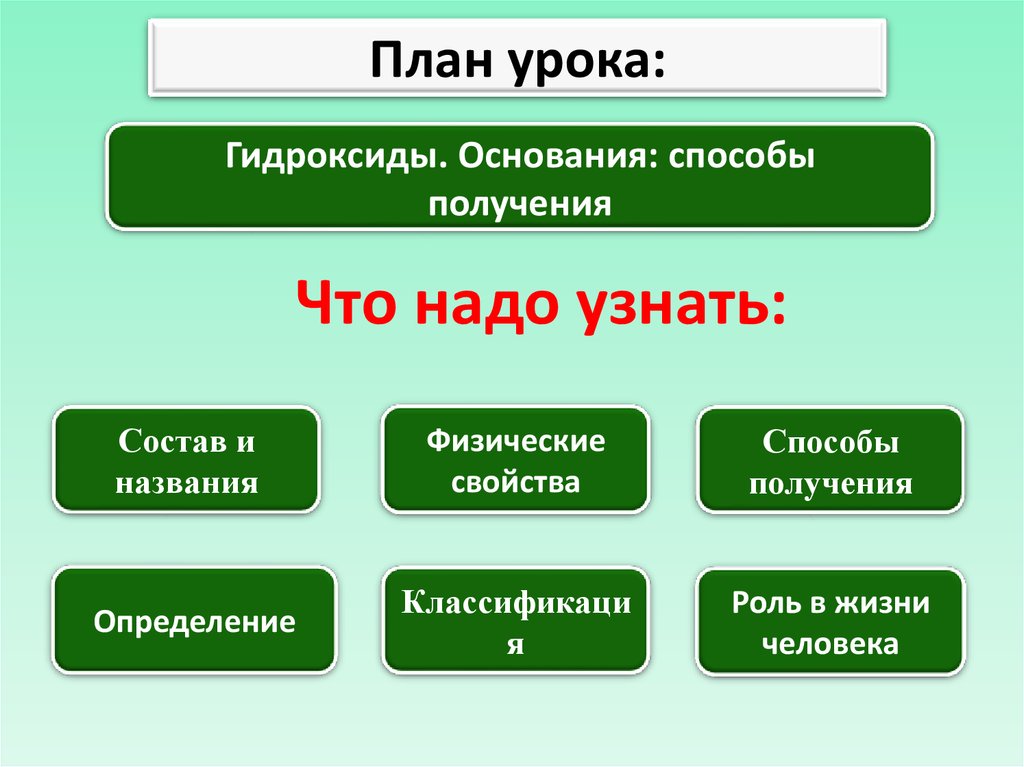
План урока:Гидроксиды. Основания: способы
получения
Что надо узнать:
Состав и
названия
Физические
свойства
Способы
получения
Определение
Классификаци
я
Роль в жизни
человека
8. K2O + H2O → 2KOH
9. K2O + H2O → 2KOH
Гидроксиды – это сложные вещества в составкоторых входят атомы металлов и
гидроксогруппы ОН.
!!! Число гидроксогрупп в формуле
гидроксида соответствует валентности металла
10. Гидроксиды. Основания: способы получения.
11.
Основания - это гидроксиды металлов IА иIIА (кроме Be), а также металлов в
минимальной степени окисления (если она
имеет переменное значение)
• Например: NaOH, LiOH, Mg(OH)2, Ca(OH)2,
Cr(OH)2, Mn(OH)2.
12. Работа с учебником:
Стр 137 «Классификация гидроксидов»Стр 139 «Физические свойства оснований»
? На какие группы можно классифицировать
основания?
? Физические свойства оснований?
13.
14.
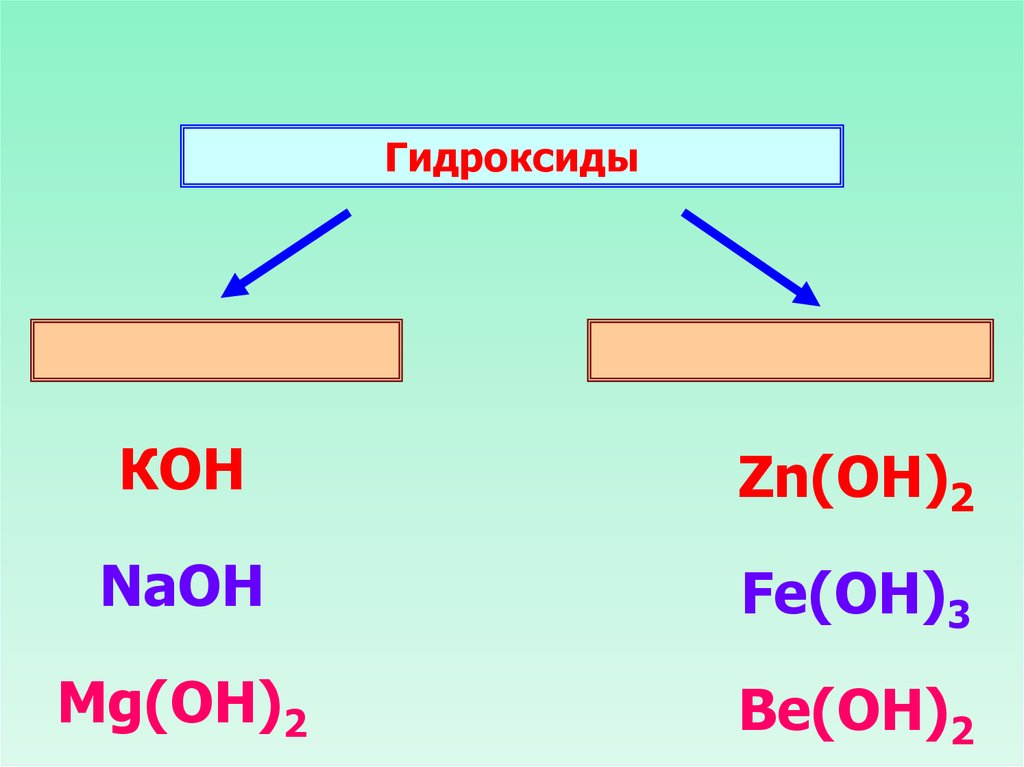
ГидроксидыКОН
Zn(ОН)2
NaOH
Fe(OH)3
Mg(OH)2
Be(OH)2
15.
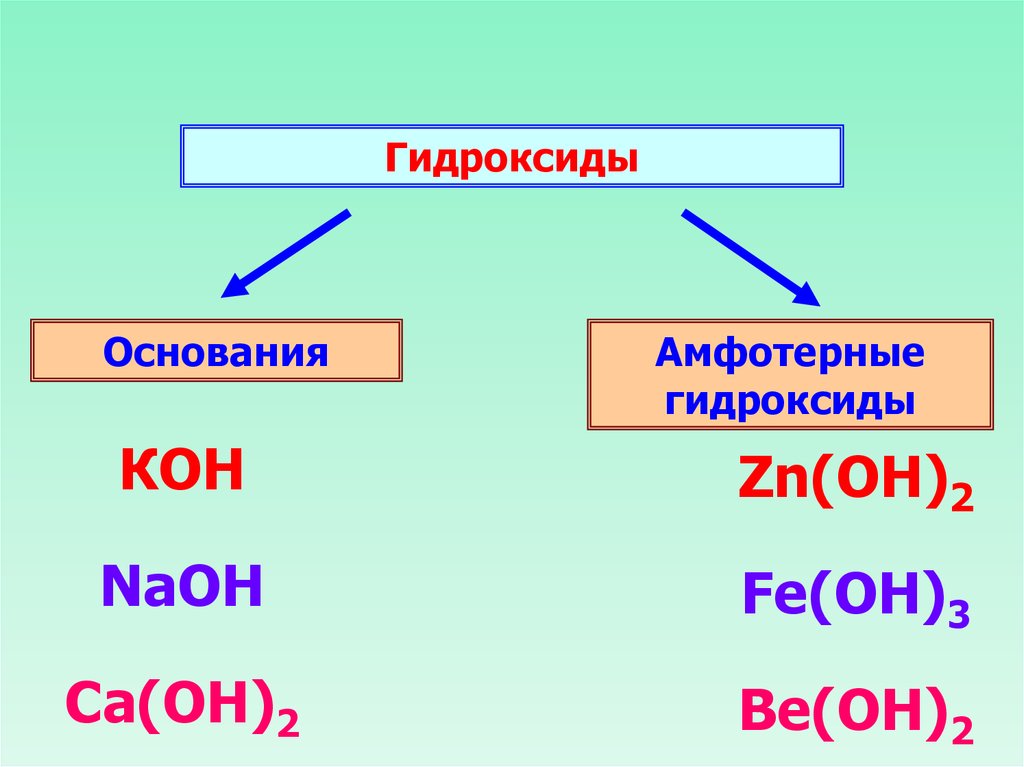
ГидроксидыОснования
Амфотерные
гидроксиды
КОН
Zn(ОН)2
NaOH
Fe(OH)3
Ca(OH)2
Be(OH)2
16.
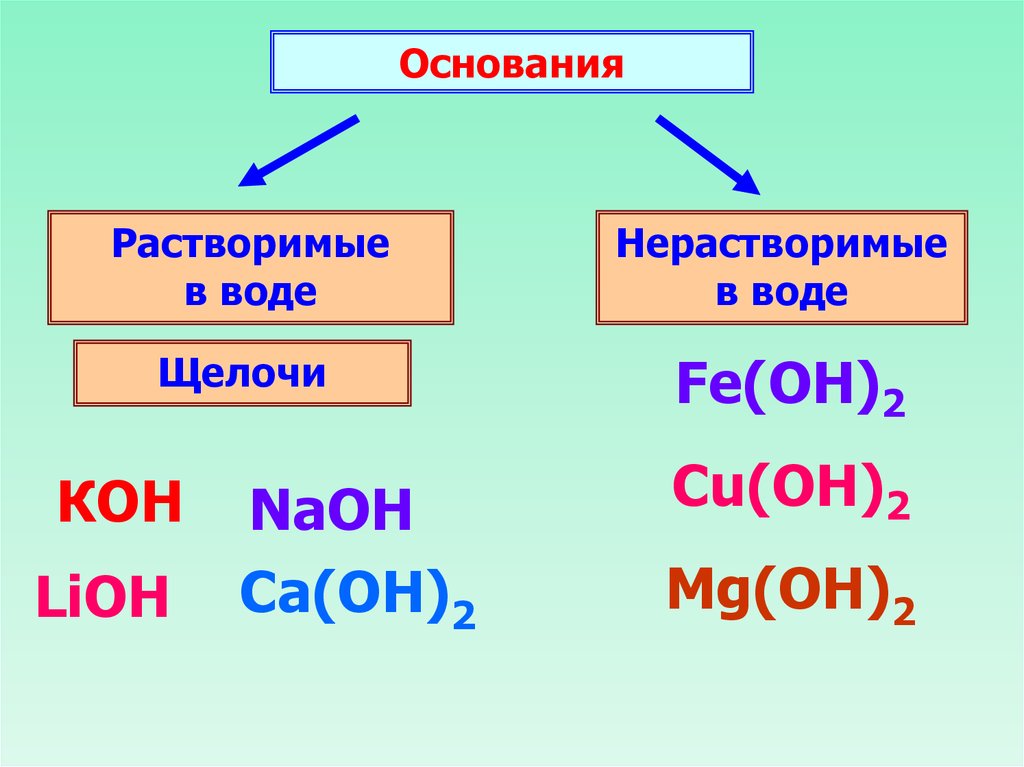
ОснованияРастворимые
в воде
Нерастворимые
в воде
Щелочи
Fe(OH)2
КОН
LiOH
NaOH
Ca(ОН)2
Cu(OH)2
Mg(ОН)2
17. NaOH – гидроксид натрия, едкий натр, каустическая сода
NaOH – гидроксид натрия, едкийкаустическая сода
натр,
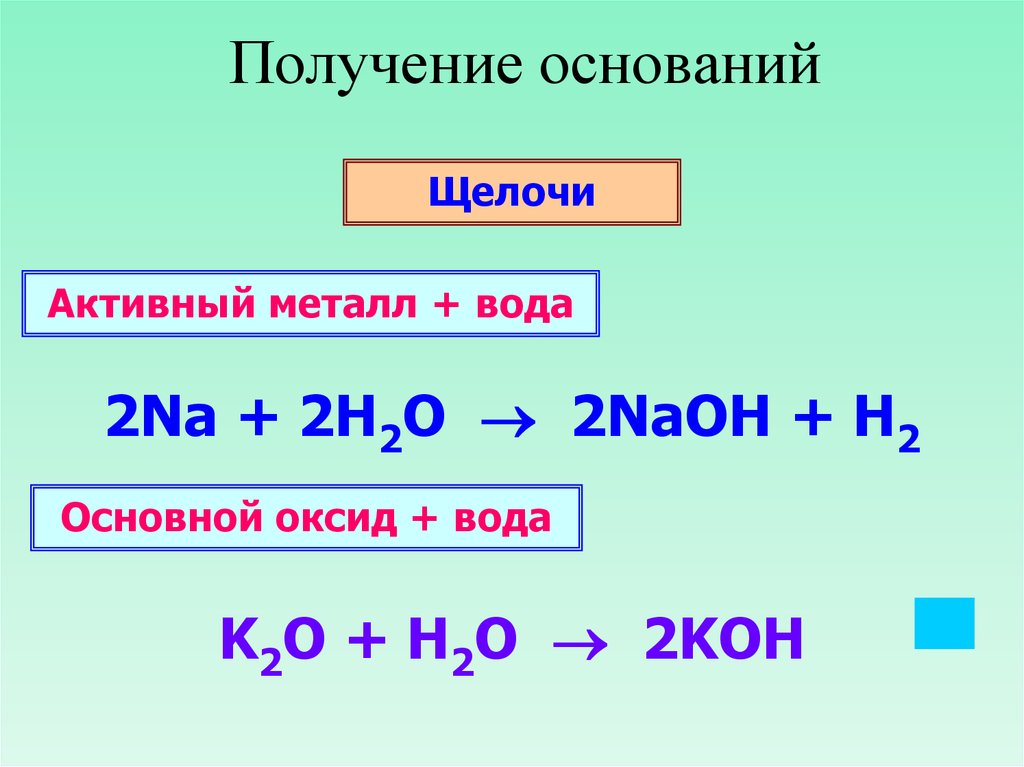
18. Получение оснований
ЩелочиАктивный металл + вода
2Na + 2H2O 2NaOH + H2
Основной оксид + вода
K2O + H2O 2KOH
19.
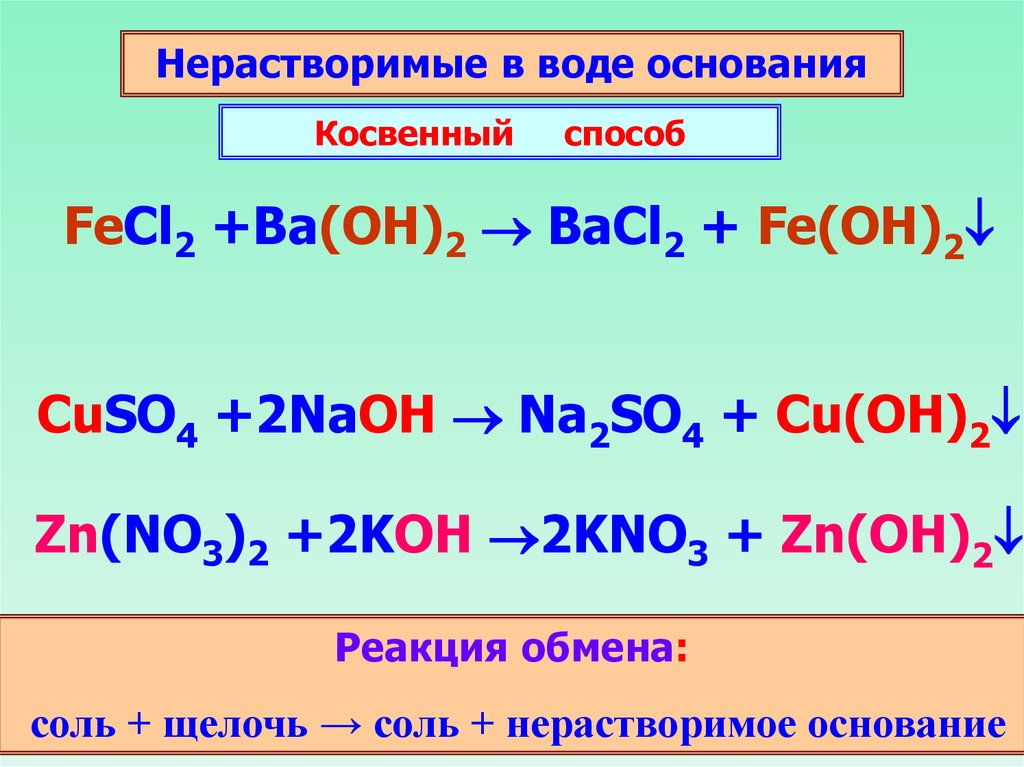
Нерастворимые в воде основанияКосвенный
способ
FeCl2 +Ba(OH)2 BaCl2 + Fe(OH)2
CuSO4 +2NaOH Na2SO4 + Cu(OH)2
Zn(NO3)2 +2KOH 2KNO3 + Zn(OH)2
Реакция обмена:
соль + щелочь → соль + нерастворимое основание
20.
План урока:Гидроксиды. Основания: способы
получения
Что надо узнать:
Состав и
названия
Определение
Физические
свойства
Способы
получения
Классификация
Роль в жизни
человека
21. Домашнее задание:
• §41• По задачнику
22.
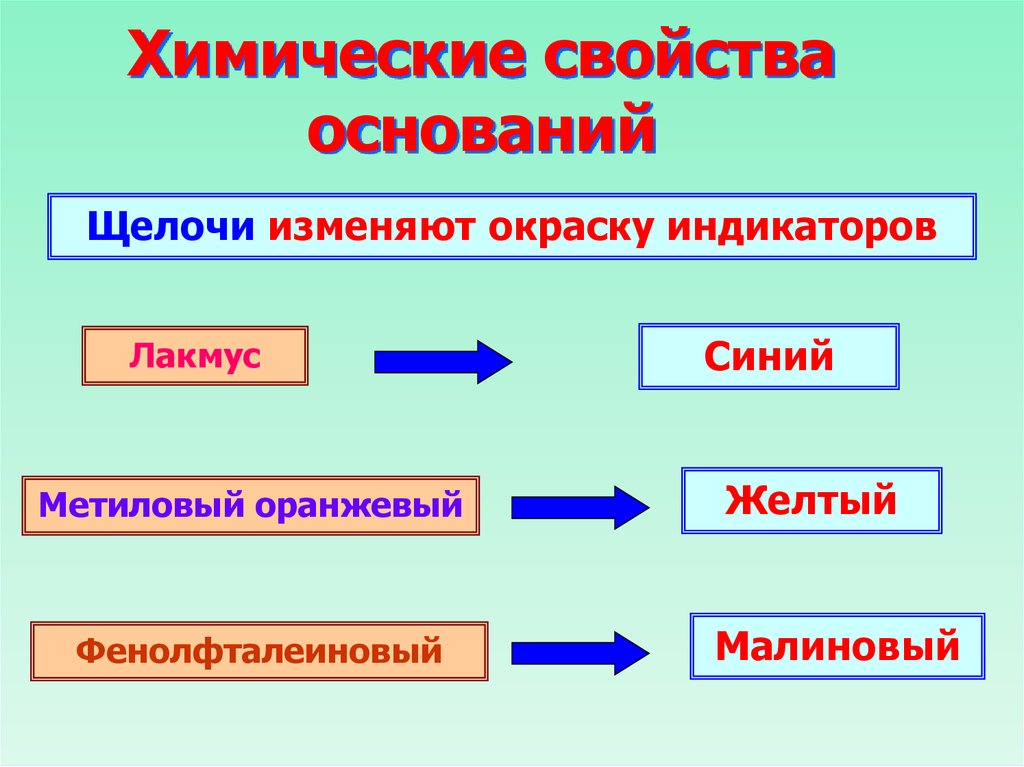
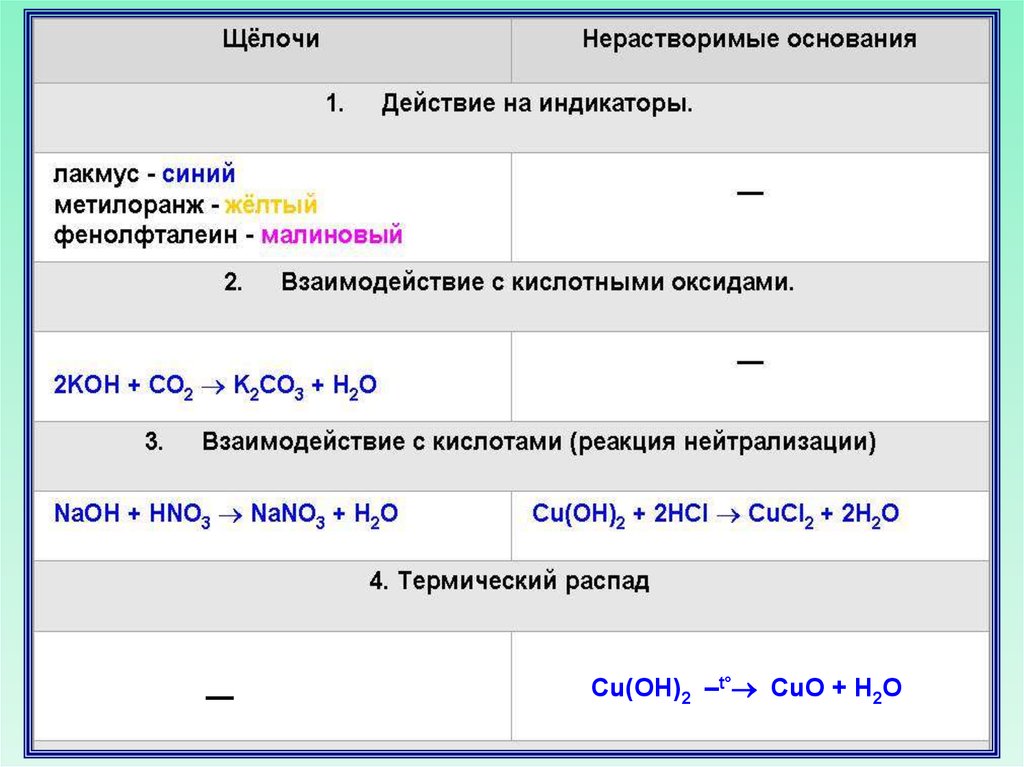
23. Химические свойства оснований
Щелочи изменяют окраску индикаторовЛакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
24.
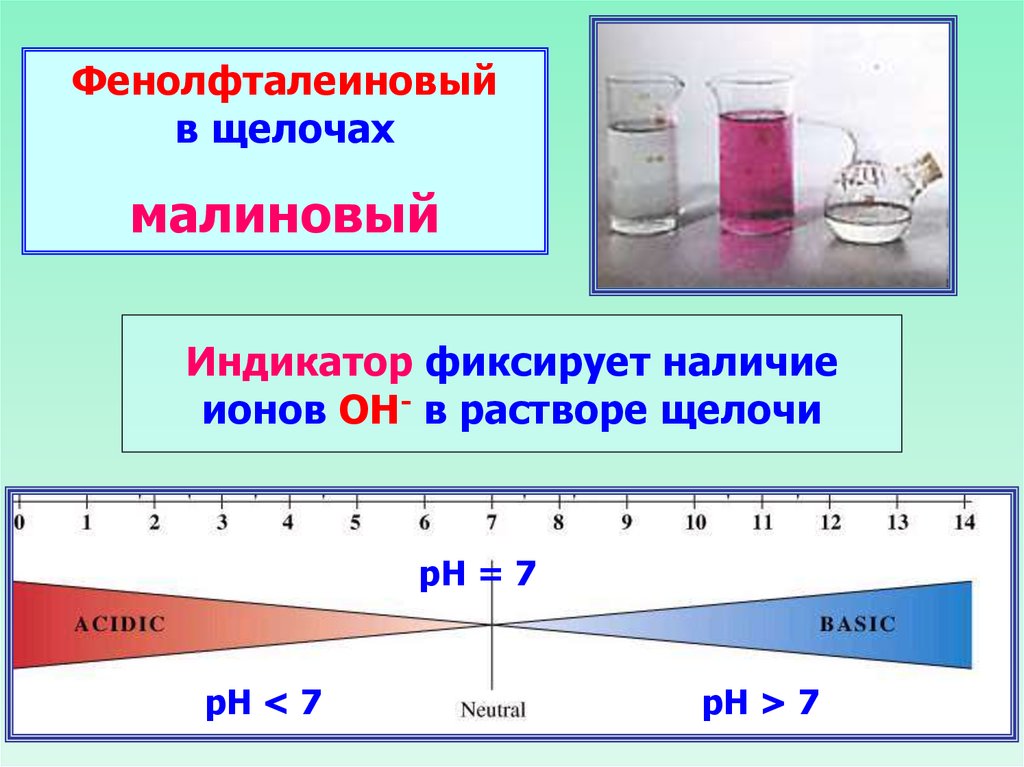
Фенолфталеиновыйв щелочах
малиновый
Индикатор фиксирует наличие
ионов ОН- в растворе щелочи
рН = 7
рН < 7
рН > 7
25.
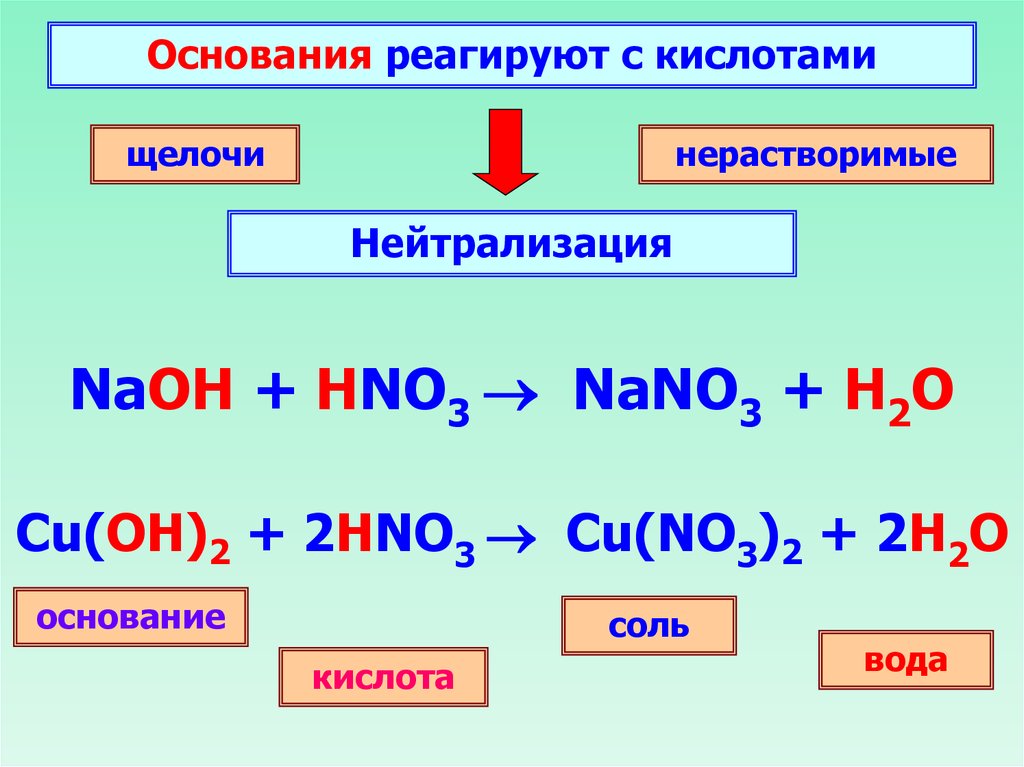
Основания реагируют с кислотамищелочи
нерастворимые
Нейтрализация
NaOH + HNO3 NaNO3 + H2O
Cu(OH)2 + 2HNO3 Cu(NO3)2 + 2H2O
основание
соль
кислота
вода
26.
27.
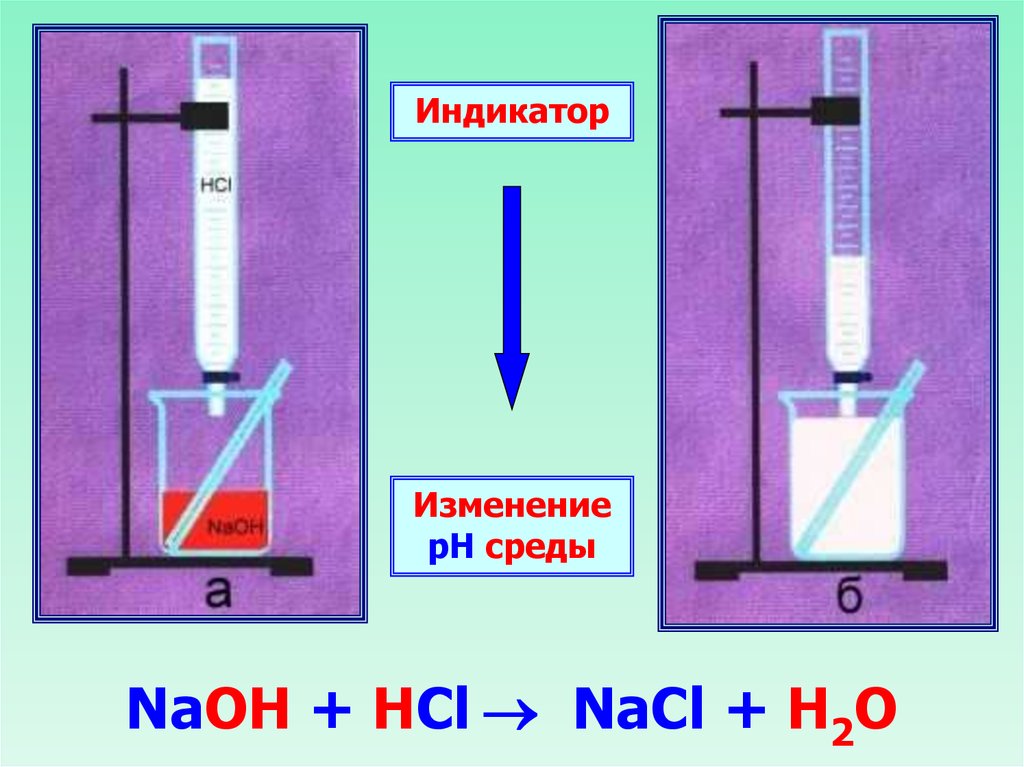
ИндикаторИзменение
рН среды
NaOH + HCl NaCl + H2O
28.
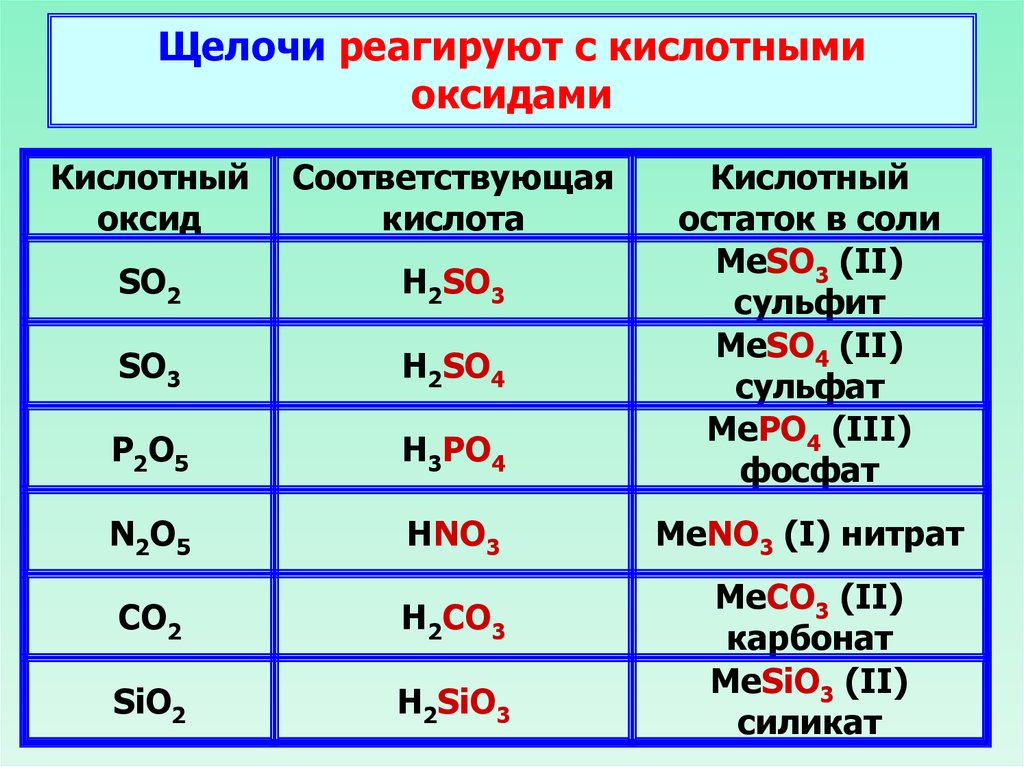
Щелочи реагируют с кислотнымиоксидами
Кислотный
оксид
Соответствующая
кислота
SO2
H2SO3
SO3
H2SO4
P2O5
H3PO4
Кислотный
остаток в соли
MeSO3 (II)
сульфит
MeSO4 (II)
сульфат
MePO4 (III)
фосфат
N2O5
HNO3
MeNO3 (I) нитрат
CO2
H2CO3
SiO2
H2SiO3
MeCO3 (II)
карбонат
MeSiO3 (II)
силикат
29.
6NaOH + P2O5 2Na3PO4 + 3H2OЩелочь
+
Кислотный
оксид
Соль
Н3 PO4
+
Вода
2KOH + CO2 K2CO3 + H2O
Н2 CO3
Нейтрализация
30.
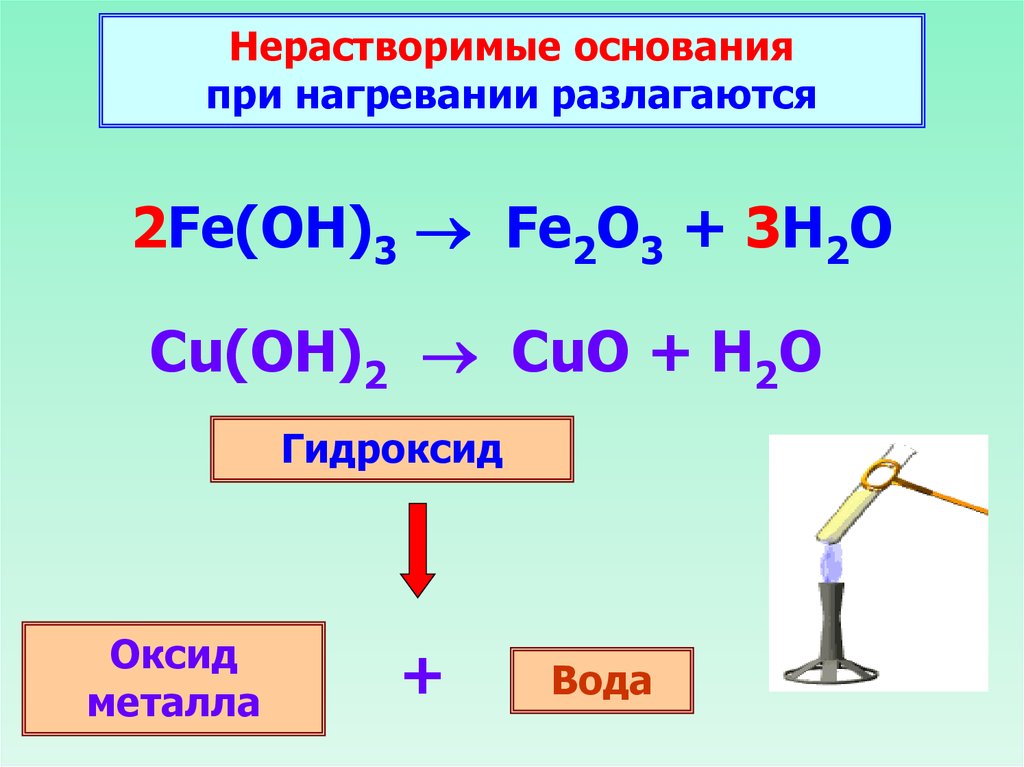
Нерастворимые основанияпри нагревании разлагаются
2Fe(OH)3 Fe2O3 + 3H2O
Cu(OH)2 CuO + H2O
Гидроксид
Оксид
металла
+
Вода
31.
––Cu(OH)2 –t° CuO + H2O
32.
33. Определение оснований
Ме(ОН)nКОН
Гидроксиды
Ca(ОН)2 Al(ОН)3
Ba(ОН)2
KOH K+1 + OH-1
Ba(ОН)2 Ba+2 + 2 OH-1
Основания – вещества, в растворах которых
содержатся гидроксильные ионы
34. Сильные и слабые основания
Сильные основанияNaOH гидроксид
натрия (едкий натр)
KOH гидроксид калия
(едкое кали)
LiOH гидроксид
лития
Ba(OH)2 гидроксид
бария
Ca(OH)2 гидроксид
кальция
Слабые основания
Mg(OH)2 гидроксид
магния
Fe(OH)2 гидроксид
железа (II)
Zn(OH)2 гидроксид
цинка
NH4OH гидроксид
аммония
Fe(OH)3 гидроксид
железа (III)



















 Химия
Химия








