Похожие презентации:
Введение в химическую связь
1.
Введение вхимическую связь
Химическая связь - это сила, удерживающая атомы вместе,
образуя молекулы и соединения. Она возникает благодаря
электростатическим взаимодействиям между атомами.
Существуют разные типы химических связей, и каждый из них
имеет свои особенности.
Сделано: Абдыкадыров Азамат, Уразбаев Кир, Улитин Илья,
Кириллов Владислав, Бацко Артём, Кучеренко Денис, Храмов
Даниил, Алещенко Милена
2.
Ионная связь: определение ихарактеристики
Ионная связь - это тип химической связи, образующейся между атомами с большой разницей в
электроотрицательности. При этом один атом отдаёт электроны, становясь положительно заряженным ионом
(катионом), а другой атом присоединяет эти электроны, становясь отрицательно заряженным ионом (анионом).
Прочность
Направление
Полярность
Ионная связь считается сильной
Ионная связь не имеет
Ионные связи являются
связью, что обусловлено сильным
определенного направления, а
полярными, поскольку существует
электростатическим притяжением
действует во всех направлениях,
разделение заряда между
между катионами и анионами.
окружая каждый ион.
ионами.
3.
Образование ионной связиОбразование ионной связи происходит при взаимодействии атомов с различной электроотрицательностью. Например, атом натрия (Na)
отдает один электрон атому хлора (Cl), образуя положительно заряженный ион натрия (Na+) и отрицательно заряженный ион хлора ( Cl-).
Между ними возникает сильное электростатическое притяжение, ф ормируя ионную связь.
Потеря электрона
Присоединение электрона
Атом натрия отдает электрон, становясь
Атом хлора получает электрон, становясь
катионом.
анионом.
Электростатическое притяжение
Ионы Na+ и Cl- притягиваются друг к другу,
образуя ионную связь.
4.
Свойства веществ с ионной связьюВещества с ионной связью обладают характерными свойствами. Они обычно твердые при
комнатной температуре, имеют высокую температуру плавления и кипения, растворимы в
полярных растворителях (например, воде).
1
Твердость
2
Хрупкость
Ионные соединения имеют твердую
При ударе легко разрушаются, так как
структуру, так как ионы прочно
при сдвиге ионов одноименного
удерживаются друг к другу.
заряда оказываются рядом, и
электростатическое отталкивание
приводит к разрушению
кристаллической решетки.
3
Проводимость
4
Растворимость
Ионные соединения проводят
Ионные соединения хорошо
электрический ток только в
растворимы в полярных
расплавленном состоянии или в
растворителях, таких как вода, так как
растворе, когда ионы могут свободно
полярные молекулы воды могут
перемещаться.
окружать ионы, ослабляя ионные
связи.
5.
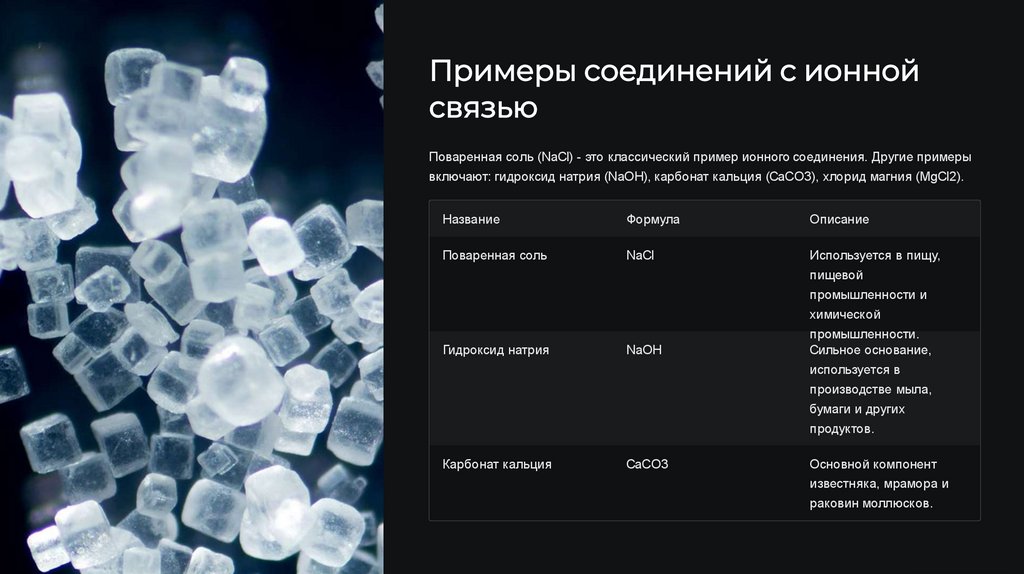
Примеры соединений с ионнойсвязью
Поваренная соль (NaCl) - это классический пример ионного соединения. Другие примеры
включают: гидроксид натрия (NaOH), карбонат кальция (CaCO3), хлорид магния (MgCl2).
Название
Формула
Описание
Поваренная соль
NaCl
Используется в пищу,
пищевой
промышленности и
химической
Гидроксид натрия
NaOH
промышленности.
Сильное основание,
используется в
производстве мыла,
бумаги и других
продуктов.
Карбонат кальция
CaCO3
Основной компонент
известняка, мрамора и
раковин моллюсков.
6.
Металлическая связь: определение и характеристикиМеталлическая связь - это тип химической связи, возникающей между атомами металлов, в которой электроны свободно перемещаются
между атомами, образуя "электронный газ".
Делокализованные электроны
Сила связи
Электропроводность
Электроны не связаны с конкретным
Металлическая связь считается сильной,
Свободные электроны в металлической
атомом, а свободно перемещаются по
так как электронный газ обеспечивает
связи позволяют металлам легко
всему куску металла.
прочное электростатическое притяжение
проводить электрический ток.
между атомами.
7.
Образование металлической связиВ металлах атомы расположены близко друг к другу. Валентные электроны внешних электронных оболочек атомов металлов
слабо связаны с ядрами и легко переходят в общее электронное облако. Это общее облако электронов свободно перемещается
по всему куску металла.
Атомы металла
Свободные электроны
Электронное облако
Атомы металла имеют слабо связанные
Валентные электроны становятся
Свободные электроны свободно
валентные электроны.
делокализованными, образуя
перемещаются по всему металлу,
электронный газ.
образуя электронное облако.
8.
Свойства веществ с металлическойсвязью
Вещества с металлической связью имеют ряд характерных свойств, обусловленных наличием
электронного газа. Металлы обычно твердые, ковкие, пластичные и обладают высокой тепло- и
электропроводностью.
1
Твердость
Металлическая связь обеспечивает прочную структуру, что делает металлы твердыми.
2
Пластичность
Атомы металла могут скользить друг относительно друга, что позволяет изменять
форму металла без разрушения.
3
Теплопроводность
Свободные электроны легко передают тепловую энергию, обеспечивая высокую
теплопроводность.
4
Электропроводность
Свободные электроны легко перемещаются в электрическом поле, обеспечивая
высокую электропроводность.
9.
Примеры металлов и сплавовМеталлы - это важный компонент нашей жизни. Они широко используются в строительстве, промышленности,
электронике и других областях.
Золото
Медь
Алюминий
Используется в ювелирной
Применяется в электропроводке,
Используется в производстве
промышленности, электронике и
водопроводе и других областях.
упаковочных материалов, посуды и
медицине.
самолетов.
10.
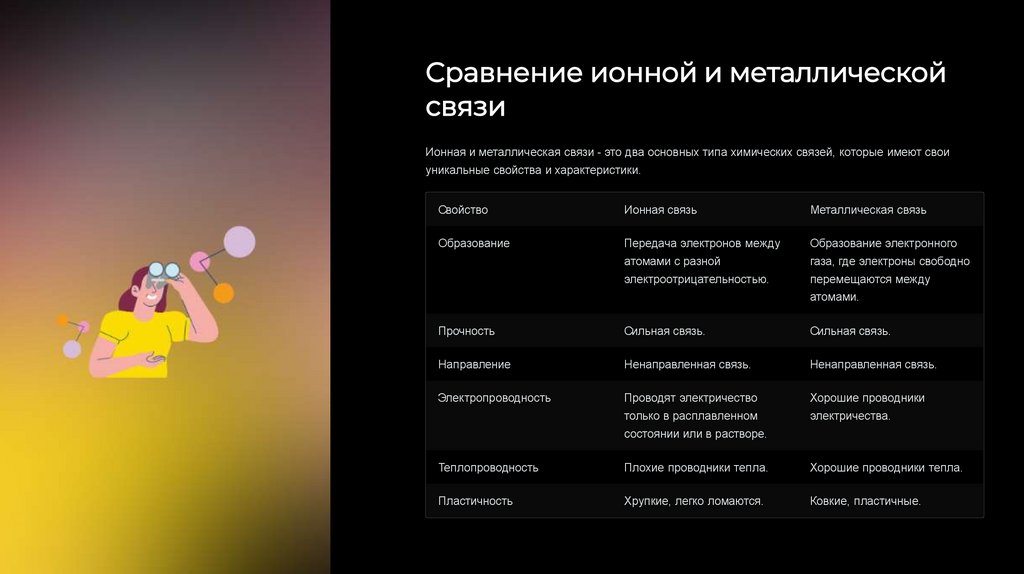
Сравнение ионной и металлическойсвязи
Ионная и металлическая связи - это два основных типа химических связей, которые имеют свои
уникальные свойства и характеристики.
Свойство
Ионная связь
Металлическая связь
Образование
Передача электронов между
Образование электронного
атомами с разной
газа, где электроны свободно
электроотрицательностью.
перемещаются между
атомами.
Прочность
Сильная связь.
Сильная связь.
Направление
Ненаправленная связь.
Ненаправленная связь.
Электропроводность
Проводят электричество
Хорошие проводники
только в расплавленном
электричества.
состоянии или в растворе.
Теплопроводность
Плохие проводники тепла.
Хорошие проводники тепла.
Пластичность
Хрупкие, легко ломаются.
Ковкие, пластичные.








 Химия
Химия








