Похожие презентации:
Химическая связь
1.
Химическая связь2. Химическая связь
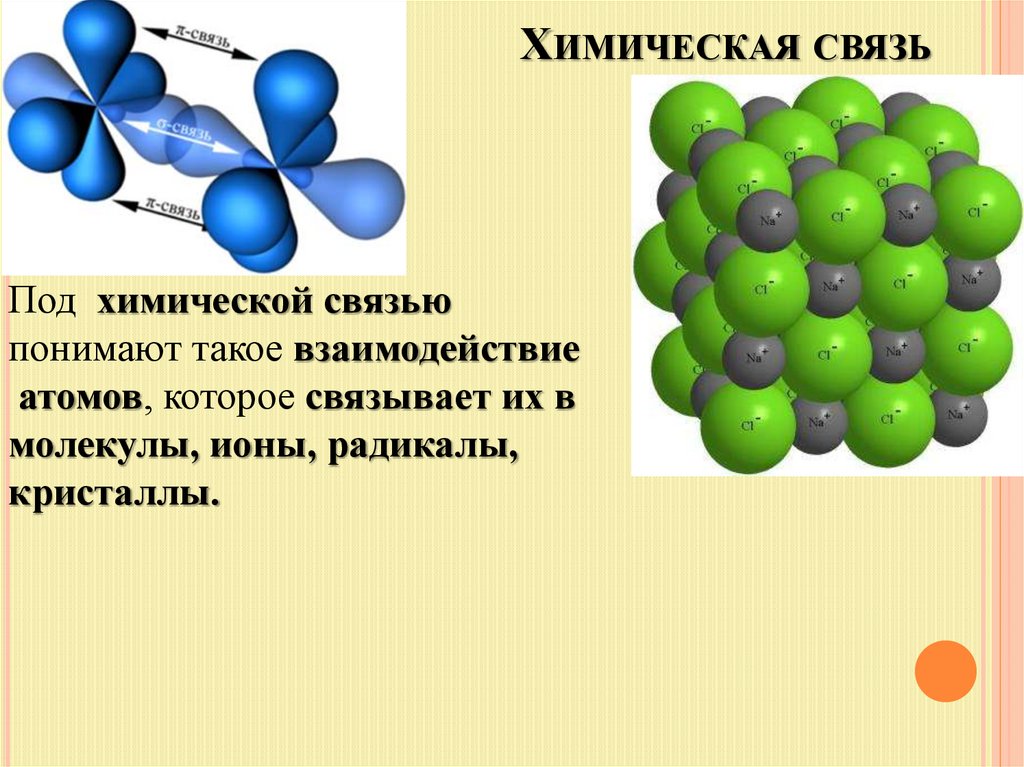
ХИМИЧЕСКАЯ СВЯЗЬПод химической связью
понимают такое взаимодействие
атомов, которое связывает их в
молекулы, ионы, радикалы,
кристаллы.
3. Причины образования химической связи:
ПРИЧИНЫ ОБРАЗОВАНИЯ ХИМИЧЕСКОЙ СВЯЗИ:Неустойчивость
атомов с незавершённым внешним
уровнем и стремление к его заполнению.
Стремление к минимуму энергии.
По современным данным химическая связь
определяется взаимодействием положительно
заряженных ядер и отрицательно заряженных
электронов.
Значит, природа химической связи
электростатическая.
4. Электроотрицательность (ЭО) -
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО) - это способность атомов элементовоттягивать к себе общие электронные пары
в химических соединениях.
Значения электроотрицательности элементов
позволяют определить:
- заряды атомов в соединении;
- сдвиг электронов при образовании
химической связи.
5. Изменение электроотрицательности в Периодической системе
ИЗМЕНЕНИЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ВПЕРИОДИЧЕСКОЙ СИСТЕМЕ
С увеличением порядкового номера элементов ЭО
изменяется периодически.
В периоде она растёт слева направо при накоплении
электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа
электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые
маленькие атомы с семью внешними электронами — атомы
галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с
одним внешним электроном — атома щелочного металла.
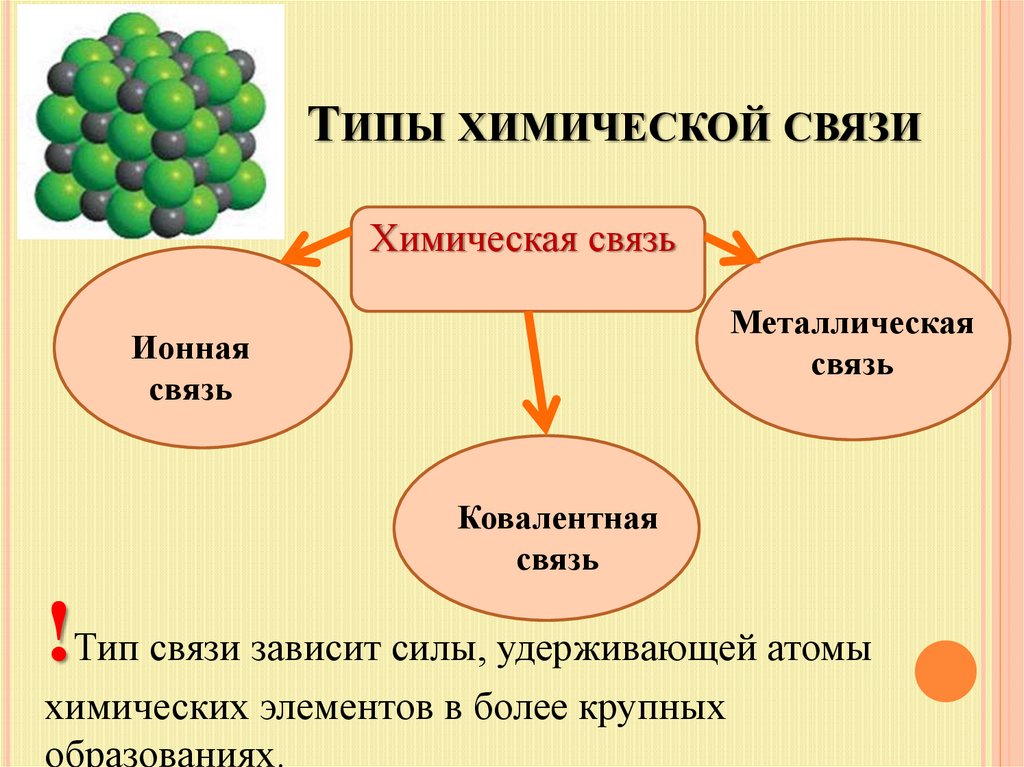
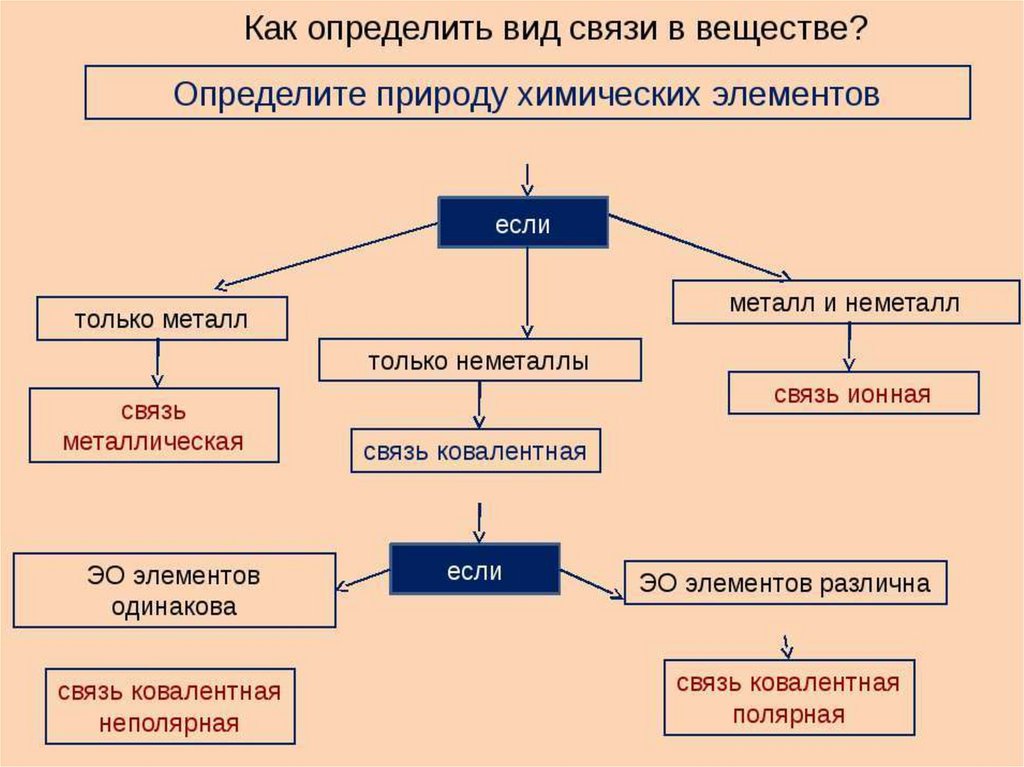
6. Типы химической связи
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИХимическая связь
Металлическая
связь
Ионная
связь
Ковалентная
связь
!Тип связи зависит силы, удерживающей атомы
химических элементов в более крупных
образованиях.
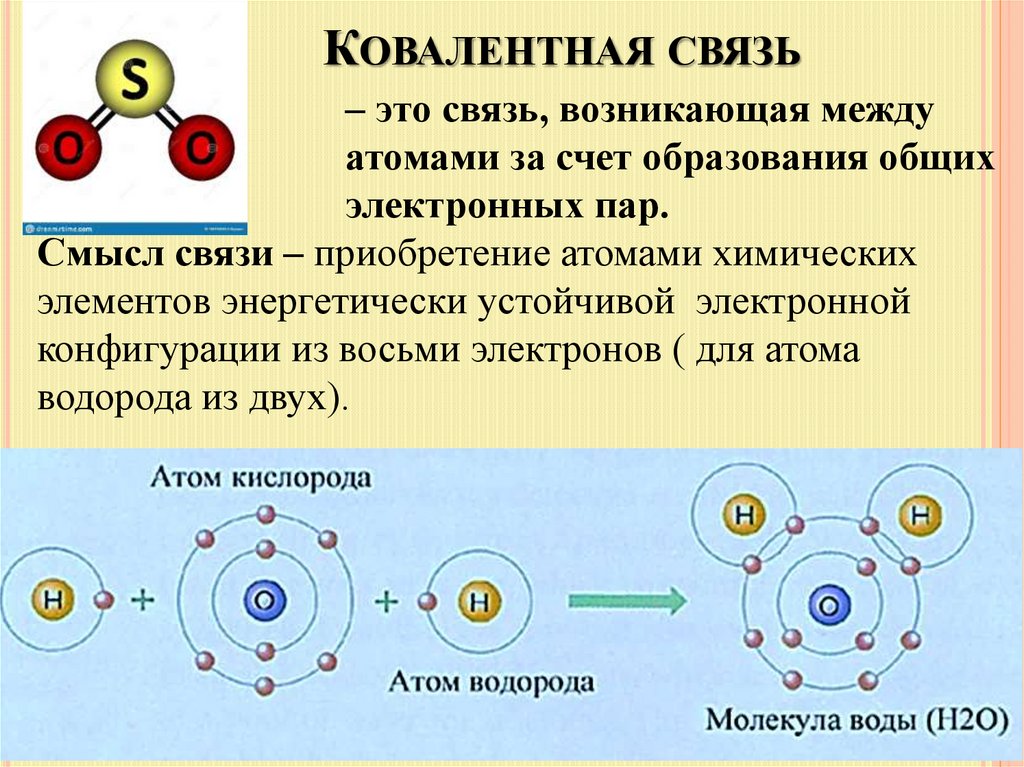
7. Ковалентная связь
КОВАЛЕНТНАЯ СВЯЗЬ– это связь, возникающая между
атомами за счет образования общих
электронных пар.
Смысл связи – приобретение атомами химических
элементов энергетически устойчивой электронной
конфигурации из восьми электронов ( для атома
водорода из двух).
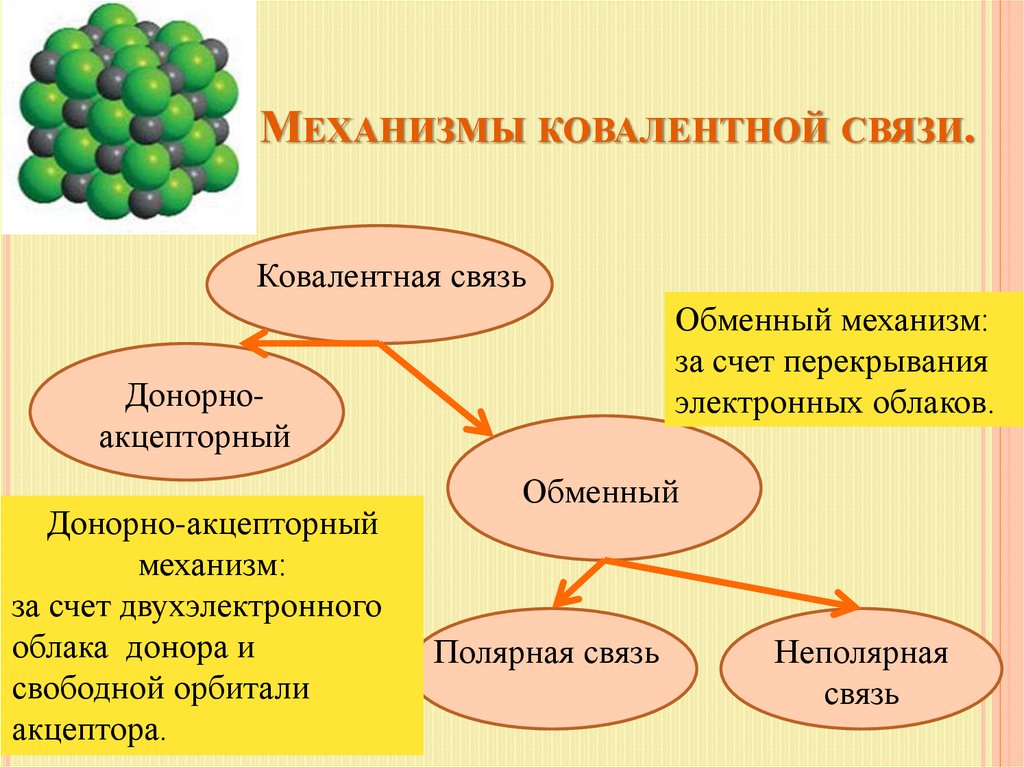
8. Механизмы ковалентной связи.
МЕХАНИЗМЫ КОВАЛЕНТНОЙ СВЯЗИ.Ковалентная связь
Обменный механизм:
за счет перекрывания
электронных облаков.
Донорноакцепторный
Донорно-акцепторный
механизм:
за счет двухэлектронного
облака донора и
свободной орбитали
акцептора.
Обменный
Полярная связь
Неполярная
связь
9. Ковалентная связь
КОВАЛЕНТНАЯ СВЯЗЬКовалентная связь образуется при взаимодействии
неметаллов.
Атомы неметаллов имеют высокую
электроотрицательность и стремятся заполнить
внешний электронный слой за счёт чужих электронов,
чтобы перейти в устойчивое состояние.
По степени смещенности общих электронных пар
к одному из связанных ими атомов ковалентная
связь может быть полярной и неполярной.
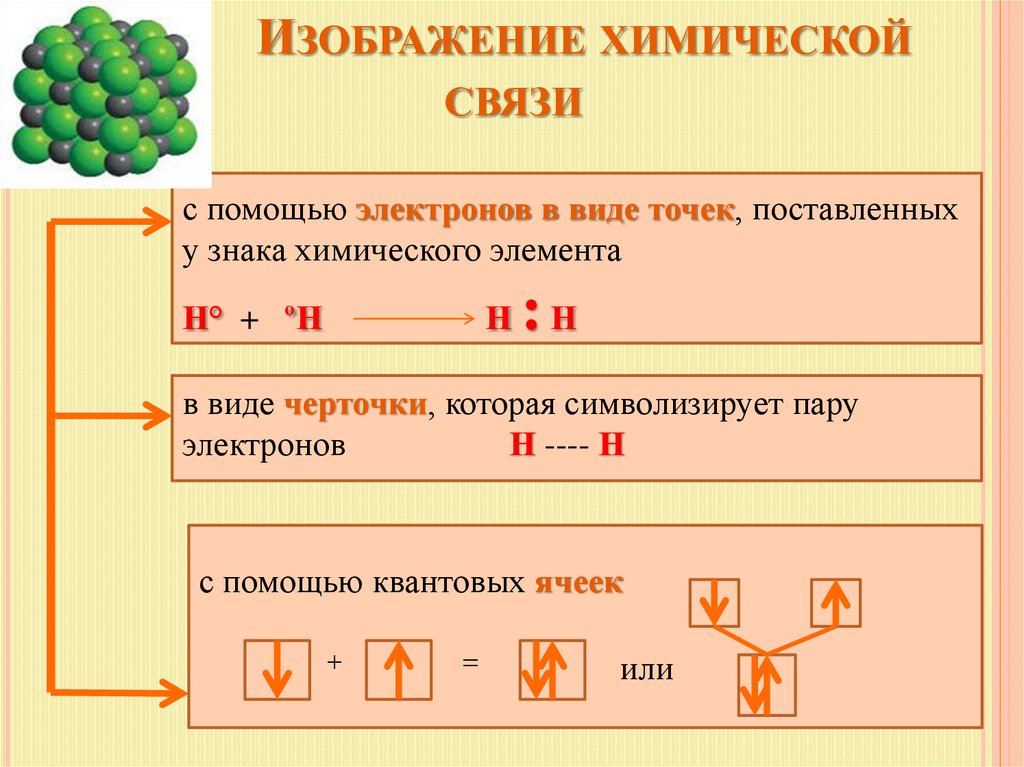
10. Изображение химической связи
ИЗОБРАЖЕНИЕ ХИМИЧЕСКОЙСВЯЗИ
с помощью электронов в виде точек, поставленных
у знака химического элемента
Н° + ºН
Н
:Н
в виде черточки, которая символизирует пару
электронов
Н ---- Н
с помощью квантовых ячеек
+
=
или
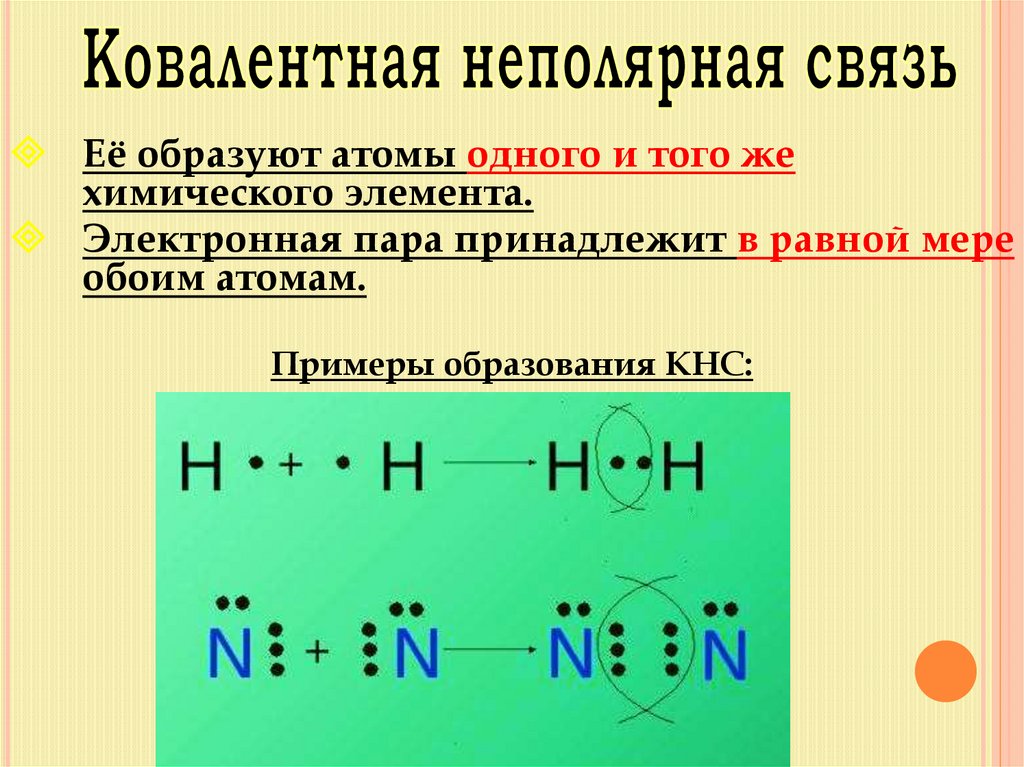
11.
Её образуют атомы одного и того жехимического элемента.
Электронная пара принадлежит в равной мере
обоим атомам.
Примеры образования КНС:
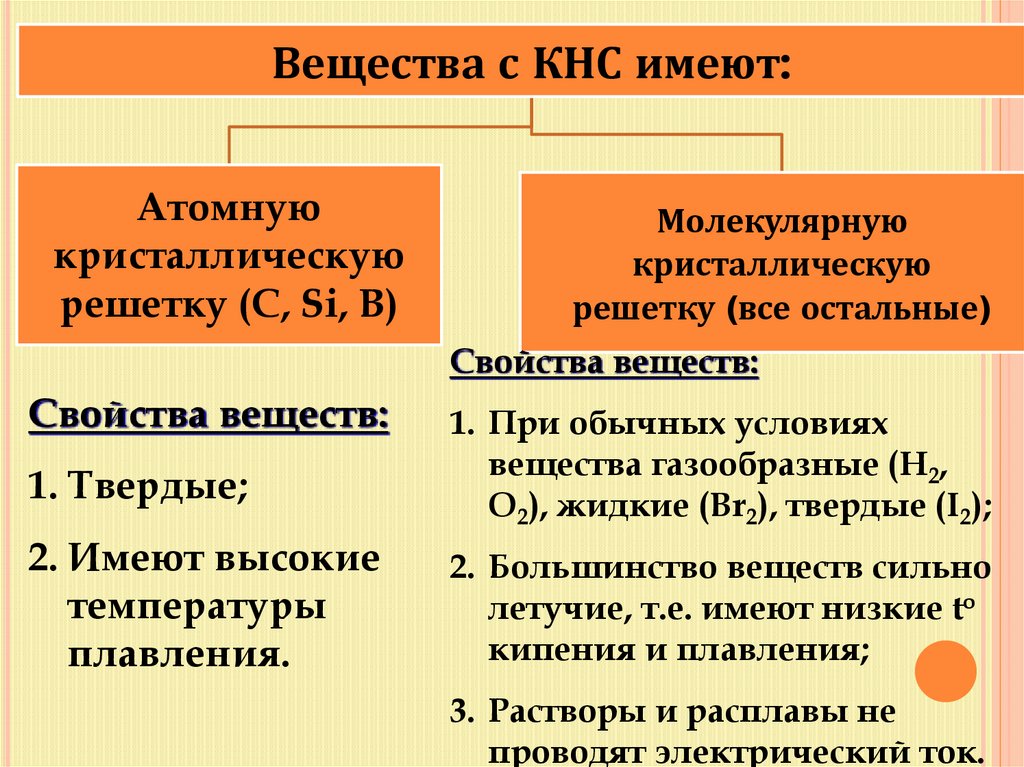
12.
Вещества с КНС имеют:Атомную
кристаллическую
решетку (C, Si, B)
Молекулярную
кристаллическую
решетку (все остальные)
Свойства веществ:
Свойства веществ:
1. Твердые;
2. Имеют высокие
температуры
плавления.
1. При обычных условиях
вещества газообразные (H2,
O2), жидкие (Br2), твердые (I2);
2. Большинство веществ сильно
летучие, т.е. имеют низкие to
кипения и плавления;
3. Растворы и расплавы не
проводят электрический ток.
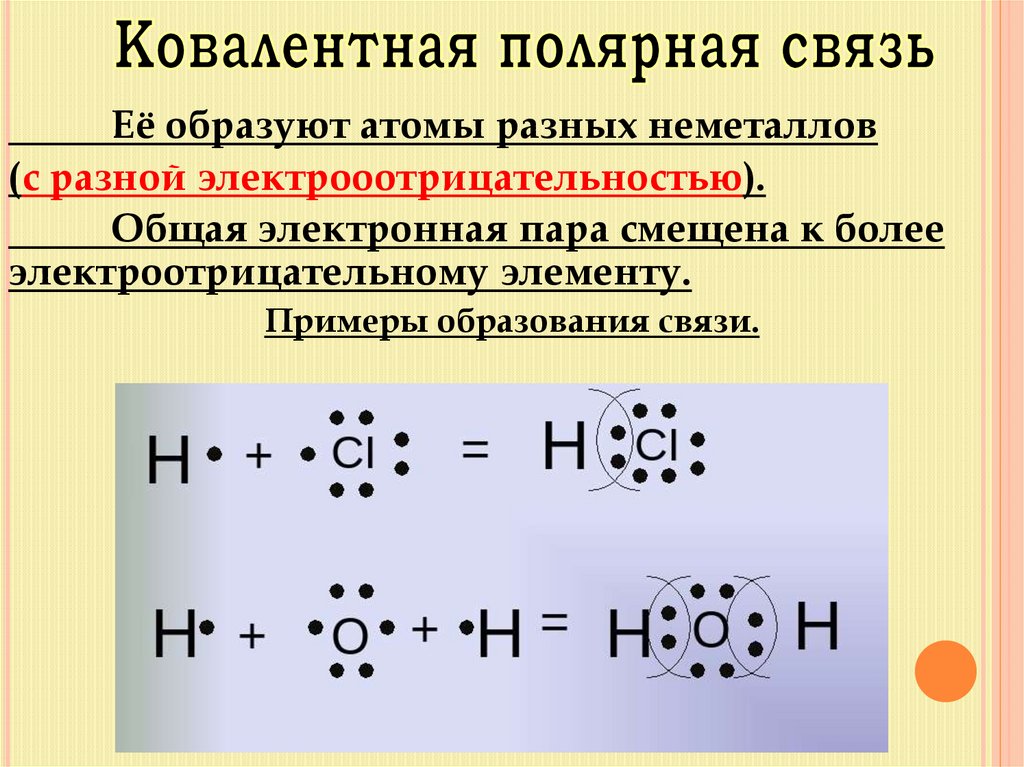
13.
Её образуют атомы разных неметаллов(с разной электрооотрицательностью).
Общая электронная пара смещена к более
электроотрицательному элементу.
Примеры образования связи.
14.
Вещества с КПС имеют:Молекулярную
кристаллическую
решетку (все остальные)
Атомную крисаллическую
Решетку (SiC, SiO2)
Свойства веществ:
Свойства веществ:
1. Твердые;
2. Имеют высокие to
плавления.
1. При обычных условиях
вещества газообразные,
жидкие, твердые;
2. Большинство веществ
сильнолетучие, т.е. имеют
низкие to кипения и
плавления;
3. Растворы и расплавы
проводят электрический ток.
15. Ионная химическая связь
ИОННАЯ ХИМИЧЕСКАЯ СВЯЗЬИонная или электровалентная связь –
химическая связь между ионами за счет
электростатического притяжения.
Ионы — заряженные частицы, в которые
превращаются атомы в результате отдачи или принятия
электронов.
Она образуется между атомами металлов и
неметаллов, т.е. между атомами резко отличающимися
друг от друга по электроотрицательности.
16.
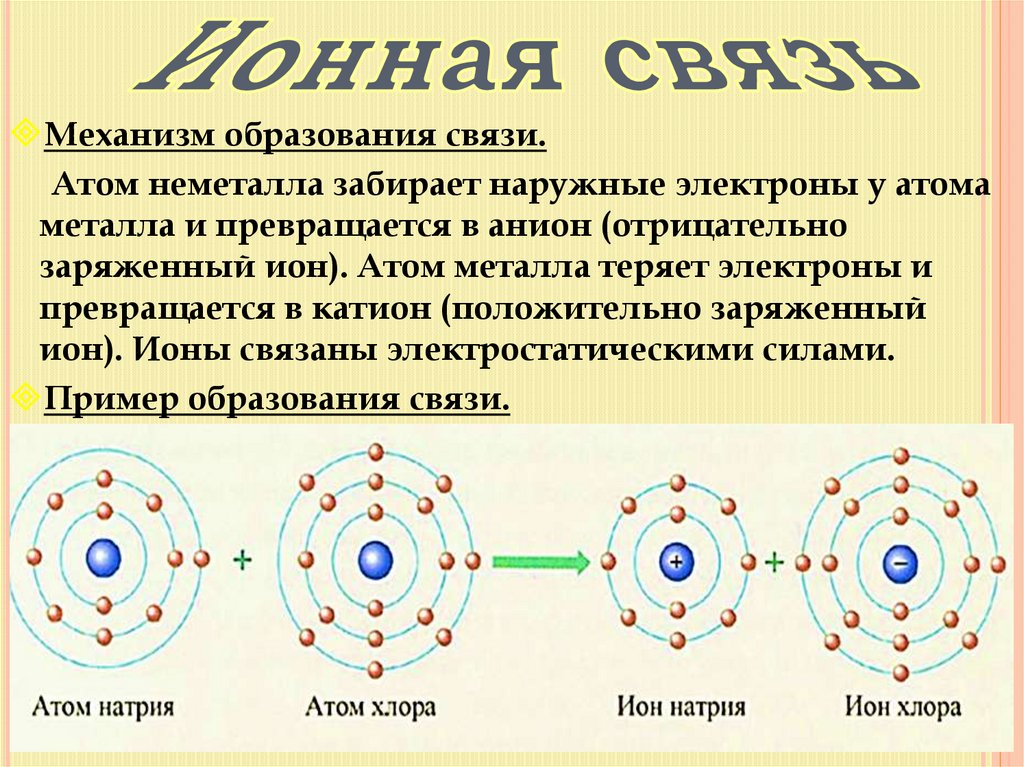
Механизм образования связи.Атом неметалла забирает наружные электроны у атома
металла и превращается в анион (отрицательно
заряженный ион). Атом металла теряет электроны и
превращается в катион (положительно заряженный
ион). Ионы связаны электростатическими силами.
Пример образования связи.
..
..
17.
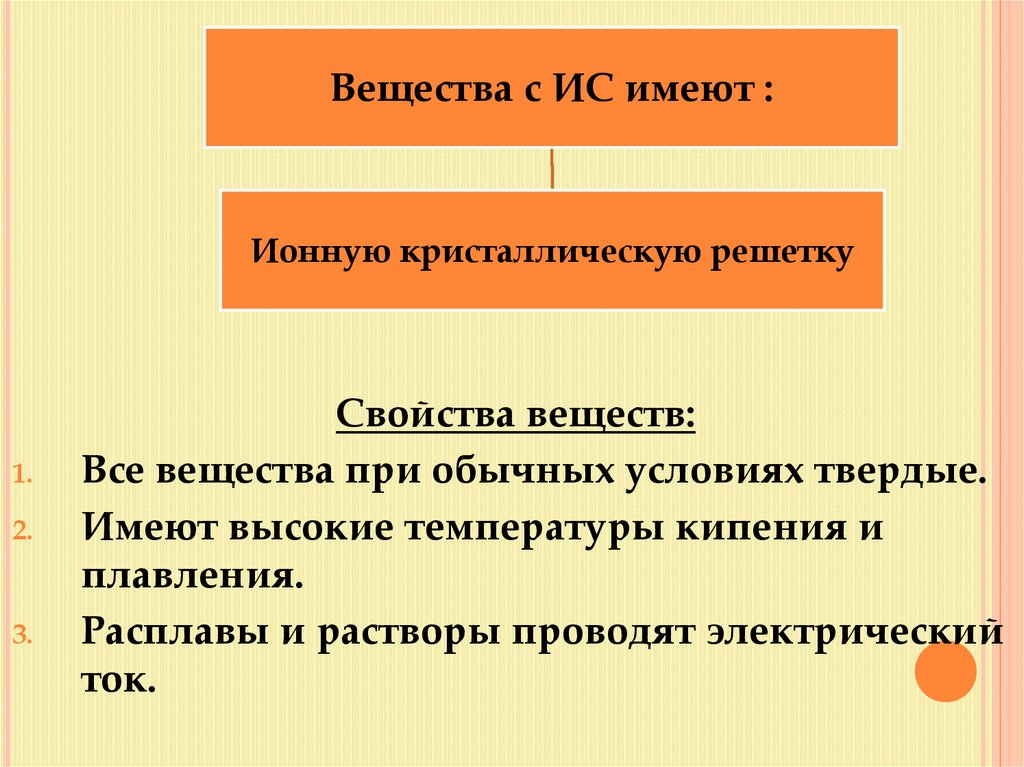
Вещества с ИС имеют :Ионную кристаллическую решетку
1.
2.
3.
Свойства веществ:
Все вещества при обычных условиях твердые.
Имеют высокие температуры кипения и
плавления.
Расплавы и растворы проводят электрический
ток.
18. Металлическая химическая связь
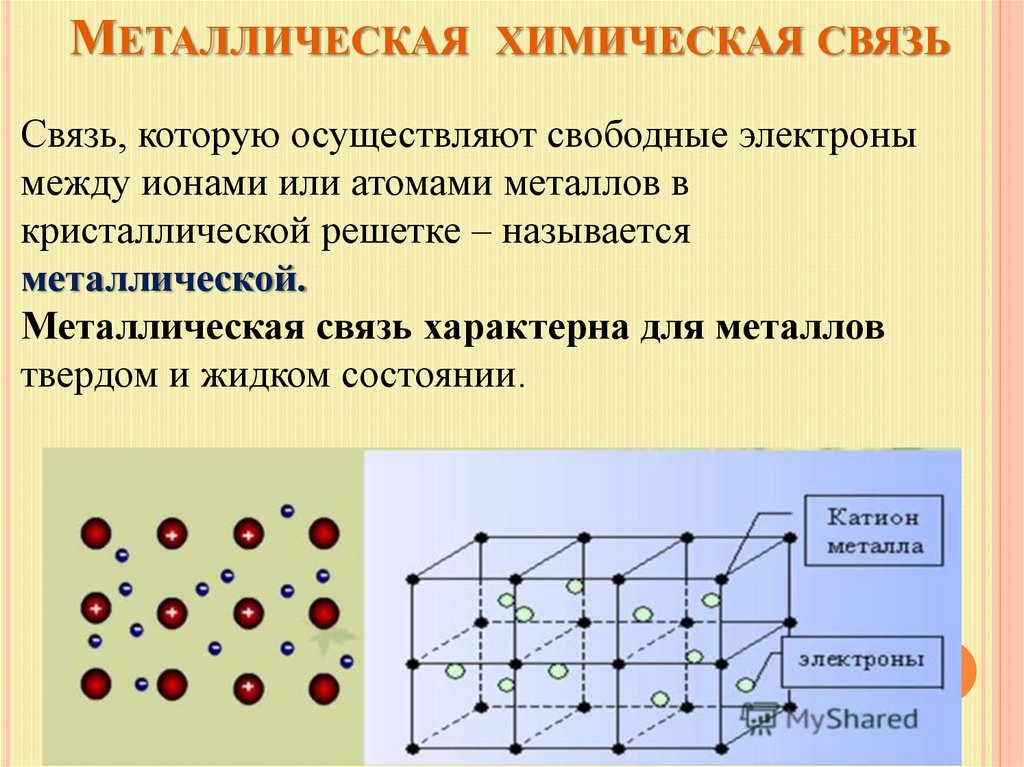
МЕТАЛЛИЧЕСКАЯ ХИМИЧЕСКАЯ СВЯЗЬСвязь, которую осуществляют свободные электроны
между ионами или атомами металлов в
кристаллической решетке – называется
металлической.
Металлическая связь характерна для металлов
твердом и жидком состоянии.
19. Особенности металлической связи
ОСОБЕННОСТИ МЕТАЛЛИЧЕСКОЙ СВЯЗИОсобенность атомов металлов — небольшое число
электронов на внешнем уровне и сравнительно большие
радиусы. Поэтому атомы металлов в отличие от атомов
неметаллов легко отдают наружные электроны и
превращаются в положительные ионы:
Оторвавшиеся от атомов электроны, осуществляющие связь,
обобществлены («электронный газ») и перемещаются по
всему куску металла, в целом электронейтрального.
Соединяясь с ионами, электроны временно превращают их в
атомы. Потом электроны снова отрываются и
присоединяются к другим ионам и так далее.
Между электронами и положительными ионами возникает
электростатическое взаимодействие. Отрицательные
электроны удерживают слои положительных ионов.








 Химия
Химия








