Похожие презентации:
Классификация и номенклатура неорганических веществ. 9 класс
1.
Химия 9 классУрок №3
Дата 11.09.2024г
Тема урока
Классификация и номенклатура
неорганических веществ
2.
Классификация неорганических веществ.3.
4.
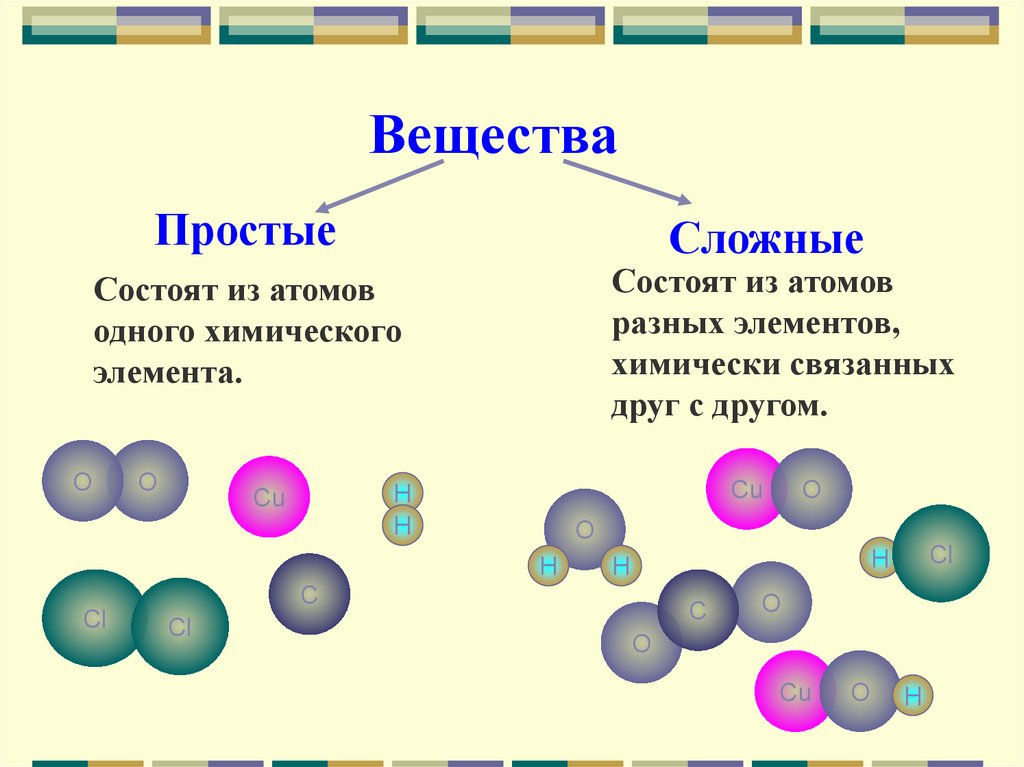
ВеществаПростые
Сложные
Состоят из атомов
разных элементов,
химически связанных
друг с другом.
Состоят из атомов
одного химического
элемента.
О
О
Н
Н
Cu
О
Н
Н
Н
C
Cl
Cl
О
Cu
C
Cl
О
О
Cu
О
Н
5.
Простые веществаМеталлы
Неметаллы
Na
Cu
S
Fe
Cl2
O2
Благородные газы
He
Ne
Rn
6. ПРОСТЫЕ ВЕЩЕСТВА
Активные(галогены
)
Неметаллы
Среднеактивные
(N2, С, Si)
Благородные
(He, Ne, Ar)
Активные
(Na, K, Ca )
Металлы
Среднеактивные
(Fe, Cr, Ni)
Благородные
(Au, Pt, Rh)
7. ПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
КЛАССИФИКАЦИЯПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ,
ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
Неорганические соединения
Одноэлементные
(простые)
вещества
Двухэлементные
(бинарные)
соединения
(H2, O3, S8 )
(NH3, NaCl, Fe2O3 )
Многоэлементные
соединения
(Ca3(PO4)2, H2[PtCl6] )
8.
Сложные веществаОксиды
ЭxOy
Основания
Me(OH)n
Кислоты
Соли
HxKO
Mex(KO)y
9.
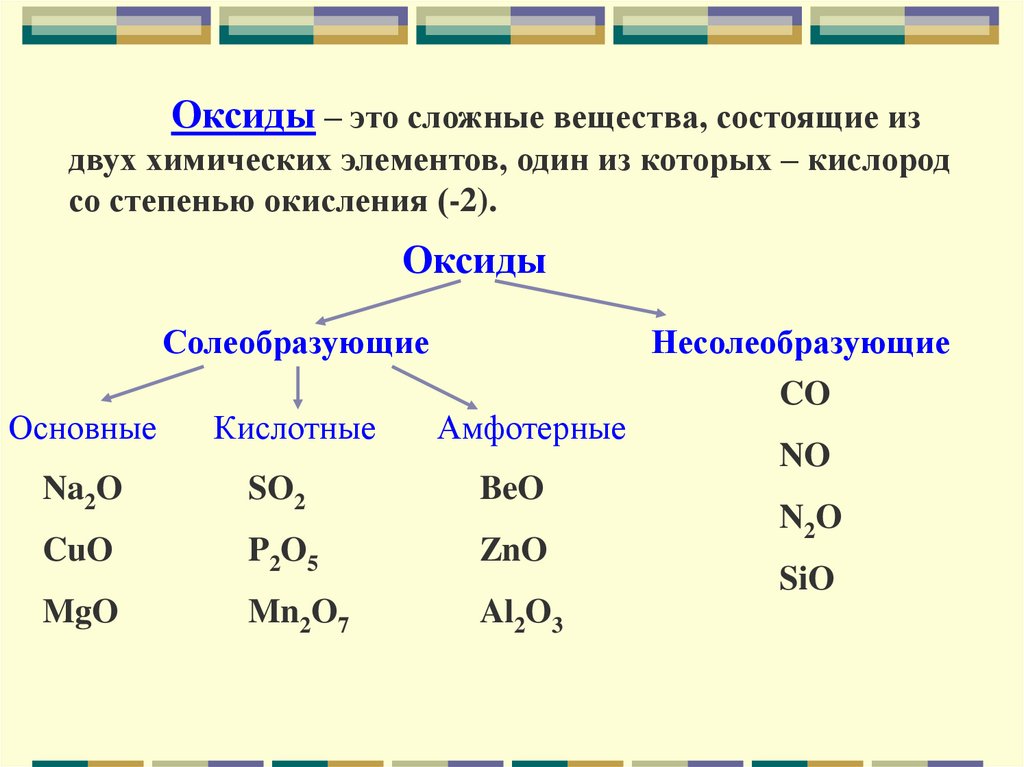
Оксиды – это сложные вещества, состоящие издвух химических элементов, один из которых – кислород
со степенью окисления (-2).
Оксиды
Солеобразующие
Основные
Кислотные
Амфотерные
Na2O
SO2
BeO
CuO
P2O5
ZnO
MgO
Mn2O7
Al2O3
Несолеобразующие
CO
NO
N2O
SiO
10. Самый известный оксид – вода, занимающий большую часть поверхности Земли.
Оксид алюминия образуетминерал корунд, а также
входит в состав рубинов и
сапфиров.
Корунд.
Оксид кремния(IV),
входящий в состав
огромного количества
минералов.
Горный хрусталь.
11. Глина, используемая в силикатной промышленности для производства керамики, в ее составе оксиды кремния, алюминия и вода.
КерамикаФарфор
12.
13.
14. ОКСИДЫ (O2)
ОКСИДЫ (O 2)Формула
Na2О
Р2O5
SO2
FeO
Fe2O3
Fe3O4
(FeII Fe2III)O4)
Названия
ИЮПАК
Традиционная
оксид натрия
«Русская»
окись натрия
оксид фосфора(V) или
пентаоксид дифосфора пятиокись фосфора
оксид серы(IV) или
диоксид серы
оксид железа(II)
оксид железа(III) или
триоксид дижелеза
двуокись серы
закись железа
окись железа
оксид железа(II, III) или
оксид железа(II)закись-окись железа,
дижелеза(III)
железная окалина
15. Среди веществ найдите оксиды:
1)CuO2)HCL
3) AL2O3
4) H2SO4
5) NaCl
6)CaCO3
7)Mg(OH)2
8)AlCl3
9)NaOH
10)CaO
11)H3PO4
12)CO2
13)Na2O
14)HNO3
15)P2O5
16)Ca(OH)2
17)HBr
18)H2O
16.
Основания – это сложные вещества, состоящиеиз атомов металла и одной или нескольких
гидроксогрупп (-OH).
Основания
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Cu(OH)2
KOH
Al(OH)3
Ba(OH)2
Fe(OH)2
17.
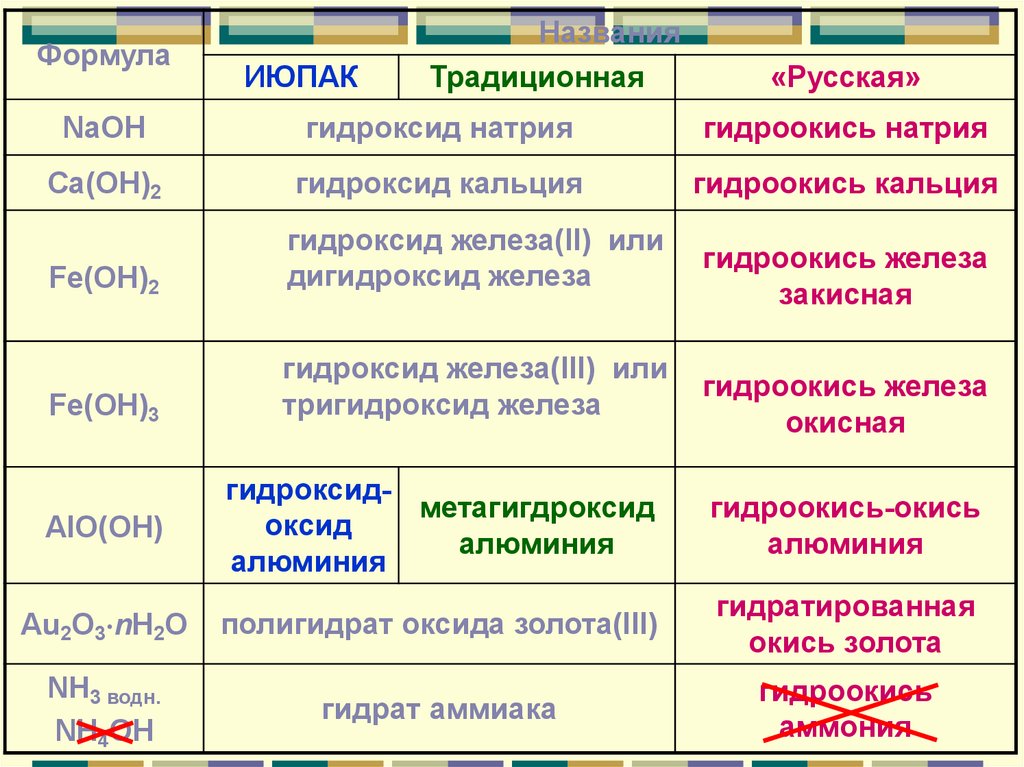
ФормулаИЮПАК
Названия
Традиционная
«Русская»
NaOH
гидроксид натрия
гидроокись натрия
Ca(OH)2
гидроксид кальция
гидроокись кальция
Fe(OH)2
гидроксид железа(II) или
дигидроксид железа
Fe(OH)3
гидроксид железа(III) или
тригидроксид железа
гидроокись железа
закисная
гидроокись железа
окисная
AlO(OH)
гидроксидметагигдроксид
оксид
алюминия
алюминия
гидроокись-окись
алюминия
Au2O3 nH2O
полигидрат оксида золота(III)
гидратированная
окись золота
NH3 водн.
NH4OH
гидрат аммиака
гидроокись
аммония
18. В любой аптечке можно найти нашатырный спирт – гидроксид аммония.
Гидроксид натрия (едкийнатр, каустическая сода)
применяется для очистки
нефтепродуктов, в
производстве мыла.
Гидроксид кальция –
гашеную известь
используют в
строительстве.
19.
20.
21. Среди веществ найдите основания:
1)CuO2)HCL
3) AL2O3
4) H2SO4
5) NaCl
6)CaCO3
7)Mg(OH)2
8)AlCl3
9)NaOH
10)CaO
11)H3PO4
12)CO2
13)Na2O
14)HNO3
15)P2O5
16)Ca(OH)2
17)HBr
18)H2O
22.
Кислоты – это сложные вещества, состоящие изатомов водорода, способных замещаться на атомы
металла, и кислотных остатков.
Кислоты
Бескислородные
Кислородсодержащие
HCl
HNO3
HF
H2SO4
H2S
H3PO4
23. Кислоты
Примеры: HCl – соляная кислотаH2S – сероводородная кислота
HNO3 – азотная кислота
H2SO4 - серная кислота
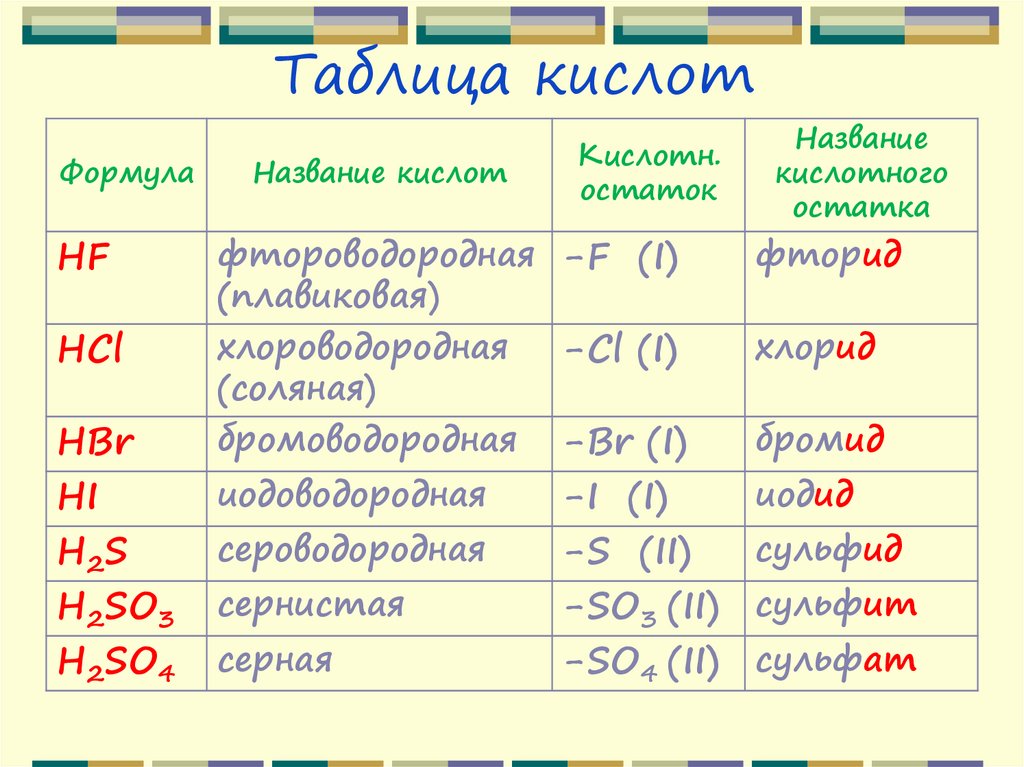
24. Таблица кислот
ФормулаHF
HCl
HBr
HI
H2S
H2SO3
H2SO4
Название кислот
Кислотн.
остаток
Название
кислотного
остатка
фтороводородная -F (I)
(плавиковая)
хлороводородная
-Cl (I)
(соляная)
бромоводородная -Br (I)
фторид
сероводородная
сульфид
иодоводородная
сернистая
серная
-I (I)
-S (II)
-SO3 (II)
-SO4 (II)
хлорид
бромид
иодид
сульфит
сульфат
25. Таблица кислот
ФормулаНазвание кислот
HNO2
HNO3
H2SiO3
H2CO3
H3PO4
азотистая
H3PO3
фосфористая
HPO3
Кислотн.
остаток
Название
кислотного
остатка
-NO2 (I) нитрит
азотная
-NO3 (I) нитрат
кремниевая
-SiO3 (II) силикат
угольная
-CO3 (II) карбонат
ортофосфорная -PO4 (III) ортофосфат
метафосфорная -PO3 (I)
метафосфат
-PO3 (III) фосфит
26. Таблица кислот
ФормулаНазвание кислот
HMnO4 марганцовая
H2CrO4 хромовая
HClO
хлорноватистая
HClO2
HClO3
HClO4
HCN
хлористая
хлорноватая
хлорная
Кислотн.
остаток
Название
кислотного
остатка
-MnO4 (I) перманганат
-CrO4 (II) хромат
-ClO (I)
гипохлорит
-ClO2 (I)
-ClO3 (I)
-ClO4 (I)
синильная
-CN (I)
(циановодородная)
хлорит
хлорат
перхлорат
цианид
27. Кислоты (используют в производстве)
лекарстваКислоты
удобрения
(используют в производстве)
красители
взрывчатые вещества
28. Среди веществ найдите кислоты:
1)CuO2)HCL
3) AL2O3
4) H2SO4
5) NaCl
6)CaCO3
7)Mg(OH)2
8)AlCl3
9)NaOH
10)CaO
11)H3PO4
12)CO2
13)Na2O
14)HNO3
15)P2O5
16)Ca(OH)2
17)HBr
18)H2O
29.
Соли – это сложные вещества, состоящие изатомов металла и кислотных остатков.
Соли
Средние
CuSO4
NaCl
KNO3
Кислые
KHCO3
NaHSO4
KH2PO4
Основные
FeOHCl
CuOHNO3
AlOHCl2
Комплексные
Na[Al(OH)4]
K4[Fe(CN)6]
[Cu(H2O)4]SO4•H2O
30. Классификация солей
Средние: Na3PO4, K2SO4, MgCl2Кислые: NaH2PO4, Na2HPO4, KHSO4
Основные: Mg(OH)Cl
Двойные: K2NaPO4
Смешанные: CaOCl2
Комплексные: K3 Fe(CN)6
31. Соли
пищевая содаСоли
гипс
марганцовка
поваренная соль
мрамор
32. Соли
NaCl -хлорид натриясоль соляной кислоты HCl
K2SO4 – сульфат калия
соль серной кислоты H2SO4
Mg3(PO4)2 – фосфат магния
соль фосфорной кислоты
H3PO4
33. Дайте названия веществам. К какому классу неорг. соедин. они относятся?
Оксид кальция – осн. оксидCaO
Ca(OH)2 Гидроксид кальция – основание
Ca(NO3)2 Нитрат кальция – соль
Азотная кислота – кислота
HNO3
Оксид азота (V) – кисл. оксид
N2O5
Al2(SO4)3 Сульфат алюминия - соль
34.
Экспресс-работаЗадание 1.
Распределить вещества по классам:
Fe(OH)2, H2SO4, NaCl, K2O, SO3, Mg(OH)2, CuO,
Ca(NO3)2, NaOH, HBr, CO2, HClO4, Ca(OH)2, HCl.
Назвать вещества.
Оксиды
Основания
Кислоты
Кислотные Основные Щёлочи Нераст-е Бескисл-е Кисл-сод-е
Соли
35.
Проверим:Оксиды
Основания
Кислоты
Соли
Кислотные Основные Щёлочи Нераст-е Бескисл-е Кисл-сод-е
SO3
K2O
NaOH
Fe(OH)2
HBr
H2SO4
NaCl
CO2
CuO
Ca(OH)2 Mg(OH)2
HCl
HClO4
Ca(NO3)2
36. Домашнее задание
Параграф 1.Ответить письменно на вопрос №7
стр.11.
Схемы, определения, названия
некоторых химических веществ,
названия кислот выписать в тетрадь
и выучить.
































 Химия
Химия








