Похожие презентации:
Ферменты. 2 часть
1.
Вас приветствует кафедраМедицинской Химии
Предмет: Биологическая Химия
Ферменты. 2 часть
Зав кафедрой:
Проф. д.м.н. Бойченко Павел Константинович
Лектор:
Доц. к.м.н. БлагодаренкоЕвгений Анатольевич
Сообщество в VK Биохимия Человека @medbiochemistry
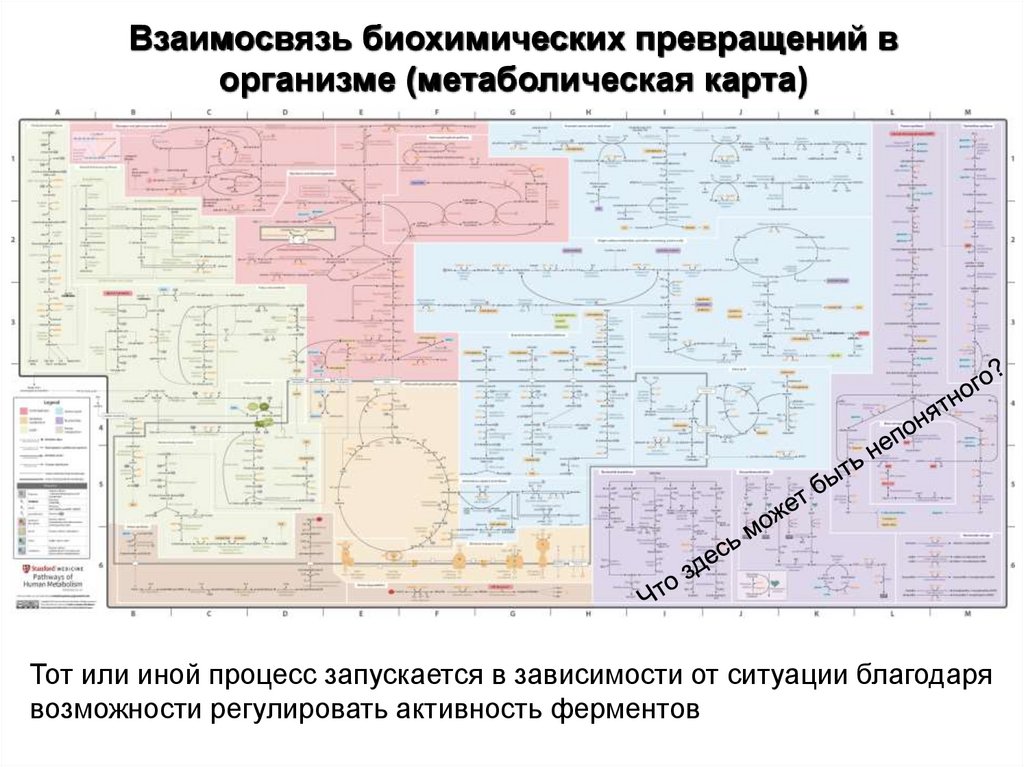
2. Взаимосвязь биохимических превращений в организме (метаболическая карта)
Тот или иной процесс запускается в зависимости от ситуации благодарявозможности регулировать активность ферментов
3.
4.
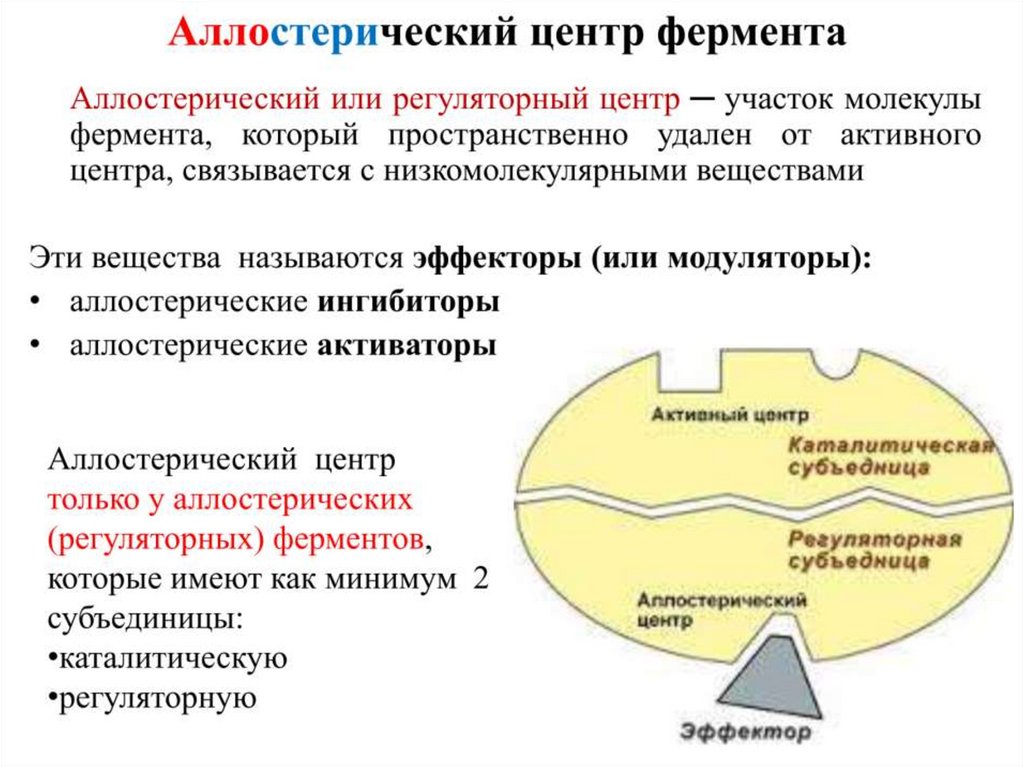
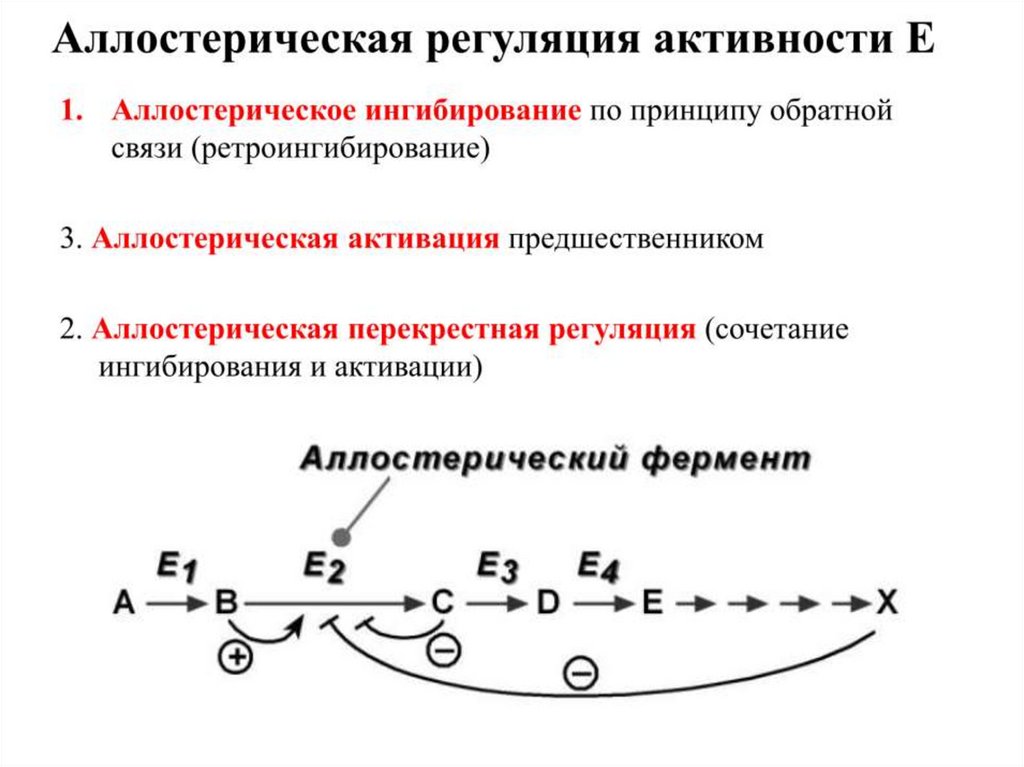
Контроль количества фермента5. АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ ФЕРМЕНТОВ
6.
7.
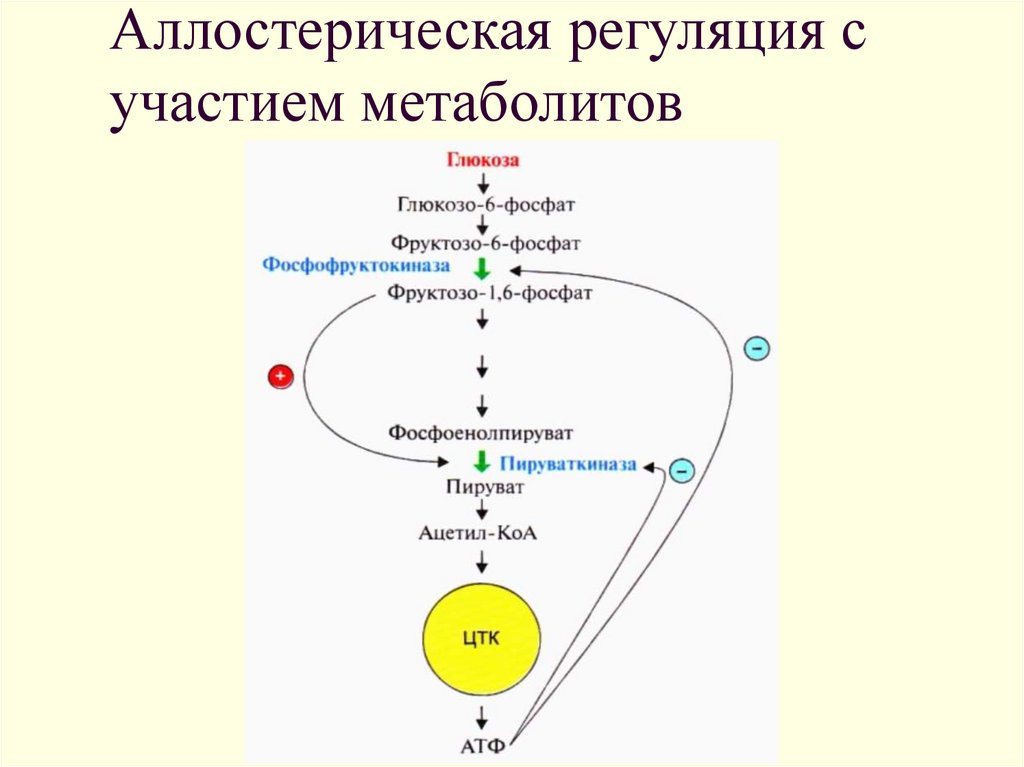
8. Аллостерическая регуляция с участием метаболитов
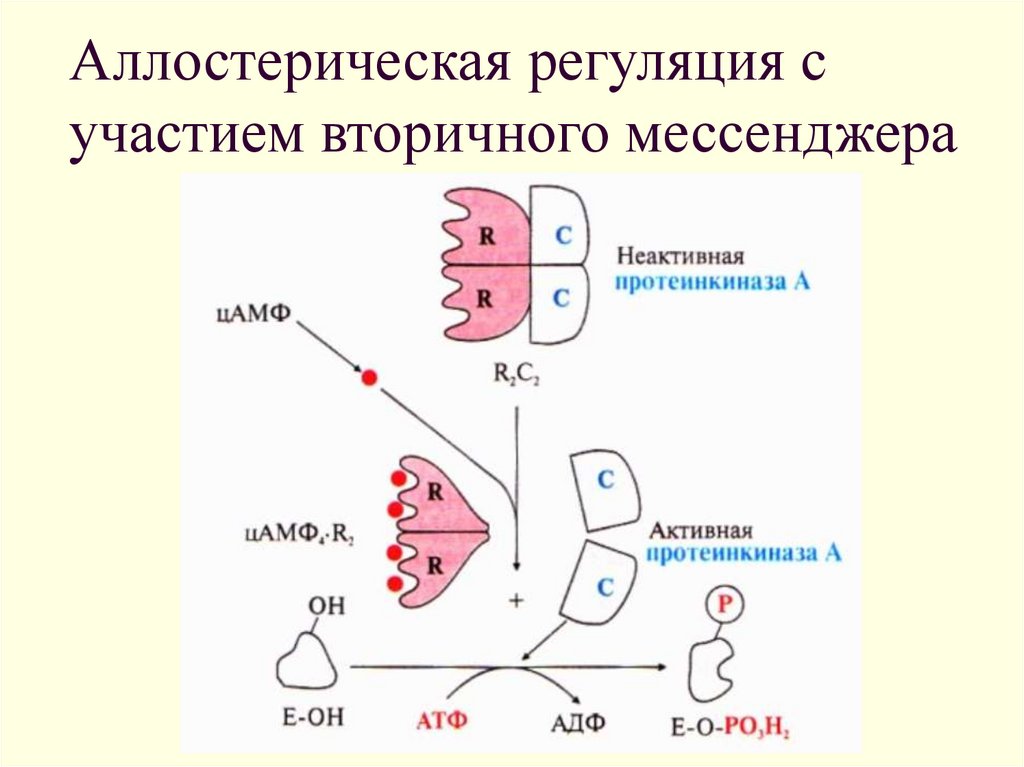
9. Аллостерическая регуляция с участием вторичного мессенджера
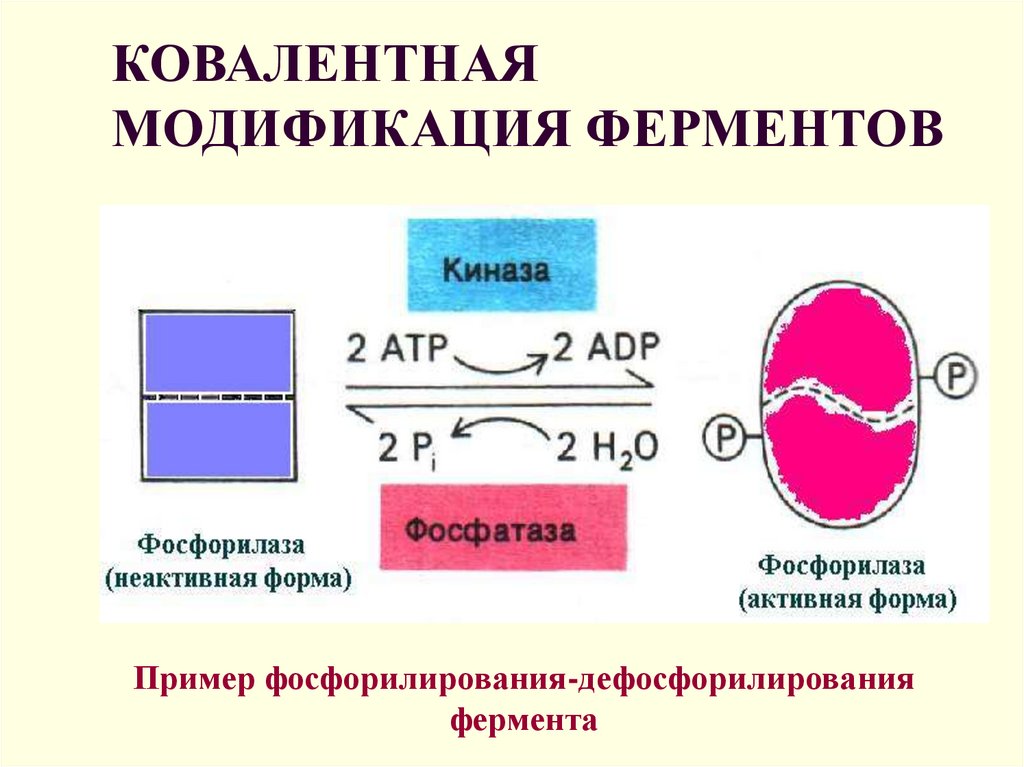
10. КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
Пример фосфорилирования-дефосфорилированияфермента
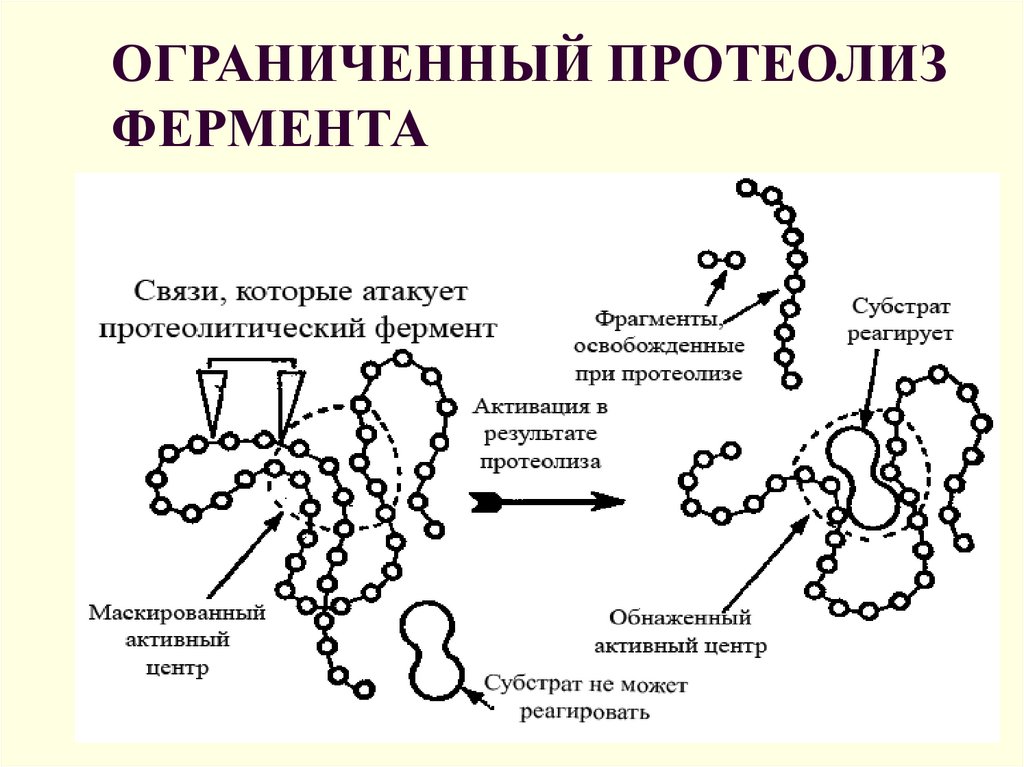
11. ОГРАНИЧЕННЫЙ ПРОТЕОЛИЗ ФЕРМЕНТА
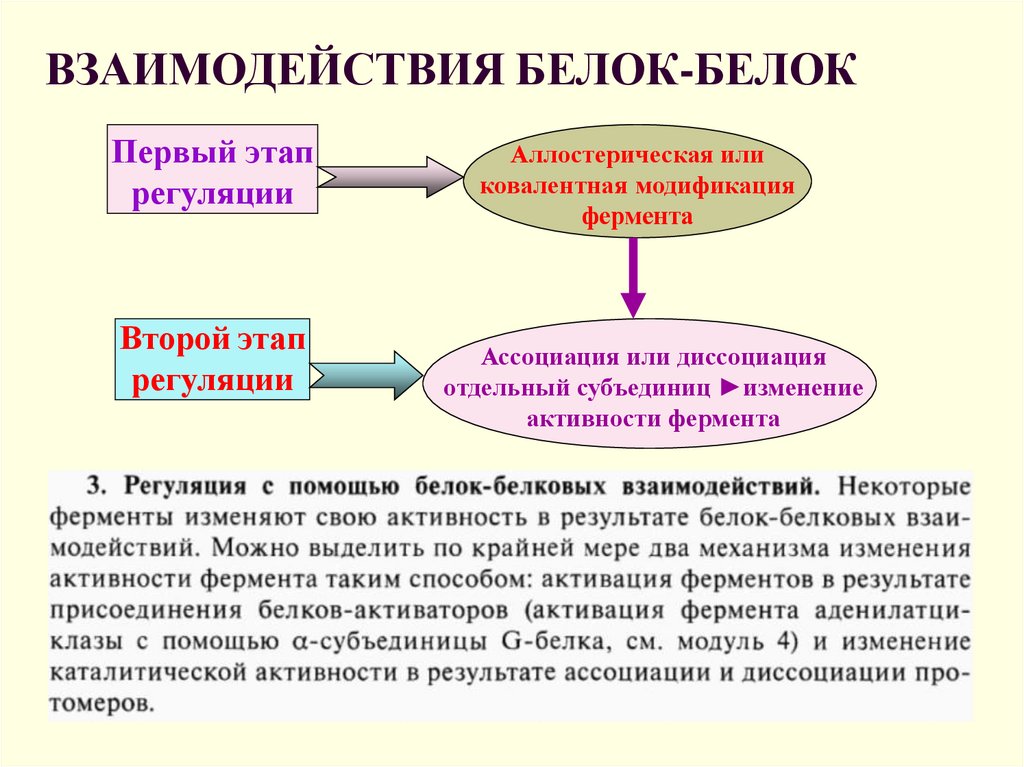
12. ВЗАИМОДЕЙСТВИЯ БЕЛОК-БЕЛОК
Первый этапрегуляции
Второй этап
регуляции
Аллостерическая или
ковалентная модификация
фермента
Ассоциация или диссоциация
отдельный субъединиц ►изменение
активности фермента
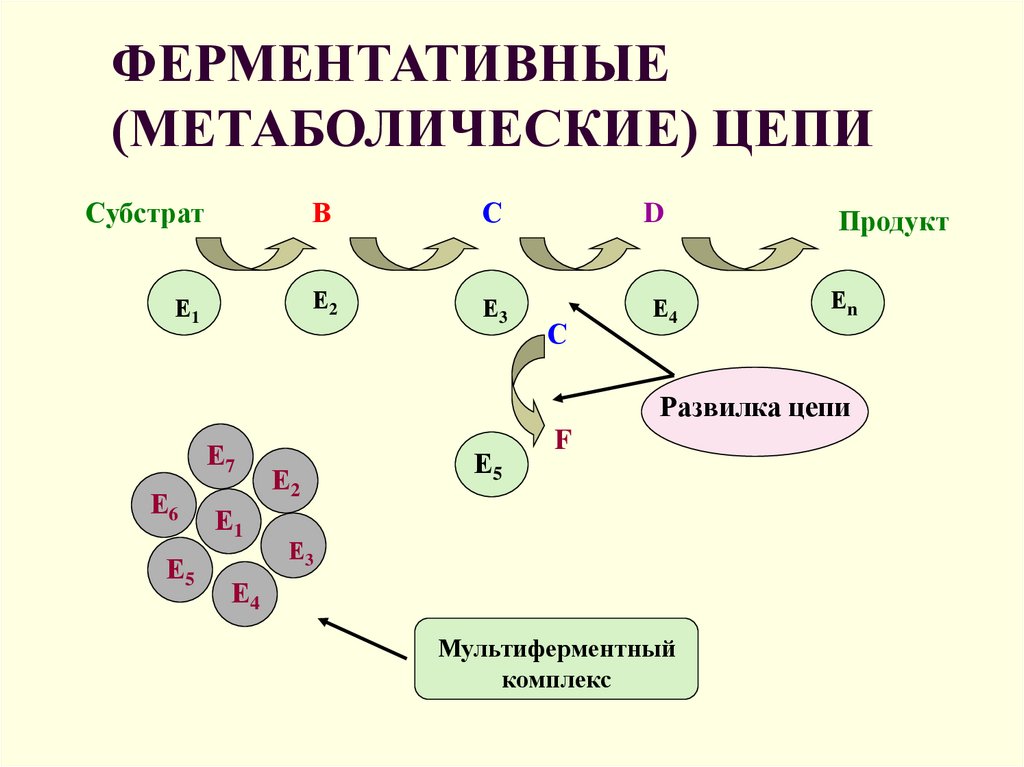
13. ФЕРМЕНТАТИВНЫЕ (МЕТАБОЛИЧЕСКИЕ) ЦЕПИ
СубстратВ
С
D
Продукт
Е1
Е2
Е3
Е4
Еn
С
Развилка цепи
Е7
Е6
Е5
Е1
Е2
Е5
F
Е3
Е4
Мультиферментный
комплекс
14.
15.
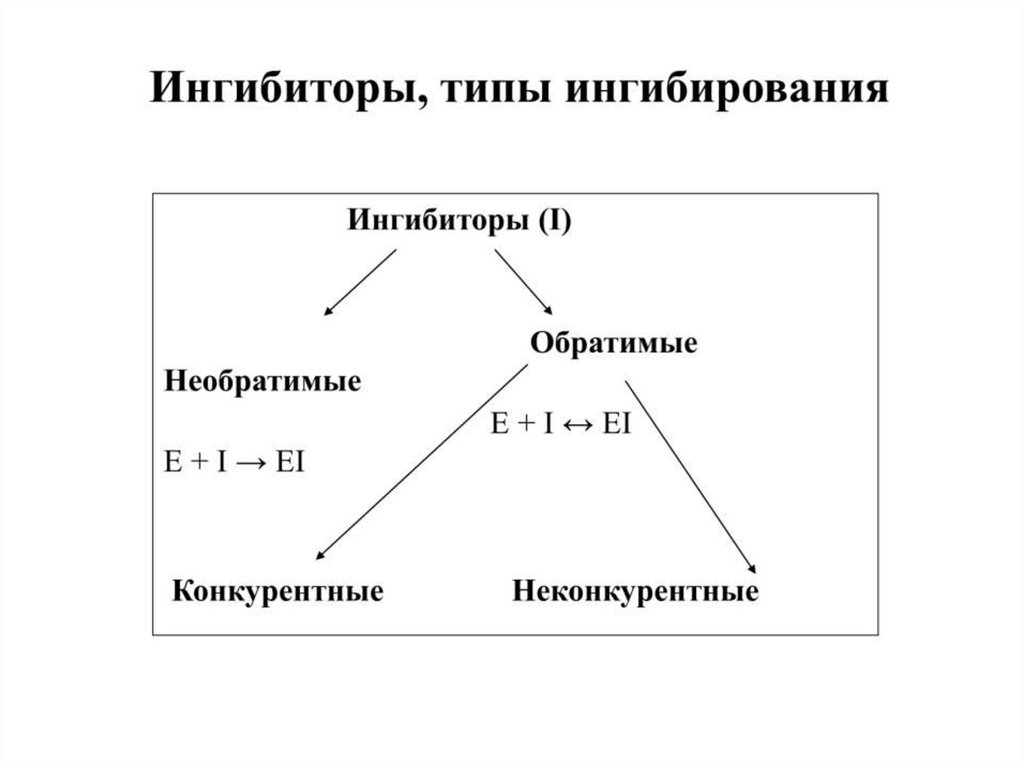
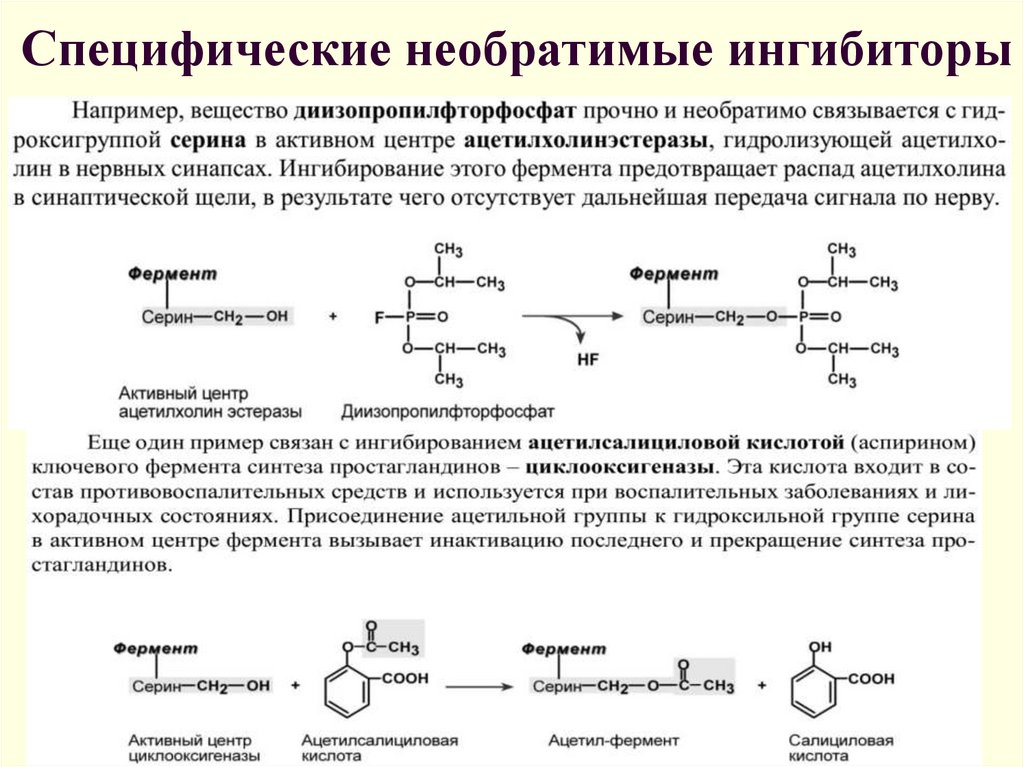
Неспецифические необратимые ингибиторы16. Специфические необратимые ингибиторы
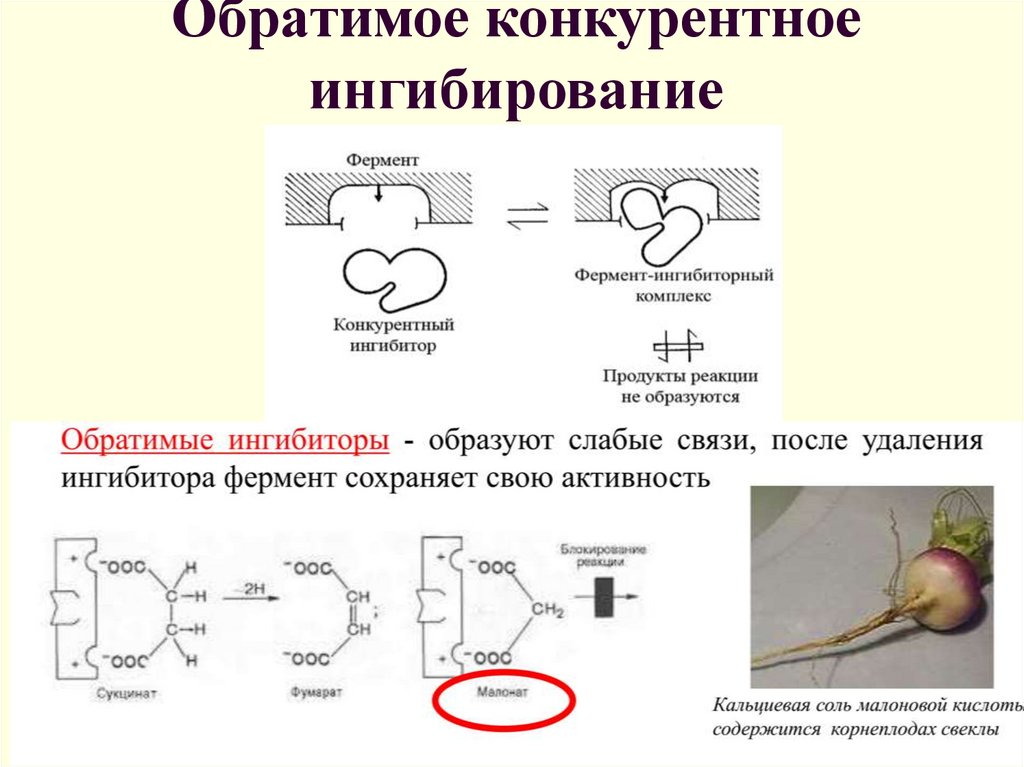
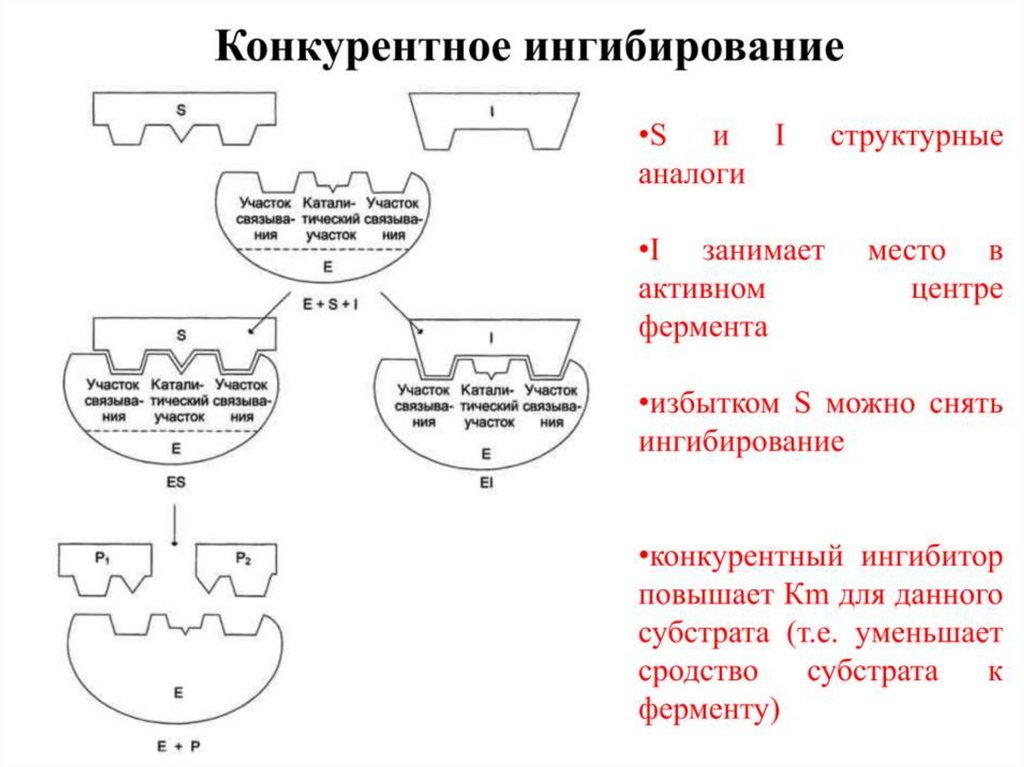
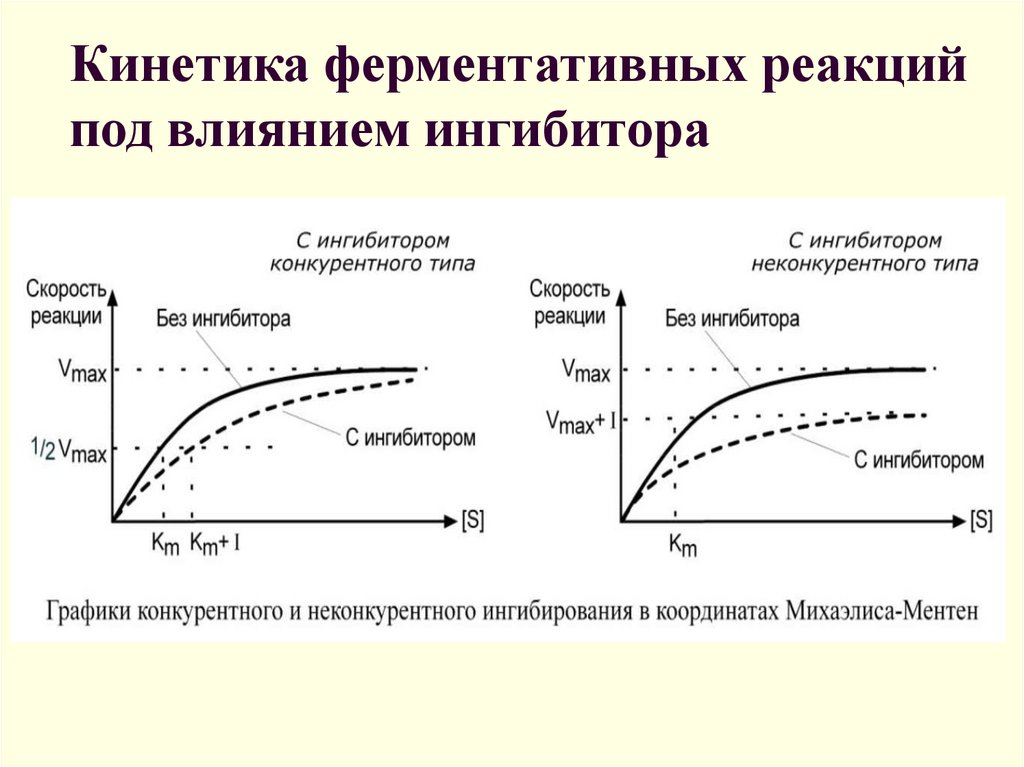
17. Обратимое конкурентное ингибирование
18.
19.
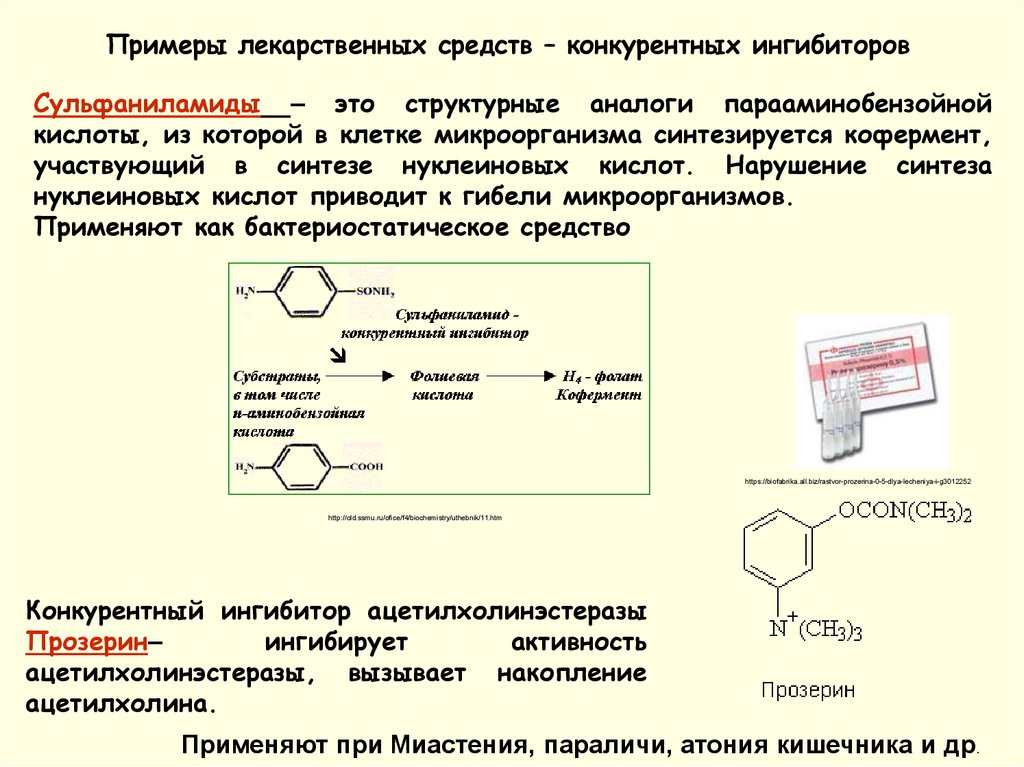
Примеры лекарственных средств – конкурентных ингибиторовСульфаниламиды – это структурные аналоги парааминобензойной
кислоты, из которой в клетке микроорганизма синтезируется кофермент,
участвующий в синтезе нуклеиновых кислот. Нарушение синтеза
нуклеиновых кислот приводит к гибели микроорганизмов.
Применяют как бактериостатическое средство
https://biofabrika.all.biz/rastvor-prozerina-0-5-dlya-lecheniya-i-g3012252
http://old.ssmu.ru/ofice/f4/biochemistry/uthebnik/11.htm
Конкурентный ингибитор ацетилхолинэстеразы
Прозерин–
ингибирует
активность
ацетилхолинэстеразы, вызывает накопление
ацетилхолина.
Применяют при Миастения, параличи, атония кишечника и др.
20.
Примеры лекарственных средств,являющихся ингибиторами
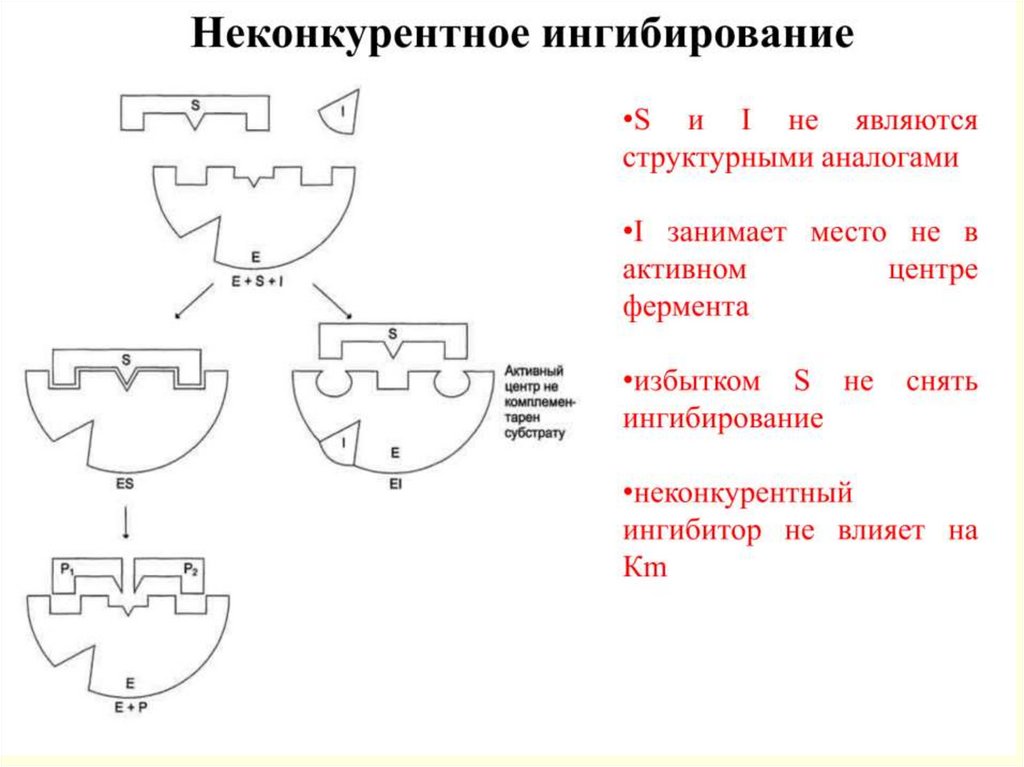
21.
22.
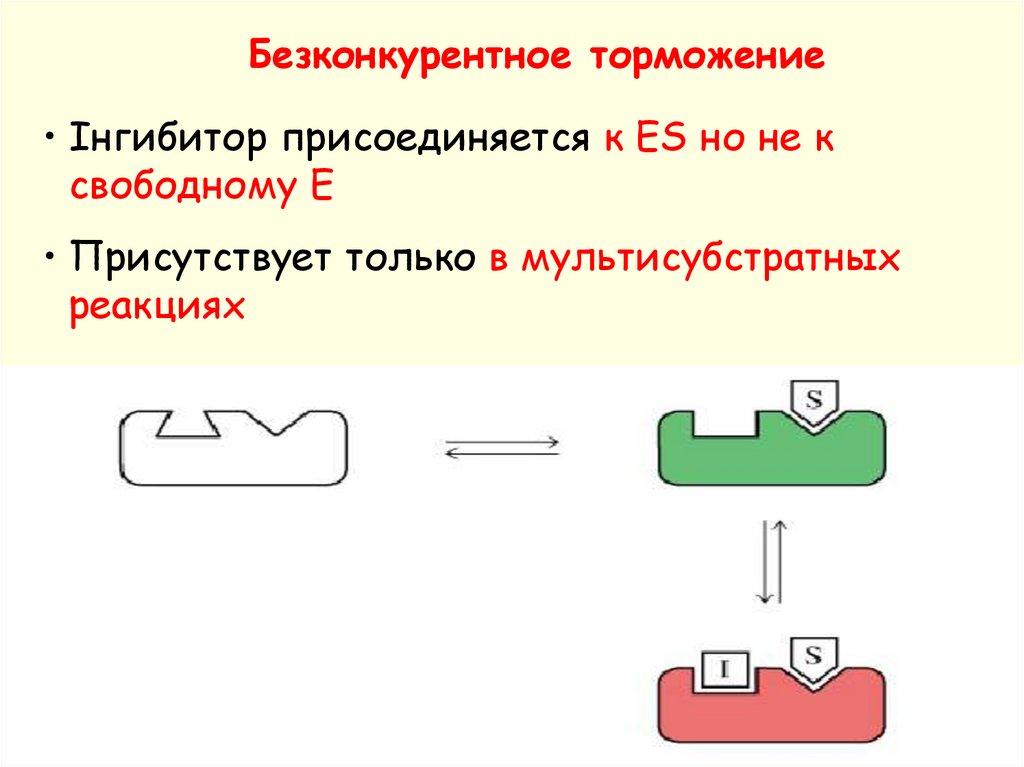
Безконкурентное торможение• Інгибитор присоединяется к ES но не к
свободному E
• Присутствует только в мультисубстратных
реакциях
23. Кинетика ферментативных реакций под влиянием ингибитора
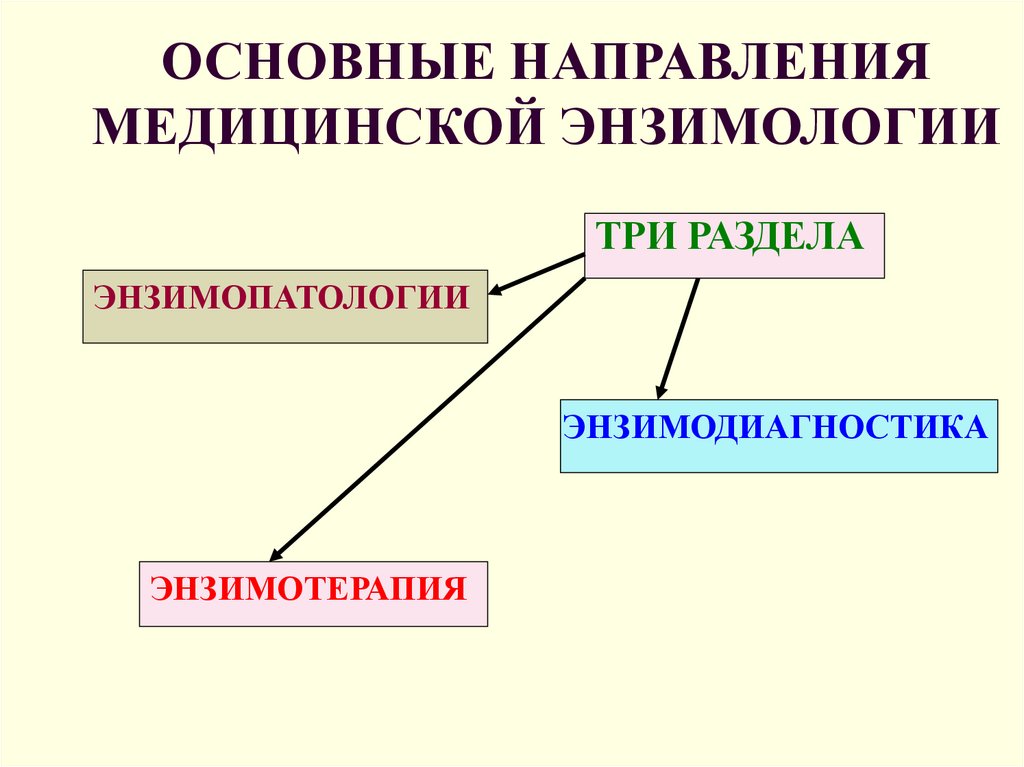
24. ОСНОВНЫЕ НАПРАВЛЕНИЯ МЕДИЦИНСКОЙ ЭНЗИМОЛОГИИ
ТРИ РАЗДЕЛАЭНЗИМОПАТОЛОГИИ
ЭНЗИМОДИАГНОСТИКА
ЭНЗИМОТЕРАПИЯ
25. Энзимотерапия
Заместительная терапия - использованиеферментов в случае их недостаточности:
Заместительная энзимотерапия эффективна при желудочнокишечных заболеваниях, связанных с недостаточностью секреции
пищеварительных соков. Например, пепсин используют при
ахилии, гипо- и анацидных гастритах.
Дефицит панкреатических ферментов также в значительной
степени может быть компенсирован приёмом внутрь препаратов,
содержащих основные ферменты поджелудочной железы –
панкреатин (панзинорм, энзистал, мезим-форте, фестал и др.)
26. Энзимотерапия
Как элемент комплексной терапии - применениеферментов в сочетании с другой терапией.
В качестве дополнительных терапевтических средств ферменты используют при
ряде заболеваний.
–
- Протеолитические ферменты (трипсин, химотрипсин) применяют при
местном воздействии для обработки гнойных ран с целью расщепления белков
погибших клеток, для удаления сгустков крови или вязких секретов при
воспалительных заболеваниях дыхательных путей.
–
- Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют
в качестве противовирусных препаратов при лечении аденовирусных
конъюнктивитов, герпетических кератитов.
–
- Ферментные препараты стали широко применять при тромбозах и
тромбоэмболиях. С этой целью используют препараты фибринолизина,
стрептолиазы, стрептодеказы, урокиназы.
–
- Фермент гиалуронидазу (лидазу), катализирующий расщепление
гиалуроновой кислоты, используют подкожно и внутримышечно для
рассасывания контрактур рубцов после ожогов и операций (гиалуроновая
кислота образует сшивки в соединительной ткани)
–
- Аспарагиназа (разрушает аминокислоту апсрагин) используется при
онкологических заболеваниях крови, ограничиыая поступления аспарагина в
опухолевые клетки.
27. Применение ферментов в качестве специфических реактивов в лабораторной практике
специфические эндонуклеазы, катализирующие разрывымежнуклеотидных связей ДНК, для диагностики фенилкетонурии,
α- и β-талассемии и других наследственных болезней)
• глюкозооксидазу применяют для количественного определения
глюкозы в моче и крови.
• Фермент уреазу используют для определения содержания
количества мочевины в крови и моче.
• С помощью различных дегидрогеназ обнаруживают
соответствующие субстраты, например пируват, лактат, этиловый
спирт и др.
28. Энзимодиагностика
- постановка диагноза заболевания (или синдрома) наоснове определения активности ферментов в
биологических жидкостях человека
- В особую группу выделяются иммуноферментные
диагностические методы, состоящие в применении
антител, химически связанных с каким-либо
ферментом, для определения в жидкостях веществ,
образующих с данными антителами комплексы антиген
— антитело.
29. Энзимодиагностика
Известно около 20 тестов, основанных наколичественном определении активности
ферментов (и изоферментов), главным
образом в крови (реже в моче), а также в
биоптатах. В практическом плане
энзимологические тесты должны помогать в
ранней постановке и дифференциации
диагноза, информировать о возможном исходе
болезни.
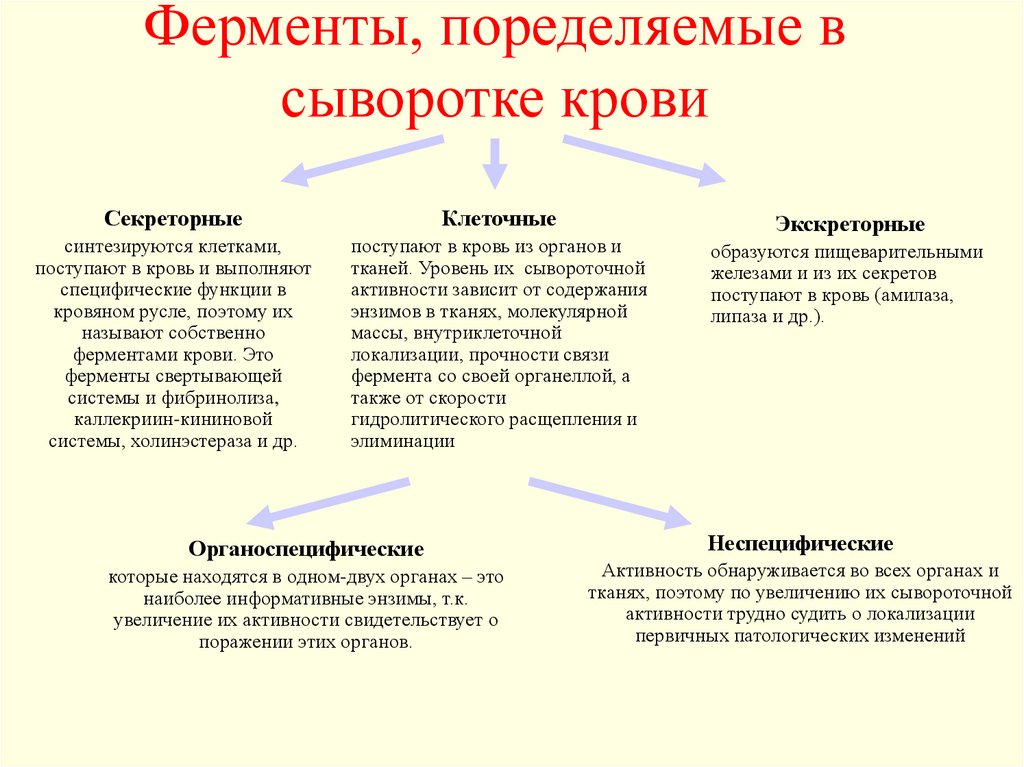
30. Ферменты, поределяемые в сыворотке крови
СекреторныеКлеточные
синтезируются клетками,
поступают в кровь и выполняют
специфические функции в
кровяном русле, поэтому их
называют собственно
ферментами крови. Это
ферменты свертывающей
системы и фибринолиза,
каллекриин-кининовой
системы, холинэстераза и др.
поступают в кровь из органов и
тканей. Уровень их сывороточной
активности зависит от содержания
энзимов в тканях, молекулярной
массы, внутриклеточной
локализации, прочности связи
фермента со своей органеллой, а
также от скорости
гидролитического расщепления и
элиминации
Органоспецифические
которые находятся в одном-двух органах – это
наиболее информативные энзимы, т.к.
увеличение их активности свидетельствует о
поражении этих органов.
Экскреторные
образуются пищеварительными
железами и из их секретов
поступают в кровь (амилаза,
липаза и др.).
Неспецифические
Активность обнаруживается во всех органах и
тканях, поэтому по увеличению их сывороточной
активности трудно судить о локализации
первичных патологических изменений
31. Причины повышения активности клеточных ферментов в крови
нарушение проницаемости мембраны клеток (при
воспалительных процессах)
нарушение целостности клеток (при некрозе)
повышенная пролиферация клеток с ускорением
клеточного цикла (например, при онкопролиферативных
процессах)
повышенный синтез ферментов
обструкция путей секреции ферментов в полости
снижение клиренса (например, активность амилазы в
сыворотке повышается при острой почечной
недостаточности)
32. Факторы, определяющие концентрацию фермента в крови при повреждении клеток
• природа повреждающего воздействия,• время действия и степень повреждения
биомембран клеток и субклеточных структур
органов,
• период полужизни (полураспада) в плазме крови
каждого из диагностических ферментов,
• особенности распределения (топографии)
ферментов в индивидуальных органах и тканях, а
также их внутриклеточная локализация.
33. Причины понижения активности клеточных ферментов в крови (гипоферментемия)
Гипоферментемия встречается относительно редко икасается в основном секреторных ферментов.
В подавляющем большинстве случаев она связана с
генетически детерминированными нарушениями
синтеза определенных энзимов,
реже – с ингибированием, усиленной деградацией
или экскрецией


















 Биология
Биология








