Похожие презентации:
Ферменты - 2
1. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
ЛЕКЦИЯФЕРМЕНТЫ – 2
КРАСНОДАР
2016
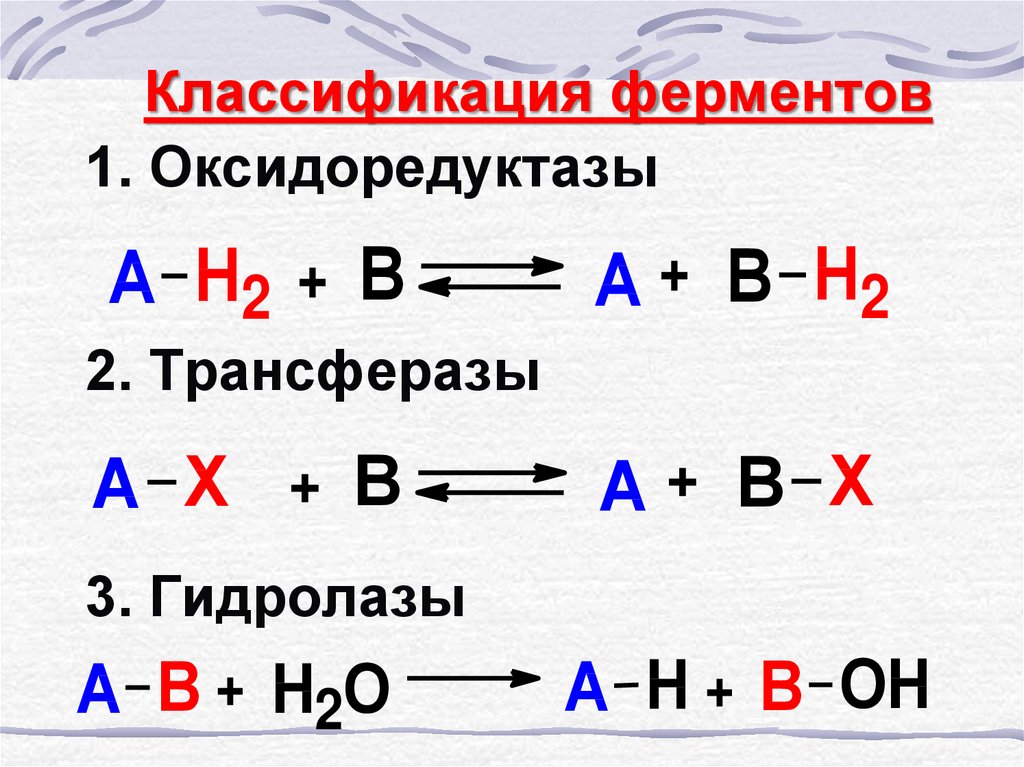
2. Классификация ферментов
1. ОксидоредуктазыА Н2 + В
А + В Н2
2. Трансферазы
А Х + В
А+ В Х
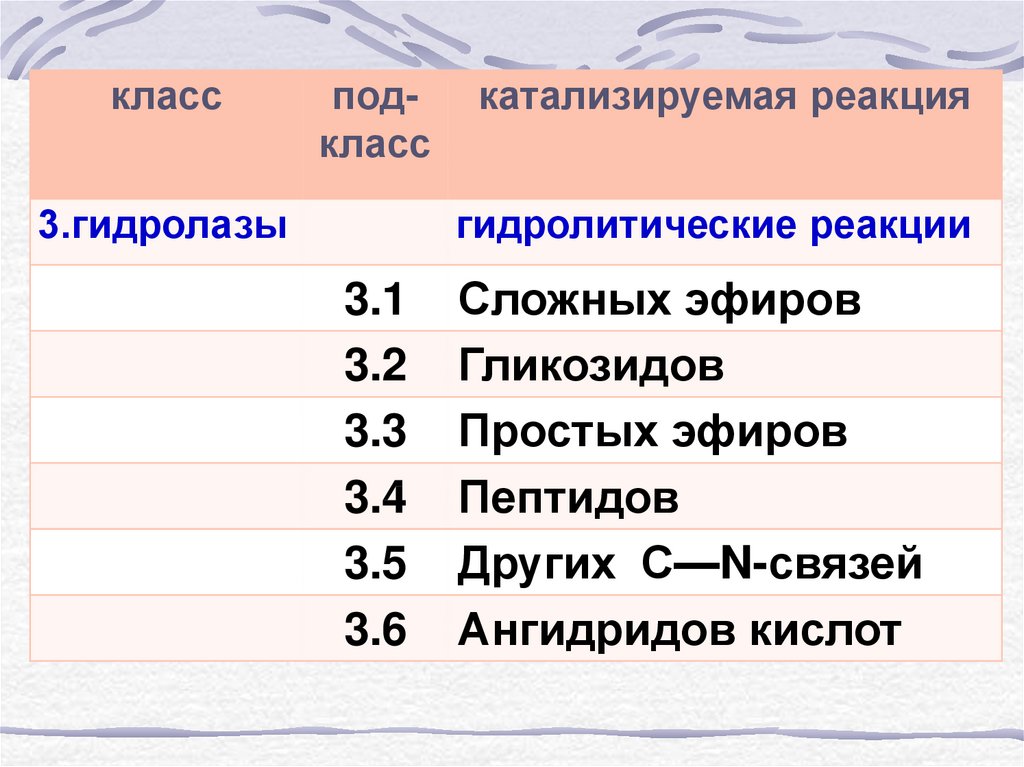
3. Гидролазы
А В + Н2О
А Н + В ОН
3.
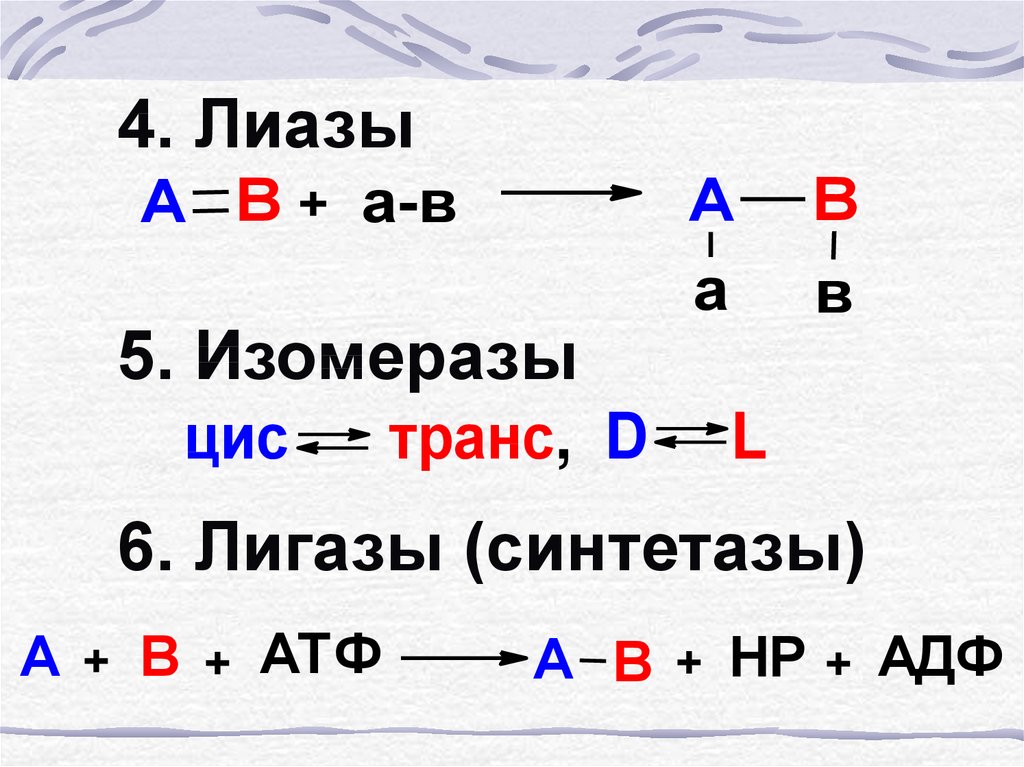
4. ЛиазыА В + а-в
5. Изомеразы
цис
транс, D
А
а
В
в
L
6. Лигазы (синтетазы)
А + В + АТФ
А В + НР + АДФ
4. Класс фермента
характеризует химическую реакцию,катализируемую данным ферментом
(6 классов ферментов)
Подкласс фермента
характеризует основные виды субстратов,
участвующих в данном типе химических
превращений
5.
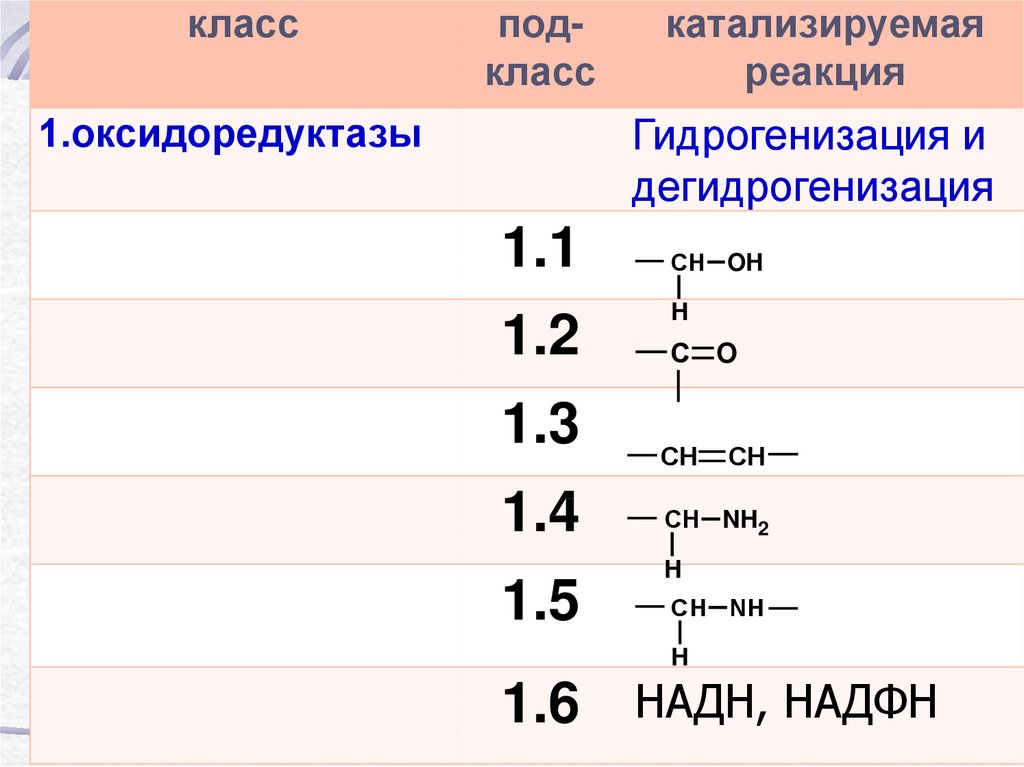
классподкласс
1.оксидоредуктазы
катализируемая
реакция
Гидрогенизация и
дегидрогенизация
1.1
1.2
1.3
1.4
1.5
СН OH
H
С O
СН
СН
СН NH2
H
СН NН
H
1.6 НАДН, НАДФН
6.
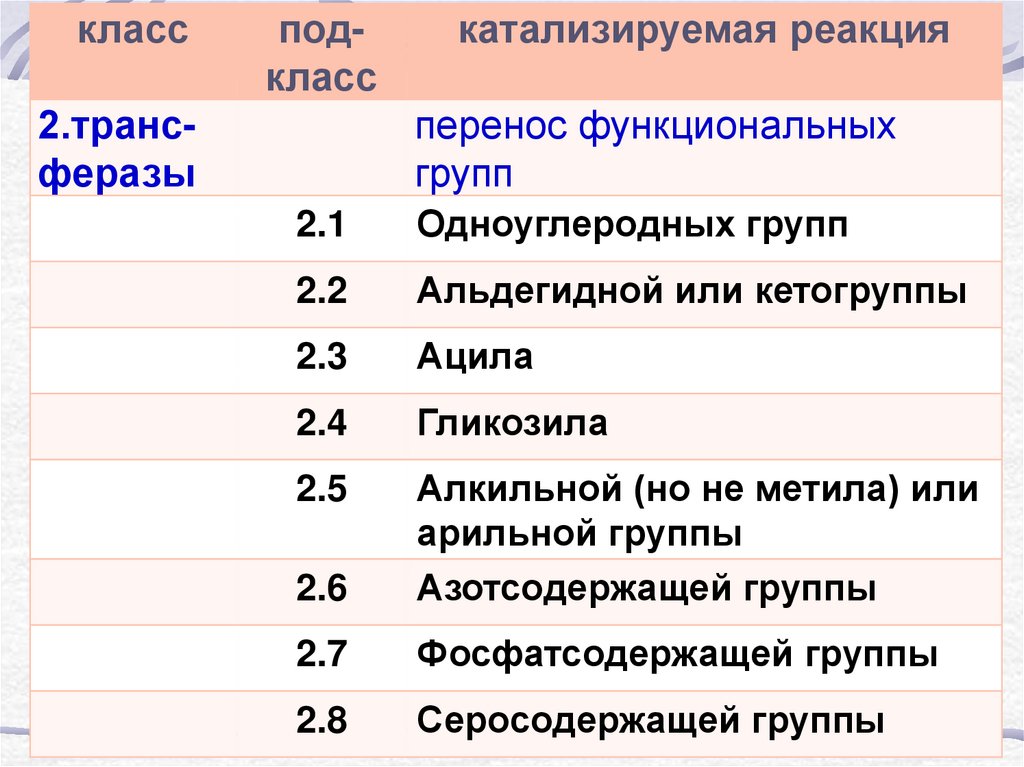
классподкласс
2.трансферазы
катализируемая реакция
перенос функциональных
групп
2.1
Одноуглеродных групп
2.2
Альдегидной или кетогруппы
2.3
Ацила
2.4
Гликозила
2.5
2.6
Алкильной (но не метила) или
арильной группы
Азотсодержащей группы
2.7
Фосфатсодержащей группы
2.8
Серосодержащей группы
7.
классподкласс
3.гидролазы
катализируемая реакция
гидролитические реакции
3.1
3.2
3.3
3.4
3.5
3.6
Сложных эфиров
Гликозидов
Простых эфиров
Пептидов
Других С—N-связей
Ангидридов кислот
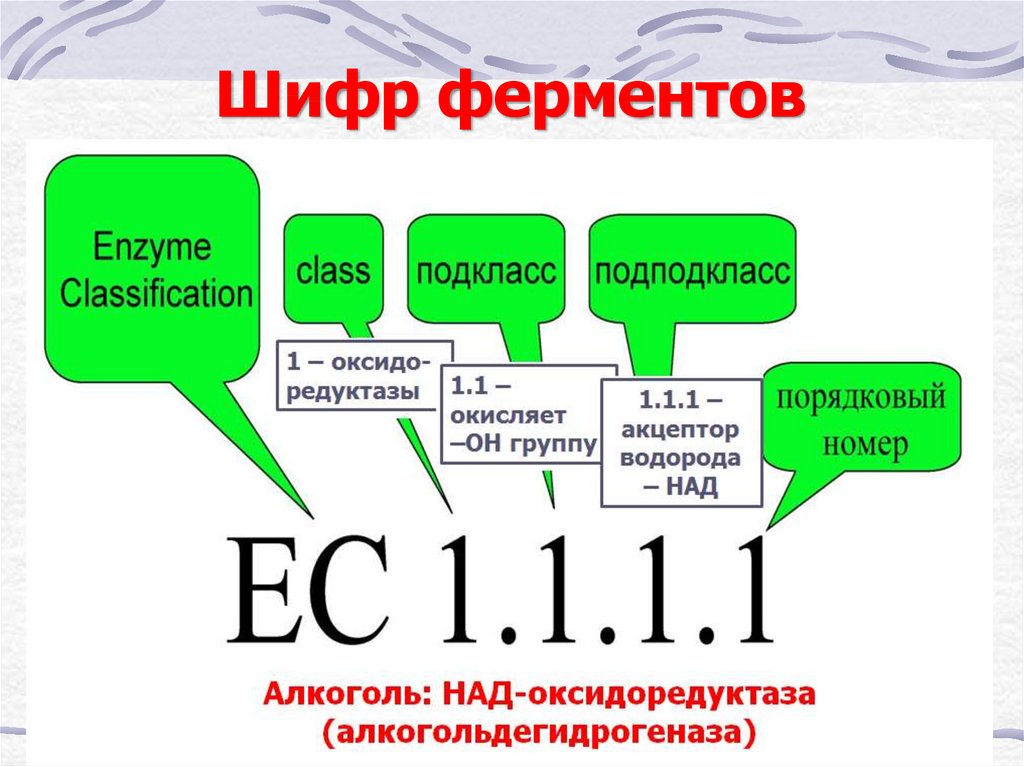
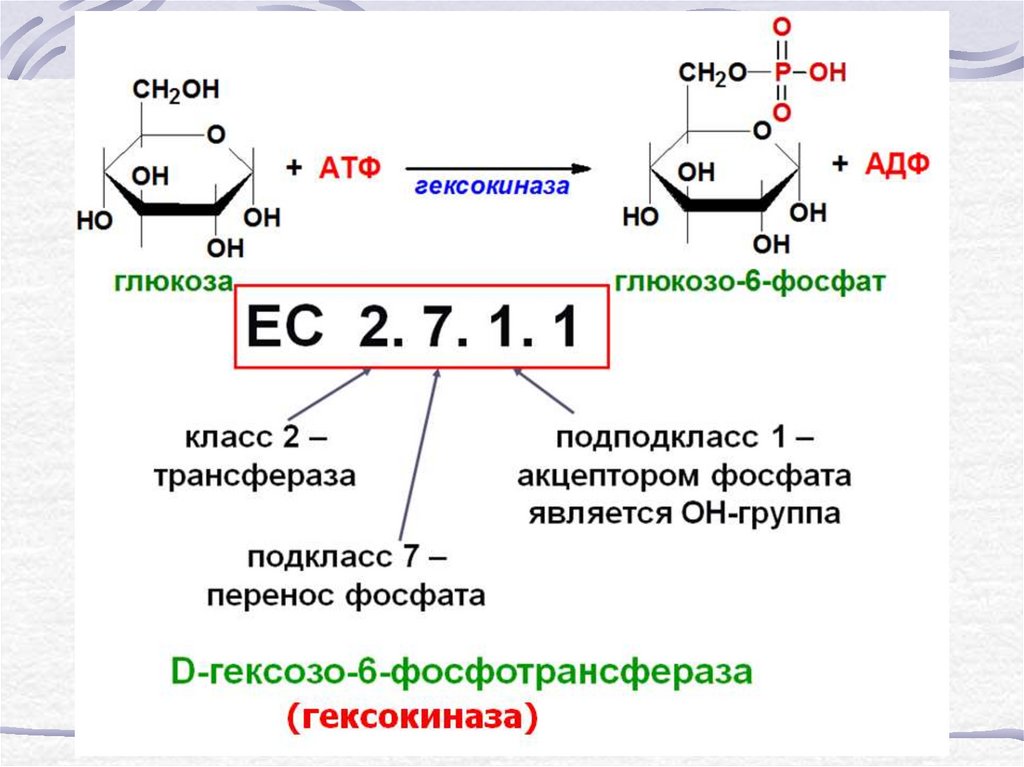
8. Шифр ферментов
9.
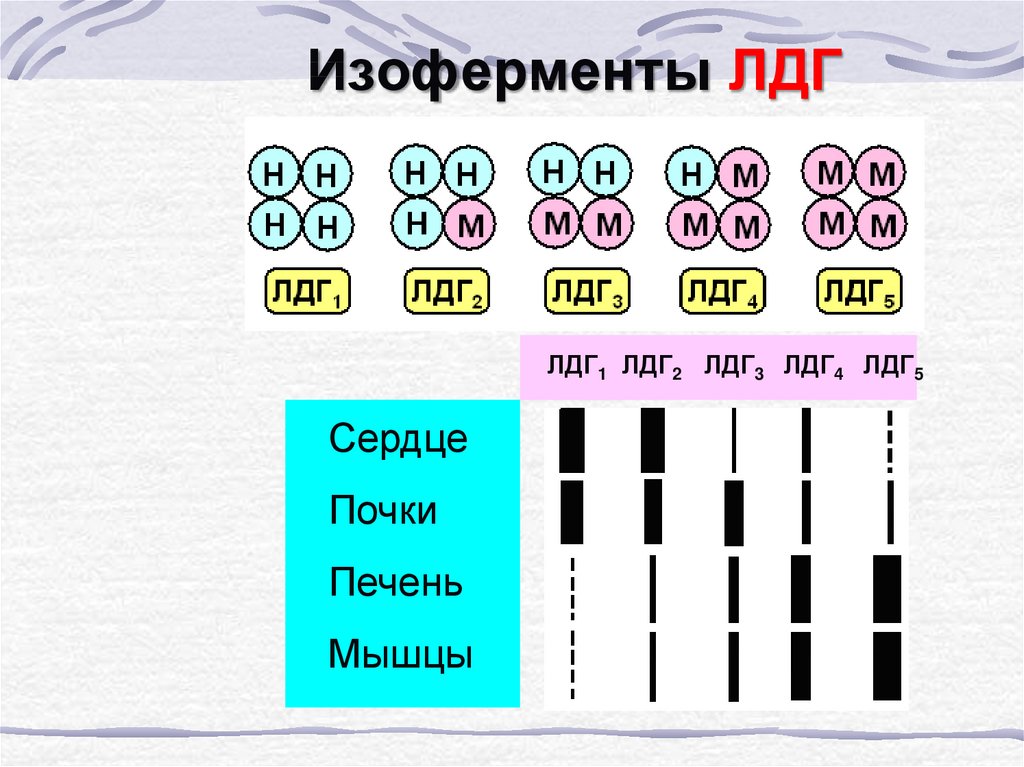
10. Изоферменты –
ферменты, катализирующие однуи ту же реакцию, но
отличающиеся по первичной
структуре и локализованные в
разных тканях
11. Изоферменты ЛДГ
ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5Сердце
Почки
Печень
Мышцы
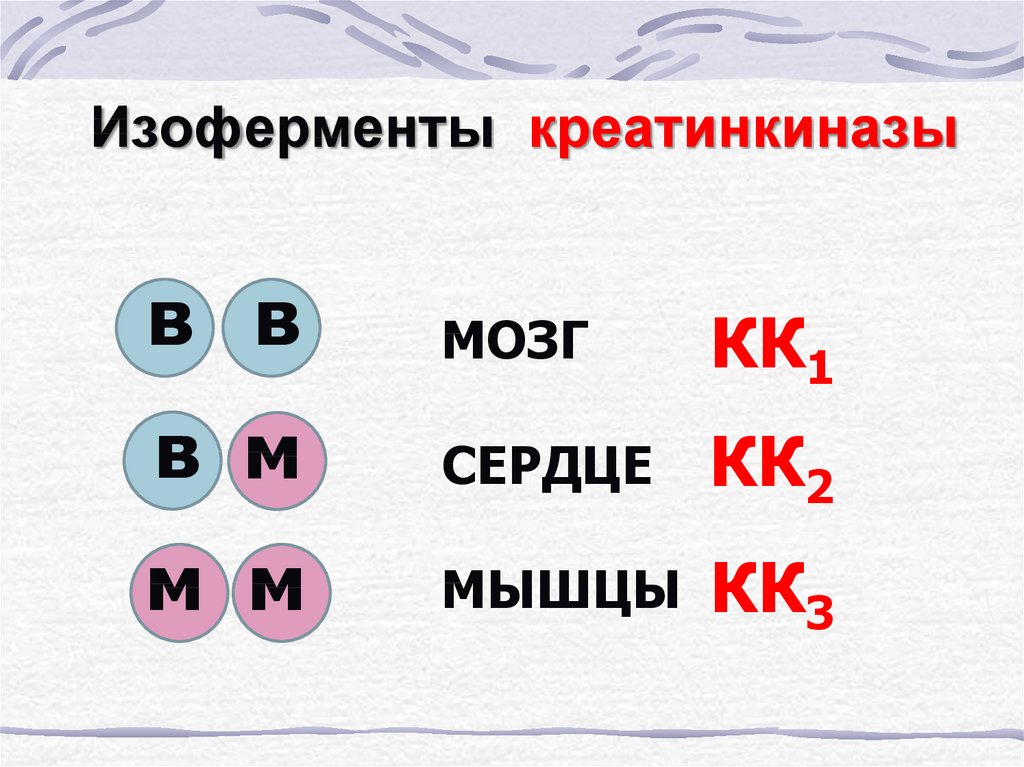
12. Изоферменты креатинкиназы
в вМОЗГ
КК1
в м
СЕРДЦЕ
КК2
м м
МЫШЦЫ
КК3
13. Регуляция скорости ферментативных реакций
1. Количеством ферментов2. Доступностью фермента и
субстрата
3. Регуляцией активности
самого фермента:
компонентами самой клетки
аллостерическая
химическая модификация
частичный протеолиз
14. Регуляция скорости ферментативных реакций
компонентами самой клетки –температурой, рН, количеством
субстрата, компартментализацией
ферментов, наличием эффекторов
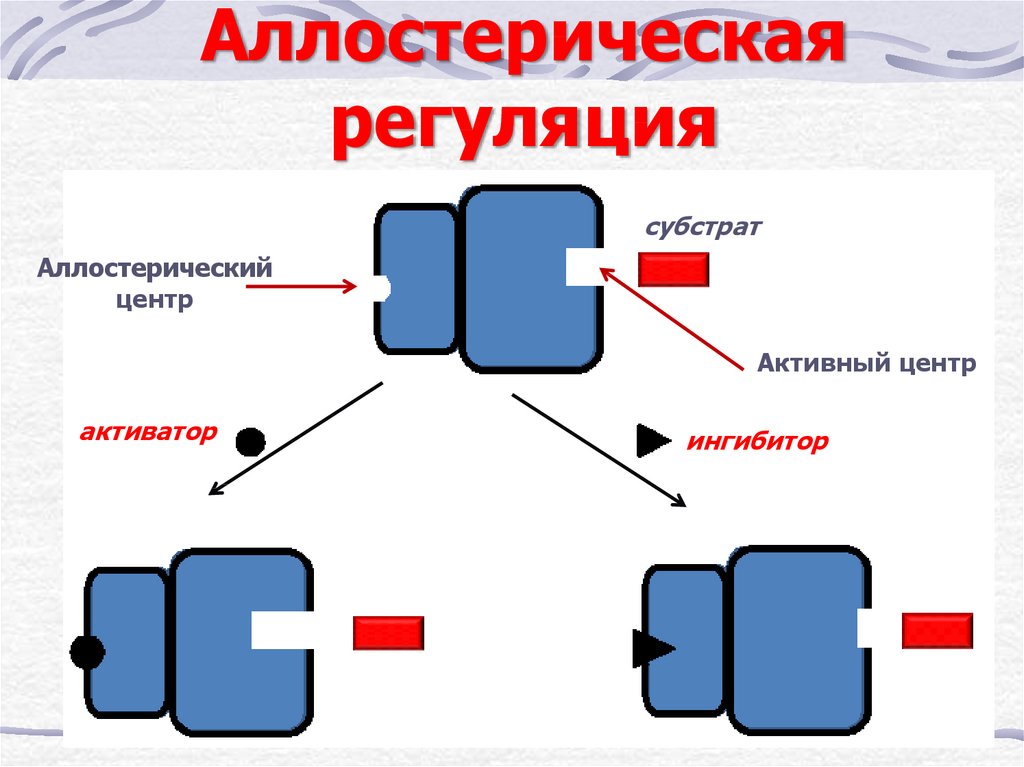
15.
Аллостерическаярегуляция
субстрат
Аллостерический
центр
Активный центр
активатор
ингибитор
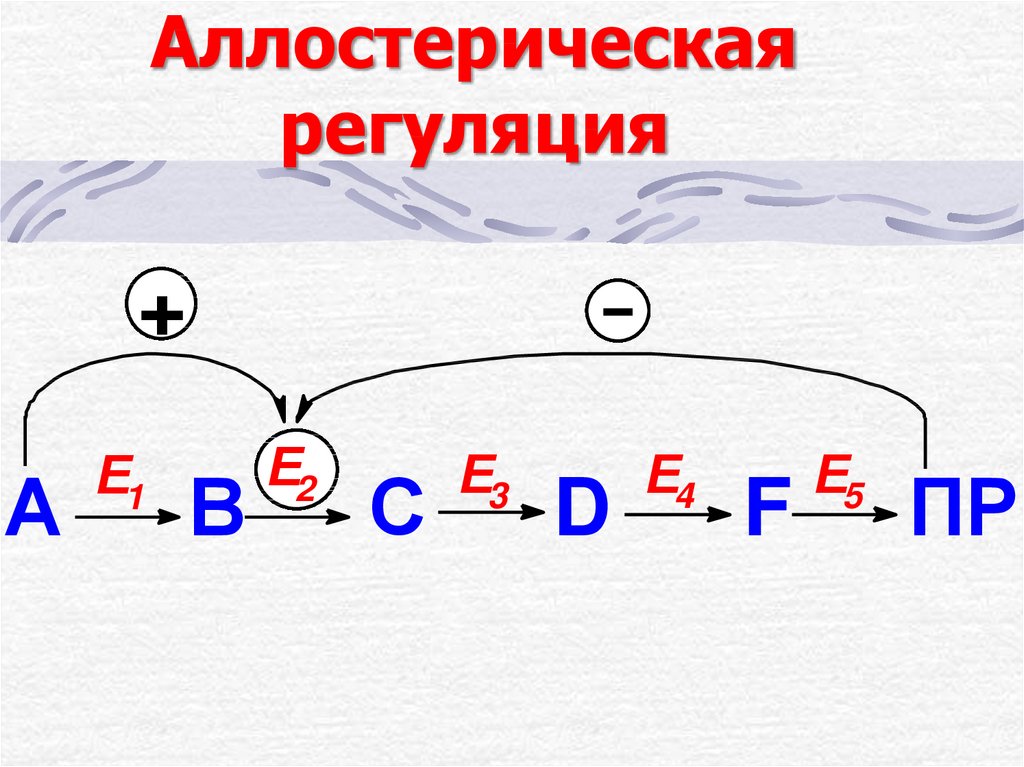
16. Аллостерическая регуляция
+А
Е1
В
Е2
С
Е3
D
Е4
F
Е5
ПР
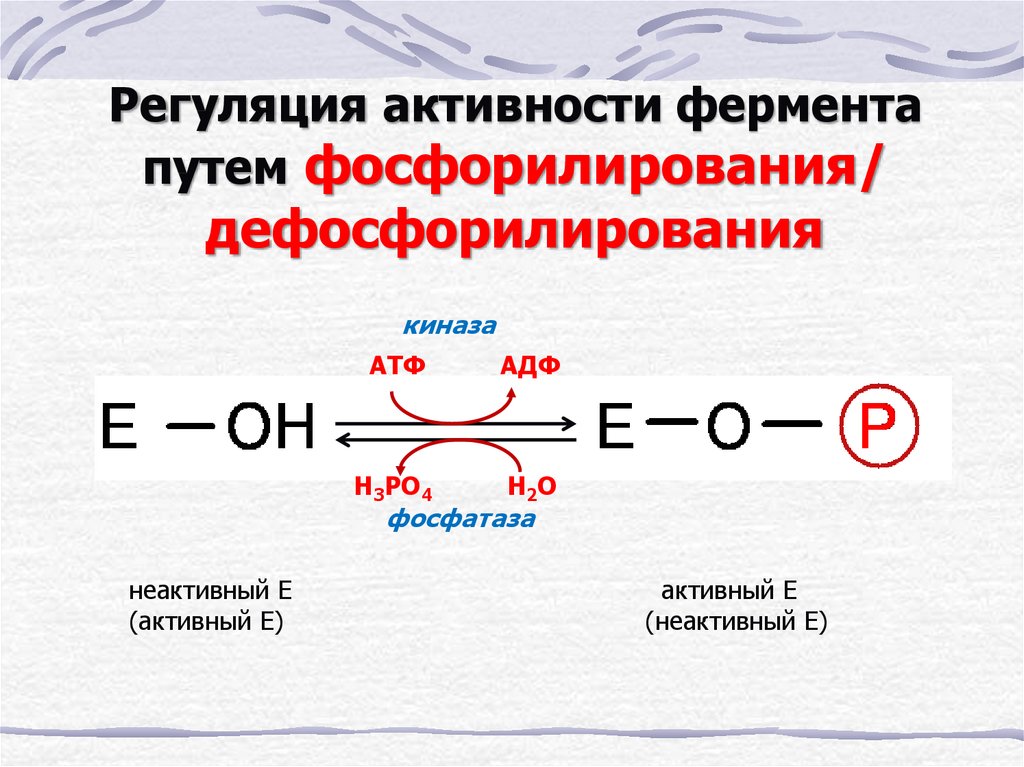
17. Регуляция активности фермента путем фосфорилирования/ дефосфорилирования
киназаАТФ
АДФ
Н3РО4
Н 2О
фосфатаза
неактивный Е
(активный Е)
активный Е
(неактивный Е)
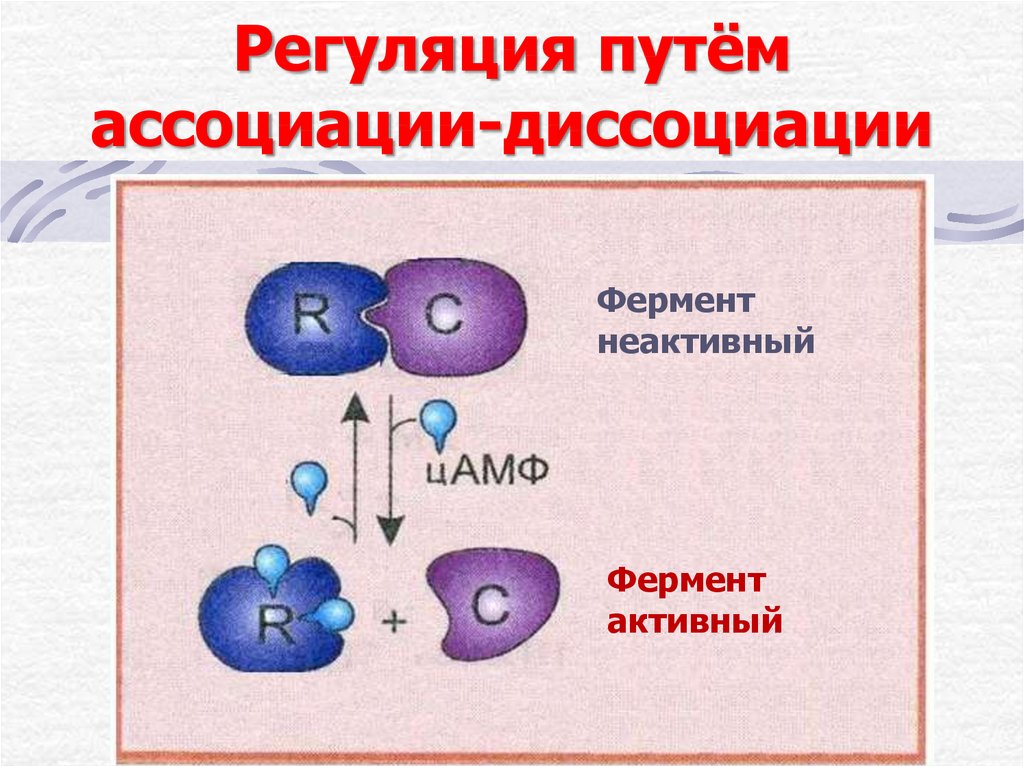
18. Регуляция путём ассоциации-диссоциации
Ферментнеактивный
Фермент
активный
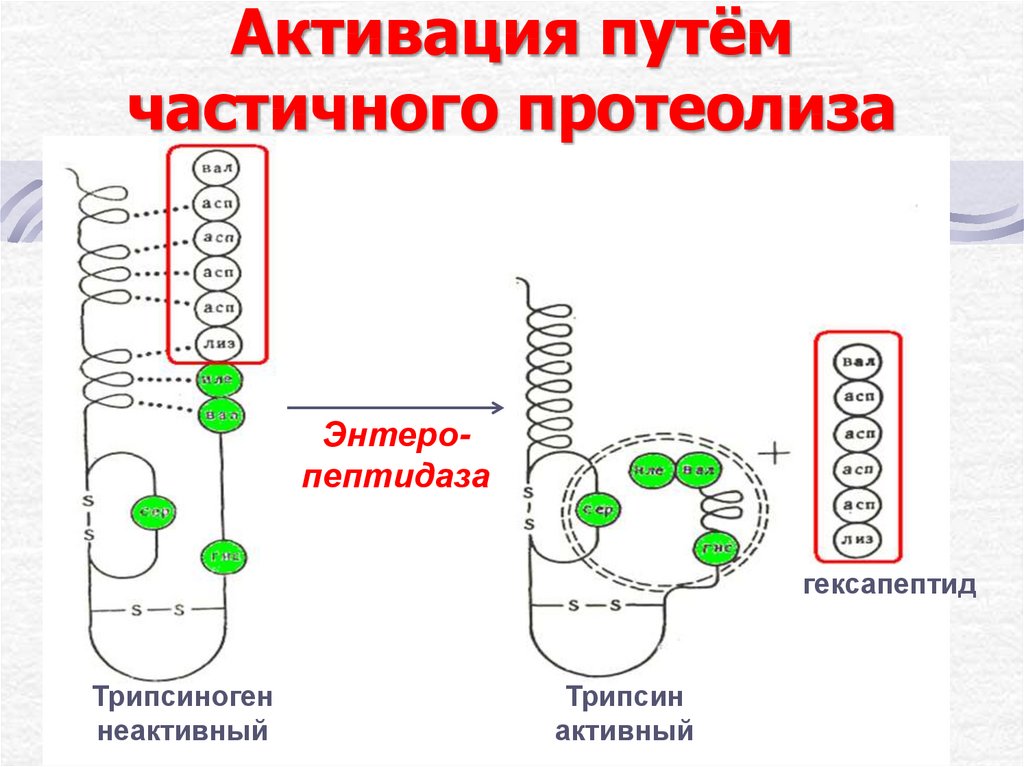
19. Активация путём частичного протеолиза
Энтеропептидазагексапептид
Трипсиноген
неактивный
Трипсин
активный
20. Энзимология –
раздел биохимии, изучающийстроение, механизм действия и
молекулярную структуру
ферментов, а также выделение,
процессы биосинтеза
ферментов и их практическое
применение, в т.ч. для
энзимодиагностики и
энзимотерапии.
21. Энзимодиагностика -
Энзимодиагностика определениеактивности
ферментов с
диагностической
целью
22. 2 группы ферментов:
• Ферменты жизнеобеспечения(одинаковые во всех клетках)
• Органоспецифические
ферменты
Ферментный состав клеток
изменяется в онтогенезе и при
болезнях
23. Происхождение ферментов крови:
• Собственныеферменты крови;
• Ферменты секретов и
экскретов;
• Тканевые ферменты.
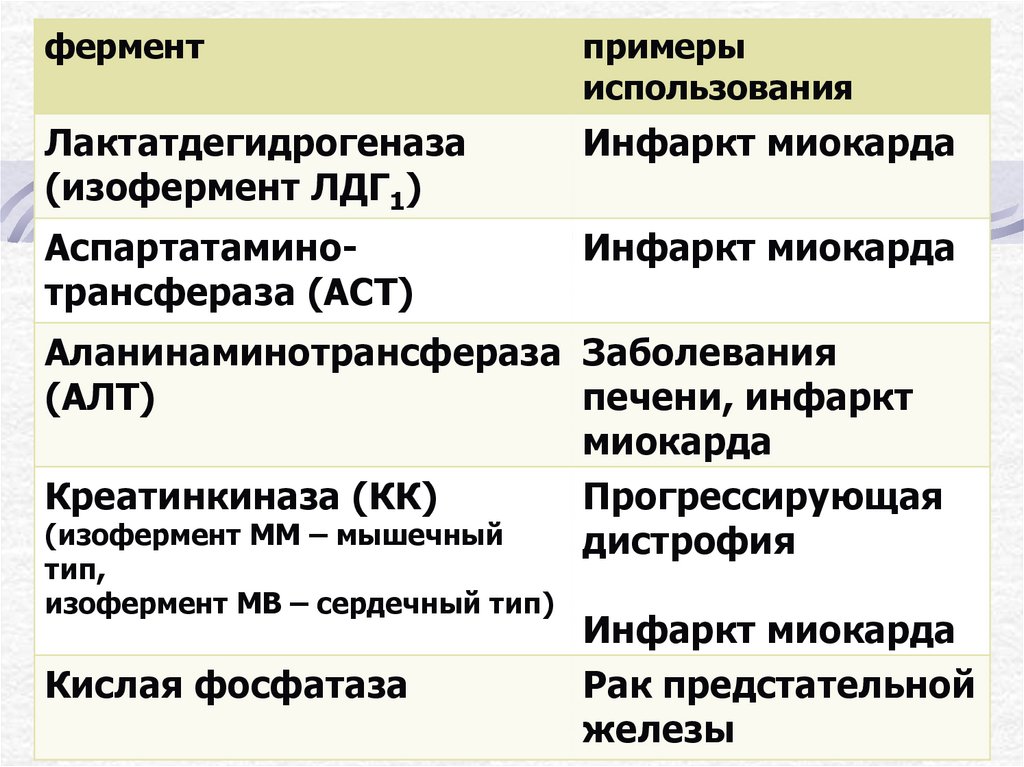
24.
ферментпримеры
использования
Лактатдегидрогеназа
(изофермент ЛДГ1)
Инфаркт миокарда
Аспартатаминотрансфераза (АСТ)
Инфаркт миокарда
Аланинаминотрансфераза Заболевания
(АЛТ)
печени, инфаркт
миокарда
Креатинкиназа (КК)
Прогрессирующая
(изофермент ММ – мышечный
дистрофия
тип,
изофермент МВ – сердечный тип)
Кислая фосфатаза
Инфаркт миокарда
Рак предстательной
железы
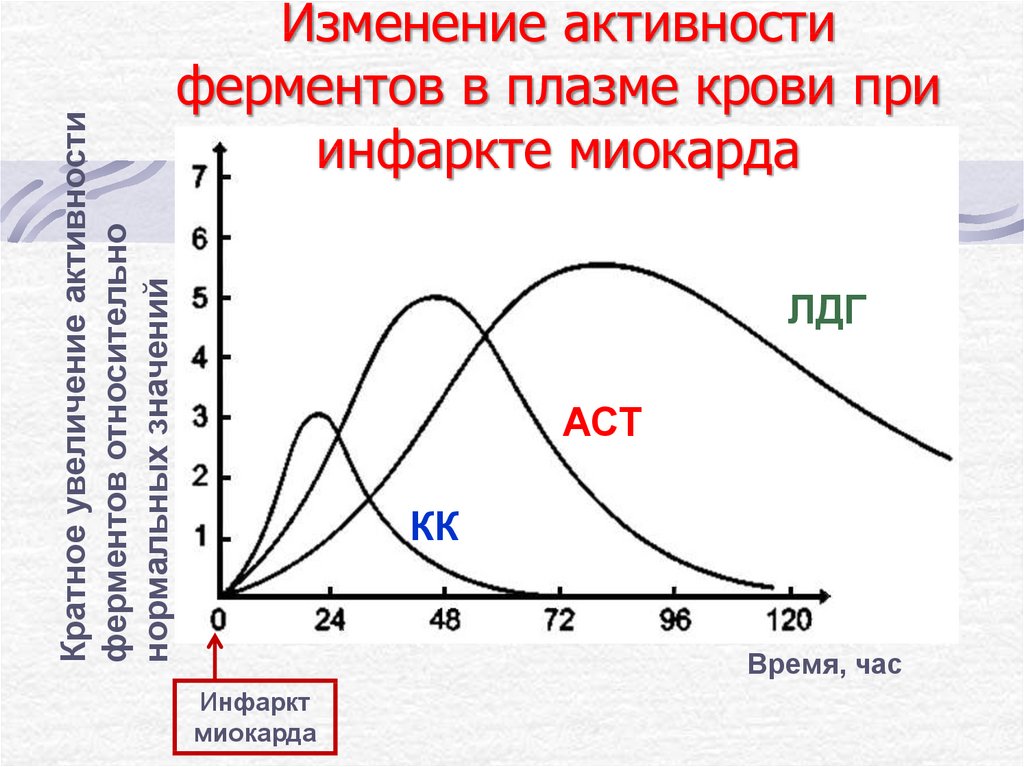
25. Изменение активности ферментов в плазме крови при инфаркте миокарда
Кратное увеличение активностиферментов относительно
нормальных значений
Изменение активности
ферментов в плазме крови при
инфаркте миокарда
ЛДГ
АСТ
КК
Время, час
Инфаркт
миокарда
26.
Энзимотерапия использованиеферментов с
лечебной целью
27. Использование ферментов с лечебной целью
• Ферментозаместительнаятерапия;
• Противовоспалительная
терапия;
• Фибринолитическая
терапия;
• Литическая терапия
28.
ферментпримеры использования
Пепсин
Нарушение переваривания
белков в желудке,
нарушение синтеза или
секреции пепсина
Лечение гнойных ран
Трипсин,
химотрипсин
(Девитас)
Гиалуронидаза
Рассасывание рубцов
Стрептокиназа,
урокиназа
Рассасывание тромбов
Нуклеазы
(ДНКаза)
Вирусный конъюнктивит,
ринит, гнойный бронхит
29. Иммобилизованные ферменты
─ препараты ферментов, молекулы которых связаны сматрицей, или носителем (например, целлюлозой),
сохраняя при этом свои каталитические свойства.
Преимущества иммобилизованных ферментов:
• более высокая стабильность ферментных препаратов,
• возможность их удаления из реакционной среды и его
повторного использования,
• длительность хранения,
• возможность создания непрерывных процессов на
ферментных колонках,
• относительная стабильность иммобилизованных
ферментов к денатурирующим воздействиям –
нагреванию, действию агрессивных сред, аутолизу и др.
30.
Использование ферментов вкачестве аналитических
реагентов
фермент
примеры
использования
Глюкозооксидаза Определение концентрации
глюкозы
Липаза
Определение концентрации
липидов
Уреаза
Определение концентрации
мочевины
31. Энзимопатии
Наследственные(связаны с
отсутствием
или
нарушением
синтеза
ферментов)
Вторичные
• токсические;
• алиментарные;
• регуляторные;
• нарушение
локализации
фермента в
клетке.
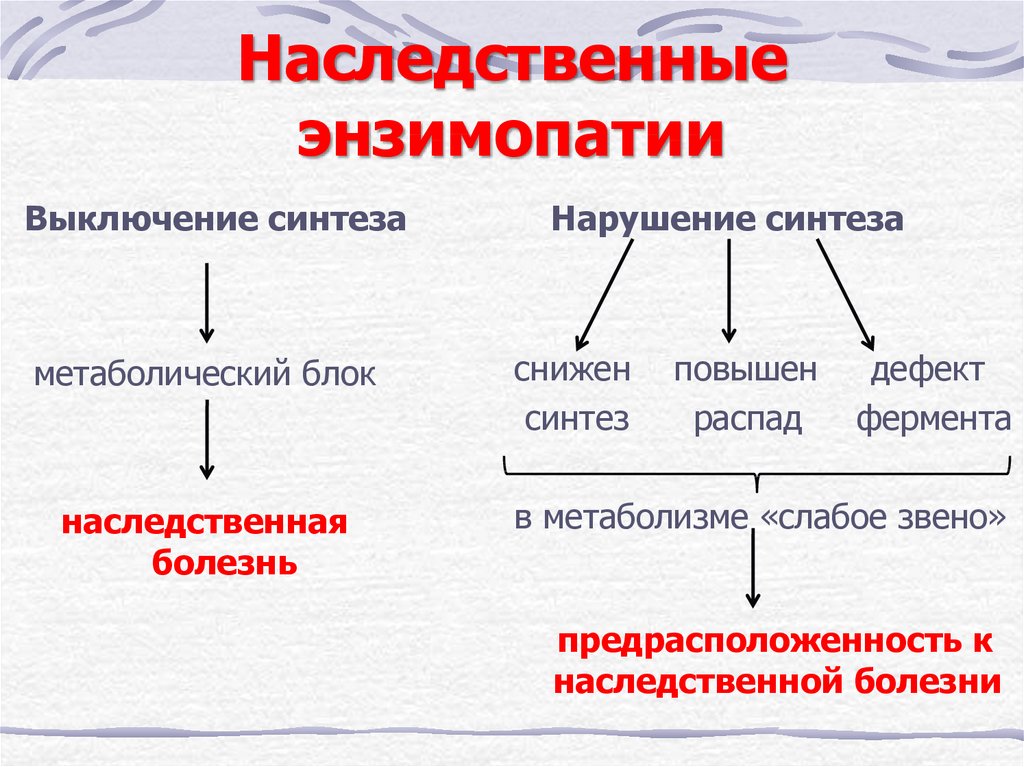
32. Наследственные энзимопатии
Выключение синтезаметаболический блок
наследственная
болезнь
Нарушение синтеза
снижен
синтез
повышен
распад
дефект
фермента
в метаболизме «слабое звено»
предрасположенность к
наследственной болезни
33. Единицы измерения количества и активности фермента
1МЕ =1 мкмоль превращенного S
1 мин
34. nМЕ – количество единиц активности
nМЕ =Кол-во превращенного S (мкмоль)
Время (мин)
35. Катал
1 моль превращенного S1 катал =
1 секунда
36. Связь международной единицы ферментативной активности с каталом
76х10
1 кат =
МЕ
1 МЕ = 16,67 нкат



















 Биология
Биология








