Похожие презентации:
Предмет коллоидной химии, ее значение для фармации. Поверхностные явления. Поверхностное натяжение. Адсорбция ПАВ
1.
Предмет коллоидной химии, еезначение для фармации.
Поверхностные явления.
Поверхностное натяжение.
Адсорбция ПАВ на поверхности
раздела жидкость-газ
2.
Коллоидная химия - наука,изучающая дисперсные системы и
поверхностные явления.
К дисперсным системам близки по
свойствам растворы ВМВ, поэтому
они так же рассматриваются в
курсе коллоидной химии.
3.
Основателем коллоидной химииявляется английский ученый Томас
Грэм.
• В 1861 г. Т. Грэм предложил
разделить все химические
вещества на коллоиды и
кристаллоиды по их способности
образовывать растворы с резко
отличающимися свойствами.
4.
Кристаллоиды образуют истинныерастворы.
Коллоиды – образуют коллоидные
растворы.
По гречески колла ( ) – клей.
5.
• Впоследствии выяснилось, чтоделение веществ на кристаллоиды
и коллоиды неправомерно, так как
одни и те же вещества могут в
различных условиях образовывать
как истинные, так и коллоидные
растворы, термин «коллоидные
растворы», а также производное от
него название науки «коллоидная
химия» сохранились.
6.
Закономерности коллоиднойхимии лежат в основе
процессов приготовления
лекарственных форм, их
хранения и старения. Поэтому
знание коллоидной химии
необходимо провизорам.
7.
Предметом изученияколлоидной химии являются
дисперсные системы и
поверхностные явления.
8.
Дисперсныминазывают
гетерогенные
системы,
в
которых одно вещество в виде
очень
мелких
частиц
(дисперсной
фазы
(ДФ)
равномерно распределено в
объеме
другого
вещества
(дисперсионной среды (ДС).
9.
К поверхностным явлениямотносятся процессы,
протекающие на границе,
раздела фаз.
10.
Состояние вещества вблизимежфазной границы, отличается от
его состояния в глубине фазы.
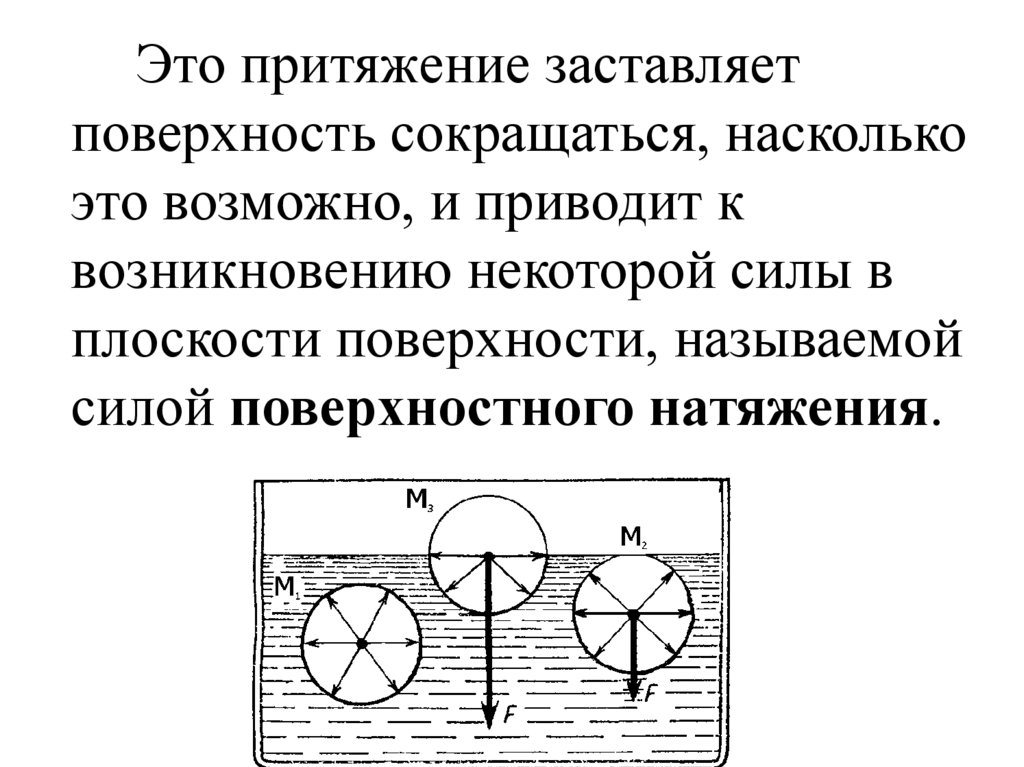
• Если молекула находится на
поверхности жидкости, она испытывает
притяжение как со стороны жидкой
фазы, так и со стороны воздуха.
• Силы притяжения со стороны газовой
фазы намного меньше, поэтому
поверхностные молекулы втягиваются в
жидкую фазу.
11.
Это притяжение заставляетповерхность сокращаться, насколько
это возможно, и приводит к
возникновению некоторой силы в
плоскости поверхности, называемой
силой поверхностного натяжения.
12.
Поэтому жидкие и твёрдые теласамопроизвольно приобретают
минимальный возможный
объём и практически не
поддаются сжатию.
13.
• молекулы поверхностного слояобладают избыточной свободной
поверхностной энергией
(поверхностной энергией Гиббса) Gs.
Gs = S
Где - коэффициент
пропорциональности или коэффициент
поверхностного натяжения,
S - площадь поверхности раздела фаз[м2]
14.
Физический смысл - свободнаяповерхностная энергия, приходящаяся на
единицу площади поверхности раздела
фаз. Размерность СИ [Дж/м2]
Поверхностное натяжение можно также
рассматривать как силу, стремящуюся
сократить поверхность до минимума при
данном соотношении объёмов фаз. В этом
случае размерность [Н/м].
15.
Gs = SСамопроизвольно энергия Гиббса
(свободная поверхностная энергия GS )
всегда уменьшается.
Уменьшение GS может достигаться: G = S
S
1. Уменьшением площади поверхности
раздела фаз.
Самопроизвольное принятие частицами
такой геометрической формы, которая
отвечает минимуму свободной
поверхностной энергии.
Объединение (агрегация) мелких частиц в
более крупные (агрегаты).
16.
2. Уменьшения поверхностного натяжения:GS = S
Уменьшение поверхностного натяжения
достигается введением в дисперсную
систему поверхностно-активных веществ
(ПАВ).
17.
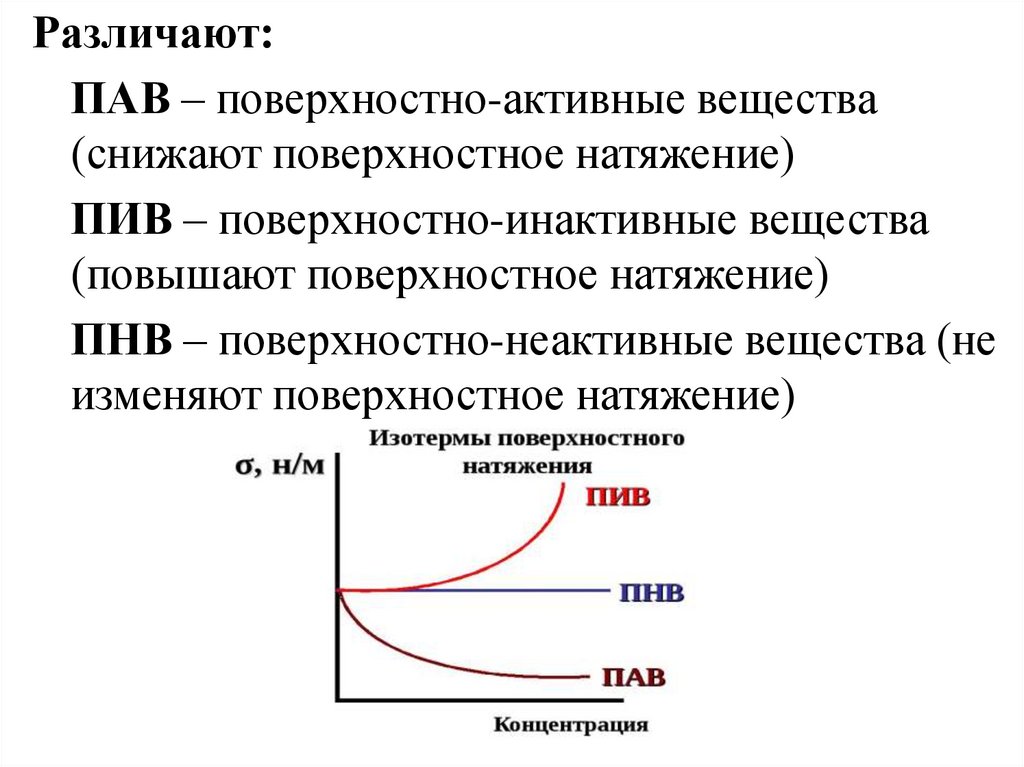
Различают:ПАВ – поверхностно-активные вещества
(снижают поверхностное натяжение)
ПИВ – поверхностно-инактивные вещества
(повышают поверхностное натяжение)
ПНВ – поверхностно-неактивные вещества (не
изменяют поверхностное натяжение)
18.
Способностью понижать поверхностноенатяжение обладают органические вещества с
несимметричными молекулами, в которых
имеются как полярные (гидрофильные), так и
неполярные гидрофобные (липофильные)
группы. Гидрофильные группы (-ОН, -СООН,
-SO3H, -NH2 и т. п.) обеспечивают сродство
ПАВ к воде, гидрофобные (обычно
углеводородные радикалы, как алифатические,
так и ароматические) сродство ПАВ к
неполярным средам.
19.
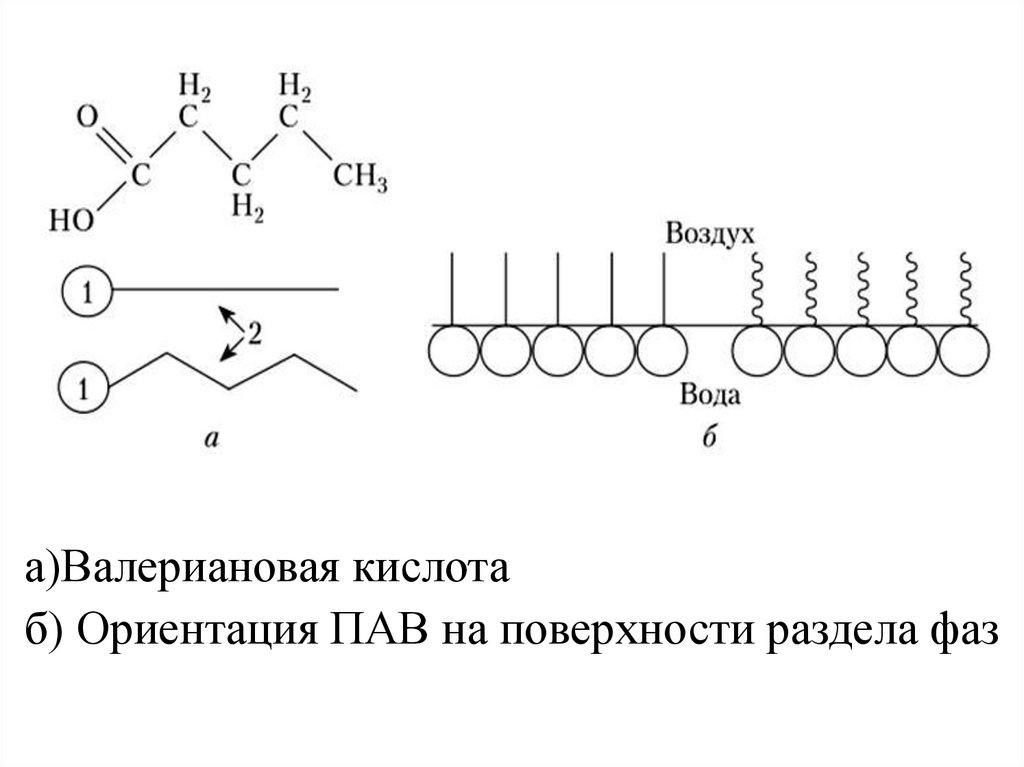
Графически молекула ПАВизображается символом , в
котором кружок обозначает
гидрофильную группу, а черта гидрофобную.
На границе раздела фаз молекулы
ПАВ ориентируются следующим
образом: гидрофильные группы - в
сторону полярной фазы, гидрофобные
- в сторону неполярной фазы.
20.
а)Валериановая кислотаб) Ориентация ПАВ на поверхности раздела фаз
21.
Классификация ПАВ1. По размерам молекул
ПАВ делят на
- высокомолекулярные (белки) и
- низкомолекулярные (спирты,
фенолы, карбоновые кислоты и др.)
22.
2. По типу гидрофильных групп различают- Неионные (неионогеные) ПАВ –
недиссоциируют в растворе (спирты, твины или
сорбиты).
- Ионные (ионогенные) ПАВ – диссоциируют в
растворе на ионы, одни их которых обладает
поверхностной активностью, а другие - нет. В
зависимости от знака заряда поверхностноактивного иона ПАВ делят на катионактивные,
анионактивные и амфотерные.
На практике чаще всего используются
анионактивные ПАВ: карбоновые кислоты и их
соли (мыла) и др.
23.
3. По поведению в раствореПАВ делят на:
- истинно-растворимые хорошо
растворяются в воде (спирты, фенолы,
низшие карбоновые кислоты и их соли,
амины) и
- коллоидные (или мицеллообразующие,
МПАВ) способны образовывать
мицеллярные (коллоидные) растворы ПАВ
(танниды, органические
красители, мыла).
24.
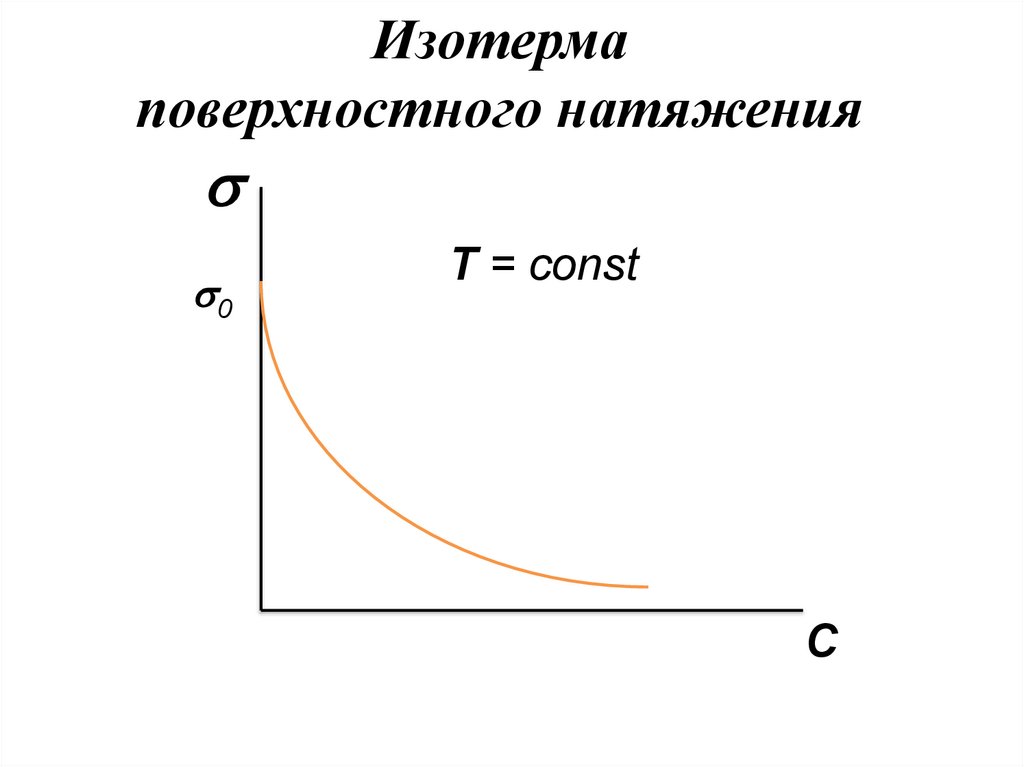
Изотермаповерхностного натяжения
Зависимость растворов ПАВ от их
концентрации выражается изотермами.
Изотерма поверхностного натяжения
выходит из точки 0, которая отвечает
поверхностному натяжению чистого
растворителя.
25.
Изотермаповерхностного натяжения
0
T = const
С
26.
Экспериментальные способы определенияповерхностного натяжения
1.Сталагмометрический способ
(метод счета капель)
основан на зависимости числа капель (n),
полученных при вытекании жидкости
определенного объема, от величины
поверхностного натяжения
исследуемой жидкости.
Чем больше поверхностное натяжение
жидкости, тем меньше капель будет
находиться в заданном объеме.
27.
Сталагмометрически величинуповерхностного натяжения
рассчитывают по уравнению:
0 n0 x
х
nx 0
28.
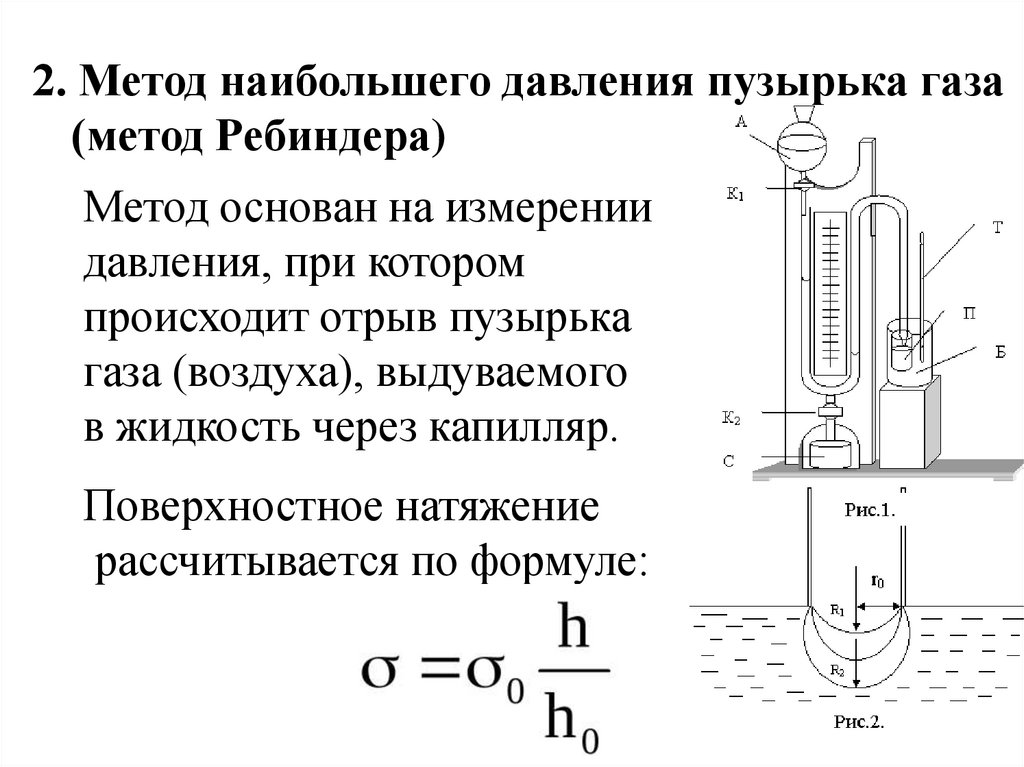
2. Метод наибольшего давления пузырька газа(метод Ребиндера)
Метод основан на измерении
давления, при котором
происходит отрыв пузырька
газа (воздуха), выдуваемого
в жидкость через капилляр.
Поверхностное натяжение
рассчитывается по формуле:
29.
Уравнение Б. ШишковскогоИзотермы поверхностного натяжения могут
быть описаны с помощью уравнения
Б. Шишковского (1908): 0 a ln( 1 bC )
или
0 a ln( 1 bC )
где - поверхностное натяжение раствора
ПАВ;
0 - поверхностное натяжение растворителя;
- понижение поверхностного натяжения
а и b - константы.
а характерна для гомологического ряда;
b характерна для каждого отдельного ПАВ.
30.
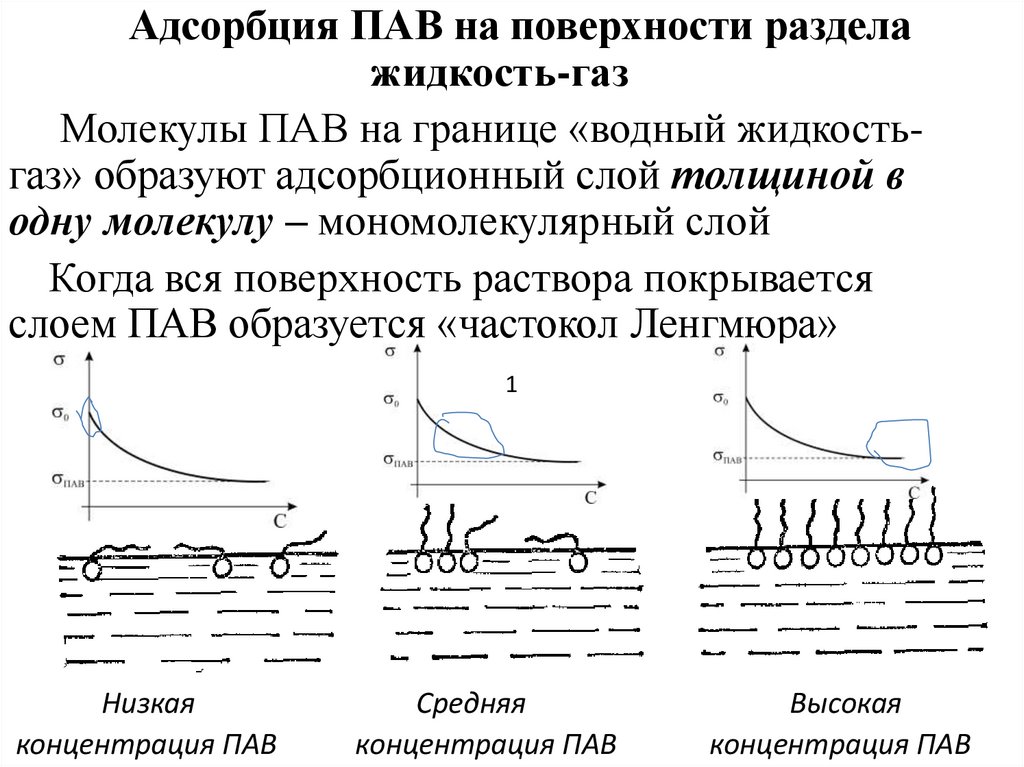
Адсорбция ПАВ на поверхности разделажидкость-газ
Молекулы ПАВ на границе «водный жидкостьгаз» образуют адсорбционный слой толщиной в
одну молекулу – мономолекулярный слой
Когда вся поверхность раствора покрывается
слоем ПАВ образуется «частокол Ленгмюра»
1
Низкая
концентрация ПАВ
1
Средняя
концентрация ПАВ
Высокая
концентрация ПАВ
31.
Изотерма адсорбции ГиббсаКоличественное соотношение между
адсорбцией (поверхностным избытком(Г)
растворенного ПАВ и изменением
поверхностного натяжения раствора с
ростом концентрации раствора определяет
изотерма адсорбции Гиббса:
С
Г
С RT
32.
СГ
С RT
- изменение поверхностного натяжение
раствора по сравнению с водой;
С - изменение концентрации раствора
ПАВ;
Т - температура выраженная в Кельвинах;
R - универсальная газовая постоянная
33.
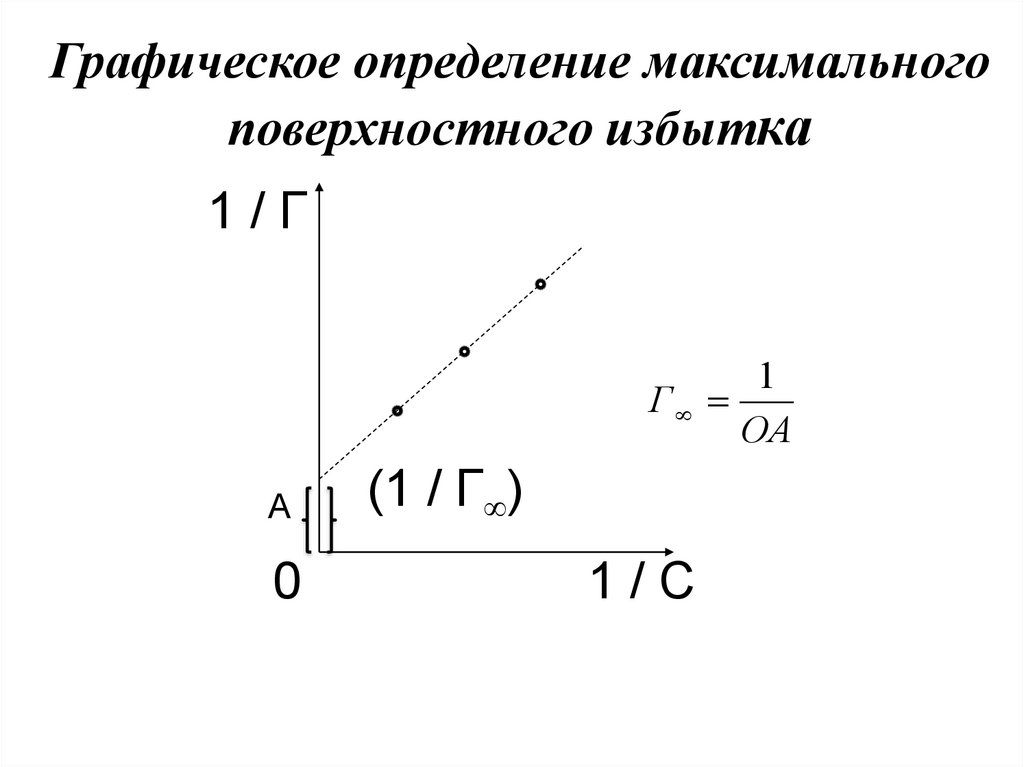
Графическое определение максимальногоповерхностного избытка
1/Г
1
Г
ОА
А
0
(1 / Г )
1/С
34.
35.
Поверхностная активностьС
Г
С RT
d
Величина ( ) называется поверхностной
dC
активностью. Она служит мерой способности
ПАВ снижать поверхностное натяжение.
d
если ( ) 0, то Г 0 – концентрация
dC
растворимого вещества в поверхностном слое
меньше, чем в объеме (отрицательная
адсорбция). Это наблюдается в растворах ПИВ.
d
Если ( dC ) 0, то Г 0 (положительная
адсорбция). Это наблюдается в растворах ПАВ.
36.
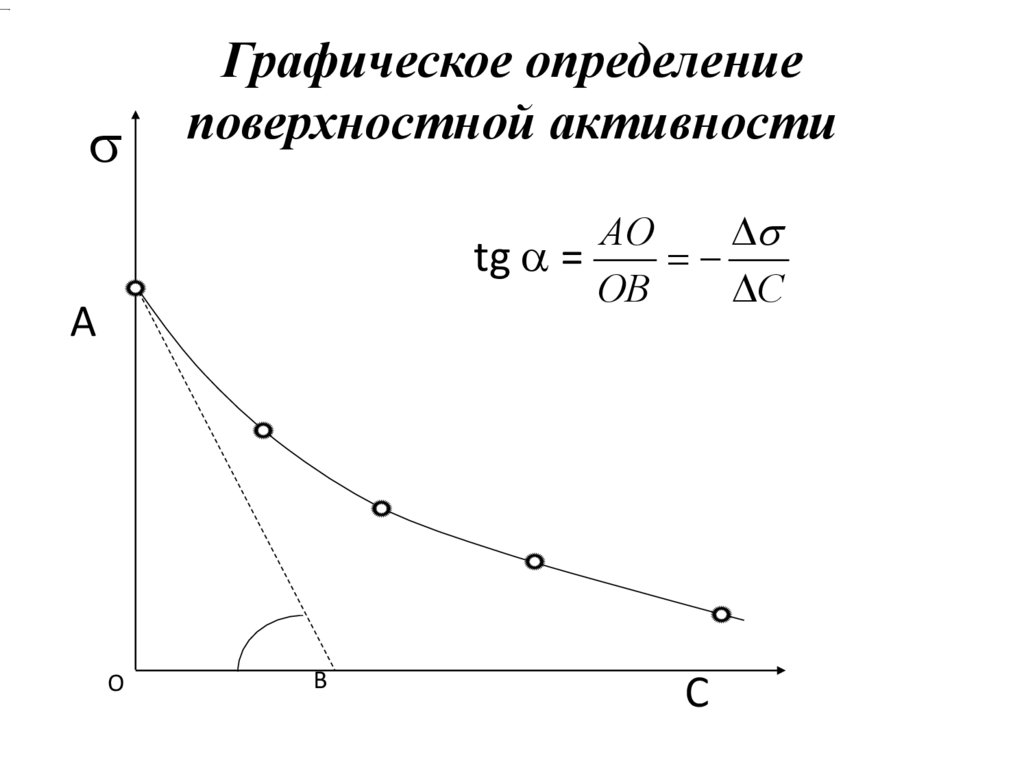
Графическое определениеповерхностной активности
АО
tg =
ОВ
С
А
О
В
С
37.
Правило П.Э. Дюкло И. ТраубеЗависимость поверхностной активности
от строения молекул ПАВ описывается
правилом П.Э. Дюкло И. Траубе:
Увеличение длины углеводородного
радикала в молекуле ПАВ на одну группу СН2 приводит к возрастанию
поверхностной активности в 3 – 5 раз
(приблизительно в 3,2 раза).
38.
Сродство молекул ПАВ к водной иневодной фазам оценивается величиной
гидрофильно-липофильного баланса (ГЛБ).
ГЛБ – это соотношение между энергией
взаимодействия гидрофильной группы
молекулы ПАВ с водой и энергией
взаимодействия гидрофобной группы ПАВ с
неполярной средой (бензолом, толуолом и
т.п.).
39.
Чем больше значение ГЛБ, тем сильнеевыражены гидрофильные свойства ПАВ и
те меньше его липофилые свойства.































 Химия
Химия








