Похожие презентации:
Типы химических связей. Частицы составляют ядро атома
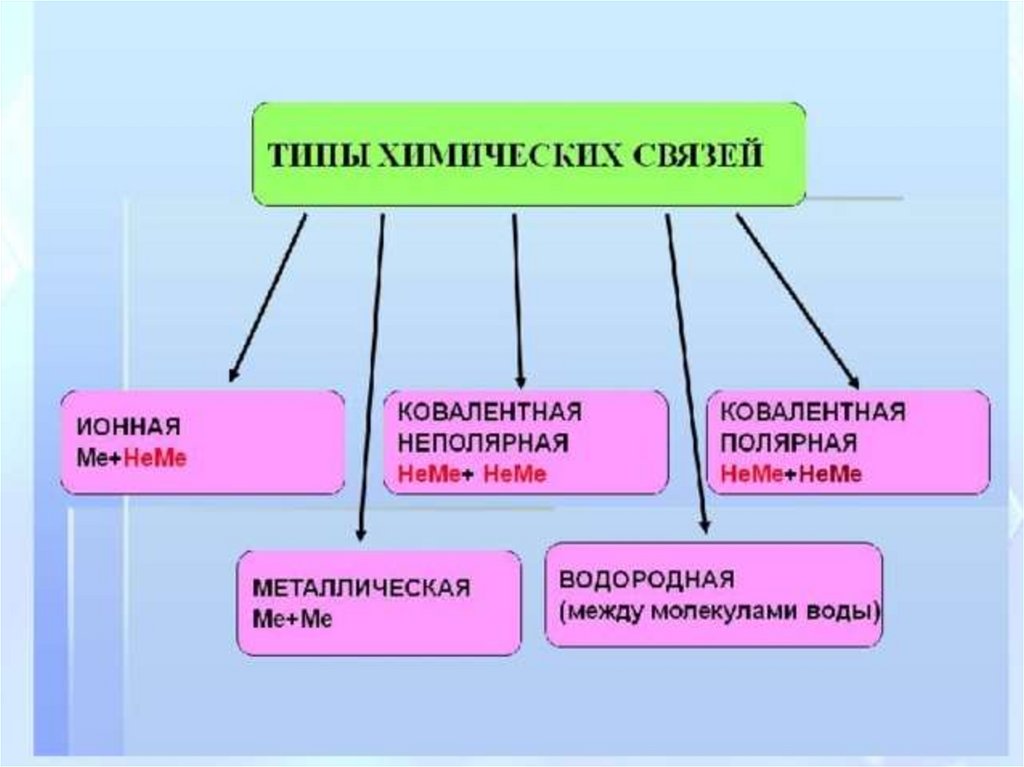
1. Типы химических связей
2. Повторение и опрос: Д/з: Составить схемы строения атомов: Fe, Al, P, Br. §30-31 учить.
1)Какие элементарные частицы составляют ядро атома?2)Как определить заряд ядра атома, количество протонов
в ядре, количество нейтронов, массовое число элемента?
3)С помощью какой формулы можно рассчитать
максимальное число электронов на энергетическом
уровне?
4)Как определить сколько энергетических уровней
содержит атом?
5) Как определить сколько электронов находится на
последнем энергетическом уровне?
6)Как рассчитать сколько электронов находится на
предпоследнем энергетическом уровне?
3. Давайте с вами вспомним, что такое металлы и что такое неметаллы?
Давайте с вами вспомним, что такое металлы и чтотакое неметаллы?
• Металлы – это химические элементы,
которые отдают электроны с последнего
энергетического уровня при химическом
взаимодействии.
• Неметаллы – это элементы, которые
принимают электроны на последний
энергетический уровень для его
завершения.
4.
5.
6.
7.
8.
9.
10. А каков результат приема – отдачи электронов для атомов металлов и атомов неметаллов?
А каков результат приема – отдачи электроновдля атомов металлов и атомов неметаллов?
• Атомы металлов отдают электроны и получают на
предпоследнем энергетическом уровне 8 электронов
(исключение – металлы II-го периода).
• Атомы неметаллов, принимая электроны на последний
уровень, получают 8 электронов на последний уровень.
• Общие схемы перехода электронов для металлов и
неметаллов:
Me0 – nē → Me+n
неMe0 + nē → неMe-n
11.
12.
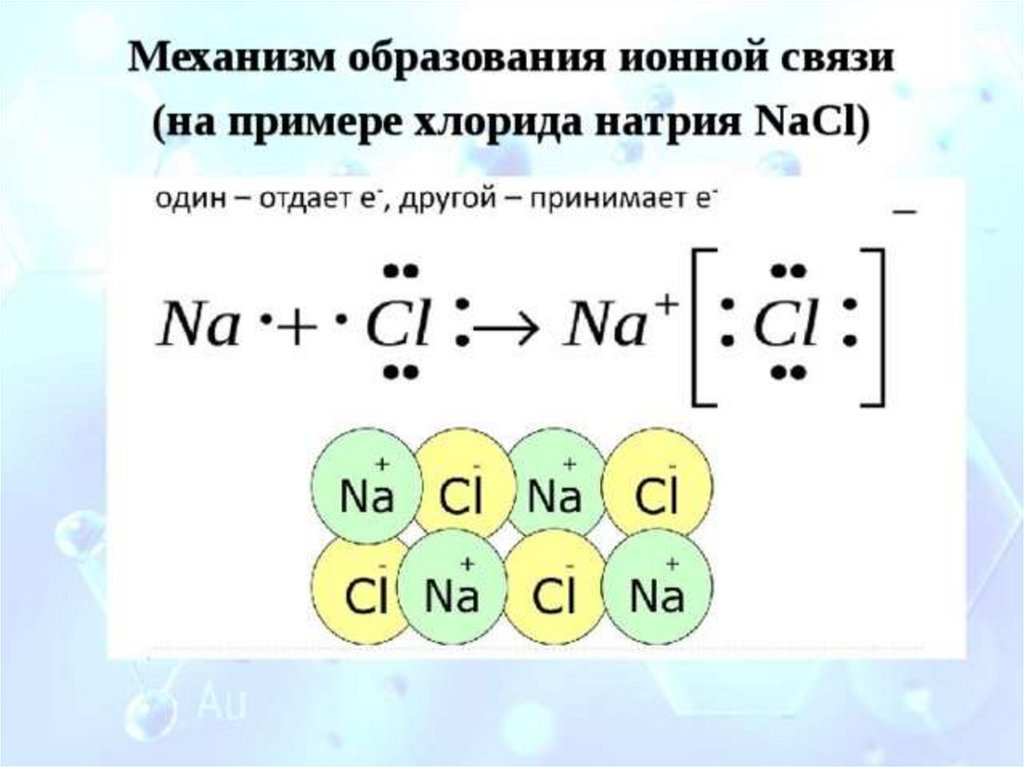
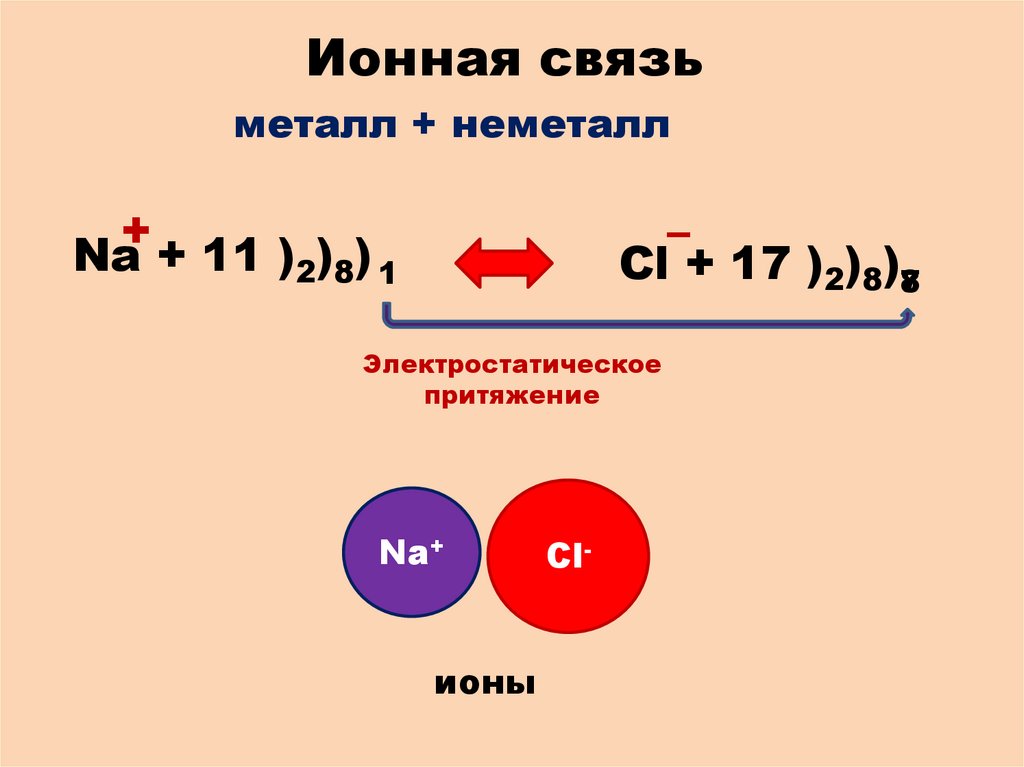
Ионная связьметалл + неметалл
+
Na + 11 )2)8) 1
–
Cl + 17 )2)8)78
Электростатическое
притяжение
Na+
ионы
Cl-
13. Алгоритм записи схемы образования ионной связи
14. Задание 1.
Самостоятельно составьте схемыобразования ионной связи для:
Na2O, K3N, AlF3.
15.
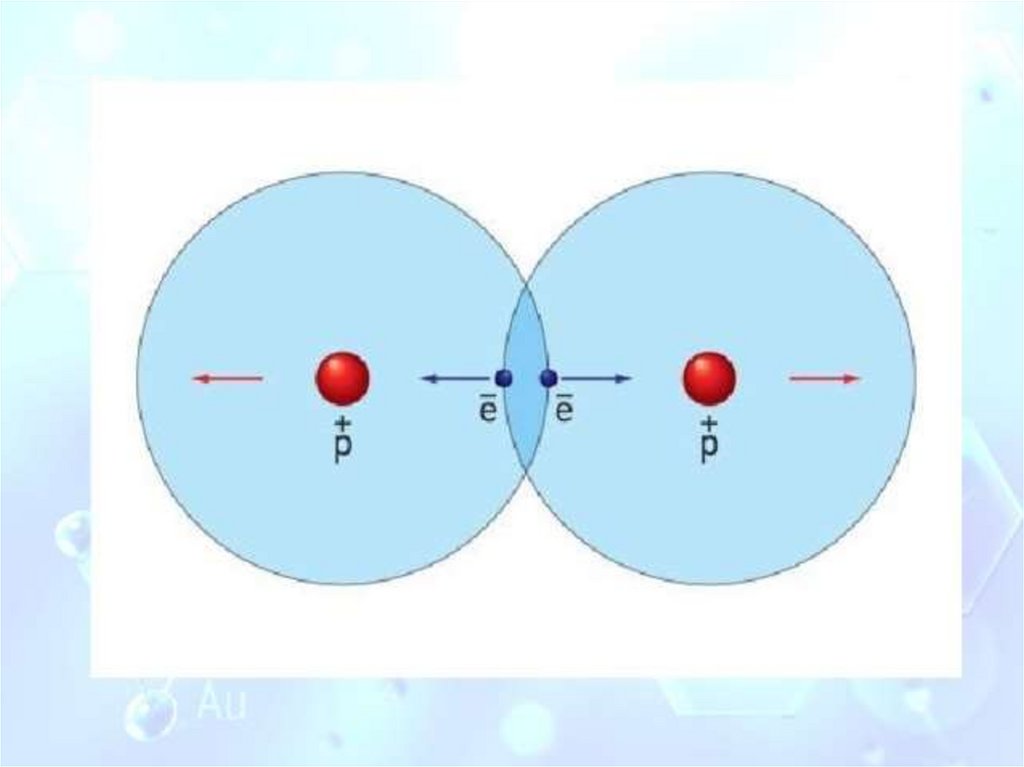
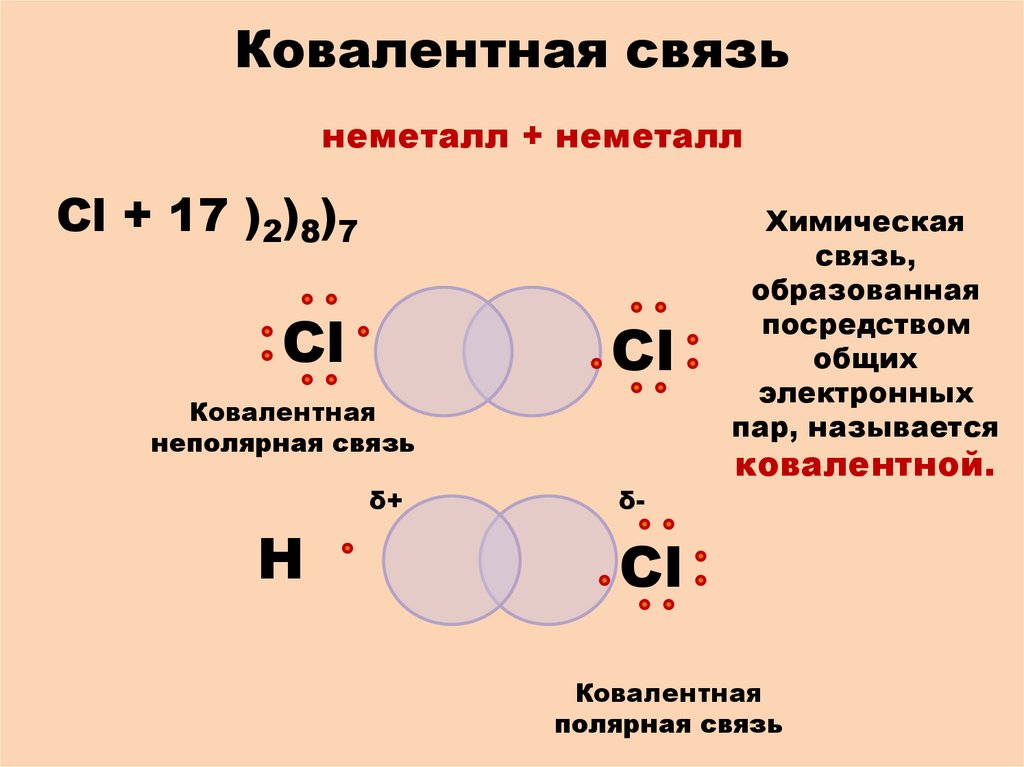
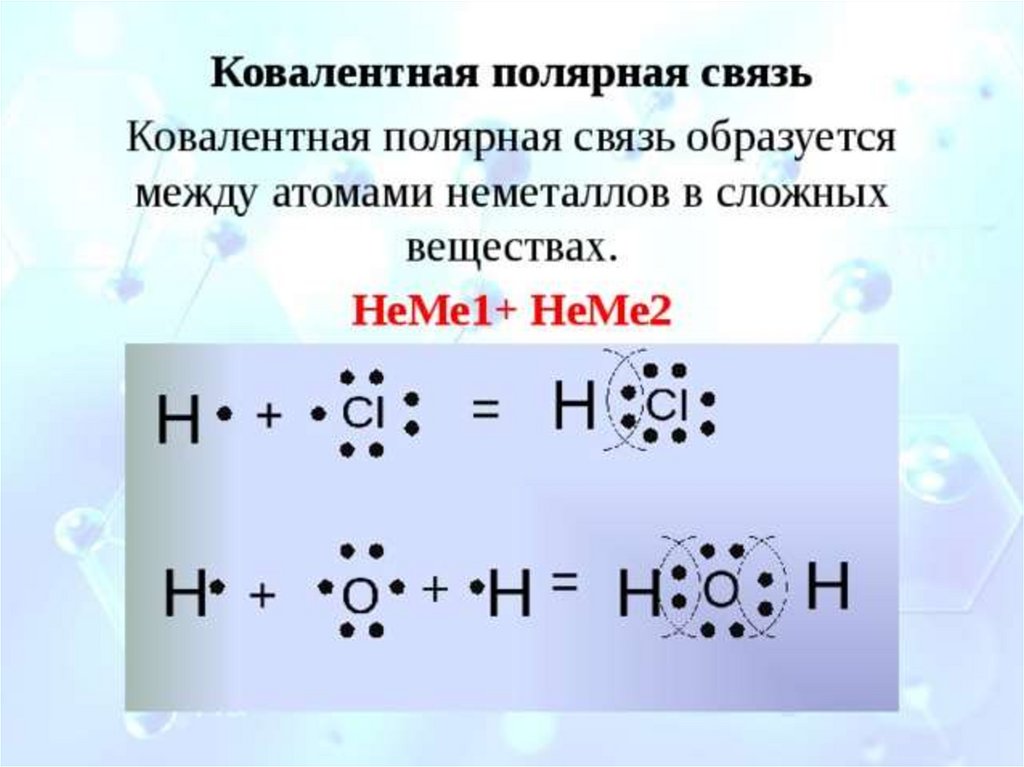
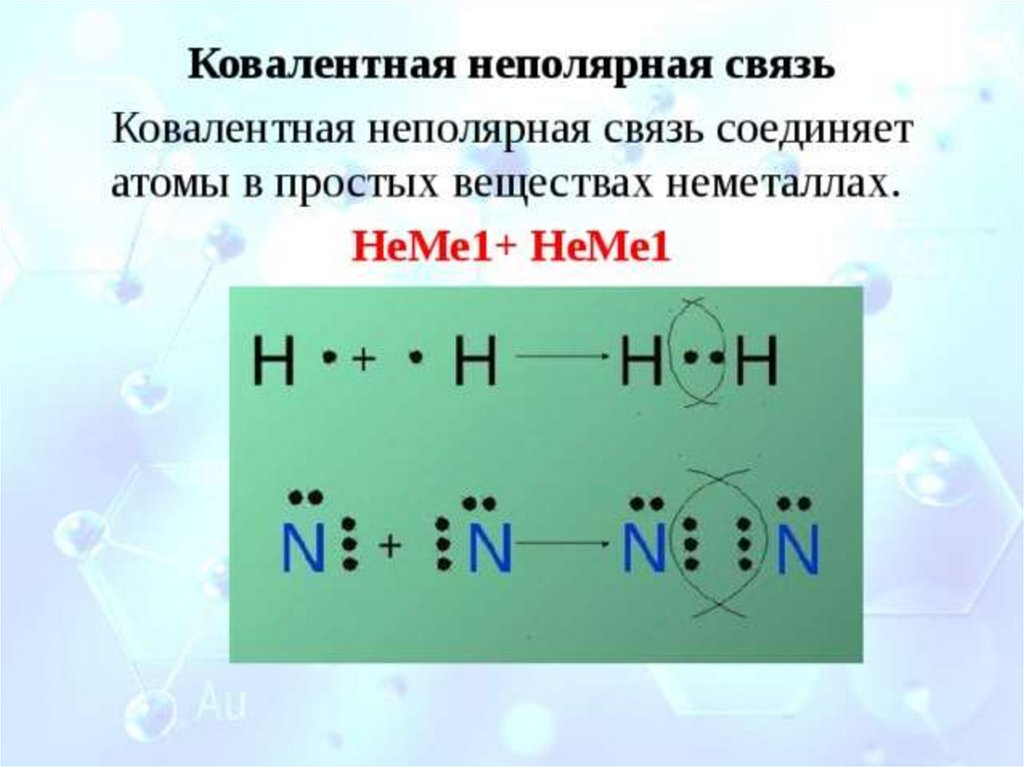
Ковалентная связьнеметалл + неметалл
Cl + 17 )2)8)7
Сl
Сl
Ковалентная
неполярная связь
δ+
Н
δ-
Химическая
связь,
образованная
посредством
общих
электронных
пар, называется
ковалентной.
Сl
Ковалентная
полярная связь
16.
17.
18.
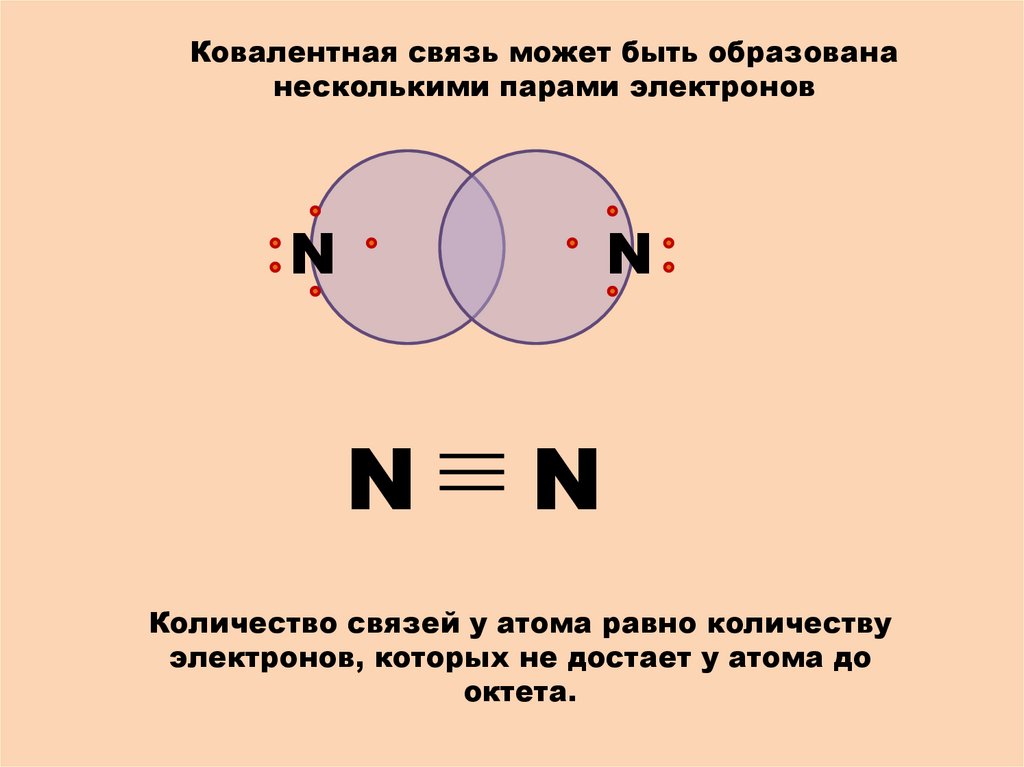
Ковалентная связь может быть образовананесколькими парами электронов
N
N
N
N
Количество связей у атома равно количеству
электронов, которых не достает у атома до
октета.
19.
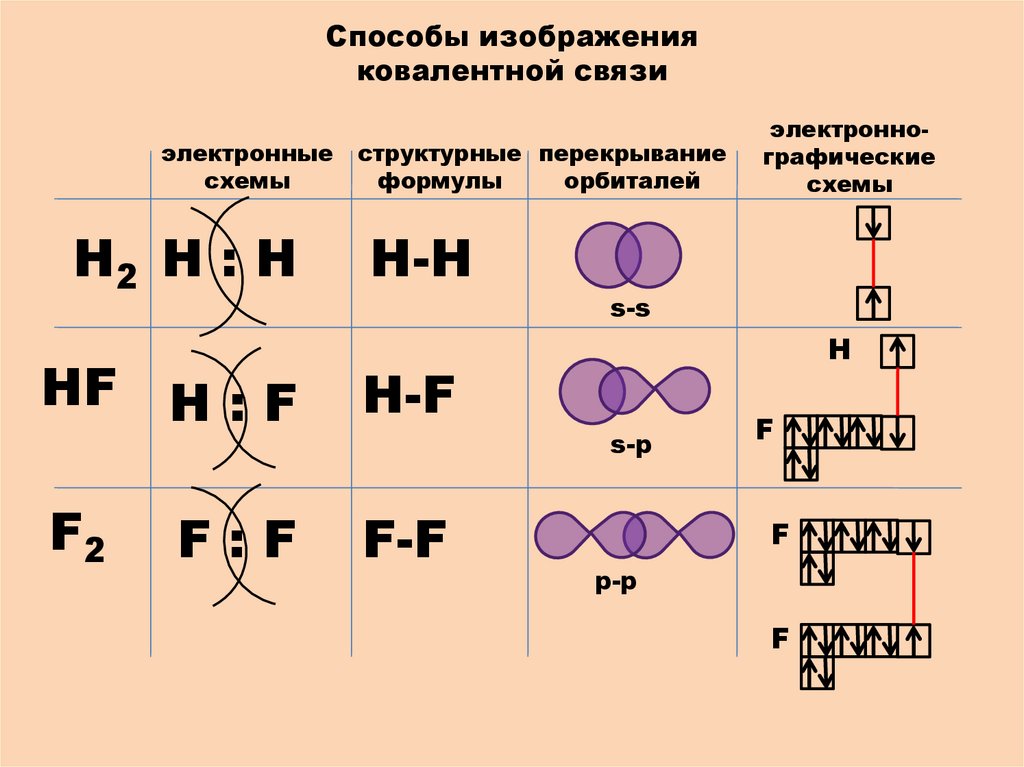
Способы изображенияковалентной связи
электронные
схемы
Н2 Н : Н
структурные перекрывание
формулы
орбиталей
Н-H
s-s
НF Н : F
Н-F
F2
F-F
F:F
электроннографические
схемы
H
s-p
F
F
p-p
F
20. Задание 2.
21.
22.
++
+
+
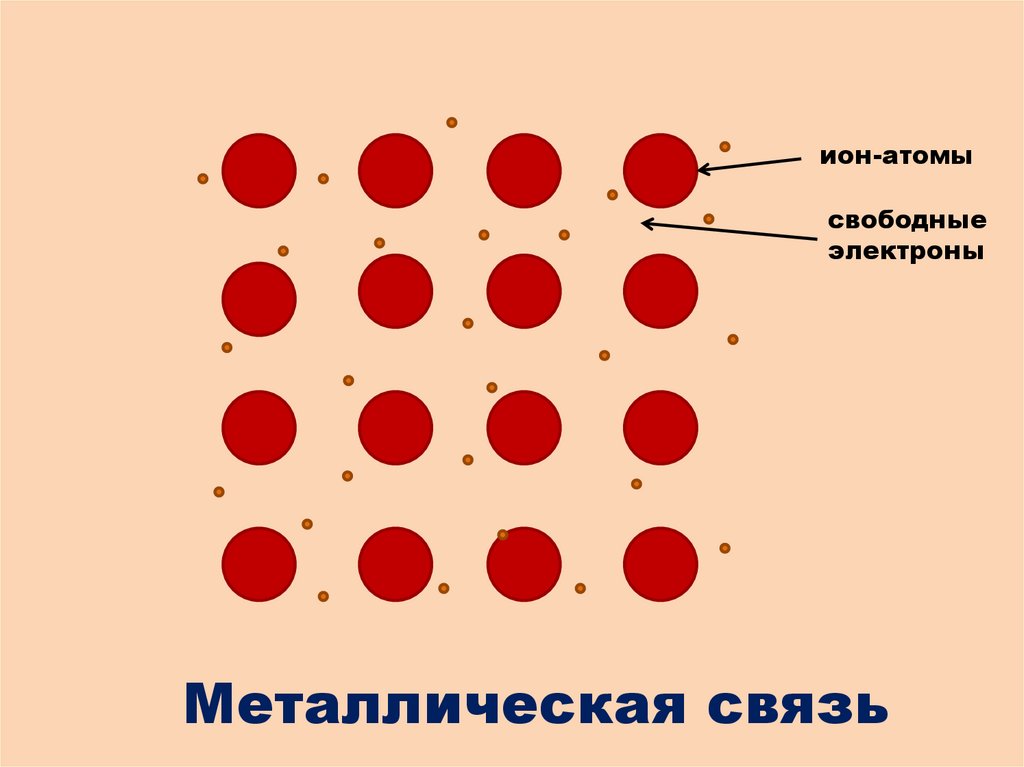
ион-атомы
свободные
электроны
+
+
+
+
+
+
+
+
+
+
+
+
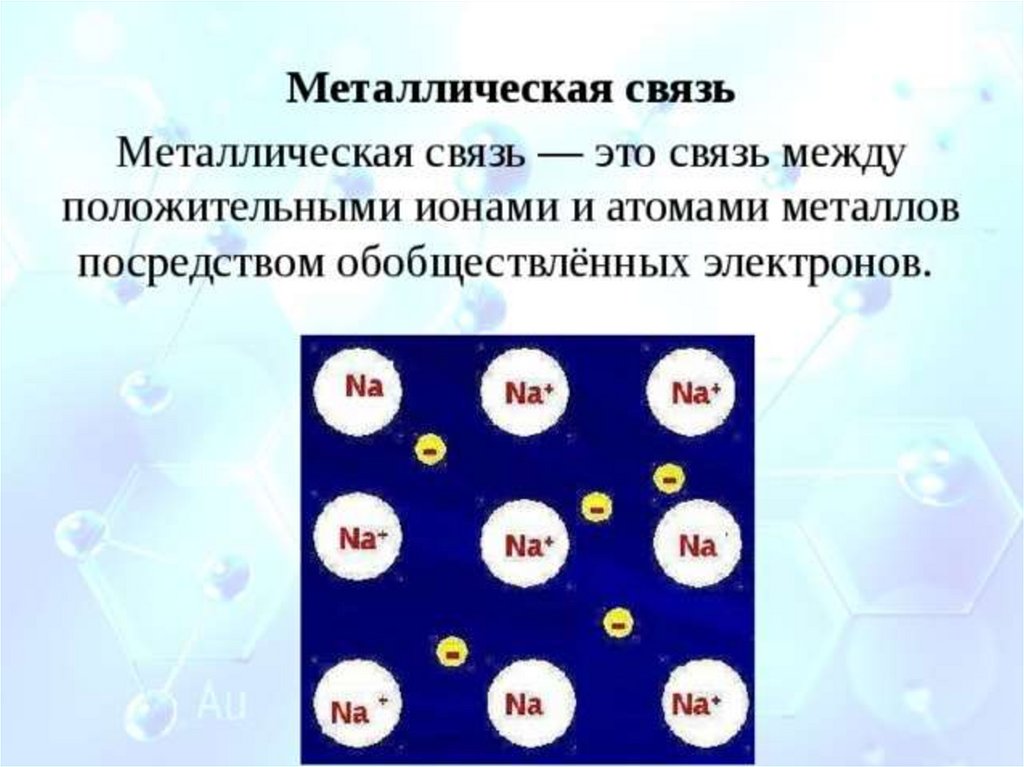
Металлическая связь
23. Процесс превращения атомов металлов в ионы и наоборот происходит непрерывно. Его можно изобразить следующей условной схемой:
24. Задание 3.
• Металлическая связь имеет черты сходствас ковалентной связью. Сравните эти
химические связи между собой.
• Металлическая связь имеет черты сходства
с ионной связью. Сравните эти химические
связи между собой.
25.
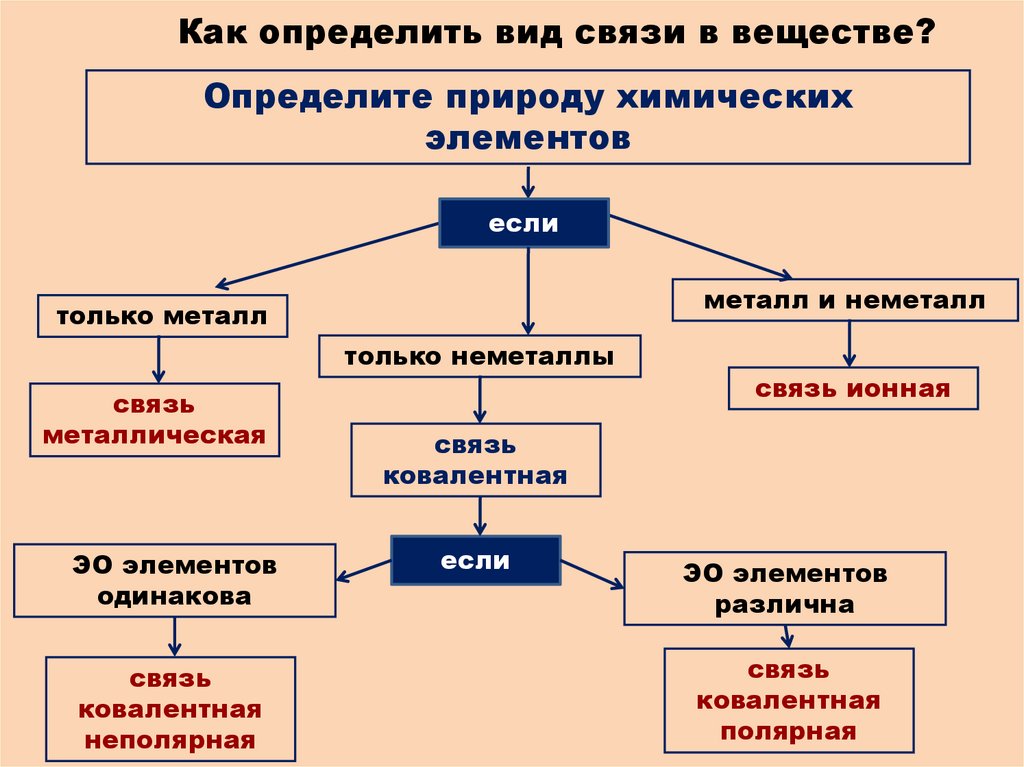
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
26.
Определите вид связи в следующихвеществах:
Н2, Na, NaF, H2S, NH3, O2, Zn,
CaS, Mg3N2, CH4, Al, F2.
27. Итоги урока:
- Что называют химической связью?- Что называют электроотрицательностью?
- Какие типы химической связи мы сегодня
изучили?
- Охарактеризуйте каждую химическую
связь.
- Как определить вид связи в веществе?
28. Рефлексия:
- Какие трудности у вас возникли во времяурока?
- Что вызвало затруднения во время
урока?
- Чему вы смогли научиться во время
урока?
29. Домашнее задание
• Параграфы 34, 35, 36, 37 прочитать;• Стр. 152 упр. 3; стр. 162 упр. 5;
• Запишите схемы образования химических
связей для веществ, состав которых
отображают формулами KCl и F2.

















 Химия
Химия








