Похожие презентации:
Химическая связь и ее виды
1. Химическая связь и ее виды
2. Химическая связь – это связь между химическими частицами (атомами, молекулами, ионами), объединяющая их в более сложные
структуры (молекулы,ионы).
3. Причины образования химической связи: Причины образования химической связи: 1. Неустойчивость атомов с незавершѐнным
Причины образованияхимической связи:
1. Неустойчивость атомов с
незавершѐнным внешним уровнем
и стремление к его заполнению.
2. Стремление к минимуму
энергии.
4. 3. В свободном атоме электроны притягиваются только к ядру собственного атома. 4. Когда два атома приближаются друг к
3. В свободном атоме электроныпритягиваются только к ядру
собственного атома.
4. Когда два атома приближаются
друг к другу, между их ядрами и
электронами начинают действовать
силы отталкивания.
Но появляются также силы притяжения
между ядром одного атома и электронами
другого.
5. 5. Силы отталкивания уравновешиваются силами притяжения и атомы удерживаются вместе. Так возникает химическая связь.
6. Способность атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях, называется
электроотрицательностью(ЭО).
7. Различают четыре типа химических связей:
1.Ионная связь.2.Ковалентная связь.
3.Металлическая связь.
4.Водородная связь.
8.
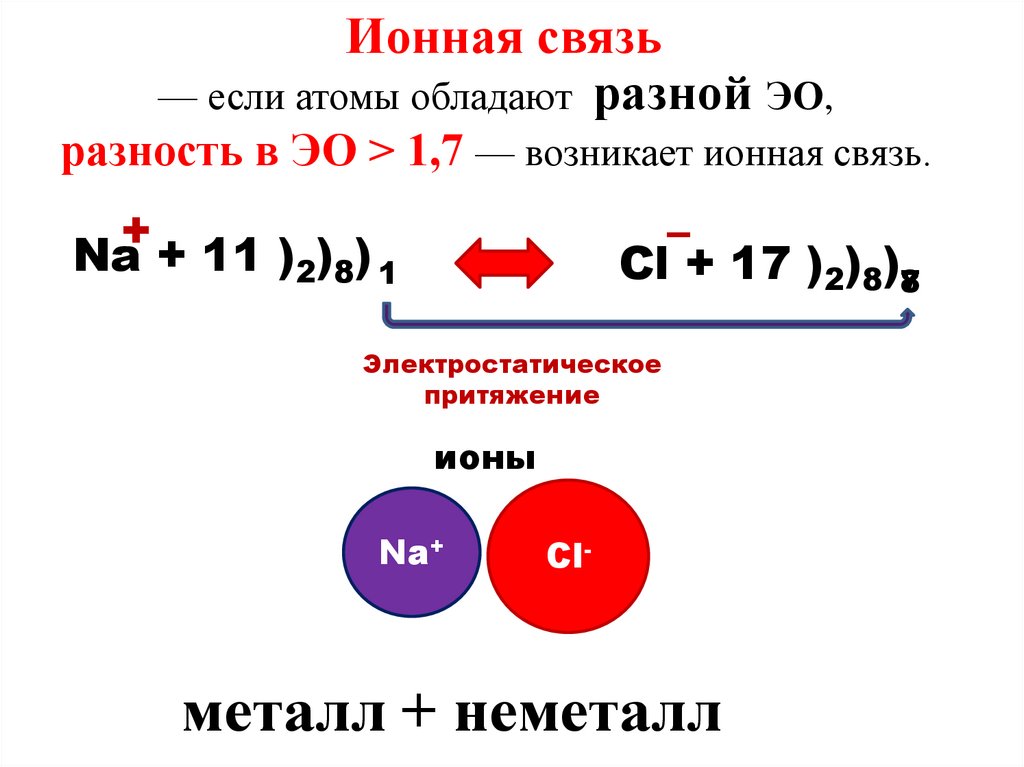
Ионная связь— если атомы обладают разной ЭО,
разность в ЭО > 1,7 — возникает ионная связь.
+
Na + 11 )2)8) 1
–
Cl + 17 )2)8)78
Электростатическое
притяжение
ионы
Na+
Cl-
металл + неметалл
9. Ионная- это связь, которая образуется между ионами металла и неметалла за счет принятия и отдачи электронов.
10.
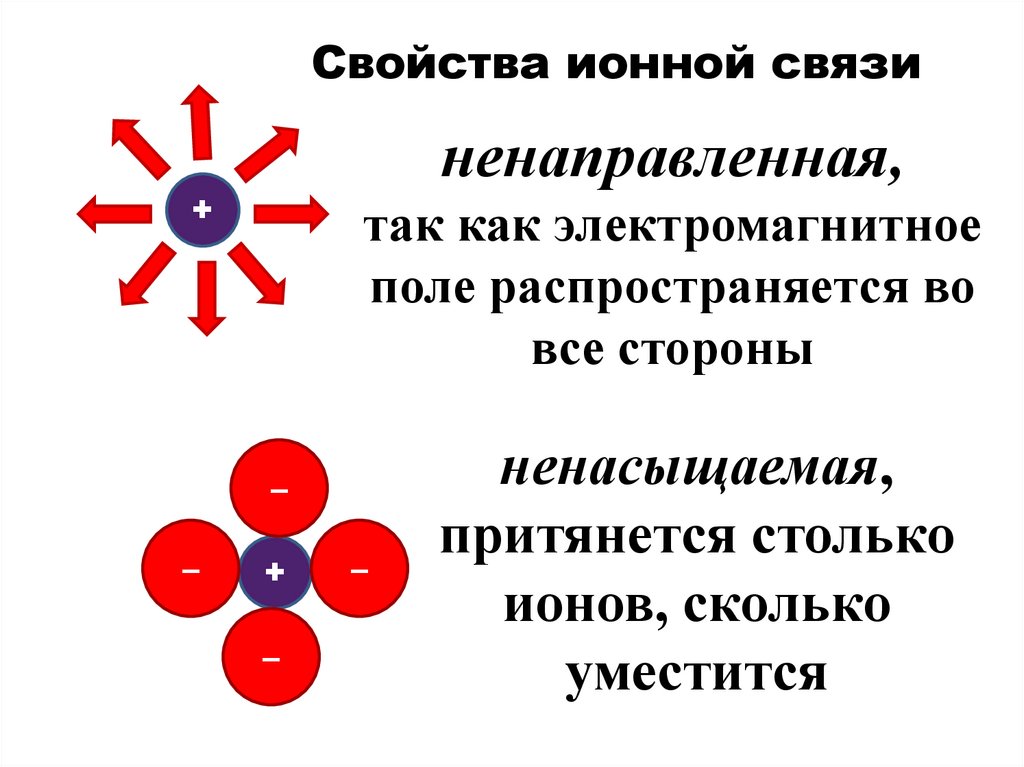
Свойства ионной связиненаправленная,
+
так как электромагнитное
поле распространяется во
все стороны
–
–
+
–
–
ненасыщаемая,
притянется столько
ионов, сколько
уместится
11.
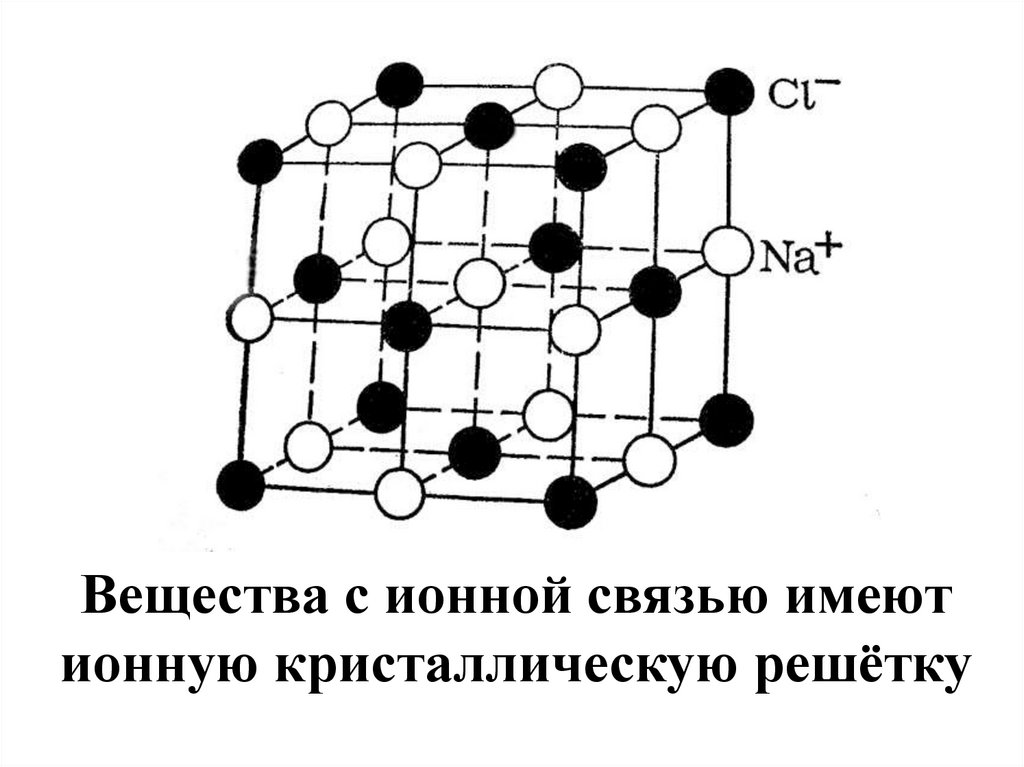
Вещества с ионной связью имеютионную кристаллическую решётку
12. Свойства веществ с ионной связью Притяжение между ионами достаточно сильное, поэтому ионные вещества имеют высокие температуры
Свойства веществ сионной связью
Притяжение между ионами достаточно
сильное, поэтому ионные вещества
имеют высокие температуры
кипения и плавления.
Все ионные соединения при
обычных условиях твѐрдые
вещества.
13.
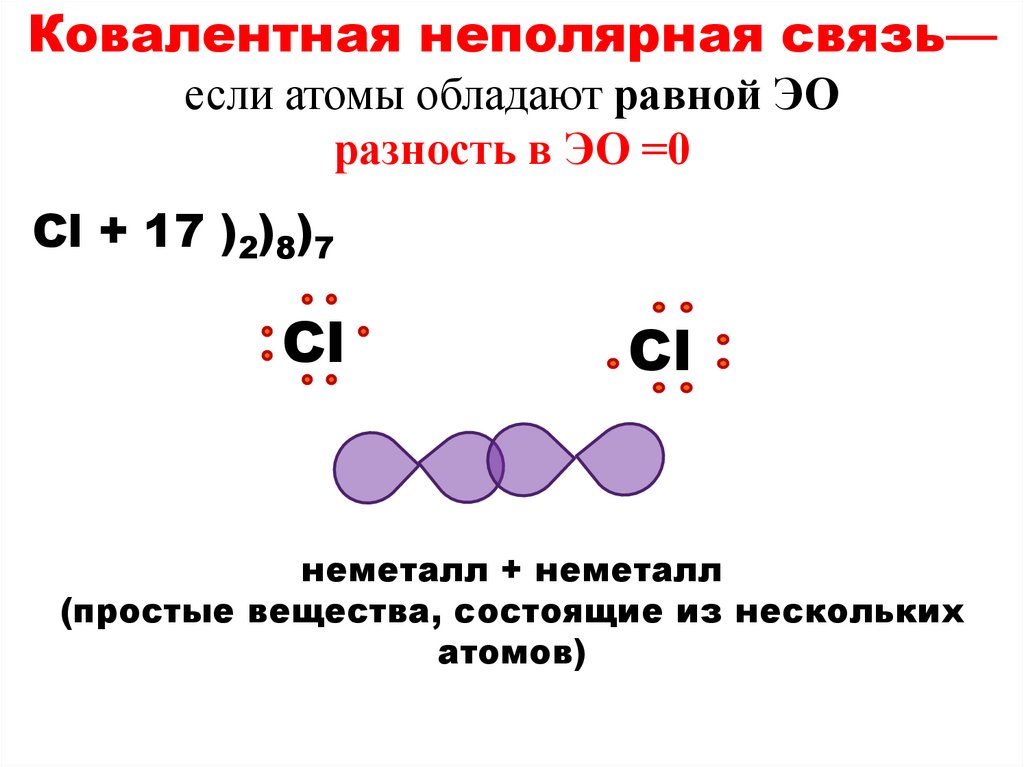
Ковалентная неполярная связь—если атомы обладают равной ЭО
разность в ЭО =0
Cl + 17 )2)8)7
Сl
Сl
неметалл + неметалл
(простые вещества, состоящие из нескольких
атомов)
14.
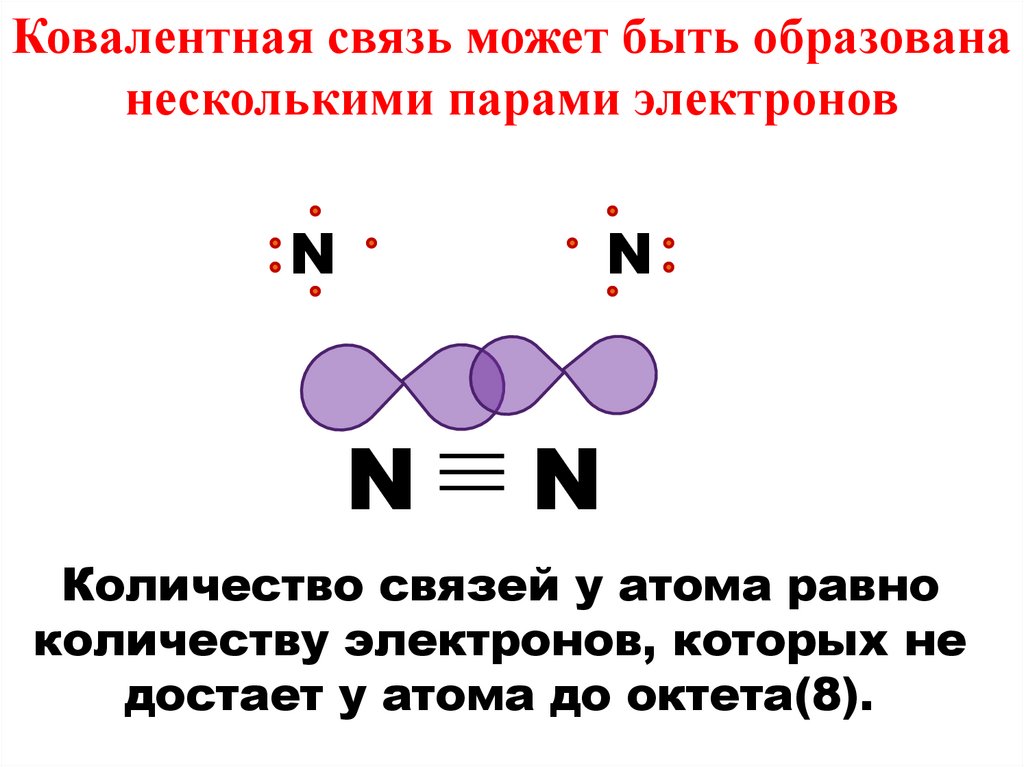
Ковалентная связь может быть образовананесколькими парами электронов
N
N
N
N
Количество связей у атома равно
количеству электронов, которых не
достает у атома до октета(8).
15. Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
16. В случае когда общая электронная пара в одинаковой степени притягивается к ядрам взаимодействующих атомов, ковалентную связь
называютнеполярной.
17.
Ковалентная полярная связь—если атомы обладают разной ЭО, но не резко
отличаются, разность в ЭО < 1,7
неметалл + неметалл
Н + 1 )1
Cl + 17 )2)8)7
δ+
Н
δ-
Сl
18. В случае когда общая электронная пара смещена в сторону одного из атомов, ковалентную связь называют полярной.
19.
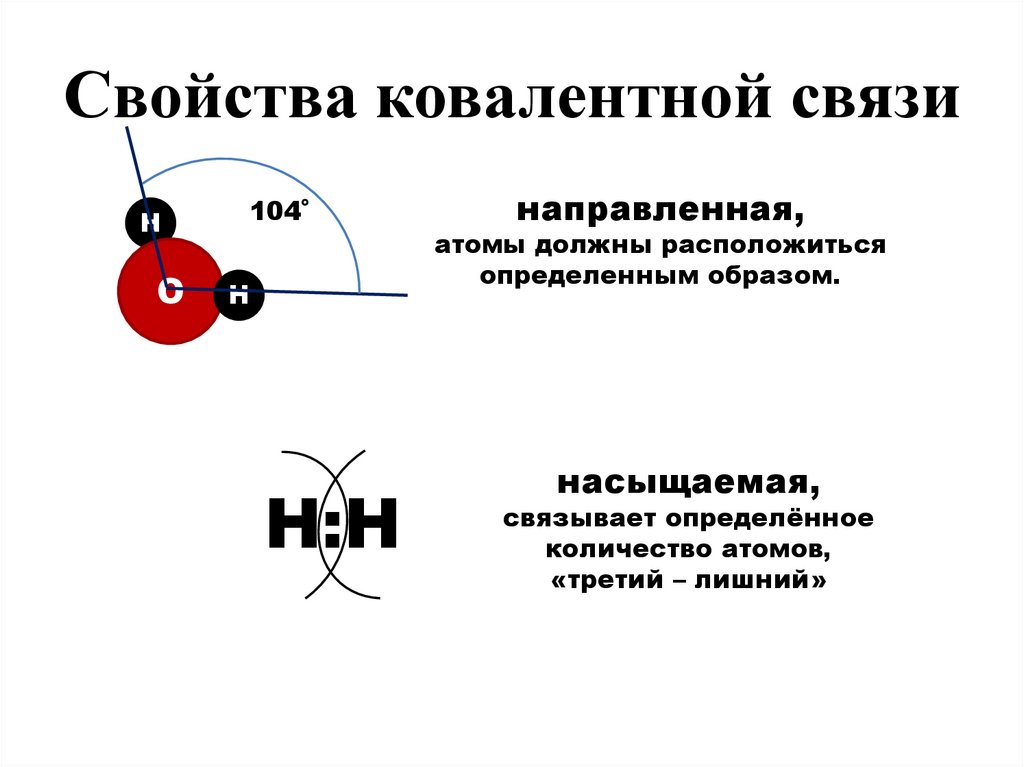
Свойства ковалентной связиН
О
104˚
Н
Н:Н
направленная,
атомы должны расположиться
определенным образом.
насыщаемая,
связывает определённое
количество атомов,
«третий – лишний»
20. МОЛЕКУЛЯРНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
Кристаллическая решеткайода
• В узлах располагаются молекулы веществ.
• Химические связи в них ковалентные, как полярные, так и
неполярные.
• Связи между молекулами веществ слабые, легко разрушаются
• Вещества с молекулярной кристаллической решеткой имеют
малую твёрдость, плавятся при низкой температуре, летучие,
при обычных условиях находятся в газообразном или жидком
состоянии. (О2, N2, СО2, Н2О)
21.
Способы изображенияковалентной связи
электронные
схемы
Н2 Н : Н
структурные перекрывание
формулы
орбиталей
Н-H
s-s
НF Н : F
Н-F
F2
F-F
F:F
электроннографические
схемы
H
s-p
F
F
p-p
F
22.
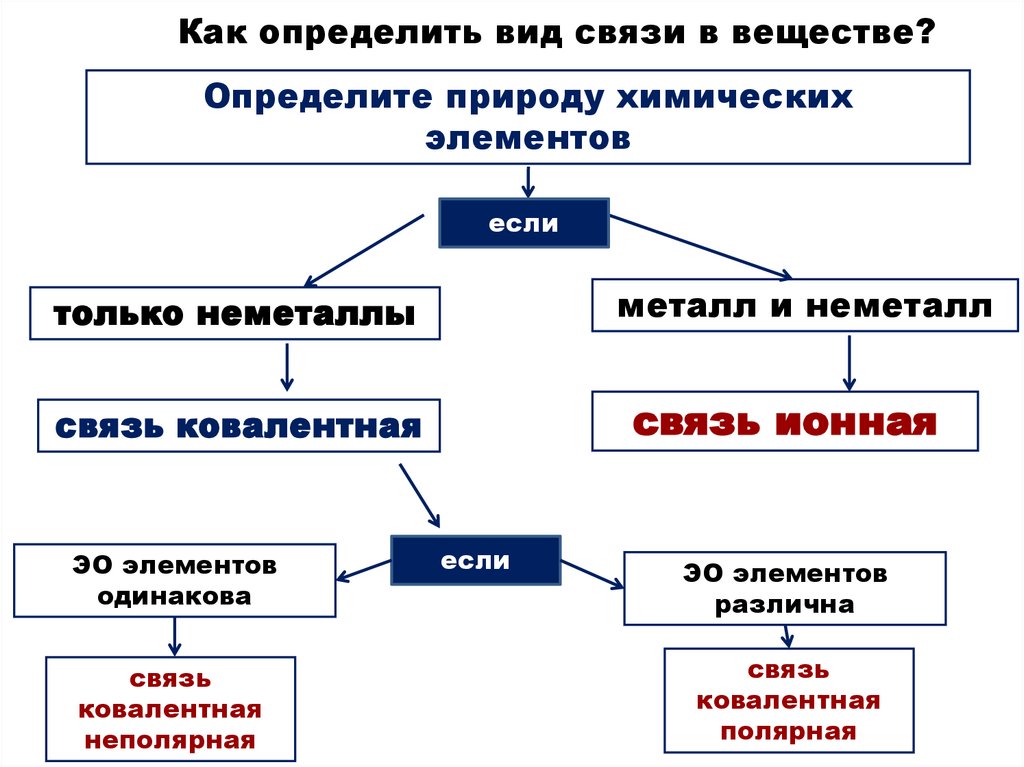
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только неметаллы
связь ионная
связь ковалентная
ЭО элементов
одинакова
связь
ковалентная
неполярная
если
ЭО элементов
различна
связь
ковалентная
полярная
23.
Определите вид связи вследующих веществах:
Н2, NaF, H2S, NH3, O2,
CaS, Mg3N2, CH4, F2.
















 Химия
Химия








