Похожие презентации:
Химическая связь и ее виды
1. Химическая связь и ее виды.
2. Химическая связь – это связь между химическими частицами (атомами, молекулами, ионами), объединяющая их в более сложные
структуры (молекулы,ионы).
3. Причины образования химической связи: Причины образования химической связи: Неустойчивость атомов с незавершѐнным
Причины образованияхимической связи:
Неустойчивость атомов с
незавершѐнным внешним уровнем
и стремление к его заполнению.
Стремление к минимуму энергии.
4. В свободном атоме электроны притягиваются только к ядру собственного атома. Когда два атома приближаются друг к другу,
В свободном атоме электроныпритягиваются только к ядру
собственного атома.
Когда два атома приближаются друг
к другу, между их ядрами и
электронами начинают действовать
силы отталкивания.
Но появляются также силы
притяжения между ядром одного
атома и электронами другого.
5. Силы отталкивания уравновешиваются силами притяжения и атомы удерживаются вместе. Так возникает химическая связь.
6. Способность атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях, называется
электроотрицательностью(ЭО).
7.
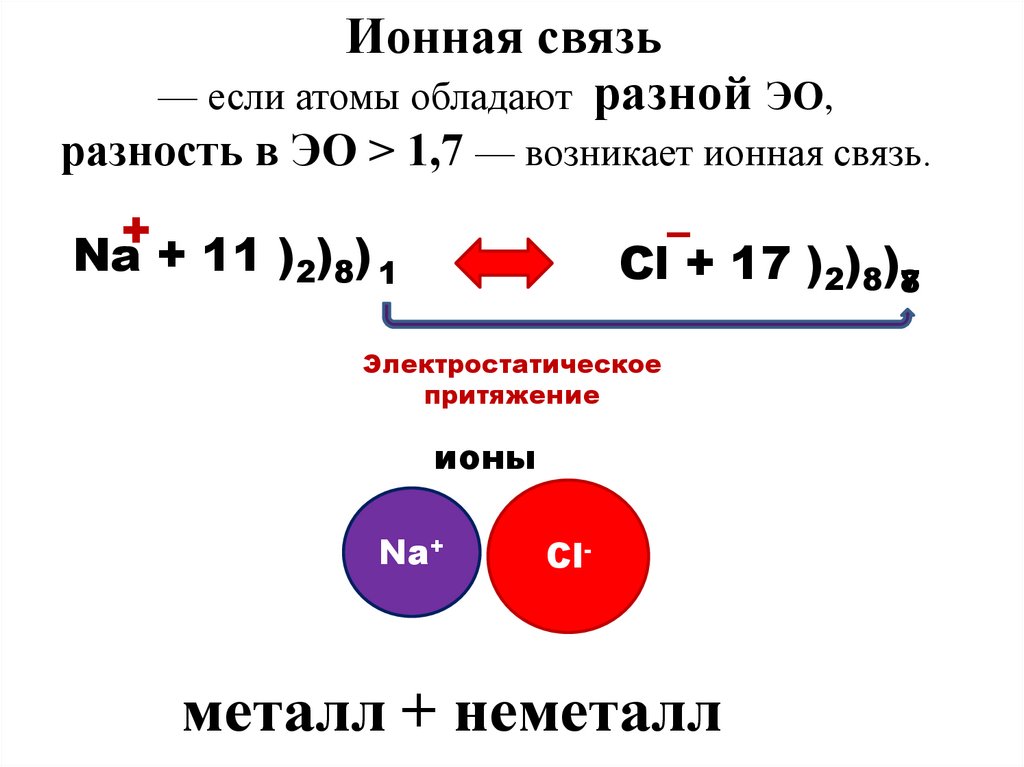
Ионная связь— если атомы обладают разной ЭО,
разность в ЭО > 1,7 — возникает ионная связь.
+
Na + 11 )2)8) 1
–
Cl + 17 )2)8)78
Электростатическое
притяжение
ионы
Na+
Cl-
металл + неметалл
8. Ионная- это связь, которая образуется между ионами металла и неметалла за счет принятия и отдачи электронов.
9.
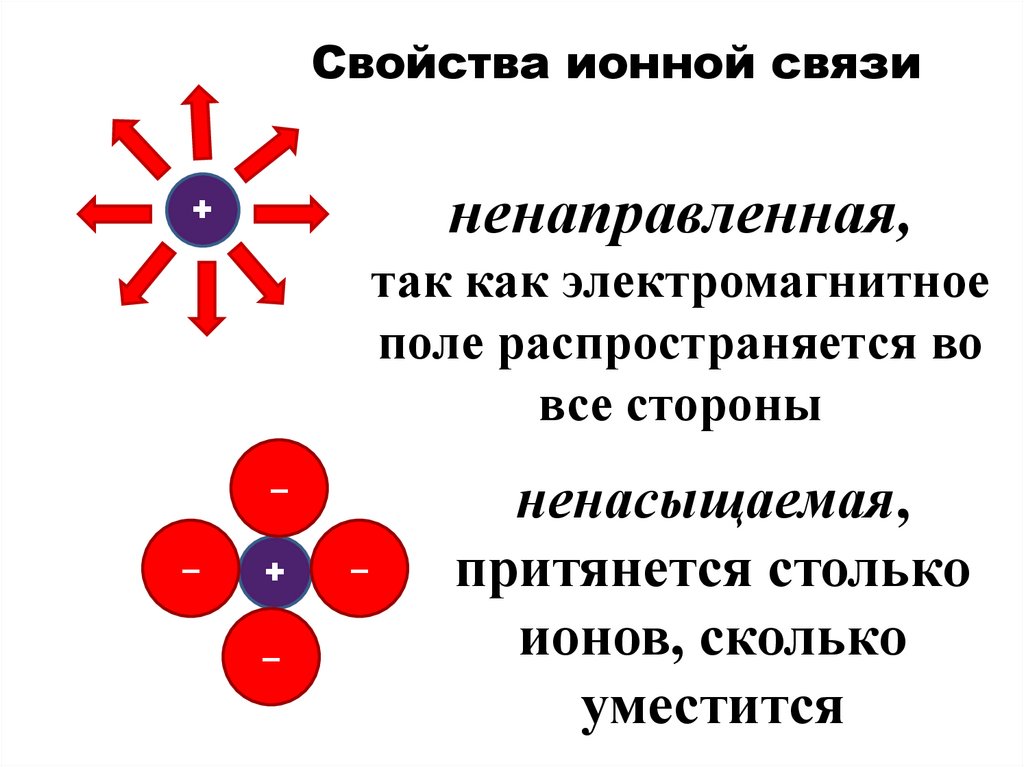
Свойства ионной связиненаправленная,
+
так как электромагнитное
поле распространяется во
все стороны
–
–
+
–
–
ненасыщаемая,
притянется столько
ионов, сколько
уместится
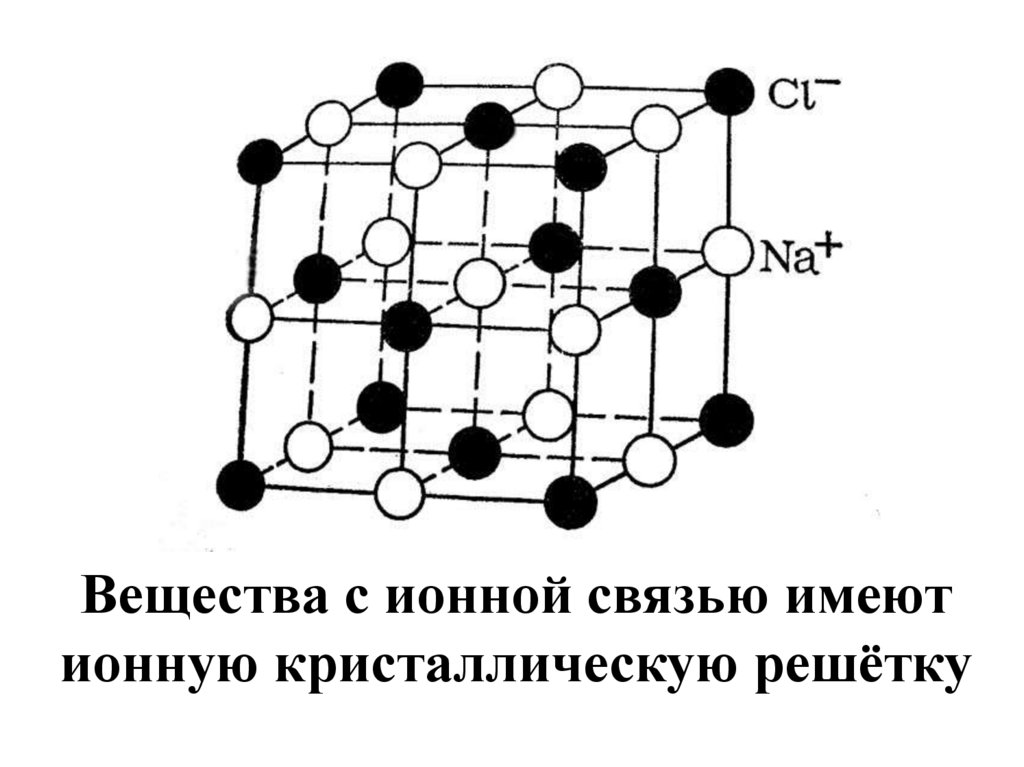
10.
Вещества с ионной связью имеютионную кристаллическую решётку
11. Свойства веществ с ионной связью Притяжение между ионами достаточно сильное, поэтому ионные вещества имеют высокие температуры
Свойства веществ сионной связью
Притяжение между ионами достаточно
сильное, поэтому ионные вещества
имеют высокие температуры
кипения и плавления.
Все ионные соединения при
обычных условиях твѐрдые
вещества.
12.
Ковалентная неполярная связь—если атомы обладают равной ЭО
разность в ЭО =0
Cl + 17 )2)8)7
Сl
Сl
неметалл + неметалл
(простые вещества, состоящие из нескольких
атомов)
13.
Ковалентная связь может быть образовананесколькими парами электронов
N
N
N
N
Количество связей у атома равно
количеству электронов, которых не
достает у атома до октета(8).
14. Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
15. В случае когда общая электронная пара в одинаковой степени притягивается к ядрам взаимодействующих атомов, ковалентную связь
называютнеполярной.
16.
Ковалентная полярная связь—если атомы обладают разной ЭО, но не резко
отличаются, разность в ЭО < 1,7
неметалл + неметалл
Н + 1 )1
Cl + 17 )2)8)7
δ+
Н
δ-
Сl
17. В случае когда общая электронная пара смещена в сторону одного из атомов, ковалентную связь называют полярной.
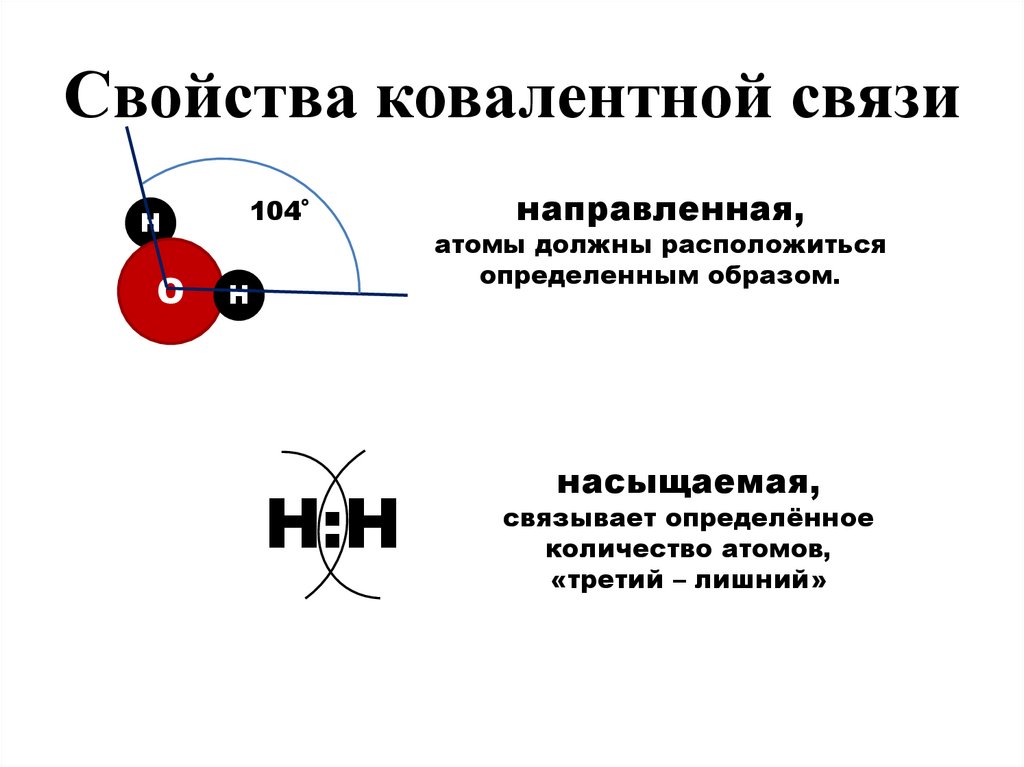
18.
Свойства ковалентной связиН
О
104˚
Н
Н:Н
направленная,
атомы должны расположиться
определенным образом.
насыщаемая,
связывает определённое
количество атомов,
«третий – лишний»
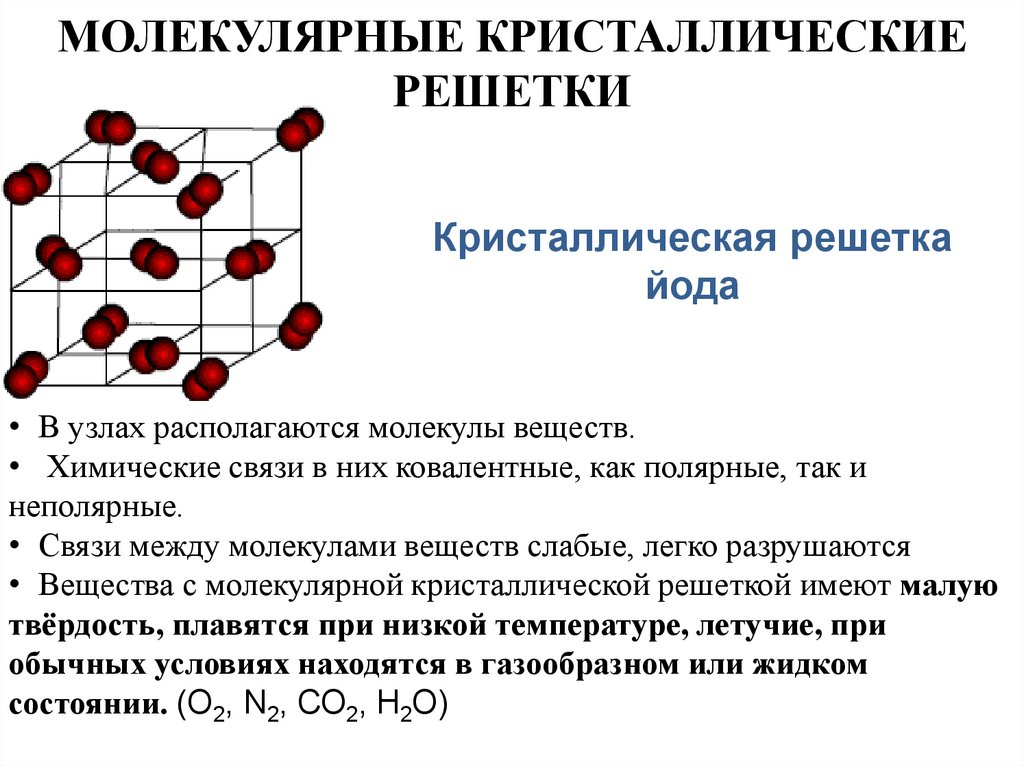
19. МОЛЕКУЛЯРНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ
Кристаллическая решеткайода
• В узлах располагаются молекулы веществ.
• Химические связи в них ковалентные, как полярные, так и
неполярные.
• Связи между молекулами веществ слабые, легко разрушаются
• Вещества с молекулярной кристаллической решеткой имеют малую
твёрдость, плавятся при низкой температуре, летучие, при
обычных условиях находятся в газообразном или жидком
состоянии. (О2, N2, СО2, Н2О)
20.
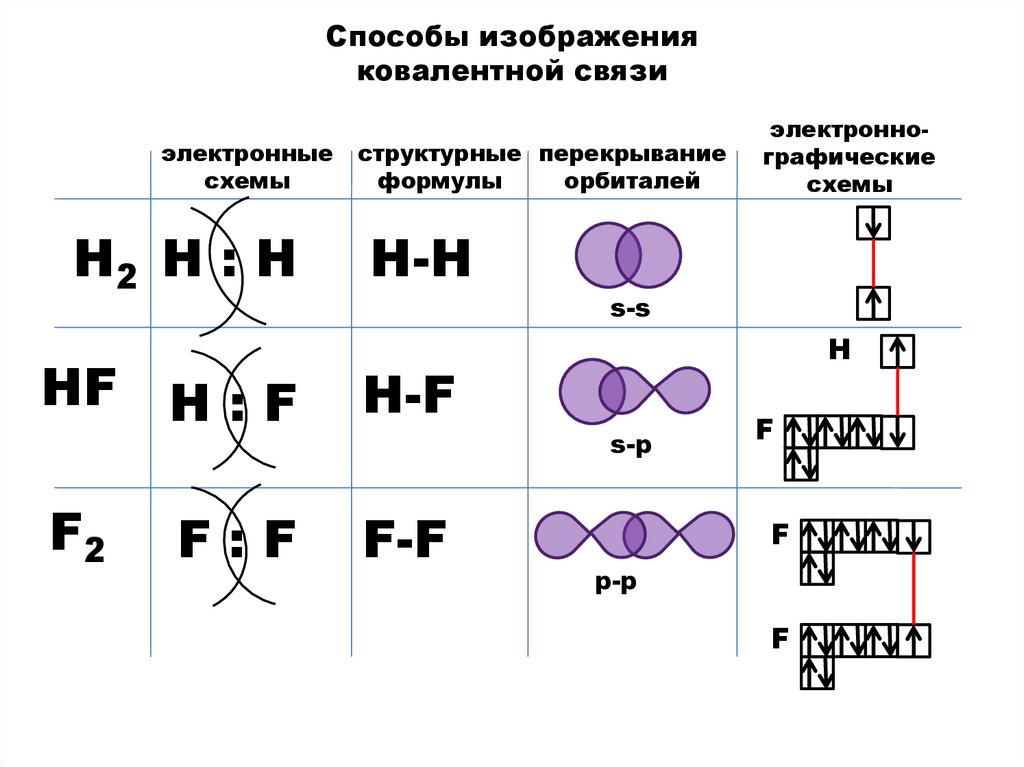
Способы изображенияковалентной связи
электронные
схемы
Н2 Н : Н
структурные перекрывание
формулы
орбиталей
Н-H
s-s
НF Н : F
Н-F
F2
F-F
F:F
электроннографические
схемы
H
s-p
F
F
p-p
F
21.
Как определить вид связи в веществе?Определите природу химических
элементов
если
только неметаллы
металл и неметалл
связь ковалентная
связь ионная
ЭО элементов
одинакова
связь
ковалентная
неполярная
если
ЭО элементов
различна
связь
ковалентная
полярная
22.
Определите вид связи вследующих веществах:
Н2, NaF, H2S, NH3, O2,
CaS, Mg3N2, CH4, F2.
















 Химия
Химия








