Похожие презентации:
Иммунитет и специфическая профилактика бешенства
1.
Иммунитет и специфическаяпрофилактика возникновения
бешенства
Кандидат ветеринарных наук
Воронцова Анастасия Андреевна
2.
Начиная с 28 сентября 2007г. по инициативе Всемирной организацииздравоохранения (ВОЗ) мировая общественность отмечает Всемирный день
борьбы с бешенством, основной задачей которого является привлечение
внимание к данной проблеме распространения этой болезни, а также к ее
последствиям.
Ежегодно от этого заболевания во всём мире погибают около 55 тыс. человек, причём
90% смертельных случаев регистрируется в Юго-Восточной Азии и Африке. Количество эпизодов
инфекции в различных регионах определяется комплексом социальных, политических и
экономических факторов
Из-за абсолютной летальности бешенства вопросы постэкспозиционной
профилактики заболевания имеют исключительно важное значение.
Единственным способом предотвратить заболевание людей бешенством
является своевременное введение пациенту антирабических препаратов —
вакцины и антирабического иммуноглобулина при укусах опасной локализации,
что является единой мировой тактикой. По данным ВОЗ, до 20 млн человек в
мире ежегодно получают антирабическое лечение, что позволяет предотвращать
сотни тысяч случаев смерти от бешенства. В Российской Федерации ежегодно в
связи с укусами и контактами с больными или подозрительными на бешенство
животными за антирабической помощью обращаются до 450 тыс. человек .
3.
различают несколько диких и один культивированный штаммы вирусабешенства.
Первые циркулируют в природе, имеют длительный инкубационный период,
чаще образуют специфические тельца, локализуются в нервных клетках,
слюнных железах и роговице глаза.
К ним относят:
вирус классического бешенства — RABV;
вирус рукокрылых Лагос — LBV;
вирус Дювенхейдж — DUVV;
лиссавирусы европейских рукокрылых EBLV-1 и EBLV-2;
лиссавирус австралийских рукокрылых — ABLV;
вирус Мокола — MOKV.
Культивированный (фиксированный) вирус впервые выделил Луи Пастер в 1885 году
путем длительного заражения лабораторных кроликов дикой формой вируса,
которая мутировала и приобрела определенные, выгодные для нас, качества.
Например, она опасна только для лабораторных животных, на которых ее
выводили, имеет очень короткий инкубационный период, не образует
специфических телец и поражает только ЦНС. Организм человека она не убивает, но
заставляет иммунную систему вырабатывать антитела, которые могут защитить и от
других, более опасных, штаммов вируса бешенства. Стоит ли говорить, что люди с
радостью стали использовать взвесь мозга больных животных в качестве вакцины и
успешно практиковали такой метод до сравнительно недавнего времени
4.
Персистенция вируса.За последние годы описаны казуистические случаи неоднократного
выделения вируса бешенства из слюны здоровых собак на протяжении почти
двух лет после их инфицирования. Аналогичная картина наблюдалась и у
некоторых экспериментально заражѐнных кошек. В 1981 г. Представлены
результаты четырѐхлетнего изучения бешенства мангустов, выловленных в
ряде районов Гренады. С помощью ИФ вирус бешенства обнаружен в срезах
мозга 100 (2,1%) из 4754 обследованных мангустов. Среди 1675 обследованных
животных обнаружены вируснейтрализующие антитела в пробах 498
сывороток (30%).
Вируснейтрализующие антитела в пробах 498 сывороток (30%). При
сопоставлении результатов обнаружения бешенства и соответствующих
антител установлено, что число больных животных в течение 1971-1974 гг.
ежегодно снижалось (с 3,5 до 0,6%), количество мангустов с
определяемыми антителами увеличилось с 20,8 до 43,2%. Антитела к
бешенству, как отмечено, в опытах с отловленными в природе мангустами (20
особей), циркулировали в крови ещѐ 35 месяцев. У животных с наиболее
высокими титрами антител (1:1400) отмечена и наибольшая скорость их
снижения.
5.
В РФ для специфической профилактики бешенства разработаны,зарегистрированы и применяются ряд культуральных инактивированных
антирабических вакцин медицинского и ветеринарного назначения. Эти
вакцинные препараты показали высокую эффективность в профилактике
инфекции у домашних и сельскохозяйственных животных. В то же время
основным резервуаром вируса бешенства (Mononegavirales: Rhabdoviridae:
Lyssavirus) (ВБ) являются дикие плотоядные (Mammalia: Carnivora). С целью их
оральной иммунизации используют живые вирусные вакцины из
аттенуированных (фиксированных) штаммов ВБ, малоустойчивых во внешней
среде.
В странах Западной Европы и Северной Америки имеется успешный опыт
применения
рекомбинантных
антирабических
вакцинных
препаратов,
содержащих в составе вирусный ген гликопротеина (G-белка). Подобные вакцины
безопасны для человека и животных.
В России разработана также векторная антирабическая вакцина на основе
аденовируса (Adenoviridae), которая может быть использована для борьбы с
данной инфекцией.
6.
История антирабических вакцин3 периода:
1. Со времен изготовления Пастером в 1885г первой вакцины до 1948 г., когда
вакцины готовили из мозга взрослых животных (кролики, овцы, козы),
инфицированных фиксированным вирусом бешенства. Это вакцины типов
Ферми (1908), Семпл (1911), Умедо, Дои (1916), в которых вирус бешенства
частично инактивирован фенолом, и вакцины типов Хемпт (1925) и Келсер
(1925),
инактивированные
эфиром+фенол
и
эфиром+хлороформ
соответственно
2. с 1949 г. по 1955 г., когда готовили живые аттенуированные вакцины (после
того, как шт. Флюри вируса бешенства был адаптирован Копровским и Коксом
к куриным эмбрионам);
3. с 1956 г. живые или инактивированные вакцины готовят из штаммов вируса
бешенства, адаптированных к культуре клеток
7.
Эталонная антирабическая вакцинадолжна быть :
1.безопасна и высокоэффективна для животных, т. е. неэнцефалогенна,
2.содержать минимальное количество балластных белков, индуцировать в
короткий срок напряженный и длительный иммунитет при малых дозировках и
ограниченном количестве инъекций,
3.обладать защитной способностью при введении животным, уже
инфицированным вирусом бешенства,
4 быть простой в изготовлении и стабильной при длительном хранении,
5. быть пригодной к применению в составе ассоциированных вакцин.
Хотя в настоящее время нет антирабической вакцины с такими качествами,
достижения современной техники и вирусологии делают еѐ получение вполне
реальным.
Требования безвредности и иммунологический эффективности должны
соблюдаться при конструировании любой антирабической вакцины
8.
Антирабические вакциныприменяемые для людей в РФ
В нашей стране для вакцинации людей зарегистрированы и
применяются
культуральные
концентрированные
инактивированные
очищенные вакцины как отечественного (из штамма «Внуково-32»), так и
зарубежного (из штамма Flury LEP, Sovereign Pharma Pvt. Ltd., Индия)
производства.
• Клиническая практика показывает их высокую эффективность в ходе
профилактической и постэкспозиционной вакцинации против
бешенства
• При этом для проведения последней необходимо до 6 инъекций
препарата, что не всегда удобно и нередко ведёт к отказам пациентов
от антирабической помощи в полном объёме.
Перспективное направление
Разработка антирабических вакцин нового поколения, способных
создавать полноценный иммунитет к заболеванию при однократной
иммунизации
9.
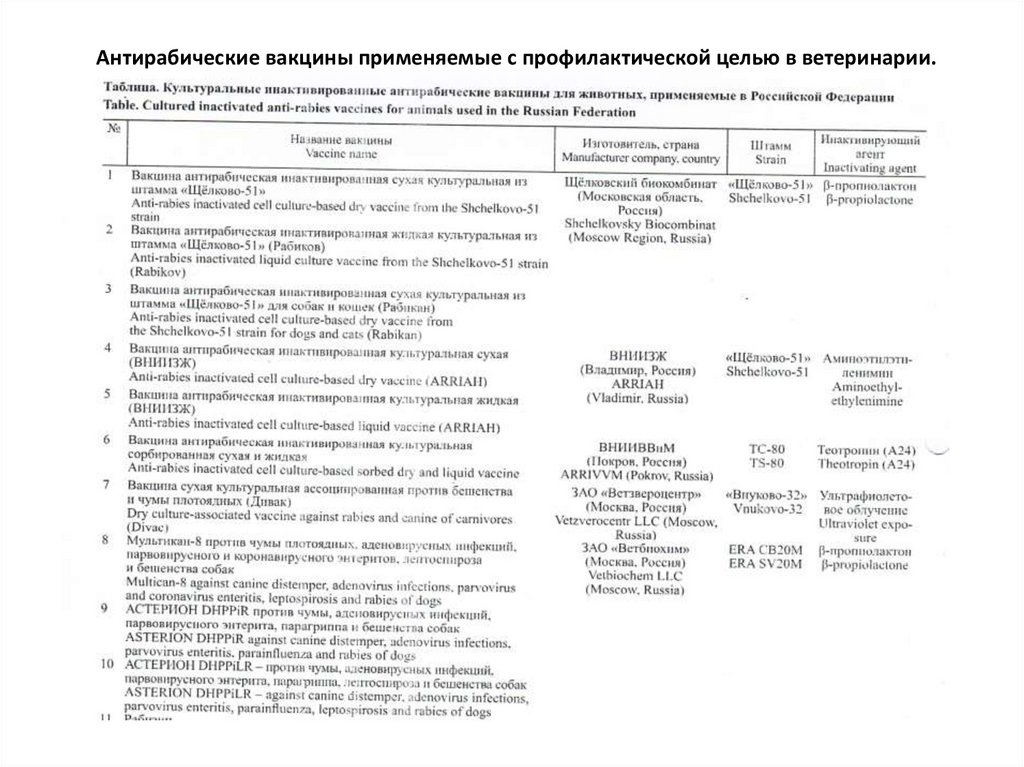
Антирабические вакцины применяемые с профилактической целью в ветеринарии.10.
Антирабические вакцины применяемые с профилактической целью в ветеринарии.11.
• Можно видеть, что инактивированные антирабические вакцины разныхпроизводителей отличаются значительным разнообразием используемых штаммов
ВБ.
• Кроме того, имеются различия по способам инактивации вируса и применяемым
адъювантам (чаще всего используют гидроксид алюминия (Al(OH)3 ).
• Наряду с антирабическими моновакцинами существуют поликомпонентные
препараты, содержащие помимо субстрата ВБ антигены к другим инфекционным
возбудителям в зависимости от вида животных, для которых они предназначены
чума плотоядных, парвовирусный
и коронавирусный энтериты,
аденовирусные инфекции и др
герпесвирусная
инфекция, панлейкопения
и др.
Все инактивированные антирабические вакцины подвергаются проверке на
стерильность, безвредность, полноту инактивации вируса, иммуногенность и другие
показатели. Лишь при соответствии перечисленным критериям, включая полное
отсутствие живого ВБ и значение иммуногенности ≥1,0 МЕ, препараты допускаются к
использованию в медицинской и ветеринарной практике
Инактивированные антирабические вакцины наиболее безвредны, поскольку не
содержат живого инфекционного агента, и вводятся парентерально.
12.
Оральная иммунизация дикихплотоядных
Используют живые вакцины из аттенуированных (фиксированных) (РВ-97, ТС-80)
либо генетически модифицированных штаммов (ERA G333) ВБ
Большим недостатком живых антирабических вакцин является их
нестабильность в естественных условиях, так как вирус очень быстро теряет
активность при положительных температурах
существует опасность реверсии вируса к патогенному состоянию при
длительном применении, так как большинство штаммов небезопасны для
нецелевых животных, в особенности грызунов (Mammalia: Rodentia).
Наряду с этим оральная иммунизация диких плотоядных во многих странах
достаточно часто проводится посредством рекомбинантных вакцин на основе
различных вирусов (векторов), имеющих в структуре ген гликопротеина (Gбелка) ВБ.
13.
Испытание живых оральных и энтеральных антирабических вакцин показаловысокую эффективность и безопасность ряда аттенуированных штаммов. Даже
после 20 интрацеребральных пассажей на собаках риверсий вирулентных свойств
не отмечено. Безвредность шт. Flury-Hep/ВНК-21 подтверждена в опытах на 207
диких животных 15 видов, обитающих в Европе. Живая вакцина из шт. SAD/BHK21 (7,3 lg ТЦД50/мл) оказалась безвредной при введении собакам, кошкам и
лисицам.
Проводились исследования по влиянию оральной иммунизации против
бешенства на динамику популяции лисиц (ФРГ). В связи с введением оральной
иммунизации лисиц во многих регионах Германии значительно уменьшилось
распространение бешенства. На регулирование популяции лисиц влияют не
только борьба с бешенством, но и многие другие факторы, в 54 частности,
условия места обитания, кормовые ресурсы, степень воспроизводства, сезоны
года, смертность от естественных врагов и болезней, охотничье-промысловое
использование и др. При определении плотности популяции обращается
внимание на точность применения методов. Рассматриваются преимущества и
недостатки методов составления кадастра численности лисиц и анализа
статистических данных охотничьего промысла. На основании исследований
последних лет со всей настойчивостью делается вывод о необходимости
продолжения оральной иммунизации лисиц. Бешенство как зооноз представляет
большой риск для здоровья людей и не может быть регулятором популяции
лисиц.
14.
Генно-инженерные вакцины.Ещѐ в 1982 г. французские исследователи выделили клон,
образующий вирусный белок – поверхностный гликопротеин
вируса бешенства. Испытывается вакцина, разработанная
Wister Just совместно с Rhone-Merieux. Она содержит
рекомбинантный вирус коровьей оспы, несущий ген основного
гликопротеина оболочки вируса бешенства. Помимо
вышеуказанных вакцин, 58 с 1989 г. в Бельгии успешно
применяют
рекомбинантную
вакцину
WTGgRAB
(шт.
187XP26D3) для пероральной вакцинации лисиц. Вертолетами
разбрасывали
приманки,
содержащие
108
ТЦД50
рекомбинантного
вируса.
Показателем
поглощения
вируссодержащей
приманки
(биомаркером)
являлся
тетрациклин.
Разработана
также
рекомбинантная
антирабическая вакцина с использованием в качестве вектора
оспы канареек. Препарат обладал таким же защитным
действием, что и рекомбинантная антирабическая вакцина на
основе вируса оспы, и применяется в ветеринарной практике.
15.
Поствакцинальные осложнения.Данный вопрос получил широкое освещение в
работах по бешенству. Значительно большую
частоту осложнений при введении вакцины
типа Ферми объясняют наличием в препарате
не только мозговой ткани, но и незначительного
количества живого фиксированного вируса.
Требования по профилактике и ликвидации
бешенства среди животных отражены в СанПин
«Профилактике и борьбе с заразными
болезнями, общими для человека и животных»,
утверждѐнные Департаментом ветеринарии от
18 июня 1996 г.
16.
Подходы и направления вразработке антирабических вакцин
В 80-х – 90-х гг. прошлого столетия в странах Европы и Северной Америки
широко применялась хорошо зарекомендовавшая себя рекомбинантная оральная
вакцина, полученная на основе вируса осповакцины со встроенной в геном
последовательностью гена гликопротеина ВБ (vaccinia-rabies glycoprotein
recombinant virus, VR-G). Вакцина обеспечивала эффективную защиту от бешенства
лисиц и енотовидных собак при заражении вирулентным штаммом
Безопасность ее была поставлена под сомнение после сообщения о
заболевании в Соединённых Штатах Америки (США) молодой женщины, которая
отобрала приманку с вакциной у своей собаки
В дополнение к этому появились данные о недостаточной
эффективности данного вакцинного препарата у собак
Указанные обстоятельства послужили определённым стимулом к созданию
новых рекомбинантных антирабических вакцин
17.
Подходы и направления вразработке антирабических вакцин
На основе штамма D1701-V вируса контагиозного пустулёзного дерматита
(эктимы) овец и коз (Poxviridae: Paropoxvirus: Camel contagious ecthyma virus)
разработана рекомбинантная вакцина, содержащая химически синтезированную
ДНК-копию гена гликопротеина ВБ (штамм PV-11) и получившая название D1701V-RabG.
Вакцинный препарат полностью защищал белых мышей (Mus musculus) от
последующего заражения вирулентным штаммом CVS-11 в дозе 3000 ЛД50
(ЛД50 – полулетальная доза, средняя доза вещества в мг на 1 кг живой массы,
вызывающая гибель 50% подопытных животных). Иммунизация кошек и собак
показала 100% сероконверсию; у всех привитых животных обнаружены титры АТ
≥0,5 МЕ/мл
18.
Подходы и направления вразработке антирабических вакцин
В ряде стран разработан целый ряд векторных
антирабических вакцин на основе различных вирусов:
вируса болезни Ньюкасла (сем. Paramyxoviridae), вируса
Синдбис
(сем.
Togaviridae),
герпесвируса
(сем.
Herpesviridae),
бакуловируса
(сем.
Baculoviridae),
каприпоксвирусов (сем. Poxviridae), вируса парагриппа 5
типа (сем. Paramyxoviridae) . Одним из перспективных
вирусных векторов при создании антирабических вакцин
может быть аденовирус (Adenoviridae). Показано, что
аденовирусный вектор, содержащий ген гликопротеина ВБ,
способен индуцировать у собак эффективный иммунный
ответ .
19.
Подходы и направления вразработке антирабических вакцин
В РФ на основе аденовируса человека 5 серотипа
также разработана векторная конструкция Ad5RV97, имеющая в составе ген G-белка ВБ (штамм
РВ-97).
Исследование
иммуногенности
рекомбинантного аденовируса на мышах показало
100% защиту при заражении стандартным
штаммом CVS ВБ в дозе 100 ЛД50. Титры АТ в
сыворотках вакцинированных мышей составляли
>10 МЕ/мл. В настоящее время проводятся
дальнейшие испытания на лабораторных моделях .
20.
Важно подчеркнуть, что несмотря на высокую безопасность иэффективность современных антирабических вакцин, они
защищают только от заболевания бешенством, вызываемого
классическим возбудителем. В то же время в последние годы
наблюдается значительный прогресс в области изучения
лиссавирусов (Lyssavirus).
До недавнего времени этот род включал 7 следующих видов:
• - вирус классического бешенства (RABV);
• - вирус Лагос-Бат (лиссавирус летучих мышей Лагоса) (Lagos bat,
LBV);
• - вирус (лиссавирус) Мокола (Mokola, MOKV);
• - вирус Дувенхаге (Duvenhage, DUVV);
• - европейские лиссавирусы летучих мышей 1 (EBLV1) и 2 типа
(EBLV2);
• - австралийский лиссавирус летучих мышей (ABLV) .
21.
На протяжении конца 1990-х – начала 2000-х гг.описано и признано ещё 7 лиссавирусов:
• - вирус Иркут (Irkut, IRKV);
• - западнокавказский вирус летучих мышей
(WCBV);
• - вирус Араван (Aravan, ARAV);
• - вирус Худжанд (худжандский) (Khujand,
KHUV),
• - вирус Шимони-Бат (вирус летучих мышей
Шимони) (Shimoni bat, SHIBV);
• - вирус Бокело-Бат (лиссавирус летучих мышей
Бокело) (Bokeloh bat, BBLV);
• - вирус Икома (Ikoma, IKOV)
22.
• В современном состоянии классификациярода Lyssavirus включает 17 видов .
• Помимо названных это лиссавирусы
летучих мышей Льейда (Lleida bat lyssavirus,
LLEBV) , Ганнорува (Gannoruwa bat
lyssavirus, GBLV) и Тайваня (Taiwan bat
lyssavirus, TWBLV)
23.
• Все лиссавирусы могут быть условно разделены на 4филогенетические группы.
• Первая филогруппа объединяет RABV, DUVV, EBLV-1 и
EBVL-2, ABVL, BBLV, ARAV, KHUV, IRKV, GBLV, а также
TWBLV.
• Вторая включает LBV, MOKV
• SHIBV. WCBV формирует третью филогенетическую
группу,
• а Ikoma lyssavirus – четвертую.
• Вирус Lleida предположительно принадлежит к
четвертой филогенетической группе.
• Между
представителями
различных
филогрупп
отсутствует перекрёстная защита, при этом все
лиссавирусы могут вызывать у млекопитающих
(Mammalia)
клинически
идентичные
острые
энцефалиты с летальностью, близкой к 100%
24.
• Производимые в настоящее время антирабическиевакцины обладают протективным эффектом против
лиссавирусов первой филогенетической группы, но
не защищают от возбудителей других филогрупп,
поэтому для человека существует реальная
опасность заражения при контакте с летучими
мышами.
• Уже описано 8 случаев инфицирования людей
лиссавирусами от этих животных на территории
Евразии.
• На сегодняшний день ситуация с лиссавирусами
летучих мышей не является угрожающей, однако
задача разработки новых вакцинных препаратов
широкого спектра действия становится уже
актуальной.
25.
современныекультуральные
инактивированные
антирабические
вакцины медицинского и ветеринарного
назначения,
применяемые
в
РФ,
эффективны и безопасны.
Однако в мире уже разработаны и
применяются на практике рекомбинантные
антирабические вакцинные препараты
нового поколения, которые могут быть
востребованы в борьбе как с бешенством,
так и с заболеваниями, вызываемыми
другими лиссавирусами

























 Медицина
Медицина








