Похожие презентации:
Основы химической кинетики. Химическое равновесие
1.
ОСНОВЫ ХИМИЧЕСКОЙКИНЕТИКИ. ХИМИЧЕСКОЕ
РАВНОВЕСИЕ
2.
1. Основные понятия и определенияХимическая кинетика - раздел химии, изучающий
скорости химических реакций и
механизмы их
протекания.
Предмет химической кинетики – скорость реакции.
Химические реакции классифицируют на гомогенные
и гетерогенные.
4
3.
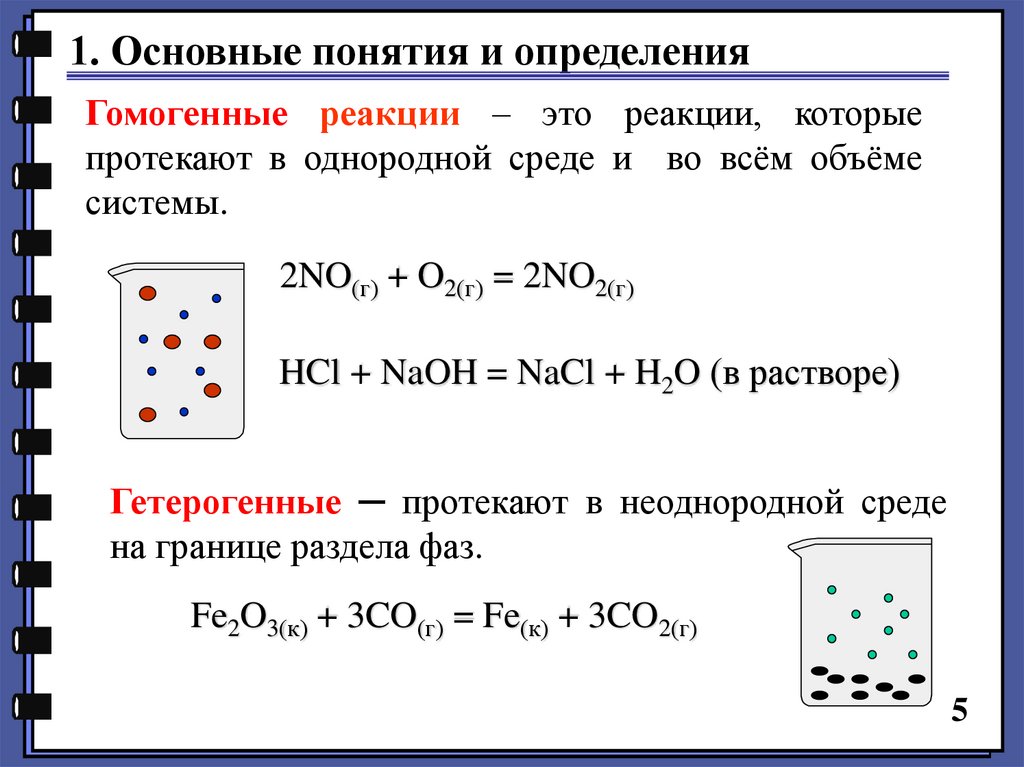
1. Основные понятия и определенияГомогенные реакции – это реакции, которые
протекают в однородной среде и во всём объёме
системы.
2NO(г) + O2(г) = 2NO2(г)
HCl + NaOH = NaCl + H2O (в растворе)
Гетерогенные ─ протекают в неоднородной среде
на границе раздела фаз.
Fe2O3(к) + 3CO(г) = Fe(к) + 3CO2(г)
5
4.
1. Основные понятия и определенияСкорости гомогенной и
определяются различно.
гетерогенной
реакций
Скорость гомогенной реакции определяется
изменением молярной концентрации одного из
реагирующих веществ или продуктов реакции за
единицу времени.
где См – молярная концентрация, моль/л;
Δτ – время протекания реакции, с.
7
5.
1. Основные понятия и определенияСкорость гетерогенной реакции – количество
вещества, вступающего в реакцию или образующего
при реакции за единицу времени на единице площади
поверхности фазы.
где n – количество вещества, моль;
s – площадь поверхности фазы, м²;
Δτ – время протекания реакции, с.
8
6.
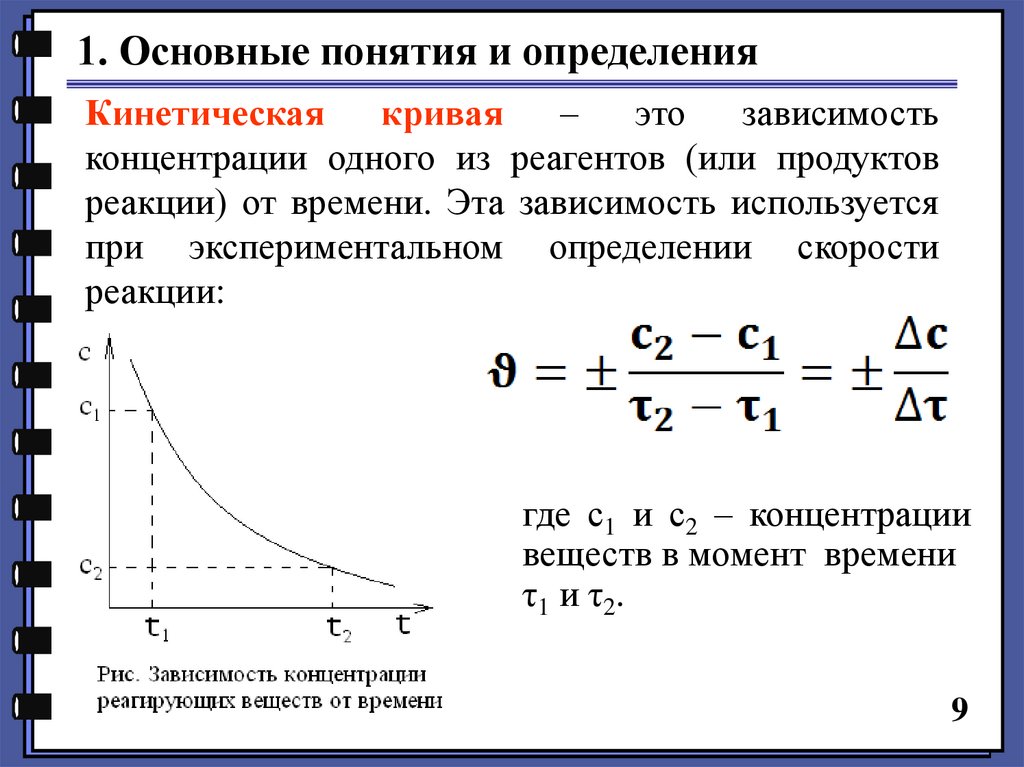
1. Основные понятия и определенияКинетическая
кривая
–
это
зависимость
концентрации одного из реагентов (или продуктов
реакции) от времени. Эта зависимость используется
при экспериментальном определении скорости
реакции:
где с1 и с2 – концентрации
веществ в момент времени
τ1 и τ2.
9
7.
1. Основные понятия и определенияФакторы, влияющие на скорость химической
реакции
1. Природа реагирующих веществ.
2. Концентрация вещества, давление (для газов).
3. Температура.
4. Наличие катализатора.
* Для гетерогенных реакций скорость зависит от
состояния поверхности твёрдого вещества и
скорости подвода реагента в зону реакции.
11
8.
2. Закон действующих массЗакон действующих масс: скорость химической
реакции при постоянной температуре прямо
пропорциональна
произведению
молярных
концентраций
реагирующих
веществ,
возведенных
в
степени,
равные
их
стехиометрическим коэффициентам в уравнении
реакции.
Для обобщенной реакции:
aA + bB = dD + fF
математическое выражение закона действующих
масс имеет вид:
15
9.
2. Закон действующих масс- кинетическое уравнение
химической реакции
где
υ – скорость химической реакции, моль/л·с;
k – константа скорости химической реакции;
С – концентрация реагирующих веществ,
моль/л;
a, b – стехиометрические коэффициенты.
16
10.
2. Закон действующих массk – константа скорости химической реакции –
численно
равна
скорости
реакции
при
концентрациях реагирующих веществ, равных
1 моль/л, т.е. константа скорости равна удельной
скорости реакции.
Константа скорости химической реакции зависит от
природы реагирующих веществ и температуры, но не
зависит от концентрации.
17
11.
2. Закон действующих массВ случае гетерогенных реакций в кинетическое
уравнение входят концентрации только тех веществ,
которые находятся в газообразной фазе или растворе.
Концентрация вещества, находящегося в твердой
фазе, обычно постоянная величина и поэтому входит в
k скорости.
С(графит) + О2(г) = СО2 (г)
υ = k·CO2
18
12.
3. Зависимость скорости от температурыЗависимость скорости химической реакции от
температуры выражается правилом Вант-Гоффа:
При повышении температуры на каждые 10°С
скорость большинства химических реакций
увеличивается в 2 – 4 раза.
Математическое выражение имеет вид:
21
13.
3. Зависимость скорости от температурыk t 10
2 4
kt
где
и
- скорость реакции
при
температурах Т1 и Т2;
γ – температурный коэффициент, показывающий
во сколько раз возрастает скорость реакции при
повышении температуры на 10°С (γ = 2÷4).
22
14.
3. Зависимость скорости от температуры1. Теория активных столкновений – теория
Аррениуса (для реакций в газах).
В смеси двух газов молекулы
должны столкнуться для того, чтобы
между ними произошло химическое
взаимодействие.
Однако,
при
сближении молекулы испытывают
взаимное
отталкивание,
для
преодоления которого они должны
обладать
некоторым
запасом
энергии.
23
15.
3. Зависимость скорости от температурыМинимальная избыточная энергия, которой должны
обладать молекулы в момент столкновения, чтобы
между ними стало возможным химическое
взаимодействие называется энергией активации Еа.
Уравнение Аррениуса:
где k – константа скорости реакции;
А – предэкспоненциальный множитель, численно
равный максимальной константе скорости реакции kmax;
е – основание натурального логарифма (2,718);
Еа – энергия активации, кДж/моль;
R – газовая постоянная (R = 8,31 Дж/моль·К).
24
16.
3. Зависимость скорости от температуры2. Теория переходного комплекса
В ходе реакции система проходит через
переходное состояние – через образование
активированного комплекса.
AB + CD = AC + BD
время существования ~ 10-13 с
A—B
+
C—D
исходные
молекулы
→
A···B
·
·
C···D
активированный
комплекс
→
A
B
│ + │
C
D
продукты
реакции
25
17.
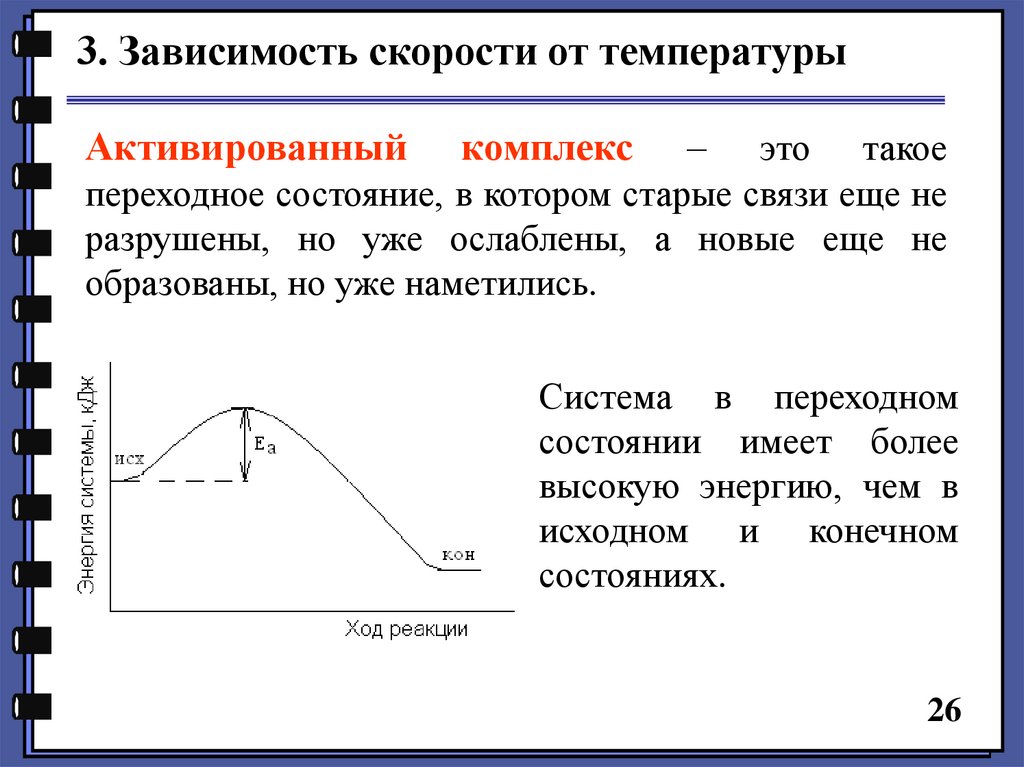
3. Зависимость скорости от температурыАктивированный
комплекс
–
это такое
переходное состояние, в котором старые связи еще не
разрушены, но уже ослаблены, а новые еще не
образованы, но уже наметились.
Система в переходном
состоянии имеет более
высокую энергию, чем в
исходном и конечном
состояниях.
26
18.
3. Зависимость скорости от температурыЭнергия активации Еа – это энергия,
необходимая для перехода системы в состояние
активированного комплекса.
Доля
молекул,
обладающих
энергией,
достаточной для образования активированного
комплекса, зависит от температуры. Эта
зависимость выражается кривой Максвелла –
Больцмана.
27
19.
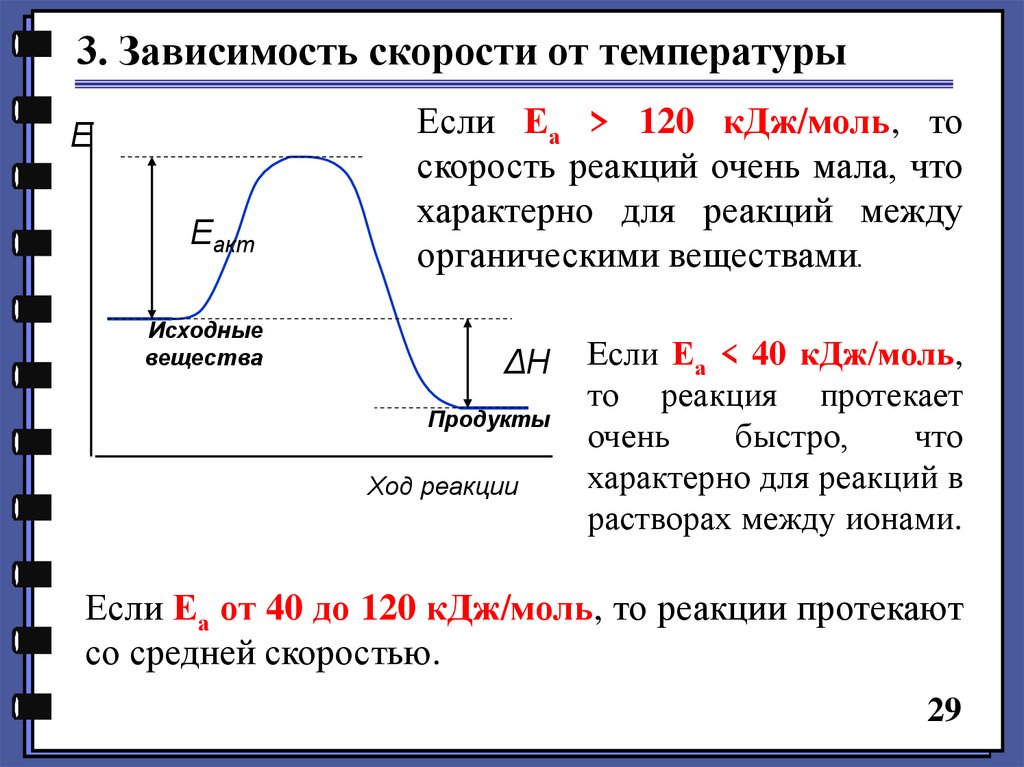
3. Зависимость скорости от температурыE
Еакт
Исходные
вещества
Если Еа > 120 кДж/моль, то
скорость реакций очень мала, что
характерно для реакций между
органическими веществами.
ΔН
Продукты
Ход реакции
Если Еа < 40 кДж/моль,
то реакция протекает
очень
быстро,
что
характерно для реакций в
растворах между ионами.
Если Еа от 40 до 120 кДж/моль, то реакции протекают
со средней скоростью.
29
20.
3. Зависимость скорости от температурыЕакт – это то избыточное количество энергии (по
сравнению со средней величиной), которой должна
обладать молекула в момент столкновения, чтобы
быть
способной
к
данному
химическому
взаимодействию.
С увеличением температуры растет доля молекул,
энергия которых равна или выше Еа, соответственно
растет доля молекул, способных к образованию
активированного
комплекса,
т.е.
происходит
увеличение скорости реакции. Чем выше Еа, тем
меньше доля частиц, способных к активному
взаимодействию.
30
21.
4. Катализ. КатализаторыКатализаторы это вещества, которые
изменяют скорость химической реакции, но не
испытывают
химических
превращений
(остаются неизменными) в ее результате.
Катализаторы не влияют на термодинамику
реакции, т.е. не изменяют энтальпию и энергию
Гиббса реакции.
31
22.
4. Катализ. КатализаторыКатализ - явление изменения скорости химической
реакции под воздействием катализаторов.
Термин «катализ» был введён
в
1835
году
шведским
учёным
Йетсом
Якобом
Берцелиусом.
Йёнс Якоб
Берцелиус
(1779 – 1848)
Ката́лиз
происходит
от
греч. κατάλυσις
восходит
к καταλύειν — разрушение.
32
23.
4. Катализ. КатализаторыРеакции,
протекающие
под
воздействием
катализаторов, называются каталитическими.
Различают гомогенный и гетерогенный катализ.
В случае гомогенного катализа катализатор и
реагирующие вещества находятся в одной фазе.
Н2О(г)
2 СО(г) + О2(г) ―――→ 2 СО2(г)
33
24.
4. Катализ. КатализаторыА + В → АВ
медленно (высокое значение Еа)
Введем катализатор К
А + К → А … К → АК (1) быстро (низкое значение Еа)
активированный
комплекс
АК+В → АК…В → АВ+К (2) быстро(низкое значение Еа)
активированный
комплекс
А + К + АК + В → АК +АВ +К
А + В → АВ
35
25.
4. Катализ. КатализаторыЕсли Еа промежуточных стадий ниже Еа процесса в
отсутствии катализатора, то общая скорость процесса
значительно возрастает, и такой катализ называется
положительным.
Положительные
катализаторы,
ускорителями
каталитических
называются активаторами.
являющиеся
процессов,
37
26.
4. Катализ. КатализаторыЕсли Еа промежуточных стадий выше Еа процесса
без катализатора, то общая скорость процесса
уменьшится, и катализ будет отрицательным.
Для замедления нежелательных процессов или для
придания реакциям более спокойного характера
используют отрицательные катализаторы, наряду с
которыми применяются и ингибиторы, которые
отличаются от последних тем, что входят в состав
продуктов реакции.
38
27.
4. Катализ. КатализаторыВ случае гетерогенного катализа катализатор
находится в системе в другой фазе (твердой) и
реакция протекает на поверхности катализатора.
Fe(т)
N2(г) + 3 H2(г)――→ 2 NH3(г)
Гетерогенными катализаторами обычно служат
переходные металлы, их оксиды, сульфиды и
другие соединения.
39
28.
4. Катализ. КатализаторыСкорость гетерогенных процессов зависит от
величины поверхности раздела, следовательно
катализатор должен находиться в тонкоизмельченном
состоянии.
Поскольку все гетерогенные процессы протекают на
поверхности раздела фаз, то они связаны с явлением
адсорбции, т.е. накоплением молекул вещества на
этой поверхности.
Для объяснения механизма гетерогенного катализа
используется адсорбционная теория, согласно
которой процесс состоит из 5 стадий:
40
29.
4. Катализ. КатализаторыI стадия - диффузия молекул реагирующих
веществ к поверхности катализатора.
II стадия - адсорбция молекул на поверхности
катализатора.
III стадия - химическая реакция. В результате
адсорбции химические связи
в молекулах
оказываются
ослабленными,
что
облегчает
химическое взаимодействие между ними на
поверхности катализатора.
IV стадия - десорбция продуктов реакции, т.е.
удаление их с поверхности катализатора.
V стадия - диффузия молекул продуктов реакции
от поверхности катализатора.
41
30.
4. Катализ. КатализаторыФерментативный
катализ
–
избирательное
ускорение химических реакций, протекающих в
живых организмах под воздействием ферментов
(энзимов).
Ферментами (энзимами) называются вещества
белковой природы, которые ускоряют химические
реакции, протекающие в клетках и тканях живого
организма
Ферментативный катализ занимает промежуточное
положение между гомогенным и гетерогенным
катализом
42
31.
4. Катализ. КатализаторыОсновными свойствами ферментов являются:
селективность, эффективность, чувствительность к
внешним условиям и каталитическим ядам.
Специфичность ферментов может быть различной.
Ферменты с низкой специфичностью катализируют
группу реакций одного типа
Эффективность ферментов объясняется тем, что
молекулы ферментов в процессе каталитических
реакций регенерируются миллионы раз в минуту
44
32.
5. Химическое равновесиеНеобратимые реакции – это реакции, которые
протекают только в одном направлении, т.е. идут до
конца.
Эти реакции сопровождаются образованием осадка,
газа или слабого электролита.
Обратимые реакции – это реакции, которые
протекают одновременно в двух противоположных
направлениях (прямом и обратном), т.е. продукты
реакции вновь образуют исходные вещества.
47
33.
5. Химическое равновесиеРассмотрим обратимую реакцию в общем виде:
aA + bB
dD + fF
По закону действующих масс:
υ = k·[A]a·[B]b
υ = k·[D]d·[F]f
где υ, υ – скорость прямой и обратной реакции;
k, k – константы скорости прямой и обратной
реакции;
[A], [B], [D], [F] – равновесные концентрации
веществ.
48
34.
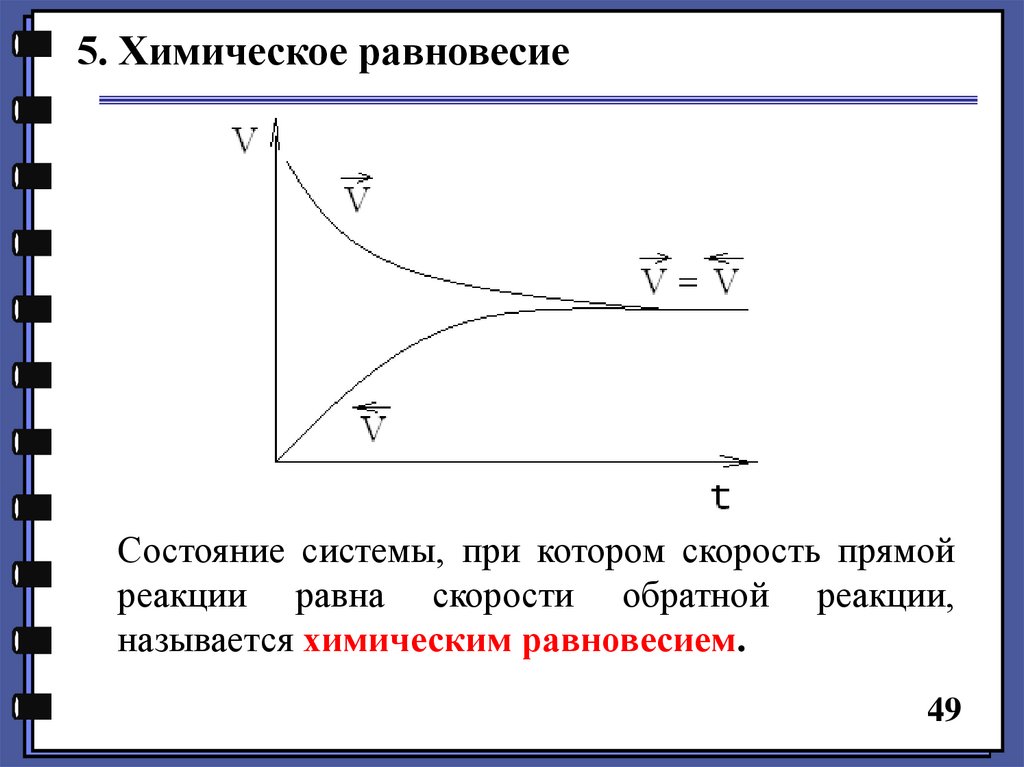
5. Химическое равновесиеСостояние системы, при котором скорость прямой
реакции равна скорости обратной реакции,
называется химическим равновесием.
49
35.
5. Химическое равновесиеυ=υ
k·[A]a·[B]b = k·[D]d·[F]f
Константа химического равновесия Кc – это
отношение произведения равновесных концентраций
продуктов реакции к произведению равновесных
концентраций исходных веществ, в степенях равных
их стехиометрическим коэффициентам.
50
36.
5. Химическое равновесиеКС зависит от природы реагирующих веществ и от
температуры, но не зависит от концентрации.
При повышении температуры КС увеличивается для
эндотермической реакции и уменьшается для
экзотермической реакции.
КС характеризует глубину протекания химической
реакции.
51
37.
5. Химическое равновесиеЕсли КС > 1 – это значит, что при равновесии
концентрация
продуктов
реакции
больше
концентрации исходных веществ и равновесие
смещается вправо (идет прямая реакция).
Если КС < 1 – это значит, что при равновесии в
системе содержатся преимущественно исходные
вещества и равновесие смещено влево (идет обратная
реакция).
52
38.
5. Химическое равновесиеКатализатор не влияет на значение КС, не смещает
химическое равновесие, т.к. он изменяет скорости
прямой и обратной реакции в одинаковой степени,
он только увеличивает скорость достижения
равновесия. Катализатор приводит реакцию к тому
же состоянию равновесия за меньший промежуток
времени, чем могла это сделать сама система без
катализатора.
53
39.
5. Химическое равновесиеКС связана с энергией Гиббса уравнением:
ΔG0 = - R·T·lnKС
или
ΔG0 = - 19.15·T·lgKС
Если КС > 1, то ΔG < 0 – идет прямая реакция.
Если КС < 1, то ΔG > 0 – идет обратная реакция.
54
40.
6. Смещение химического равновесияХимическое равновесие устанавливается при
определенных условиях: концентрация, температура
и давление, при изменении которых происходит
смещение химического равновесия.
Направление смещения химического равновесия
определяется принципом Ле – Шателье.
55
41.
6. Смещение химического равновесияЛе-Шателье
Анри-Луи
(1850 – 1936 г).
Принцип Ле – Шателье: если
на систему, находящуюся в
состоянии
химического
равновесия, оказать внешнее
воздействие, то равновесие
смещается в сторону той
реакции, которая ослабляет это
воздействие.
56
42.
6. Смещение химического равновесияВлияние концентрации на смещение
химического равновесия
При увеличении концентрации исходных веществ,
равновесие реакции смещается вправо; при
увеличении концентрации продуктов реакции
равновесие смещается влево.
FeCl3 + 3 KCNS <=> Fe(CNS)3 + 3 KCl
слабо красный раствор
Если добавить KCNS, то окраска раствора усилится,
следовательно, равновесие сместилось вправо.
Если добавить KCl, то окраска ослабеет, это значит,
что
концентрация
Fe(CNS)3
уменьшилась,
следовательно, равновесие сместилось влево.
57
43.
6. Смещение химического равновесияВлияние температуры на смещение химического
равновесия
При повышении температуры равновесие реакции
смещается в сторону эндотермической реакции, а
при понижении температуры – в сторону
экзотермической реакции.
экзо
С(графит) + О2(г) → СО2(г), ΔН0r =-393 кДж
←
эндо
При повышении температуры – равновесие
сместится влево.
При понижении температуры – равновесие сместится
вправо.
58
44.
6. Смещение химического равновесияВлияние давления на смещение химического
равновесия
Изменение давления оказывает влияние на
равновесие в том случае, если в реакции участвуют
газообразные вещества.
При увеличении давления равновесие смещается в
сторону уменьшения объема системы, т.е. в сторону
образования меньшего числа молей газа, а при
уменьшении давления – в сторону увеличения
объема системы, т.е. в сторону образования
большего числа молей газа.
59
45.
6. Смещение химического равновесияN2(г) + 3 H2г()<=> 2 NH3(г)
4 моль
2 моль
При повышении давления – равновесие сместится
вправо (в сторону меньшего числа молей газов).
При понижении давления – равновесие сместится
влево (в сторону большего числа молей газов).
60
46.
7. Примеры решения задачПри решении задач по химической кинетике
необходимо различать следующие понятия:
С0 –
начальная концентрация реагирующего
вещества
– это количество вещества,
которое
содержится в 1 л раствора или газа в момент начала
реакции, моль/л;
С – текущая концентрация вещества – это
количество вещества в 1 л реакционной системы в
определенный момент времени;
[С] – равновесная концентрация вещества – это
количество вещества в 1 л реакционной системы в
момент наступления равновесия;
61
47.
7. Примеры решения задачС – изменение концентрации вещества – это
количества в-ва (в расчете на 1 л реакционной
системы), которое израсходовалось (для исходных
веществ) или образовалось (для продуктов) в ходе
реакции к определенному моменту времени.
Для гомогенной реакции количество прореагировавших
исходных веществ и количество образовавшихся продуктов
реакции находится в пропорциональной зависимости друг
от друга.
aА + вВ = сС + dD
С А С В Сс C D
а
в
с
d
62
48.
7. Примеры решения задачЗадача 1.
Для реакции: Н2(г.) + I2(г.) = 2НI(г.)
начальные концентрации равны:
С0Н2 =2,0 моль/л;
0
Н2
С0 I2=1,5 моль/л;
С0 HI =1,0 моль/л;
Определите концентрации всех веществ в момент
равновесия, если константа равновесия равна 47.
63
49.
7. Примеры решения задачРешение:
1. Предположим, что к моменту равновесия
прореагировало Х моль (в расчете на 1 л газовой
системы) водорода, т.е. CH2 = Х моль/л.
2. Согласно со стехиометрией реакции имеем:
Н2(г.) + I2(г.) = 2НI(г.)
C H
1
2
C
1
2
C
2
64
50.
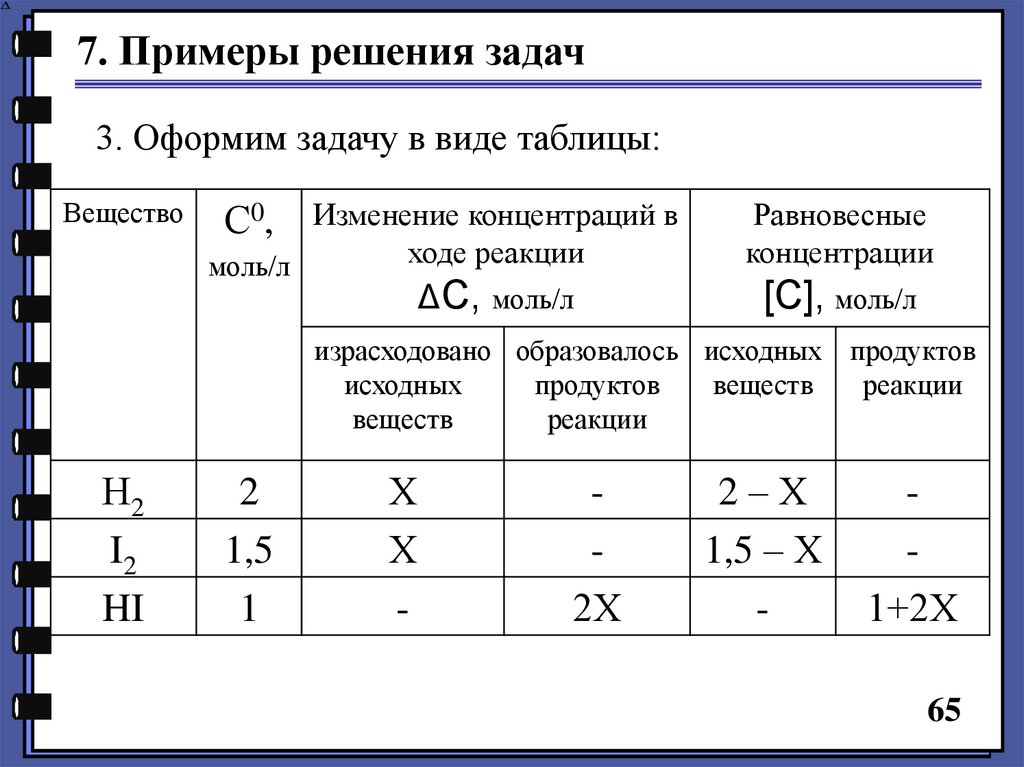
7. Примеры решения задач3. Оформим задачу в виде таблицы:
Вещество
Изменение концентраций в
ходе реакции
моль/л
С0,
ΔС, моль/л
Равновесные
концентрации
[С], моль/л
израсходовано образовалось исходных продуктов
исходных
продуктов
веществ
реакции
веществ
реакции
Н2
I2
HI
2
1,5
1
Х
Х
-
2Х
2–Х
1,5 – Х
-
1+2Х
65
51.
7. Примеры решения задач4. Запишем выражение для Кс:
Н2(г.) + I2(г.) = 2НI(г.)
kC
HI
H
2
;
I 2
2
47
1 2 x
2
2 x 1.5 x
отсюда: 43 х2 – 168,5 х + 140 = 0;
168,5 168,5 2 4 43 140 168,5 65,67
x
;
2 43
86
66
52.
7. Примеры решения задач5. Решаем квадратное уравнение и находим Х1 и Х2 :
Х1 = 1,2;
Х2 = 2,7.
Корень Х2 не имеет смысла, так как Х2 > С0.
Следовательно, равновесные концентрации веществ
составят:
[H2] = 0,8 моль/л;
[ I2] = 0,3 моль/л;
[HI] = 3,4 моль/л.
67
53.
7. Примеры решения задачЗадача 2.
0
Н2
При температуре200С некоторое кол-во вещества
вступает в реакцию за 10 минут. Рассчитать время
протекания реакции при температуре 700С, если
температурный коэффициент равен 2.
Во сколько раз при этом изменится скорость
реакции.
68
54.
7. Примеры решения задачРешение:
Уравнение Вант-Гоффа
имеет вид:
VT VT
2
T2 T1
10
1
,
Между скоростью протекания химической реакции
и её продолжительностью существует обратно
пропорциональная зависимость:
V2
1
V1
2
где
1 и 2 – время протекания реакции при
температурах T1 и T2.
69
55.
V2
1
V1
2
7. Примеры решения задач
1. Запишем уравнение правила Вант-Гоффа
для данного условия задачи:
2 1
10
2
70 20
10
2 32
5
2. Рассчитаем время протекания реакции при
температуре 700С:
2
1
32
сек.
70
56.
7. Примеры решения задач2. Рассчитаем во сколько раз изменится скорость
реакции при повышении температуры
реакционной смеси с 200С до 700С:
V70 V20
0
Н2
Тогда:
2 1
10
70 20
V70
5
10
2
2 32
V20
Следовательно, при повышении температуры с 200С
до 700С скорость реакции возрастает в 32 раза. 71
57.
7. Примеры решения задачЗадача 3.
Выразите через концентрации реагентов константу
равновесия следующей реакции:
0
Н2
N 2( г ) 3Н 2( г ) 2 NH 3( г ) ; Н 92,2кДж
Указать направление смещения этой реакции:
1) при увеличении температуры, если давление
постоянно;
2) при повышении давления, если температура
постоянна.
72
58.
7. Примеры решения задачРешение:
1. Запишем выражение константы равновесия для
следующей реакции:
0
Н2
Выразим константу равновесия реакции через
равновесные концентрации реагирующих веществ:
73
59.
7. Примеры решения задач2. Определим направление смещения равновесия в
реакции при увеличении температуры, Р = const:
N 2( г ) 3Н 2( г ) 2 NH 3( г ) ; Н 92,2кДж
0
Н2
Реакция синтеза аммиака экзотермическая (∆H<O).
Повышение температуры в этом случае должно
вызвать смещение равновесия реакции влево
– в сторону эндотермической реакции, ослабляющей
указанное воздействие.
74
60.
7. Примеры решения задач3. Определим направление смещения равновесия в
реакции при повышении давления , Т = const:
0
Н2
Повышение давления будет благоприятствовать
реакции, ведущей к образованию меньшего числа
молей газообразных веществ.
Следовательно, равновесие реакции сместится вправо.
75






















































 Химия
Химия








