Похожие презентации:
Биохимические свойства бактерий. Антагонизм микробов и антибиотики
1.
2.
3.
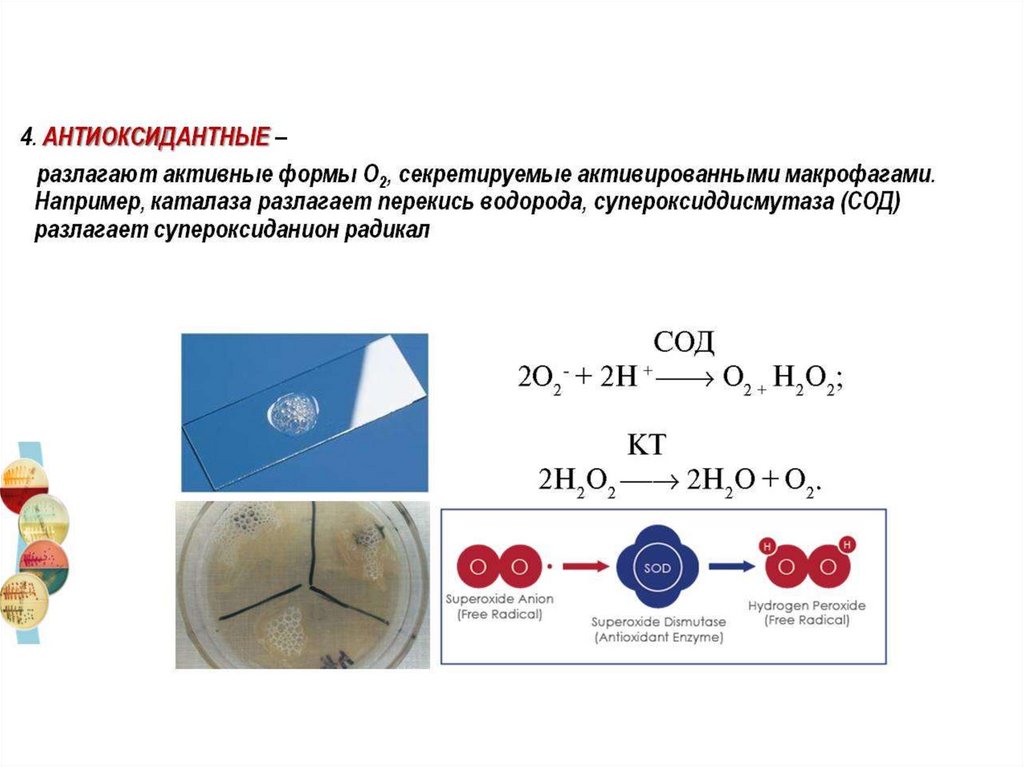
4.
5.
6.
• Функциональная активность м/озависит от особенностей морфологии(анатомии),их
хим. состава и наличия ферментов.М/о обладают
сложным и активным ферментным составом и это
используется не только в медиц.м/б,но и в
практич.медицине,в пищев.пром.,с/х, научн.
иссл.Все виды брожения(спирт,укс-кисл,маслкисл)вызываютя микр.ферментами и используются с
древних времен в
хлебопечении,виноделии,производстве молочнокисл.продуктов.
• Интенсивность микр.метаболизма высока.
• Деятельность ферм.зависит от концентрации
субстрата,температуры,рН,присутствия химич.в-в
которые способны тормозить или стимулировать
активность энзима.
7.
8.
Классификация ферментов.1.По месту действия различают:
• ЭКЗОФЕРМЕНТЫ-катализируют в основном
гидролитические р-ции вне микр.клетки и
приводят к расщеплению субстрата до
простых соединений.Благодаря их действию
становится возможным мембр.транспорт
этих соединений через кл.ст.и ЦПМ.
• ЭНДОФЕРМЕНТЫ-катализируют р-ции внутри
микр.кл.,происходящие с освобождением
энергии(биологич.окисление) и способствуют
дальнейшей утилизации питат.веществ.
9.
2.По механизму действия различают 6 групп:• Оксидоредуктазы(дегидрогеназа,оксидаза)-
катализируют окислит.-восстанов.реакции.
• Трансферазы(трансаминаза,киназа)-перенос группы
атомов,радикалов от одного соед-я к др.
• Гидролазы(липаза,амилаза,пептидаза)катализируют р-ции расщепления и синтеза таких
сложных соединений.как Б,Ж и У.с участием воды.
• Лиазы(декарбоксилаза)-негидролитическое
присоединение или отщепление от субстрата групп
атомов.
• Изомеразы(изомераза,мутаза)-осуществляют
превращение органич.соединений в их изомеры.
• Лигазы(синтетаза)-катализируют синтез сложных
органических соединений из простых.
10.
11.
3.От условий выделения(по времени синтеза вклетке)различают:
• Конститутивные-эти энзимы постоянно присутствуют в
микр.клетке,не зависимо от состава питат.среды и
обеспечивают клет.метаболизм.К ним относятся
большинство гидролитич.ферментов.
• Индуцибельные или адаптивные -выделяются
клеткой лишь при наличии сответствующего субстрата в
среде.Это результат адаптации к новым условиям,для этого
м/о нужно время для накопления определенного числа
поколений.
• Пример:галактозидаза КП,индуктором которой
явл.лактоза(ср.Эндо); пенициллиназа или лактамазавыделяютя стафилококками и определяет резистентность
м/о к пенициллину.
12.
• Количественный и качественный составферментов у разных видов бактерий
неодинаков. Различия в спектре ферментат.
акт.используют для идентификации их видовой
родовой принадлежности. Особо важное
значение в идентификации имеет определение
гидролаз и оксодоредуктаз.
• 4.По действию на различные в-ва субстрата
гидролазы подразделяются на
сахаролитические (амилолитические или
гликозидазы),
протеолитические(пепсин,трипсин),липолитиче
ские(стеатолитические)и антиоксидантные.
Исследования гидролаз проводят на ДДСср.Гисса,Эндо,3-х сахарный агар и другие.
13.
1.САХАРОЛИТИЧЕСКИЕ ФЕРМЕНТЫ(амилолитические или гликозидазы).
• Расщепляют углеводы до альдегидов, кислот,
углекислого газа и водорода.
• Исслед-е гидролаз проводят на б/х «ряду Гисса» с
моно и дисахараридами(гл,л,мальт,сах) ,
полисахаридами(крахмал,гликоген),высш.спиртам
и(маннит).При расщеплении углеводов с
обр.кислот изменяется «рн» среды
изменение цвета индикатора + газ улавливается
поплавком.
• Различия в цветовых оттенках среды в пробирках
со «ср.Гисса»,позволило называть его «пестрым
рядом».
• На этом принципе создаются
панели,планшеты,бум.индикаторные системы и
приборы для учета фермент.активности.
14.
15.
Среды Гисса16.
Плотная ДДС17.
• На плотныхсредах(диф/диагн.)ЭНДО, ПЛОСКИРЕВА ,
ЛЕВИНА, в состав
которых входит лактоза,
дифференцируют E.coli
.Она ферментирует
лактозу и образует
поэтому на среде малин.красные лактозопозитивные (lac+) колонии с
металл. блеском.
• Лактозонегативные
энтеробактерии
образуют бесцветные
колонии(lac-)
18.
19.
20.
21.
Показателями протеолитическойактивности являются:
• 1.Разжижение (расщепление)желатины при посеве
уколом(послойное,в виде гвоздя, елочки и др.)
• 2.Образование индола-для выявления которого
применяют полоски фильтр.бум., смоченные
насыщен. р-ром щавелевой кислоты.При выделении
индола нижняя часть бумажки приобретает роз.цвет.
• Еще можно использовать для опред.индола эфир и рв Эрлиха обр.малиновое кольцо.
• 3.Сероводород обнаруживают с помощью
инд.бумажки,пропитанной р-ром уксуснокислого
свинца.При выделении сероводорода обр.сульфит
свинца индик.бум.чернеет.
• 4.Наличие аммиака определяют по посинении
свисающей лакмусовой бумаги.
22.
ПРОТЕОЛИТИЧЕСКИЕ СВОЙСТВА МИКРООРГАНИЗМОВ23.
ПРОТЕАЗЫ-24.
25.
26.
27.
28.
1.Ферменты,повреждающиеклет.стенку м/о.
*Гемолизин-лизирует
эритроциты в орг. (+Кр.агар)
*Лецитиназа=лецитовителазарасщепляет лецитин,который
входит в состав клеток
(лейкоциты и др.)Можно
выявить на ЖСА(ср.Чистовича).
*ДНКаза - расщепление ДНК(на
средах с ДНК).
*Лейкоцидин- на лейкоциты д-т.
*Липаза- расщепление жиров.
29.
30.
31.
2.Ферменты инвазии ираспространения:
• Плазмокоагулаза- сворачивает плазму
(кролика).Это главный фактор патогенности
стафилококков,в результате чего каждая
бактерия покрывается пленкой(защитным
чехлом) и предохраняет ее от фагоцитоза.
• Фибринолизин-растворение
фибрина,распространение за пределы раны.
• Гиалуронидаза-расщепляет гиалуроновую
кослоту в мембранах кл.соеденит.тк.
макроорганизма увеличивается инвазия м.о.
• Нейроминидаза- расщепление сиаловой
кислоты в соед.тк.
• Коллагеназа- расщепление коллагеновых
волокон.
32.
3.Ферменты,приводящие к образованиютоксических веществ в макроорганизме.
• Декарбоксилаза а/к- ведет к образованию
биогенных аминов с токсическими
свойствами):гистидин->гистамин,лизин>кадаверин.
• Уреазы-при расщеплении мочевины
обр.аммоний с токсич.св-ми.
• Пирогены- повышение температуры вызывают
• Антифагины-препятствуют фагоцитозу.
4.Ферменты,сопутствующие
патогенности:
• Фермент,расщепл.маннит в анаэробных
условиях(на среде с маннитом –стафилококки)
33.
34.
• «Антибиотик»(греч)-anti(против),bios(жизнь).Антибиотики(АБ)-это химические вещества
биологического происхождения(продукты
биосинтеза живых организмов) и их 1/2 –
синтетические производные,способные
избирательно подавлять рост и размножение
бактерий (окзывать б/статич.и б/цидное
действие)или вызывать их гибель,а так же
задерживать развитие злокачественных
новообразований без существенного вреда для
макроорганизма.
• Предложен Ваксманом в 1942г.(открыл
стрептомицин,в 1943г.Нобелевская премия)
Химиопрепараты(ХП)- химич.в-ва природного
или синтетич.происхождения,которые оказывают
избирательное б/статич.или б/цидное действие на
микроорганизмы в организме хозяина.
35.
КРАТКАЯ ИСТОРИЧЕСКАЯ СПРАВКА
Проблема лечения инфекционных болезней имеет такую же
долгую историю, как и изучение самих болезней. С точки
зрения современного человека, первые попытки в этом
направлении были наивны и примитивны, хотя некоторые из
них не были лишены здравого смысла (например прижигание
ран или изоляция больных). Изготовление настоев и отваров
из растительного сырья было широко распространено в
античном мире, их пропагандировал Клавдий Гален (отсюда и
«галеновы»). В средневековье репутацию препаратов из
лекарственного сырья значительно «подмочили»
всевозможные зелья, «изыскания» алхимиков.
• Основателем химиотерапии с полным правом должен
считаться Парацельс, названный А.И. Герценом «первым
профессором химии от сотворения мира». Парацельс не без
успеха применял для лечения инфекций человека и животных
различные неорганические вещества (например соли ртути и
мышьяка).
36.
• После открытия Нового Света стало известно освойствах коры дерева «кина-кина»,
использовавшейся индейцами для лечения
малярии. Популярности этого средства
способствовало чудесное излечение жены вицекороля Америки, графини Цинхон, и в Европу
кора прибыла уже под названием «порошок
графини», а позднее ее имя присвоили и самому
хинному дереву. Такую же славу снискало
другое заокеанское средство – ипекакуана,
применявшееся индейцами для лечения
«кровавых» поносов.
37.
• История современных антимикробных средствначалась с открытия Паулем Эрлихом
способности анилиновых красителей убивать
трипаносомы.
• Пауль Эрлих получил препарат сальварсан
(спасающий), который спас жизнь тысячам
больных различными спирохетозами (сифилис,
фрамбезия и др.).
• Роберт Кох применил атоксил (органическое
производное мышьяка) для лечения сонной
болезни. Но через несколько месяцев
выяснилось, что этот препарат вызывает
дегенерацию зрительного нерва.
38.
• Антибиотики. При изучении сибирской язвы Л.Пастерзаметил, что заражение животного смесью возбудителя и
других бактерий часто мешает развитию заболевания, что
позволило ему предположить, что конкуренция между
микробами может блокировать патогенные свойства
возбудителя. Впервые идею о возможности применения
существующего антагонизма между микробами для
лечебных целей высказал М.М. Мечников.
• Эти находки положили начало развитию двух
направлений в подходе к лечению инфекций:
применение стерилизованных микробных культур (чему
особый толчок дало открытие и применение туберкулина
Кохом) и особых ингибирующих агентов, продуцируемых
микробами. В последующем было установлено, что
отдельные почвенные спорообразующие бактерии
выделяют вещества, убивающие бактерии других видов.
39.
• В 70-х годах ХІХ века русские врачи В.А.Маннасеин и А.Г. Полотебнов установили
бактерицидные свойства плесневых грибов и
эффективность экстрактов их культур при
лечении инфицированных язв и ран. Для этого
направления ведущее значение имело открытие
А. Флемингом пенициллинов (1928).
Следствием этой знаменитой «случайности» (в
открытую чашку со стафилококками нечаянно
попала плесень Р. notatum, образовавшая зону
задержки роста) являлось получение чистого
пенициллина (Х. Флори и Эрнст Чейн, 1940) и
начало новой эры в химиотерапии.
40.
• Первый отечественныйпенициллин (крустозин) был
получен Зинаидой Ермольевой
из P. Crustosum в 1942 году.
П.п.по своей эффективности в 1.4
раза превосходил заокеанский
пенициллин. З.В.Ермольева
получила почетное имя«Мадам Пенициллин».
• Более того, в 1985 г. в архивах
Лионского университета была
найдена диссертация рано
скончавшегося студента-медика,
за сорок лет до А.Флеминга
подробно характеризующая
открытый им препарат из плесени
P. notatum, активный против
многих патогенных бактерий.
41.
Классификация антибиотиков попроисхождению.
• 1.Бактериями(грамицидин,полимиксин)
• 2.Актиномицетами(левомицетин,тетра
циклины)
• 3.Грибами(пенициллин,цефалоспорины)
• 4.Высшими растениями(фитонциды
чеснока,лука, черемухи).
• 5.Животными и человеком(лизоцим,
эритрин, интерфероны)
42.
• Фитонциды- этоантибиотикоподобны
е летучие
вещества,которые
выделяют
растения(чеснок,лук,
черемуха,эквалипт,
зверобой и другие).
43.
44.
По механизму действия(мишень)В основе действия заключено влияние на синтез или
функцию жизненно важных для м/о структур.
• 1.Ингибиторы синтеза пептидогликана (муреинового слоя)
клеточной стенки растущих м/о(особенно у грам «+»).
Не образуется N-АМК,ДПК-протопласт-осмотический шок и гибель
клеток. Могут образовываться L-формы.
Пример:пенициллин,цефалоспорины.
• 2.Нарушение структуры и функции ЦПМ (питание, проницаемость
,обезвоживание и гибель.Пермеазы) Пример:нистатин,полимиксин.
• 3.Подавление синтеза белка на уровне рибосом.Д-т на
транспортную РНК.(левомицетин, олеандомицин, эритромицин)
• 4.Ингибиторы синтеза РНК на уровне РНК-полимеразы (рифампицин).
• 5.Ингибиторы синтеза РНК на уровне ДНК –матрицы
(актиномицины)
• 6.Ингибиторы синтеза ДНК на уровне ДНК-матрицы
(брунеомицин)
• 7.Ингибиторы ферментов,которые участвуют в жизнедеятельности
клетки.
• 8.Ингибиторы фолиевой кислоты-СА,фторхинолоны и
триметоприм.
45.
46.
47.
48.
Методы определения чувствительности кАБ.
49.
Диско-диффузионный метод.• Бактериальную культуру засевают
«газоном»на МПА или ср.МюллерХинтон.Затем на его поверхность
пинцетом помещают на равномерном расстоянии друг от друга
бумажные диски,содержащие
определенные дозы разных АБ.
Посев инкубируют при t= 37*С в
течение суток. Учет результатов
осуществляется путем измерения
диаметра(d) ЗОНЫ ЗАДЕРЖКИ
РОСТА.
• d <10мм=нечувствит.d= 10-15
мм(низкая чувств.),15- 25 мм
(средняя чувств.) и >25мм
(высокая чувств).
50.
51.
Определение чувствительности к АБс помощью Е-теста.
52.
Метод серийных разведений.53.
• Ускореные методы определениячувствительности микроорганизмов к
антибиотикам :·
• 1. определение изменений ферментативной
активности микроорганизмов под
воздействием антибиотиков.
• 2. определение цвета редокс-индикаторов при
изменении окислительно-восстановительного
потенциала во время роста бактерий в
питательной среде.
• 3.цитологичная оценка изменений
морфологии бактериальных клеток под
воздействием антибиотиков.
• 4.автоматизированный метод.
54.
• К первой группе принадлежит метод Роджерса, которыйориентируется на способность антибиотиков подавлять
ферментативную активность чувствительных
микроорганизмов(сопровождается изменением цвета
соответствующего индикатора). Суть его заключается в
дифференцированном изменении красного цвета
фенолового красного на желтый или фиолетовый в
зависимости от чувствительности исследуемого штамма. В
случае чувствительности к действию АБ не происходит
расщепления глюкозы при культивировании в среде(которая
содержит ее) и определены концентрации препарата.
• Вторая группа методов регистрирует изменения
окислительно- восстановительного потенциала среды в
процессе роста микроорганизмов, о чем свидетельствует
изменение цвета резазурина, 1,3,5-трифенилтетразолия
хлорида, 2,6-дихлорфенолиндофенола и других, которые
добавляются к среде. Этот метод технически простой, а
результаты могут быть получены через 2-6 часа.
55.
• Третья группа методов. Образованиеинволюционных форм бактерий под
воздействием антибиотиков исследуют под
ФКМ или антоптральным микроскопом
(разновидность ФКМ,изобрел в
1953г.финск. физиолог А.Вильска)- в
специальных микрокапсулах. Они
образуются в результате действия
бактериостатических концентраций
препарата. Под воздействием
суббактериостатических концентраций, а
также при резистентности исследуемого
штамма на поверхности агара вырастают
нормальные микроколонии.
56.
4.Автоматизированый метод определениячувствительности к А.Б.
57.
Требования к химиотерапевтическим препаратам.• 1.Минимальная токсичность п/п и его продуктов распада при
максимальном антибактериальном эффекте.
• 2.Выраженное избирательное воздействие на м/о in vivo.
• 3.Хорошая растворимость в воде и всасываемость.
• 4.Химич.стабильность при хранении.
• 5.Медленное развитие резистентности м/о к п/п.
• 6.Хорошее выведение п/п, не должен накапливаться.
• 7.Химиотерапевт.индекс = соотношение максим.переносимой
дозы и миним. лечебной дозы(МИК) д.б.не менее 3!!
• Для выбора эффективного п/п нужно сравнить ТК (допустимую
концентр.)АБ в орг. с МИК(МПК)АБ in vitro.
• ТК-предельно допустимая концентрация АБ in vivo!Дает
терапевтический эффект. Выражается в ед/мл. Постоянная
величина , есть в справочниках.
• Степень чувствительности определяют после сравнения ТК и МИК.
Чувствит.м/о-если МИК<TK,нечувствит.м/о-если МИК>TK.
58.
59.
60.
Механизмы лекарственнойустойчивости бактерий.
1.Естественная(видовая,врожденная)-нет «мишени»для
действия АБ(у микоплазм-нет КС,могут быть адаптивные
ферменты как у E.coli-пенициллин)
2.Приобретенная:
• Разрушение АБ ферментами(бета-лактамаза действует на
пенициллины).95% s.aureus устойчивы к АБ.
• Изменение структуры чувствительных к действию АБ
«мишеней»в клетках:
а) изменение структуры пенициллин связывающих Б
(транспептидаз) -->повышается устойчивость к бета-лактамам.
б) изменение фермента ДНК-гиразы(участвует в
суперспирализации ДНК)
в) изменение РНК-полимеразы(увелич.уст-ть к рифампицину
г) изменение структуры белков рибосом устойчивость к
макролидам растет.
61.
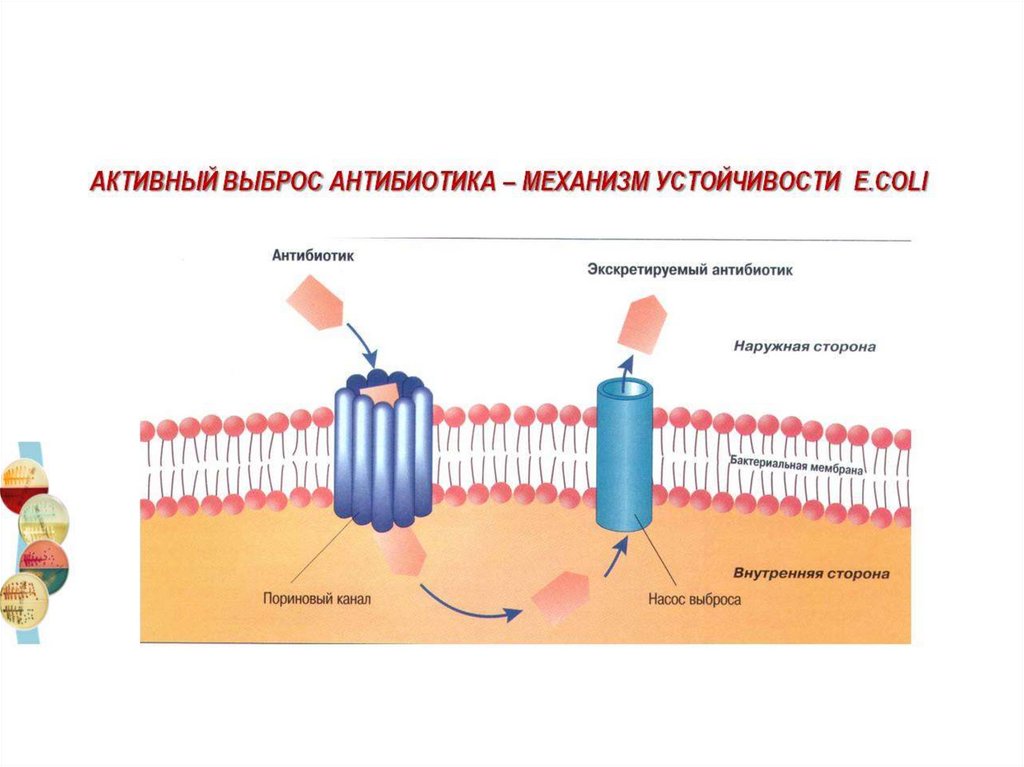
• Изменение транспорта через ЦПМ (уменьшаетсяпроницаемость , увеличивается элиминация АБ из клетки
+ изменение пориновых оснований , каналов у грам «-»м.о.)
• Изменение «мишени»в результате мутаций,
рекомбинаций,R- плазмид , транспозонов (прыгающие
гены, нуклеотидные ДНК-последовательности):
а)мутации в генах , контролирующих синтез
структурных компонентов(мишеней), транспортных
белков.
б)R- плазмиды - устойчивость к нескольким АБ. ,
транспозоны (к 1 АБ)
62.
63.
64.
65.
Устойчивость м.о.к действиюантимикробных средств.
• Известно два типа устойчивости микроорганизмов
к антимикробным средствам – естественная
(природная) и приобретенная.
• Естественная резистентность относится к видовым
признакам микроба. К основным механизмам
резистентности к действию антибактериальных
средств относят: способность к синтезу
инактивирующих ферментов (β-лактамазы
разрушают β-лактамное кольцо в молекулах
антибиотиков)и модификация мишеней, с
которыми взаимодействуют лекарственные
препараты.
66.
• Устойчивость не связанная с наследственнымисвойствами: 1) изменение метаболической
активности клеток-мишеней (большинство
антибактериальных средств эффективно подавляет
жизнедеятельность лишь активно растущих клеток;
2) уменьшение количества мишеней для лек.ср-в
(проводимая химиотерапия способна уменьшать
количество мишеней для действия препарата;
например, под действием пенициллина отдельные
бактерии способны трансформироваться в L-формы
лишенные клеточной стенки и поэтому
резистентные к действию антибиотиков с
подобным механизмом действия).
• Устойчивость, обусловленная изменениями
генома. Мутации приводят к изменениям
структурных белков (например, в структуре 30S
субъединиц рибосом) и ферментов (например ДНКзависимых РНК-полимераз). Также возможны
мутации в локусе гена, кодирующего
чувствительность к лек.средствам.
67.
• Селекция штаммов. На фоне применения антибактериального средства частопроисходит селекция штаммов, способствующая выживанию и последующему
доминированию в популяции бактерий с резистентностью к лекарств.ср.(ЛС).
Подобным путем ряд штаммов золотистого стафилококка вырабатывает
устойчивость к метициллину.
• Плазмиды резистентности обычно представлены внехромосомными
молекулами ДНК. Плазмиды могут включать один или более генов,
кодирующих синтез ферментов, осуществляющих инактивацию или
модификацию ЛС, а также опосредующих быструю элиминацию ЛС из клетки.
• Гены множественной устойчивости могут также кодировать транспозоны,
интегрированные в плазмиды. R-факторы могут придать устойчивость к
одному или нескольким ЛС одновременно. Плазмиды способны вызывать
состояние резистентности передачей соответствующих дочерних популяций
плазмид посредством бактериальной конъюгации или трансдукции.
Выделяют два основных пути преодоления устойчивости к
химиопрепаратам:
1.комбинированное применение препаратов с различными механизмами
действия .
2.использование ЛС, воздействующих на ранние этапы репродукции, что
резко снижает вероятность проявления резистентности.
68.
69.
Контрольные вопросы по теме:• 1.Ферменты-определение.Классификация ферментов(4
группы).Примеры с краткой характеристикой.
• 2. Ферменты агрессии, ферменты патогенности. Название , точка
приложения и на каких средах можно выявить.
• 3.Питательные среды, на которых можно выявить
сахаролитические , протеолитические, липолитические и
ферменты патогенности. Название среды, ее состав, что и как
выявляется.
• 4.АБ-определение.Классификация(6гр.) с пояснением .
• 5.Определение чувствительности к АБ.Методы-название и суть
метода .Учет.
• 6.Осложнения АБ-терапии. Название с пояснением(суть вопроса)и
примерами АБ.
• 7.Требования к химиотерапевтическим препаратам . Что такое
ХТИндекс, МИК(МПК), ТК? Определение, как рассчитываются?
• 8.Заслуги зарубежных и отечественных ученых в открытии и
изучении АБ.
• 9.Лекарственная устойчивость. Механизмы возникновения . Пути
преодоления.




































































 Медицина
Медицина Биология
Биология








