Похожие презентации:
Изучение влияния источника экспланта и питательной среды на антиоксидантный потенциал суспензионных клеточных культур
1.
Федеральное государственное автономное образовательное учреждениевысшего образования
Московский политехнический университет
Факультет Химической технологии и биотехнологии
Кафедра «ХимБиотех»
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ
по направлению подготовки
19.03.01 Биотехнология
РАБОТА
Изучение влияния источника экспланта и питательной среды на
антиоксидантный потенциал суспензионных клеточных культур
Maackia amurensis
Работа выполнена в Экспериментальной клинике - лаборатории биологически активных веществ
животного происхождения, ФНЦ пищевых систем им В.М. Горбатова
Научный руководитель от кафедры:
к.б.н., доцент Гайдашева Ирина Игоревна
Научный руководитель от лаборатории:
д.т.н., зав. лаб. Федулова Лилия Вячеславовна
Выполнила:
студентка гр. 201-541 Нестерова Мария Дмитриевна
Москва, 2024
2.
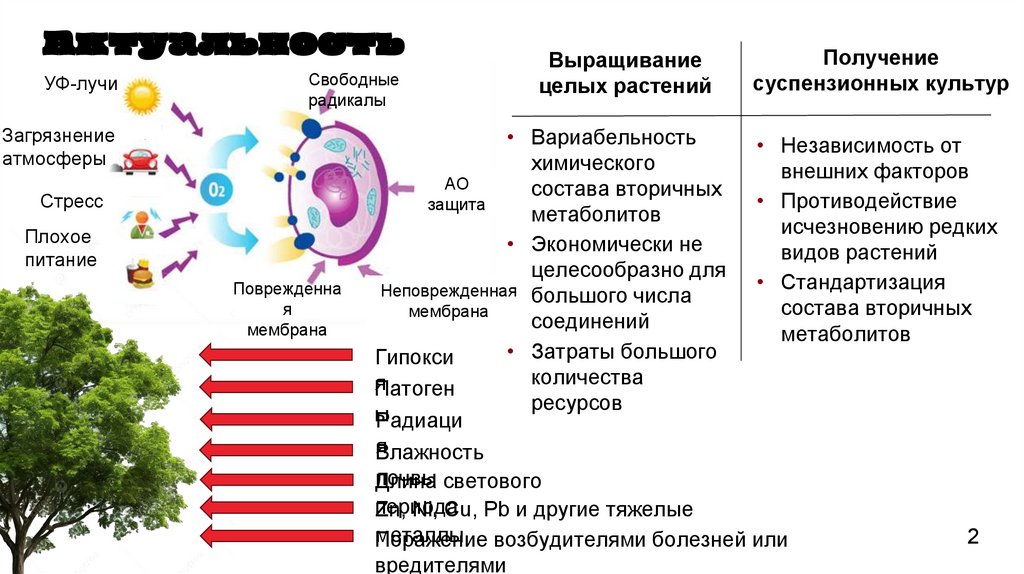
АктуальностьУФ-лучи
Свободные
радикалы
Загрязнение
атмосферы
Стресс
Плохое
питание
Поврежденна
я
мембрана
Выращивание
целых растений
Получение
суспензионных культур
• Вариабельность
• Независимость от
химического
внешних факторов
АО
состава вторичных
• Противодействие
защита
метаболитов
исчезновению редких
• Экономически не
видов растений
целесообразно для
• Стандартизация
Неповрежденная большого числа
состава вторичных
мембрана
соединений
метаболитов
• Затраты большого
Гипокси
количества
я
Патоген
ресурсов
ы
Радиаци
я
Влажность
почвы светового
Длина
периода
Zn, Ni, Cu, Pb и другие тяжелые
металлы возбудителями болезней или
2
Поражение
вредителями
3.
Цель и задачи исследованияЦель исследования - изучение влияния источника экспланта и питательных сред на
показатели антиоксидантного потенциала суспензионных культур растительных клеток
современными методами исследования на примере Maackia amurensis.
В рамках поставленной цели были обозначены следующие задачи:
-
получить суспензионные культуры клеток Maackia amurensis, инициированные из разных
эксплантов (лист и стебель);
-
подобрать и апробировать методы определения
суспензионных культур клеток Maackia amurensis;
-
на основании полученных данных оценить влияние источника экспланта и питательной
среды на антиоксидантный потенциал суспензионных культур клеток Maackia amurensis.
антиоксидантного
потенциала
3
4.
Процесс получениясуспензионной
культуры
Отбор
Интактное
растение
эксплантов
(лист и
стебель)
Перенос на
плотные
питательные
среды SH и
ДНК
Каллусогенез
Вакуумная
фильтрация,
высушивание
биомассы
Ступенчатая
экстракция
96 и 80%
этанолом
t = 40˚С, 1 сутки
до постоянного
веса
Перенос рыхлого
каллуса
на жидкие питательные
среды SH и ДНК
Темнота,
стерильные условия
t = 26˚С, 21 сутки
4
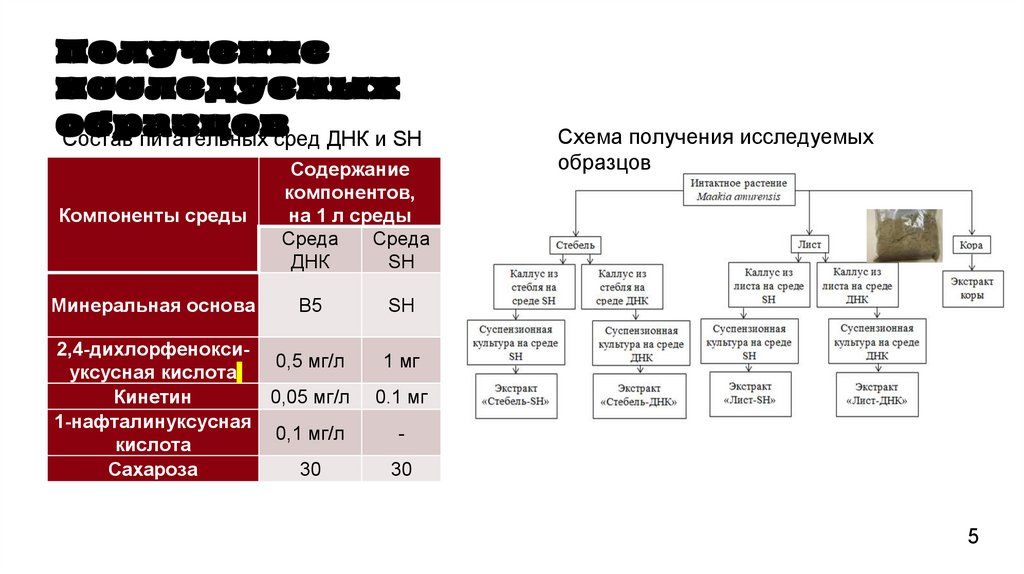
5.
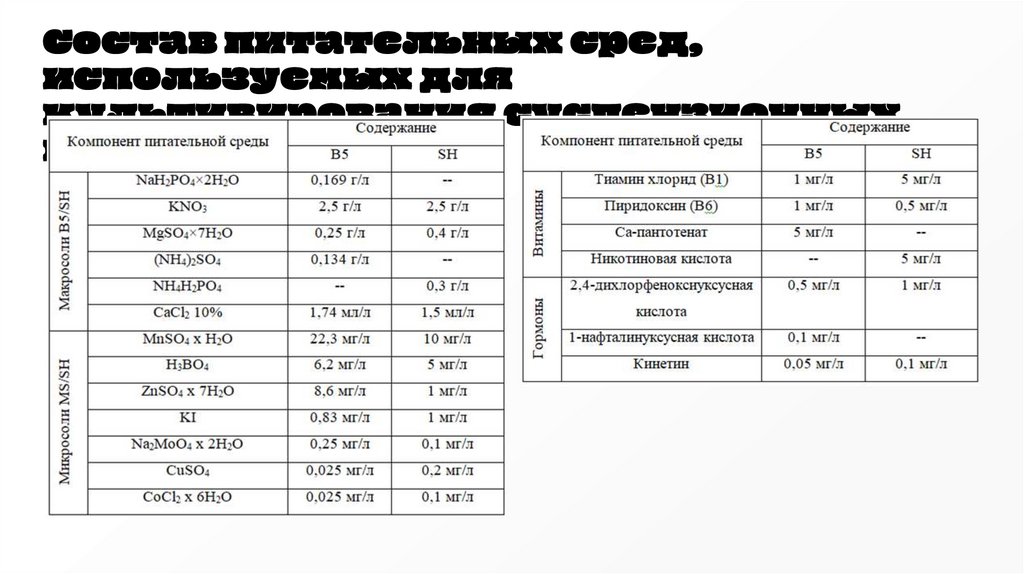
Получениеисследуемых
образцов
Состав питательных сред ДНК и SH
Компоненты среды
Минеральная основа
Содержание
компонентов,
на 1 л среды
Среда
Среда
ДНК
SH
В5
2,4-дихлорфенокси0,5 мг/л
уксусная кислота
Кинетин
0,05 мг/л
1-нафталинуксусная
0,1 мг/л
кислота
Сахароза
30
Схема получения исследуемых
образцов
SH
1 мг
0.1 мг
30
5
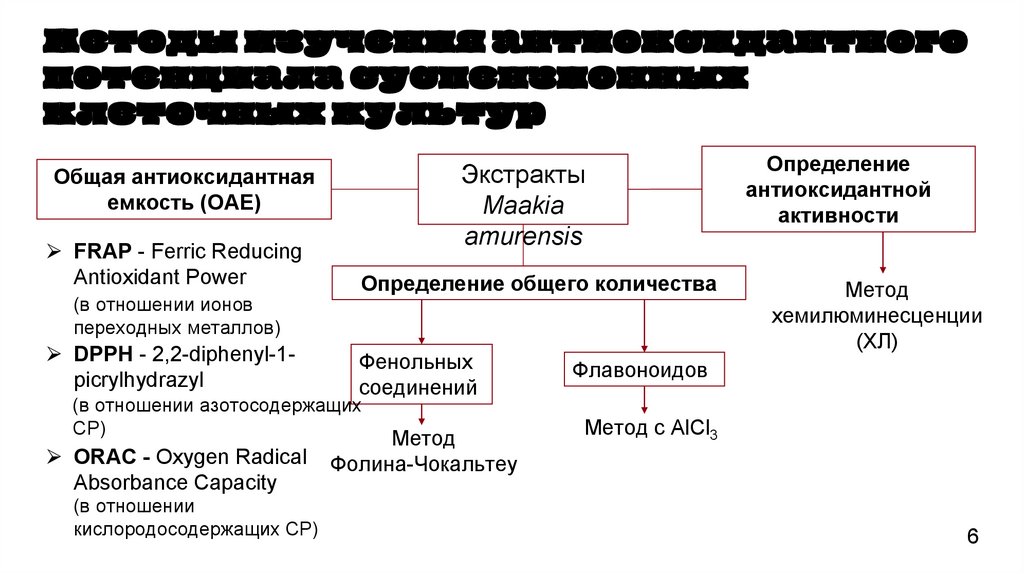
6.
Методы изучения антиоксидантногопотенциала суспензионных
клеточных культур
Экстракты
Maakia
amurensis
Общая антиоксидантная
емкость (ОАЕ)
⮚ FRAP - Ferric Reducing
Antioxidant Power
(в отношении ионов
переходных металлов)
⮚ DPPH - 2,2-diphenyl-1picrylhydrazyl
Определение общего количества
Фенольных
соединений
(в отношении азотосодержащих
СР)
⮚ ORAC - Oxygen Radical
Absorbance Capacity
(в отношении
кислородосодержащих СР)
Метод
Фолина-Чокальтеу
Определение
антиоксидантной
активности
Метод
хемилюминесценции
(ХЛ)
Флавоноидов
Метод с AlCl3
6
7.
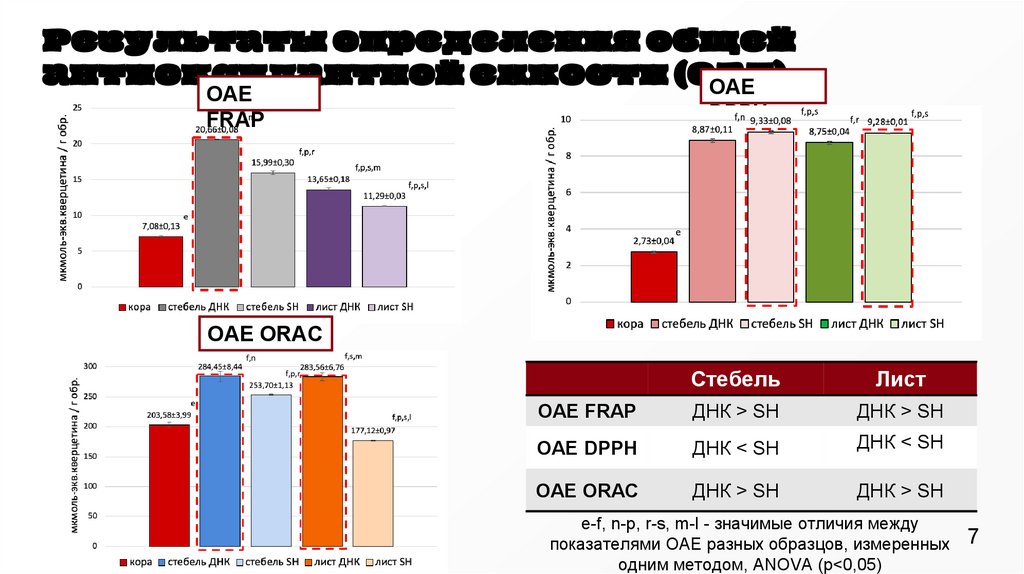
Результаты определения общейантиоксидантной емкости (ОАЕ)
ОАЕ
ОАЕ
FRAP
DPPH
ОАЕ ORAC
Стебель
Лист
OAE FRAP
ДНК > SH
ДНК > SH
OAE DPPH
ДНК < SH
ДНК < SH
OAE ORAC
ДНК > SH
ДНК > SH
e-f, n-p, r-s, m-l - значимые отличия между
показателями ОАЕ разных образцов, измеренных
одним методом, ANOVA (р<0,05)
7
8.
Результаты определения общегоколичества фенольных соединений и
флавоноидов
Фенольные соединения
Увеличение количества фенольных соединений в ряде:
лист-ДНК
< кора
< лист-SH
< стебель-SH
< стебель-ДНК
Федеральное
государственное
бюджетное научное
учреждение
ФЕДЕРАЛЬНЫЙ НАУЧНЫЙ ЦЕНТР ПИЩЕВЫХ СИСТЕМ ИМ. В.М.ГОРБАТОВА
Российской Академии Наук
Флавоноид
ы
e-f, n-p, r-s, m-l - значимые отличия между
показателями ОАЕ разных образцов, измеренных
одним методом, ANOVA (р<0,05)
https://www.vniimp.ru/
8
8
9.
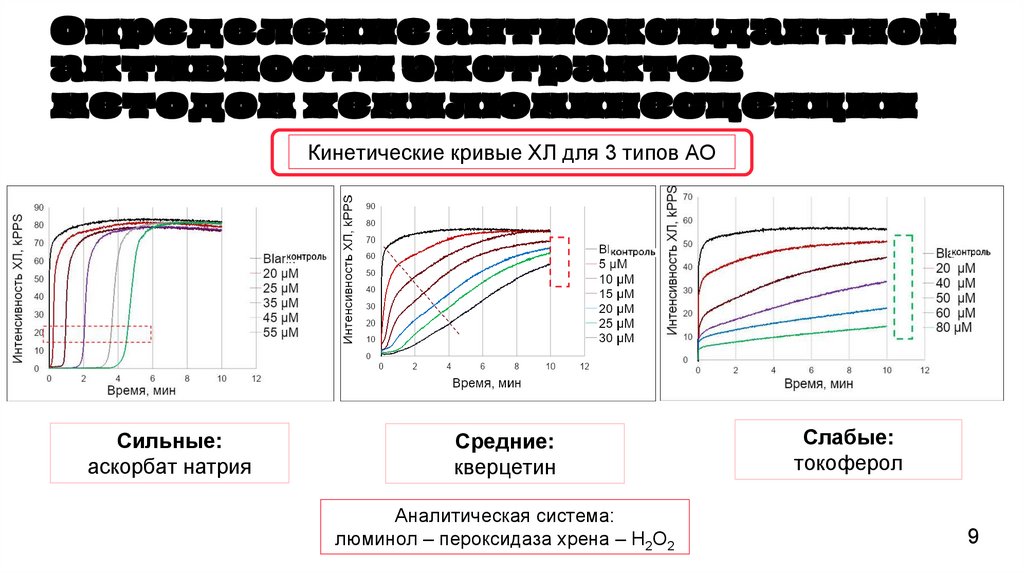
Определение антиоксидантнойактивности экстрактов
методом хемилюминесценции
Кинетические кривые ХЛ для 3 типов АО
Сильные:
аскорбат натрия
Средние:
кверцетин
Аналитическая система:
люминол – пероксидаза хрена – Н2О2
Слабые:
токоферол
9
10.
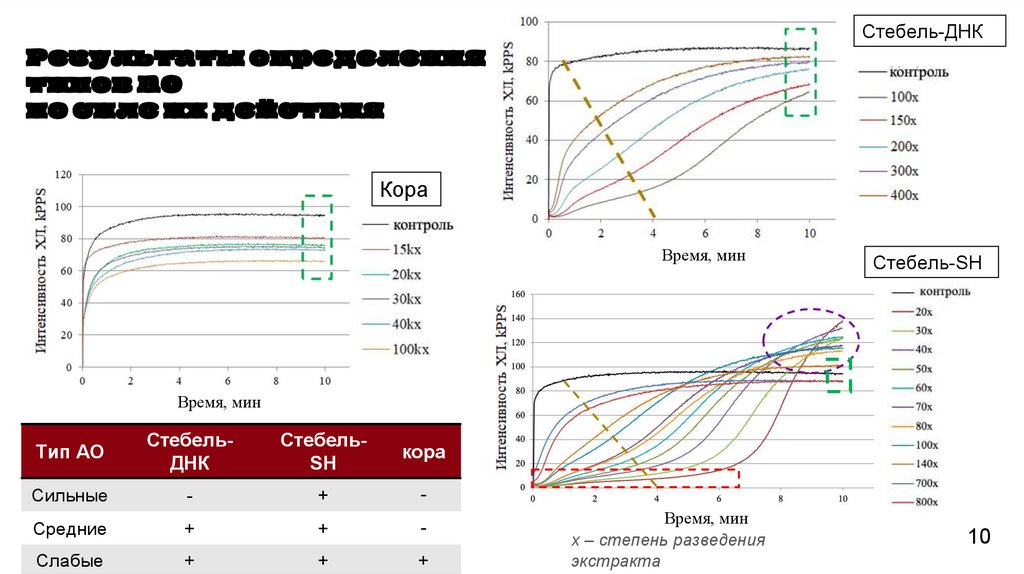
Стебель-ДНКРезультаты определения
типов АО
по силе их действия
контрол
ь
Кора
контрол
ь
Время, мин
Стебель-SH
контроль
Время, мин
Тип АО
СтебельДНК
СтебельSH
кора
Сильные
-
+
-
Средние
+
+
-
Слабые
+
+
+
Время, мин
х – степень разведения
экстракта
10
11.
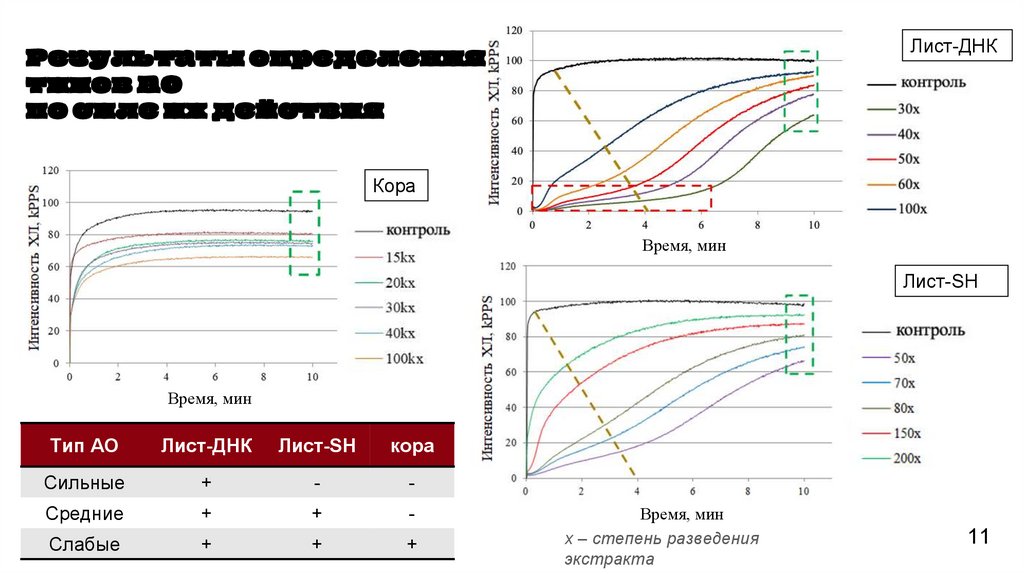
Лист-ДНКРезультаты определения
типов АО
по силе их действия
Кора
Время, мин
Лист-SH
Время, мин
Тип АО
Лист-ДНК
Лист-SH
кора
Сильные
+
-
-
Средние
+
+
-
Слабые
+
+
+
Время, мин
х – степень разведения
экстракта
11
12.
Выводы:
1. На
питательных средах SH и ДНК получены суспензионные культуры Maakia amurensis,
инициированные из каллуса листового и стеблевого происхождения. Подобраны и
апробированы методы оценки антиоксидантного потенциала суспензионных культур,
позволяющие учитывать различные механизмы действия антиоксидантов, и определять типы
антиоксидантов по силе их действия со свободными радикалами.
1. Использование среды SH для культивирования суспензионных культур Maakia amurensis
позволяло увеличить ОАЕ в отношении азотосодержащих СР (ОАЕ DPPH), а применение
среды ДНК приводило к увеличению ОАЕ ORAC в отношении кислородсодержащих СР в
независимости от экспланта. Для накопления антиоксидантов,
эффективных в
нейтрализации ионов переходных металлов (ОАЕ FRAP), целесообразно использовать
стебель в качестве экспланта и культивировать на среде ДНК.
1. Определено, что суспензионные культуры Maakia amurensis, инициированные из каллуса
стеблевого происхождения, содержат больше всего фенольных соединений, превышая кору
не менее чем в 1,2 раза (p<0,05). Использование среды SH для листа способствовало
накоплению существенно большего количества флавоноидов, превышая концентрацию в
остальных образцах более, чем в 1,7 раз (p<0,05).
Федеральное государственное бюджетное научное учреждение
ФЕДЕРАЛЬНЫЙ НАУЧНЫЙ ЦЕНТР ПИЩЕВЫХ СИСТЕМ ИМ. В.М.ГОРБАТОВА
Российской Академии Наук
https://www.vniimp.ru/
12
12
13.
Выводы:
4. Методом хемилюминесценции определено, что экстракт коры содержал только слабые
антиоксиданты, тогда как «Лист-ДНК» и «Стебель-SH» характеризовался наличием всех трех
типов антиоксидантов, а «Лист-SH» и «Стебель-ДНК» - только слабых и средних. Отмечено, что
суспензионная клеточная культура, инициированная из каллуса стеблевого происхождения на
среде SH, при высоких концентрациях проявляла прооксидантные свойства.
Полученные данные продемонстрировали, чти питательная среда существенно влияют на антиоксидантный потенциал
суспензионных
культур клеток растений. Установлено, что при подборе условий культивирования необходимо измерять
Заключе
антиоксидантный
потенциал всеми предложенными методами с учетом цели и отрасли дальнейшего использования
ние:
антиоксидантов.
Полученные данные продемонстрировали, что источник экспланта и питательная среда
существенно влияют на антиоксидантный потенциал суспензионных культур клеток растений.
Установлено, что при подборе условий культивирования необходимо измерять
антиоксидантный потенциал всеми предложенными методами с учетом цели и отрасли
дальнейшего использования антиоксидантов.
Федеральное государственное бюджетное научное учреждение
ФЕДЕРАЛЬНЫЙ НАУЧНЫЙ ЦЕНТР ПИЩЕВЫХ СИСТЕМ ИМ. В.М.ГОРБАТОВА
Российской Академии Наук
https://www.vniimp.ru/
13
13
14.
Благодарю завнимание!
Федеральное государственное бюджетное научное учреждение
ФЕДЕРАЛЬНЫЙ НАУЧНЫЙ ЦЕНТР ПИЩЕВЫХ СИСТЕМ ИМ. В.М.ГОРБАТОВА
Российской Академии Наук
https://www.vniimp.ru/
14
15.
Состав питательных сред,используемых для
культивирования суспензионных
культур клеток







 Биология
Биология








