Похожие презентации:
Эквивалент. Лекция 2
1.
Лекция 2Эквивалент
В 1905 г. А. Эйнштейн установил, что между массой и
энергией существует взаимосвязь
Е = mc2,
где Е – энергия тела, Дж; m – масса, кг; c – скорость света (с
= =2,997925 108м/с). Однако не совсем правильно было бы
считать, что масса непосредственно превращается в
энергию.
Для химических процессов изменением массы можно
пренебречь. Существуют два важных для химии следствия,
которые исторически получили названия закона сохранения
массы и закона сохранения энергии. Однако, строго говоря,
выполняются эти законы приближенно. Для химических
процессов они формулируются следующим образом.
2.
Закон сохранения массы. Массы веществ, вступающих вреакцию, равны массе веществ, образующихся в результате
реакции.
Благодаря опытам М. В. Ломоносова в 1748 – 1756 гг. химия
перешла от науки качественной к количественной. В
производстве на этой основе ведутся многие расчеты
материальных балансов в химической технологии.
3.
Закон сохранения энергии. При любых взаимодействиях,имеющих место в изолированной системе, энергия этой системы
остается постоянной и возможны лишь переходы из одного вида
энергии в другой.
Практически это означает, что если в ходе реакции энергия
выделяется или поглощается, то запас энергии в продуктах
реакции по сравнению с запасом ее в исходных веществах будет
меньше или больше соответственно. Запас энергии вещества в
химии принято называть теплосодержанием (энтальпией), а
выделяющуюся или поглощающуюся энергию – теплом.
Благодаря закону сохранения существует целая наука, которая
вместе с другими явлениями изучает тепловые эффекты
химических реакций, называется химической термодинамикой. В
производстве на основе данного закона составляются и
рассчитываются тепловые балансы.
4.
Закон постоянства состава. Любое химическииндивидуальное соединение имеет один и тот же
количественный состав независимо от способа его
получения (Ж. Пруст, 1801 – 1808 гг.).
Это значит, что соотношения между массами элементов,
входящих в состав соединения, постоянны. Закон всегда
выполнятся для газообразных и жидких веществ.
Например, для аммиака NH3 независимо от способа его
получения (прямой синтез из простых веществ, разложение
аммонийных солей) состав его молекулы всегда постоянен
– на один атом азота приходится три атома водорода. Для
вещества, находящегося в твердом состоянии, строго
говоря, закон не справедлив.
5.
Закон сохранения отношений. Если два элемента образуют друг сдругом несколько химических соединений, то весовые количества одного
элемента, приходящиеся в этих соединениях на одну и ту же массу другого,
относятся между собой как небольшие целые числа (Дж. Дальтон, 1808 г.)
Например, азот образует оксиды N2O, NO, N2O3, NO2 и N2O5.
Рассчитаем массовую долю кислорода, которая приходится на одну
массовую часть азота (ω(O)/ω(N)) в каждом соединении (табл. 5.1).
Таблица 5.1
Массовая доля кислорода, азота и их соотношении для оксидов
азота
Состав
Массовая доля
ω(N), %
Массовая доля
ω(O), %
Отношение
ω(O)/ω(N)
N2O
63,63
Соединение, формула
NO
N2O3
NO2
46,66
36,84
30,43
N2O5
25,92
36,37
53,34
63,16
69,57
74,08
0,57
1
1,14
2
1,71
3
2,28
4
2,85
5
6.
Закон объемных соотношений. При одинаковых условиях объемывступающих в реакцию газов относятся друг к другу и к объемам
образующихся газообразных продуктов реакции как небольшие
целые числа (Ж. Гей-Люссак, 1805 г.).
Например, при взаимодействии 2 объемов водорода и 1 объема
кислорода образуются 2 объема водяного пара. Эти числа
совпадают со стехиометрическими коэффициентами в уравнении
реакции. На этом законе основаны методы газового анализа,
применяемого в промышленности
Закон Авогадро. В равных объемах любых газов, взятых при одной
и той же температуре и при одинаковом давлении, содержится одно
и то же число молекул (А. Авогадро, 1811 г.).
Закон Авогадро позволил сделать выводы о числе атомов в
молекулах газов, например таких, как водород, хлор, кислород, азот.
Закон применим и для заряженных частиц в газовой фазе
(электронов, ионов), если их концентрация невелика, а
воздействием магнитных и электрических полей можно пренебречь.
7.
Основные химические величины• Количество вещества n, моль
• Молярная масса М, г/моль
• Молярный объем газа V, л/моль
• Постоянная Авогадро N, моль-1
• Эквивалент вещества Э
• Фактор эквивалентности fэкв
• Молярная масса эквивалента
(эквивалентная масса), г/моль
• Эквивалентный объем (эквивалентный
объем вещества) Vэкв, л/моль
8.
Лекция 2Эквивалент
Химический эквивалент (Э) – реальная или условная
частица вещества, которая может присоединять,
замещать в кислотно-основных реакциях один ион
водорода (или другого одновалентного металла), а в
окислительно-восстановительных
реакциях
–
присоединять или высвобождать один электрон.
9.
Фактор эквивалентности (fэ) – число,обозначающее какая доля реальной частицы
вещества Х эквивалентна одному иону
водорода в кислотно-основной реакции или
одному электрону в реакции окислениявосстановления.
1
Для простых веществ fэ(Х) =
В
где В – валентность элемента.
10.
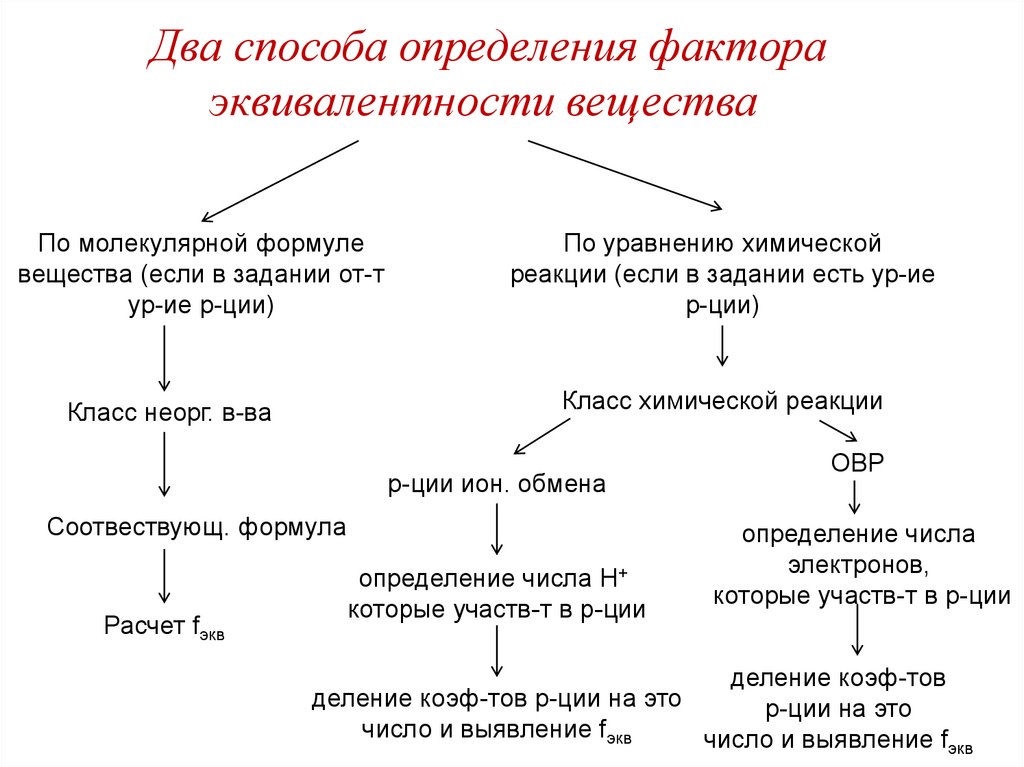
Два способа определения фактораэквивалентности вещества
По молекулярной формуле
вещества (если в задании от-т
ур-ие р-ции)
По уравнению химической
реакции (если в задании есть ур-ие
р-ции)
Класс химической реакции
Класс неорг. в-ва
р-ции ион. обмена
Соотвествующ. формула
Расчет fэкв
определение числа Н+
которые участв-т в р-ции
ОВР
определение числа
электронов,
которые участв-т в р-ции
деление коэф-тов
деление коэф-тов р-ции на это
р-ции на это
число и выявление fэкв
число и выявление fэкв
11.
Пример.Определите фактор эквивалентности
для магния.
1
1
fэ(Mg) =
=
В
2
Пример.
Определите фактор эквивалентности
6+
для серы в MgS O4.
1
1
fэ(S) =
=
В
6
12.
Молярная масса эквивалента вещества(Мэ(Х))
–
масса
одного
моля
эквивалента этого вещества, равная
произведению
фактора
эквивалентности на молярную массу
вещества Х.
Мэ(Х) = fэ(Х)М(Х)
[кг/моль, г/моль]
13.
Пример. Определите молярную массу3+
эквивалента хрома в Cr 2S3.
1
fэ(Сr) =
В
1
=
3
1
Мэ(Cr) =
52 = 17,3 г/моль
3
14.
Если одно из реагирующих веществ илипродуктов реакции (участников реакции) - газ,
то для него вводится понятие эквивалентный
объем вещества (Vэ(Х)).
Рассчитывается на основании закона Авогадро:
1 моль газа массой М(Х) занимает объем 22,4 л
1 эквивалент газа массой Мэ(Х) занимает объем Vэ(Х)
22,4 М э Х
Отсюда Vэ(Х) =
[л/моль]
М(Х)
где Мэ(Х) – молярная масса эквивалента
вещества, М(Х) – молярная масса вещества.
15.
Например, при нормальных условиях(P=760 мм.рт.ст., t = 0 оС) 1 моль эквивалентов
водорода занимает объем, равный
22,4 М э Х
Vэ(Х) =
М(Х)
1
fэ(H) =
= 1 Мэ(H) = 1 1 = 1 г/моль
В
М(H2) = 2 1 = 2 г/моль
22,4 1
= 11,2 л/моль
Vэ(H2) =
2
16.
Например, при нормальных условиях 1 мольэквивалентов кислорода занимает объем,
равный
22,4 М Х
Vэ(Х) =
э
М(Х)
1
1
1
Мэ(О) = 16 = 8 г/моль
fэ(О) =
=
В
2
2
М(О2) = 2 16 = 32 г/моль
22,4 8
= 5,6 л/моль
Vэ(О2) =
32
17.
Закон эквивалентовВ химических реакциях вещества, взаимодействующие
между собой, и образующиеся продукты реакции имеют
равные эквивалентные количества.
а А+b B=c C+d D
nэ(А)=nэ(B)=nэ(C)=nэ(D)
Эквивалентное количество вещества nэ(Х) – количество
одного моля эквивалента вещества:
nэ ( X )
m( X )
n
(
X
)
Так как
M (Х )
, то
m( X )
V (X )
M э ( Х ) Vэ ( X )
nэ ( X )
m( X )
n( X )
M ( Х ) fэ ( X ) fэ ( X )
18.
Закон эквивалентов – массы реагирующих веществпропорциональны молярным массам эквивалентов этих веществ
(для твердых и жидких веществ), а объемы – эквивалентным
объемам (для газообразных веществ).




















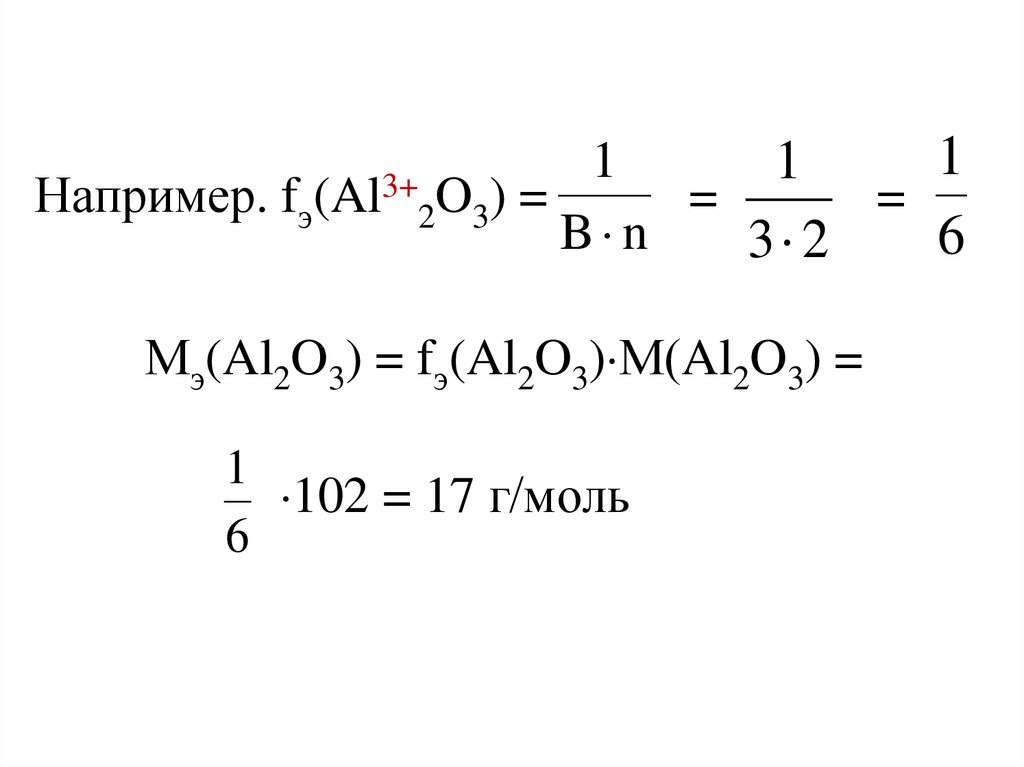

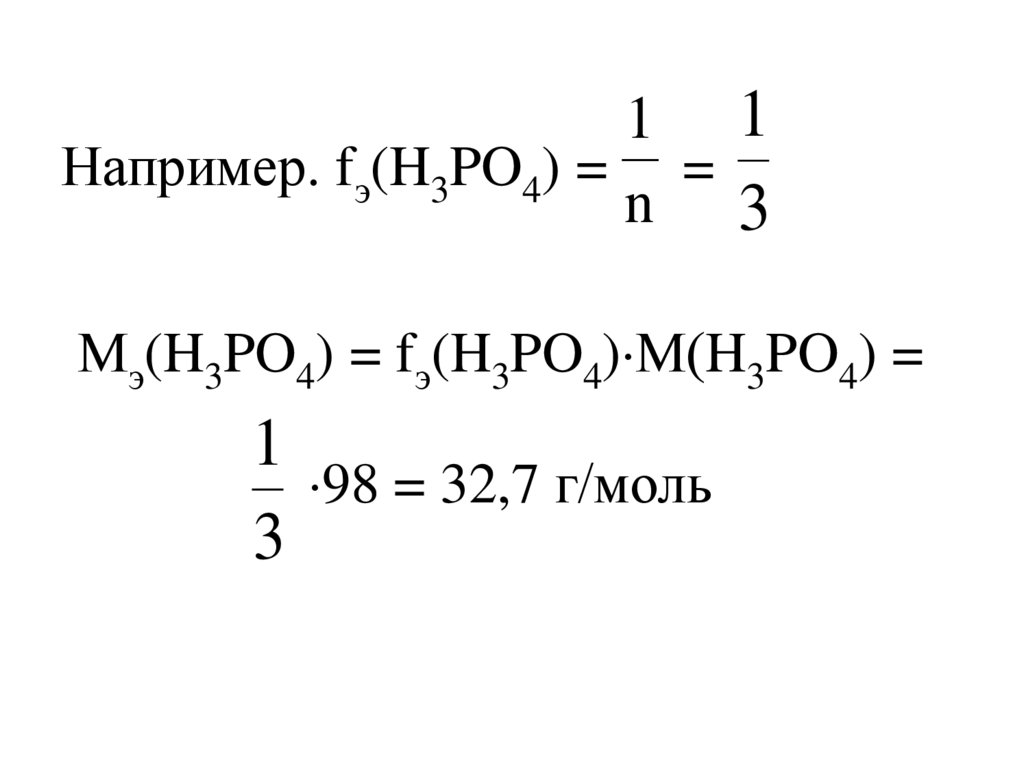



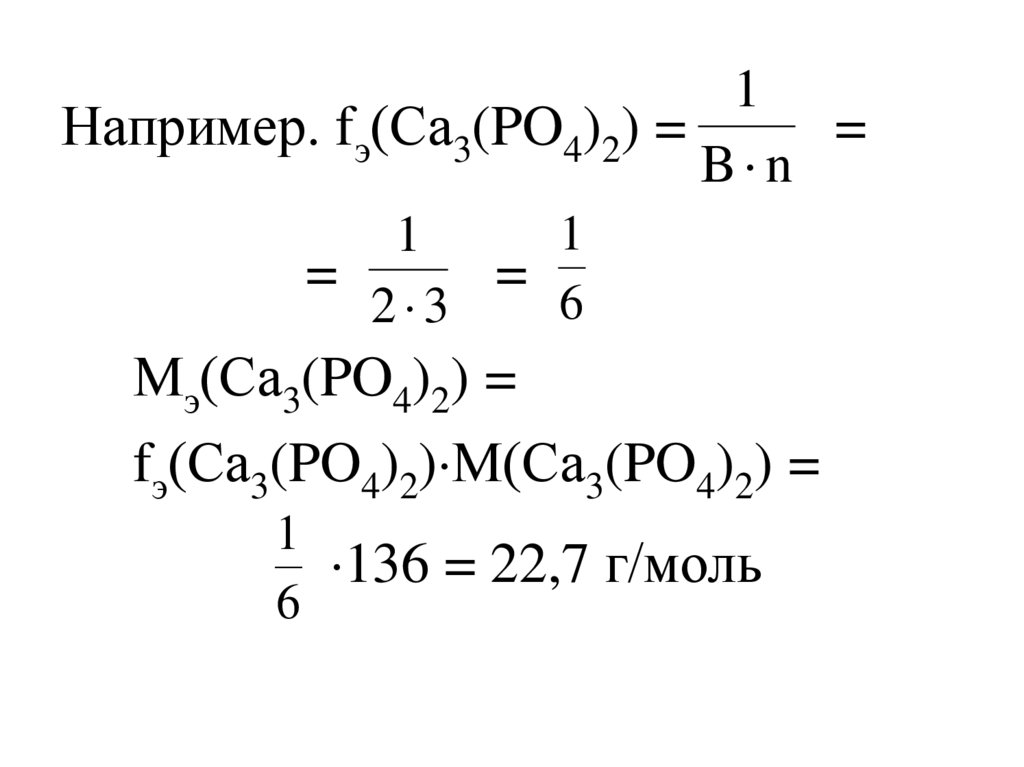




 Химия
Химия








