Похожие презентации:
Оксиды. Определение
1.
Оксиды2.
ОпределениеОксиды-это сложные вещество состоящий
из двух элементом один из которых
кислород которому всегда равен -2.
3.
Общая формулаОбщая формула оксидов: ЭхОу
Кислород имеет второе по величине
значение электроотрицательности (после
фтора), поэтому большинство соединений
химических
элементов
с
кислородом
являются оксидами.
4.
Строение оксидовМолекулярное
-Имеют оксиды
неметаллических
элементов.
-Твердые вещества с
высокой температурой
плавления и кипения. В
большинстве случаев они
не растворяются в воде.
Немолекулярное
-Имеют оксиды
металлических элементов.
-Температуры плавления и
кипения небольшие. Оксиды
неметаллических элементов
встречаются в твердом,
жидком и газообразном
состояниях.
5.
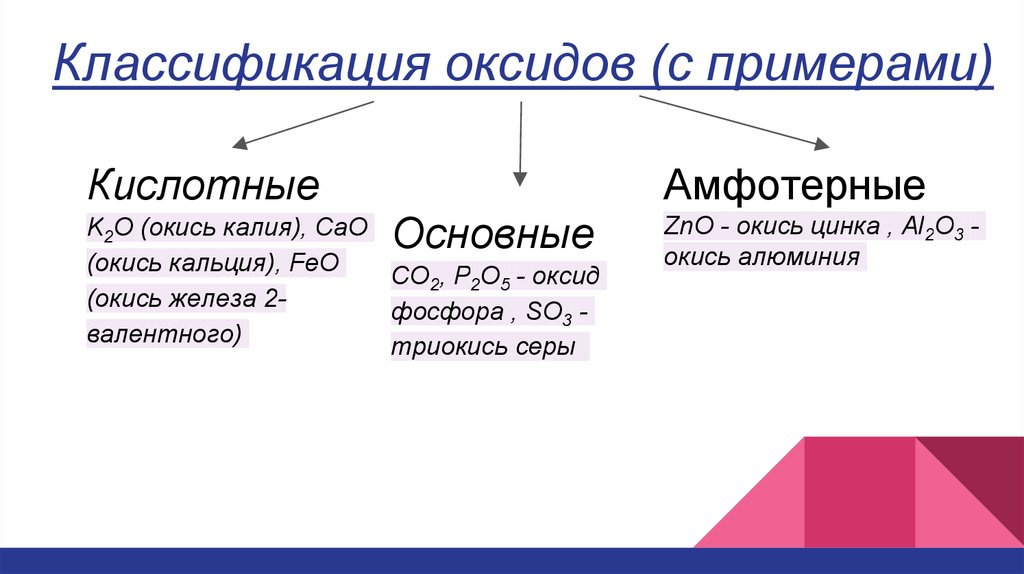
Классификация оксидов (с примерами)Кислотные
Амфотерные
Основные
K2O (окись калия), CaO
(окись кальция), FeO
CO2, P2O5 - оксид
(окись железа 2фосфора , SO3 валентного)
триокись серы
ZnO - окись цинка , Al2O3 окись алюминия
6.
Хим.свойства
основных
оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой,
образуя основания:
Na2O + H2O → 2NaOH.
2.
Взаимодействуют
соответствующие соли
с
кислотными
оксидами,
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
образуя
7.
Хим.свойства кислотных оксидов1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O → H2SO4.
Но не все кислотные оксиды непосредственно реагируют с водой
(SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
8.
Хим. свойства амфотерных оксидов1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + H2O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в
результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + H2O.
При взаимодействии оксида цинка с раствором щелочи (того же
NaOH) протекает другая реакция:








 Химия
Химия








