Похожие презентации:
Окислительно-восстановительная двойственность соединений
1.
KNO3 + Mg + H2O NH3 + Mg(OH)2 + KOHKNO3 + Zn + KOH + H2O комплекс + газ с
резким запахом
KHSO4 (конц) + Mg → MgSO4 + H2S + H2O + K2SO4
KHSO4 (разб) + Mg K2SO4 + MgSO4 + H2
2.
Окислительно-восстановительнаядвойственность соединений
3.
Пероксиды (H2O2-1, Na2O2-1)Восстановитель
Окислитель
KMnO4 + H2O2 +
H2SO4
KMnO4 + H2O2 + HCl
KMnO4 + H2O2
(нейтр)
Na2O2 + CO2
Fe(OH)2 +H2O2
Na2O2 + CO
K2O2 + SO2
NH3 + H2O2
NH3 + Na2O2
PbS + H2O2
FeSO4 + H2SO4 + H2O2
MgBr2 + H2O2 + H2SO4
Fe(OH)2 + H2O2 + H2SO4
4.
MnO2 / PbO2Восстановитель
Окислитель
MnO2 + KNO3 + KOH
K2MnO4 + KNO2 +
H2O
MnO2 + HCl
5.
Нитриты как восстановителиKNO2 + KMnO4 + H2SO4
NaNO2 + CrO3 + H2SO4
6.
Нитриты как окислителиа) KNO2 + KI + H2SO4 … + … + NO + … ;
б) KNO2 + Na2S + H2SO4
в) NH4Cl + KNO2
г) Zn + KNO2 + KOH + H2O
7.
Гипохлориты, хлораты и перхлораты –сильные окислители!
• KClO + Cr2O3 + KOH … + … + …
• KClO3 + FeO + HCl … + FeCl3 + …
• KClO3 + H2S
• KClO4 + HI
• Ba(ClO3)2 + HBr
• Ca(BrO3)2 + HI
• P + HClO3 + H2O (две кислоты)
8.
Cr+3 окисляется в щелочной среде до MeCrO4!(в хромате будет металл из щелочи)
Cr(OH)3 + Br2 + KOH
Cr(OH)3 + H2O2 + NaOH
Cr2O3 + Cl2 + KOH
Cr2O3 + NaNO3 + KOH
K3[Cr(OH)6] + Br2 + KOH
NaCrO2 + KClO + KOH
Cr2O3 + KClO3 + Na2CO3 →
9.
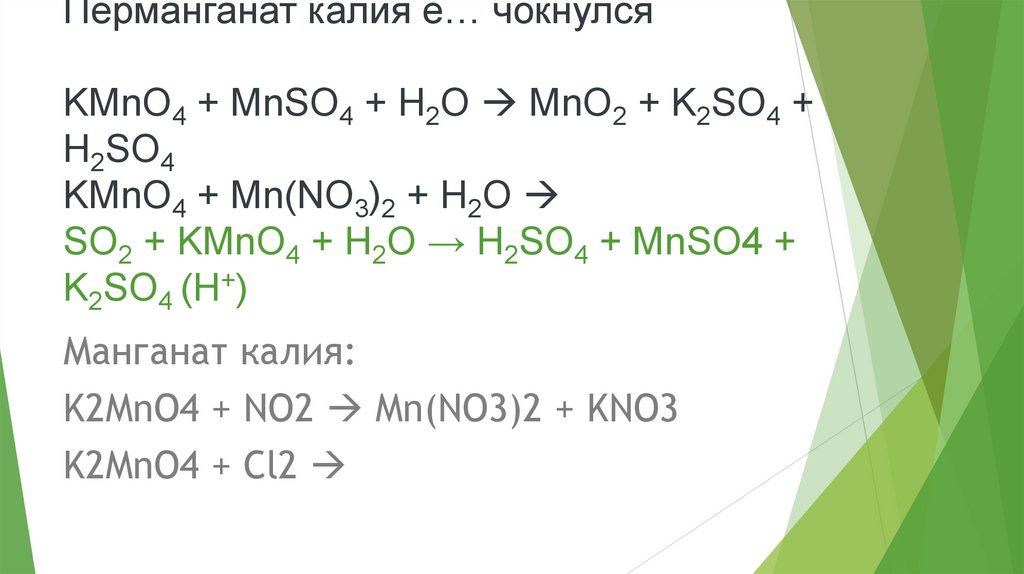
Перманганат калия е… чокнулсяKMnO4 + MnSO4 + H2O MnO2 + K2SO4 +
H2SO4
KMnO4 + Mn(NO3)2 + H2O
SO2 + KMnO4 + H2O → H2SO4 + MnSO4 +
K2SO4 (H+)
Манганат калия:
K2MnO4 + NO2 Mn(NO3)2 + KNO3
K2MnO4 + Cl2








 Химия
Химия








