Похожие презентации:
Гидролиз солей
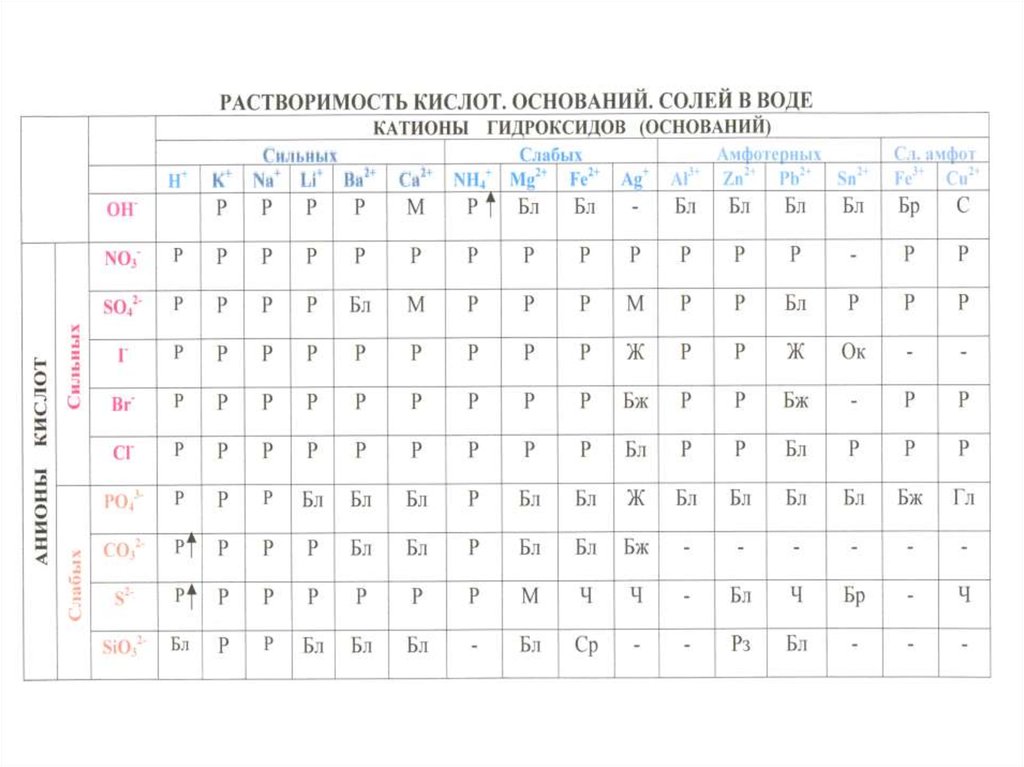
1. ГИДРОЛИЗ СОЛЕЙ
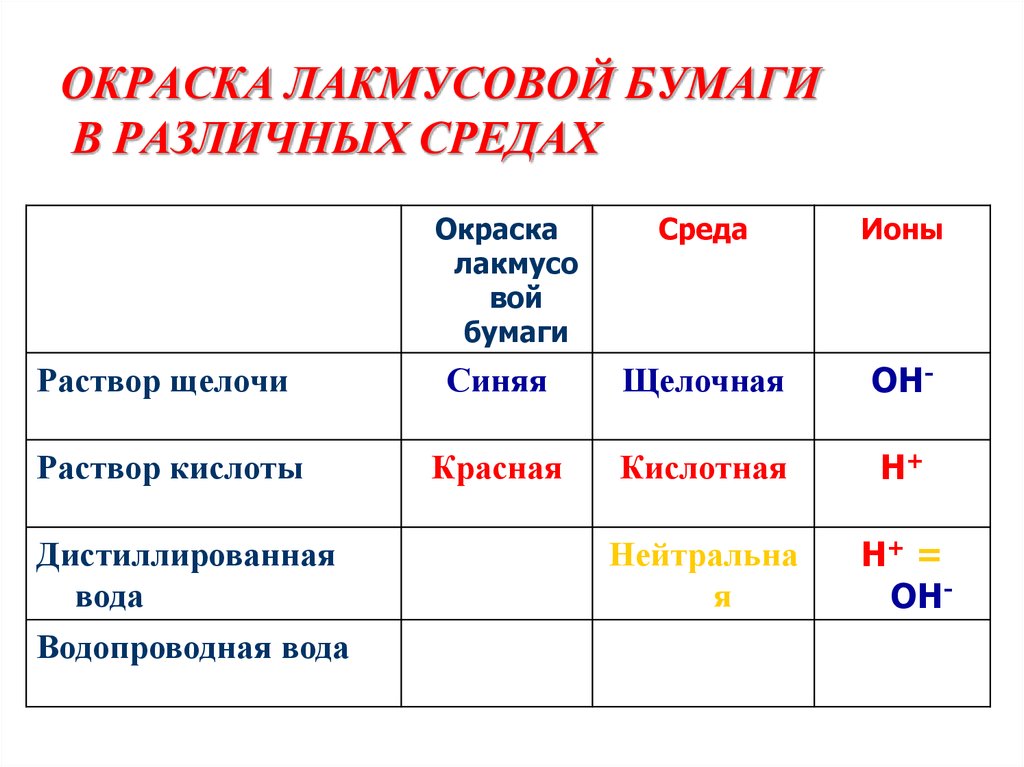
2.
3. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
Окраскалакмусо
вой
бумаги
Среда
Ионы
Раствор щелочи
Синяя
Щелочная
ОН-
Раствор кислоты
Красная
Кислотная
Н+
Бесцветная
Нейтральна
я
Н+ =
ОН-
Дистиллированная
вода
Водопроводная вода
4. Гидролиз солей
определение понятия «гидролиз»Цели:
• научиться
объяснять
химические
протекающие
в водных растворах солей
процессы,
• записывать уравнения реакций гидролиза
• предсказывать и объяснять изменение кислотности
среды
и образование кислых и основных солей в
этом процессе
• познакомиться с ролью гидролиза солей
в природе,
хозяйственной деятельности и повседневной жизни
человека.
5. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
«ГИДРОЛИЗ» от греческого«гидро» - вода
«лизис» - разложение
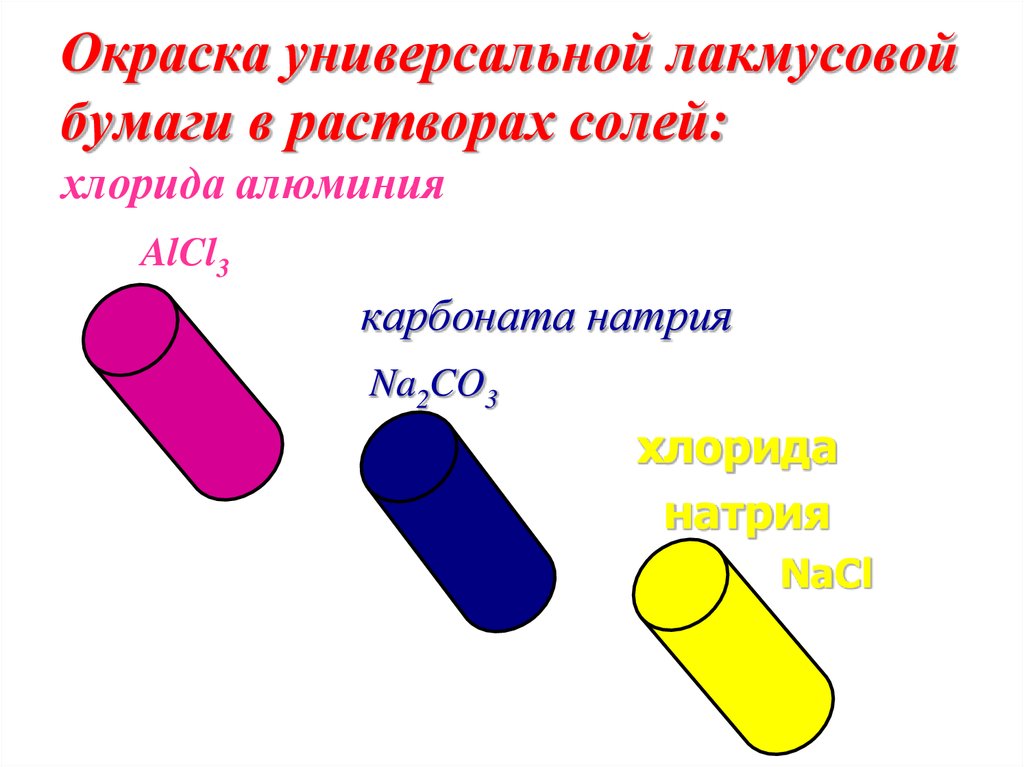
6. Окраска универсальной лакмусовой бумаги в растворах солей:
хлорида алюминияAlCl3
карбоната натрия
Na2CO3
хлорида
натрия
NaCl
7. Механизм гидролиза хлорида алюминия
1) Диссоциация молекул воды:H2O
H+ + OH-
2) Диссоциация молекул соли (под действием молекул воды):
AlCl3
Al3+ + 3Cl-
3) Гидролиз по катиону слабого основания
1 ступень:
Al3+ +3Cl- +HOH
Al (OH)3:
Al OH2+ +H+ + 3Clкислая
среда
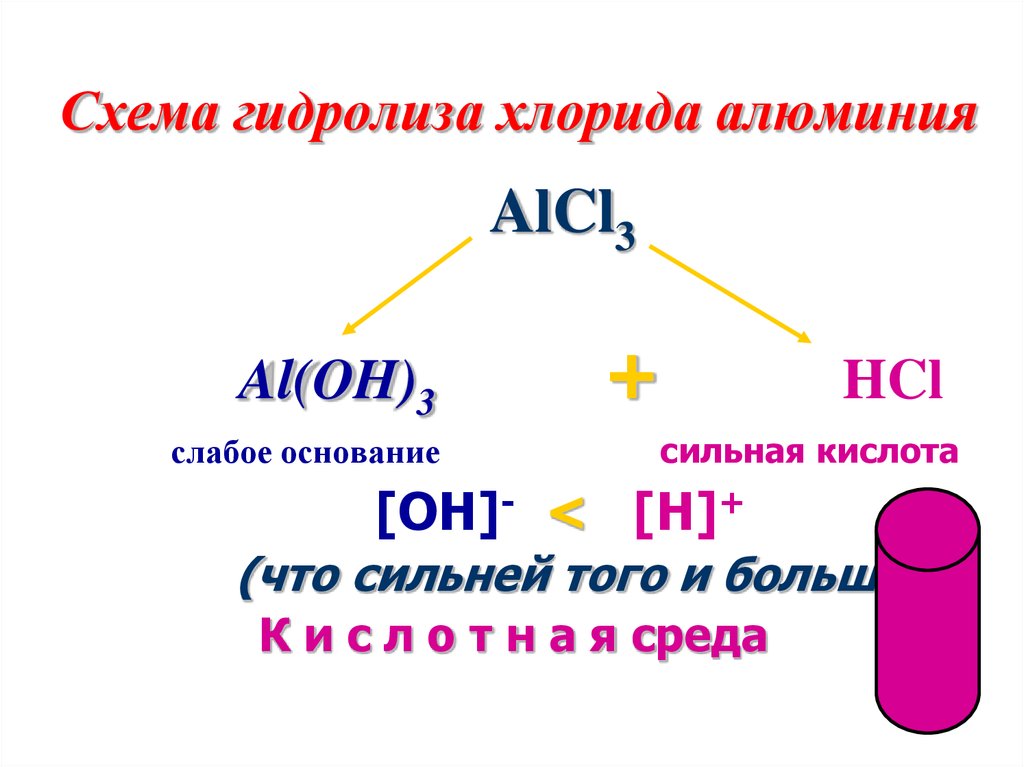
8. Схема гидролиза хлорида алюминия
AlCl3Al(OH)3
слабое основание
[OH]- <
+
HCl
сильная кислота
[H]+
(что сильней того и больше!)
К и с л о т н а я среда
9. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
• Определить состав соли, то есть указать, каким по силеоснованием и какой по силе кислотой образована
данная соль.
Взять ион слабого электролита и написать уравнение
взаимодействия его с составными частями одной
молекулы воды; в результате получить краткое ионное
уравнение гидролиза.
• Написать на основании краткого ионного уравнения
молекулярное уравнение.
Исходные вещества известны – соль и вода. Продукты
гидролиза составить, связывая образовавшиеся ионы с
теми ионами соли, которые не участвуют в реакции
гидролиза.
10. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной обменной реакции является основная соль.
Al3+ + HOHAlCl3 + H2O
AlOH2+ + H+
AlOHCl2 + HCl
Одним из продуктов данной обменной
реакции является основная соль.
Вывод:
Раствор соли, образованной
катионом слабого основания имеет
кислую реакцию, так как в растворе
избыток протонов.
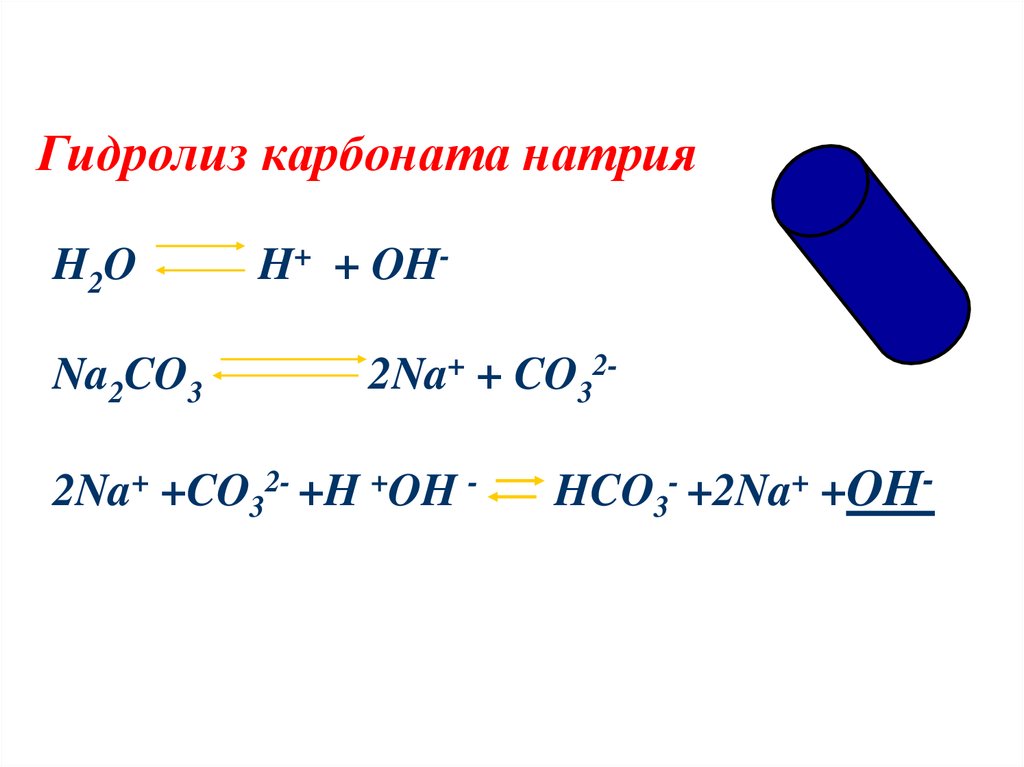
11. Гидролиз карбоната натрия
H2ONa2CO3
H+ + OH2Na+ + CO32-
2Na+ +CO32- +H +OH -
HCO3- +2Na+ +OH-
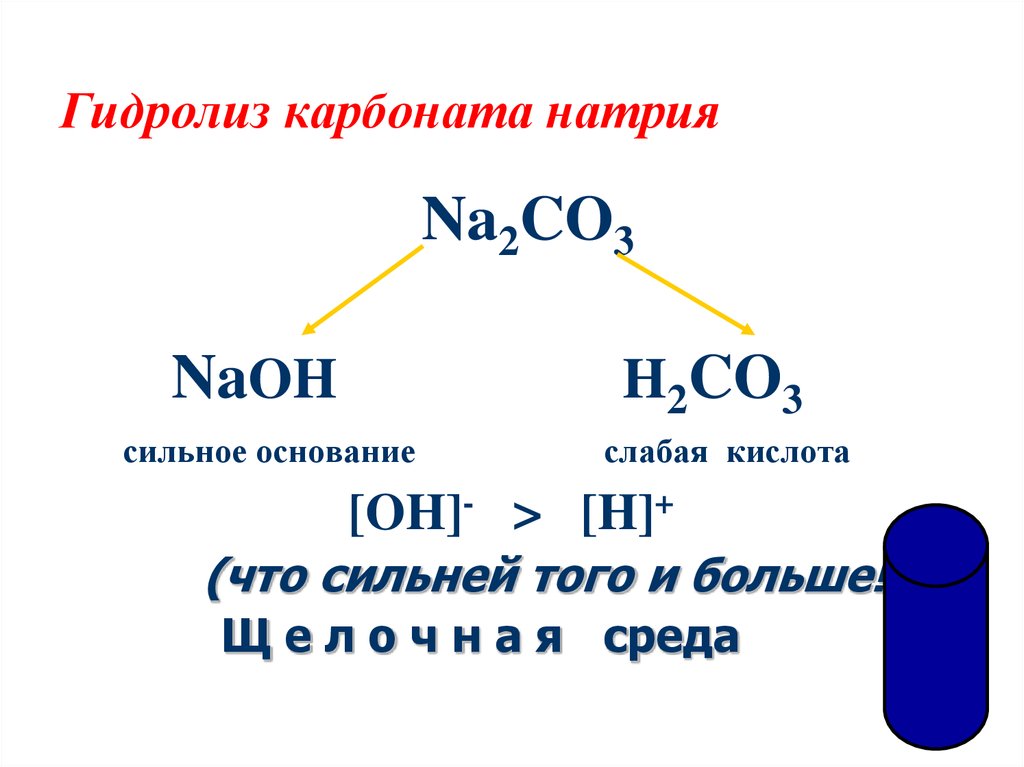
12. Гидролиз карбоната натрия
Na2CO3NaOH
H2CO3
сильное основание
[OH]- >
слабая кислота
[H]+
(что сильней того и больше!)
Щ е л о ч н а я среда
13. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА солей ПО АНИОНУ СЛАБОЙ КИСЛОТЫ
СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙсолей
ГИДРОЛИЗА
ПО АНИОНУ СЛАБОЙ КИСЛОТЫ
• Определить состав соли, то есть указать, каким по силе
основанием и какой по силе кислотой образована данная
соль.
• Взять ион слабого электролита и написать уравнение
взаимодействия его с составными частями одной молекулы
воды; в результате получить краткое ионное уравнение
гидролиза.
• Написать на основании краткого ионного уравнения
молекулярное уравнение.
Исходные вещества известны – соль и вода. Продукты
гидролиза составить, связывая образовавшиеся ионы с теми
ионами соли, которые не участвуют в реакции гидролиза.
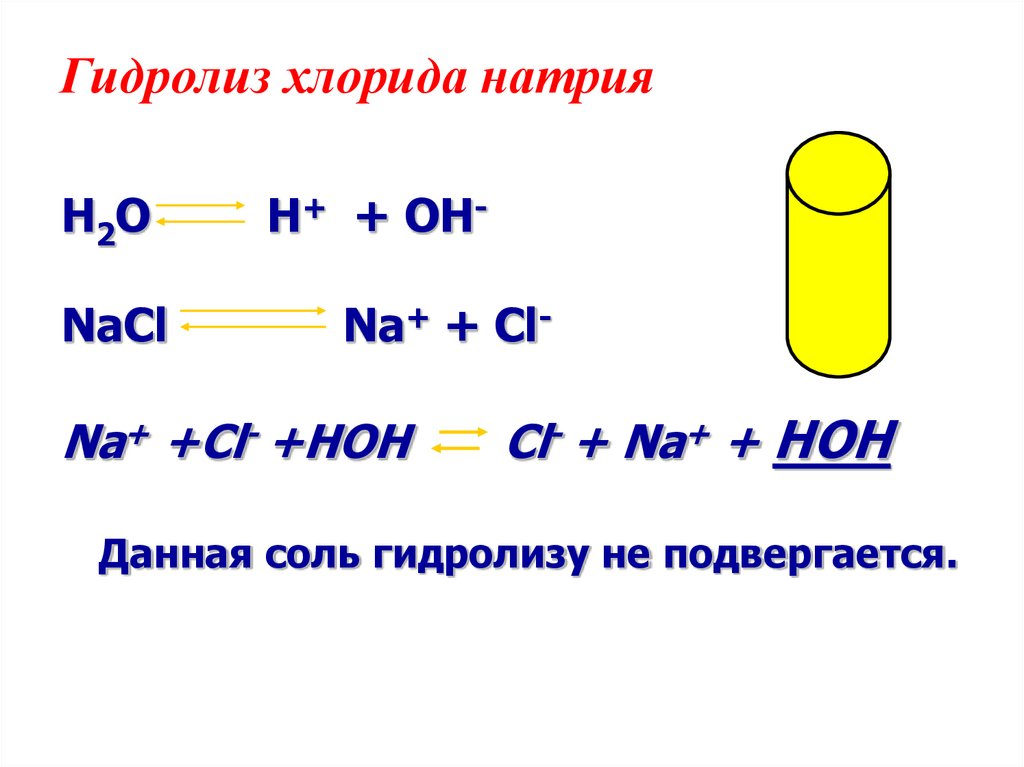
14. Гидролиз хлорида натрия
H2ONaСl
H+ + OHNa+ + Cl-
Na+ +Cl- +HOH
Cl- + Na+ + HOH
Данная соль гидролизу не подвергается.
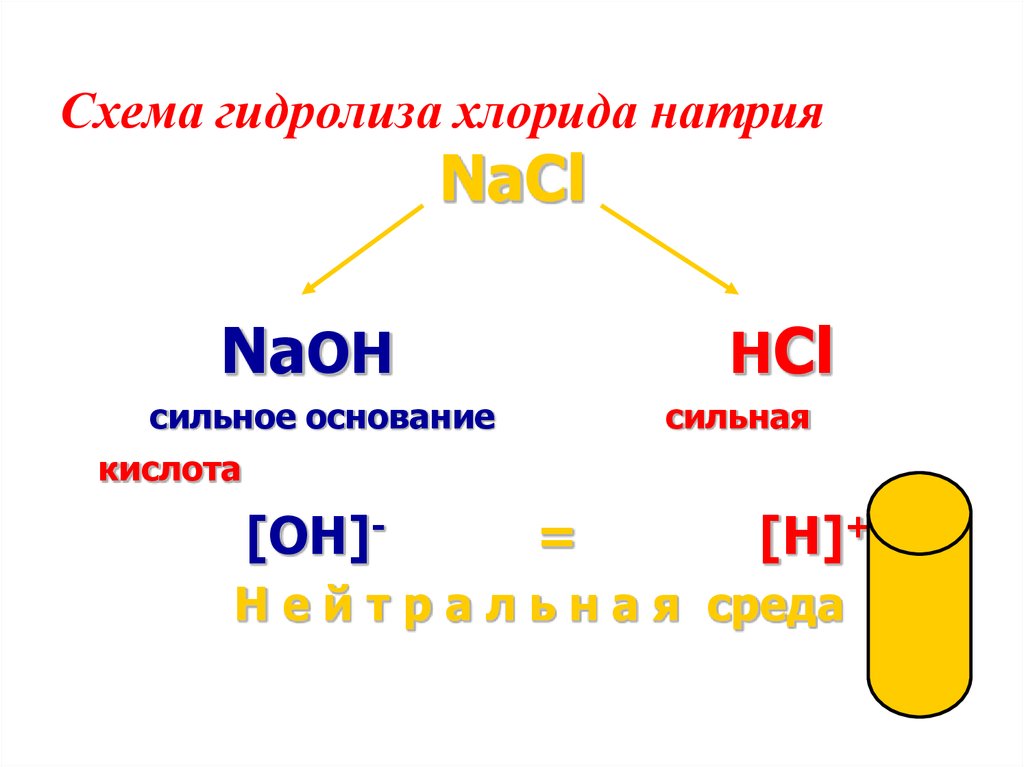
15. Схема гидролиза хлорида натрия
NaClNaOH
HCl
сильное основание
сильная
кислота
[OH]-
=
[H]+
Н е й т р а л ь н а я среда
16. NaCl + Н2О =
Вывод:Раствор соли, образованной катионом
сильного
основания
и
анионом
сильной
кислоты,
имеет
нейтральную реакцию.
В этом случае гидролиз не идет.
17.
ГИДРОЛИЗ –это реакция обмена между
некоторыми солями и водой
приводящая к образованию
слабого электролита.
18.
19.
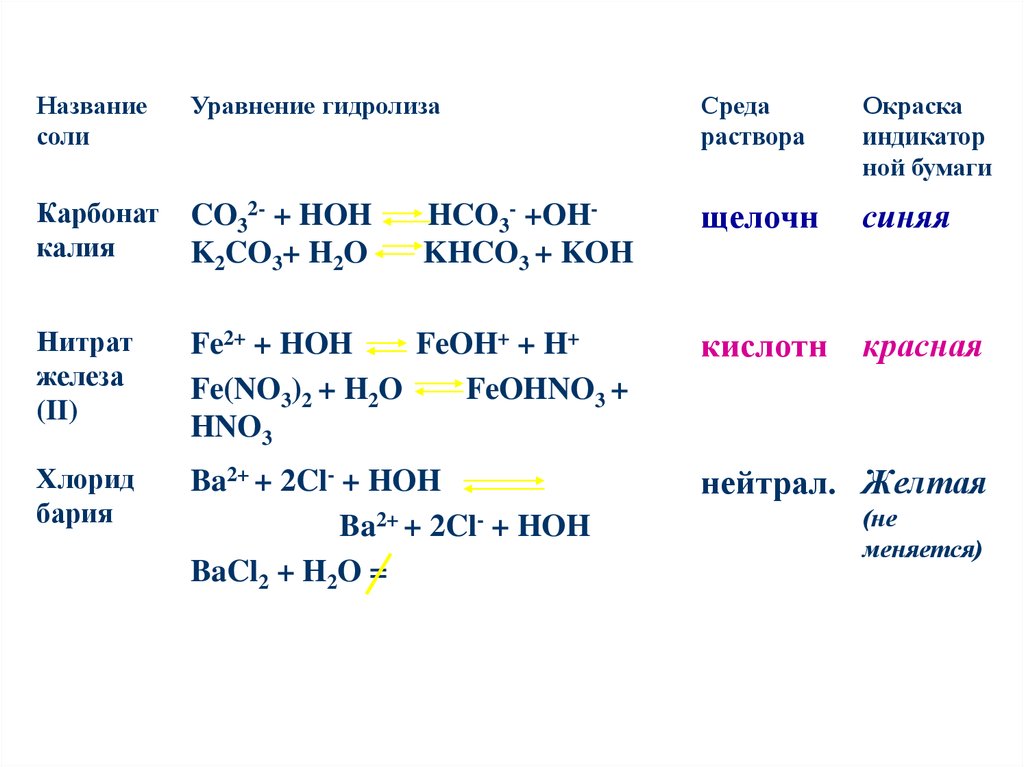
Названиесоли
Уравнение гидролиза
Среда
раствора
Окраска
индикатор
ной бумаги
Карбонат
калия
CO32- + HOH
K2CO3+ H2O
HCO3- +OHKHCO3 + KOH
щелочн
синяя
Нитрат
железа
(II)
Fe2+ + HOH
FeOH+ + H+
Fe(NO3)2 + H2O
FeOHNO3 +
HNO3
кислотн
красная
Хлорид
бария
Ba2+ + 2Cl- + HOH
Ba2+ + 2Cl- + HOH
BaCl2 + H2O =
нейтрал. Желтая
(не
меняется)
20. Роль гидролиза в природе
• Преобразование земной коры• Обеспечение слабощелочной среды
морской воды
21. Роль гидролиза в народном хозяйстве
• Порча производственного оборудования• Выработка из непищевого сырья ценных продуктов
(бумага, мыло, спирт, глюкоза, белковые дрожжи)
• Очистка промышленных стоков и питьевой воды
(сульфат алюминия + вода
гидроксид
алюминия + разбавленная серная кислота)
• Подготовка тканей к окрашиванию
• Известкование почв основано на гидролизе
22. Гидролиз в повседневной жизни человека
• Стирка• Мытье посуды
• Умывание с мылом
• Процессы пищеварения
23.
• 1 вариант:S2- + HOH
HS- + OH-
• 2 вариант:
Mg2+ + HOH
MgOH+ + H+
Приведены краткие ионные уравнения гидролиза.
Напишите:
молекулярные уравнения
гидролиза солей, которым
соответствуют эти краткие
ионные уравнения.














 Химия
Химия








