Похожие презентации:
Гидролиз солей
1. ГИДРОЛИЗ СОЛЕЙ
2.
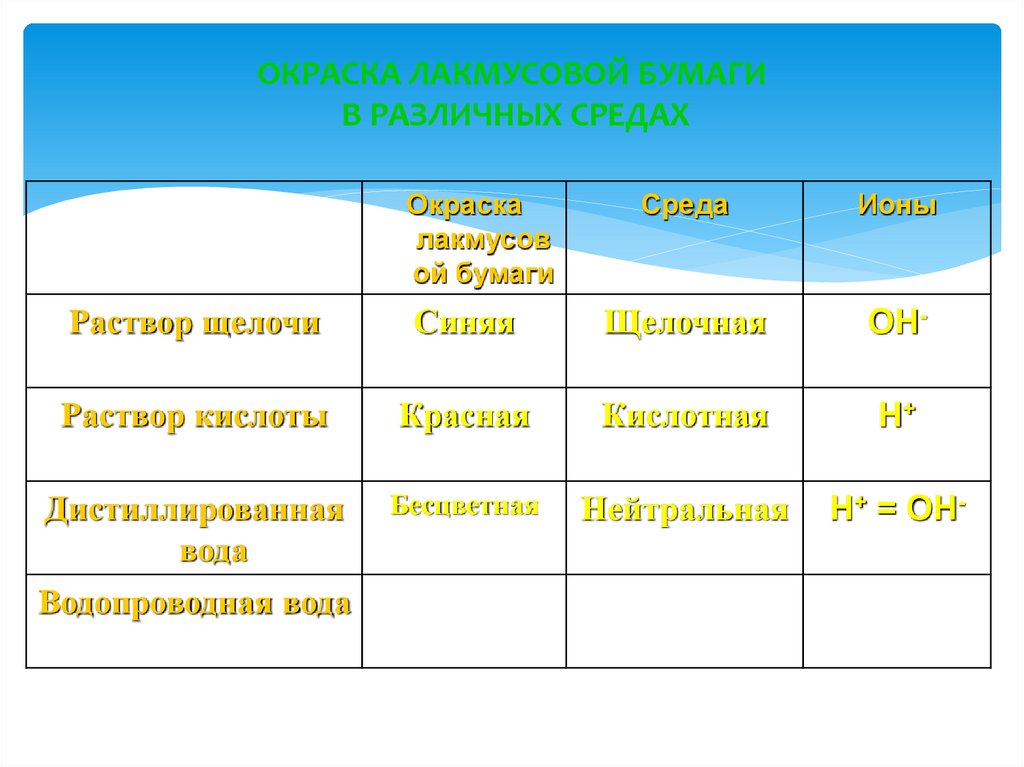
3. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
Окраскалакмусов
ой бумаги
Среда
Ионы
Раствор щелочи
Синяя
Щелочная
ОН-
Раствор кислоты
Красная
Кислотная
Н+
Дистиллированная
вода
Бесцветная
Нейтральная
Н+ = ОН-
Водопроводная вода
4. Тема: Гидролиз солей
Цель: изучить сущность гидролиза солей в водныхрастворах.
Задачи :
сформулировать определение понятия «гидролиз»
научиться
объяснять
химические
процессы,
протекающие в водных растворах солей
записывать уравнения реакций гидролиза
предсказывать и объяснять изменение кислотности
среды и образование кислых и основных солей в этом
процессе
познакомиться с ролью гидролиза солей в природе,
хозяйственной деятельности и повседневной жизни
человека.
5. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
«ГИДРОЛИЗ» от греческого«гидро» - вода
«лизис» - разложение
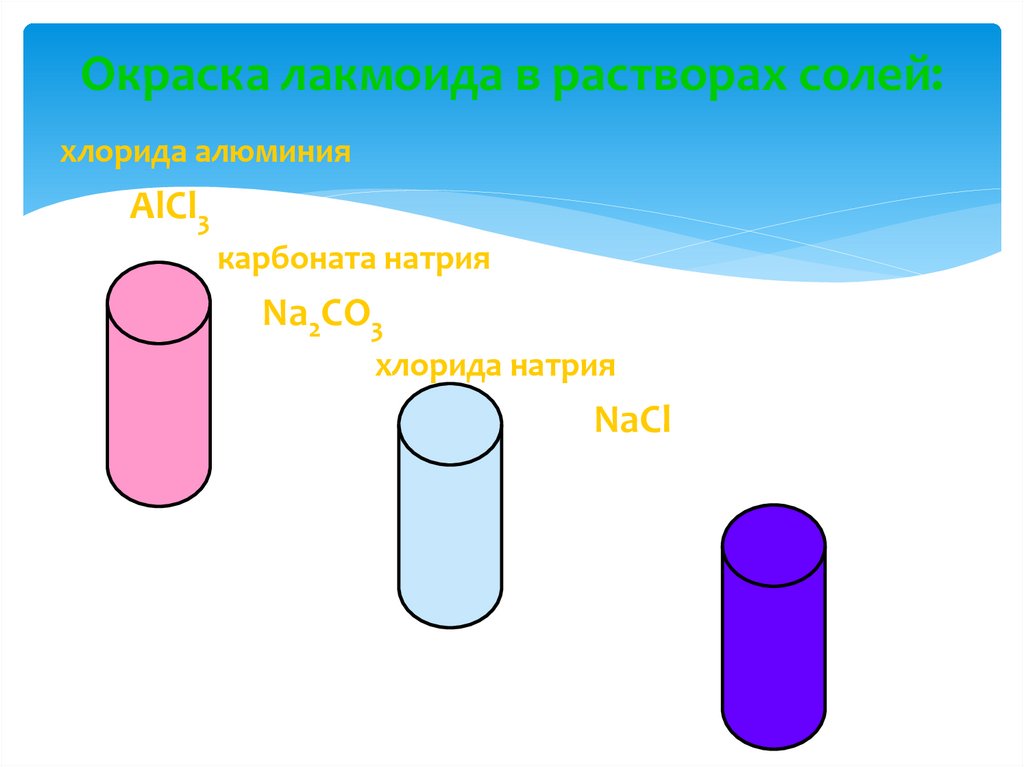
6. Окраска лакмоида в растворах солей:
хлорида алюминияAlCl3
карбоната натрия
Na2CO3
хлорида натрия
NaCl
7. ОКРАСКА ЛАКМОИДА В РАСТВОРАХ СОЛЕЙ
Окраскалакмоида
Хлорид
алюминия
AlCl3
Карбонат натрия
Na2CO3
Красный
Хлорид натрия
NaCl
Фиолетовый
Синий
Среда
Ионы
8. Механизм гидролиза хлорида алюминия
H 2OAlCl3
H+ + OHAl3+ + 3Cl-
Al3+ +3Cl- +HOH
Al OH2- +H+ + 3Cl-
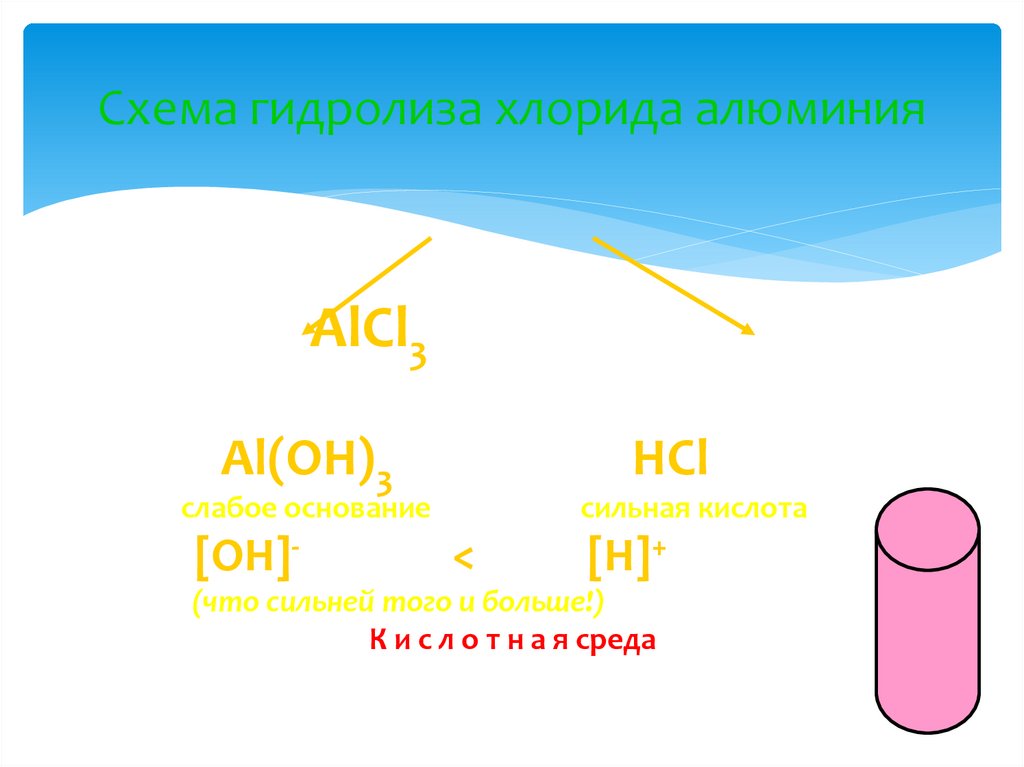
9. Схема гидролиза хлорида алюминия
AlCl3Al(OH)3
слабое основание
[OH]<
HCl
сильная кислота
[H]+
(что сильней того и больше!)
К и с л о т н а я среда
10. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
Определить состав соли, то есть указать, каким по силеоснованием и какой по силе кислотой образована данная
соль.
Взять ион слабого электролита и написать уравнение
взаимодействия его с составными частями одной
молекулы воды; в результате получить краткое ионное
уравнение гидролиза.
Написать на основании краткого ионного уравнения
молекулярное уравнение.
Исходные вещества известны – соль и вода. Продукты
гидролиза составить, связывая образовавшиеся ионы с
теми ионами соли, которые не участвуют в реакции
гидролиза.
11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной обменной реакции является основная соль.
Al3+ + HOHAlCl3 + H2O
AlOH2+ + H+
AlOHCl2 + HCl Одним из
продуктов данной обменной реакции
является основная соль.
Сформулируем вывод:
Раствор соли, образованной
________________, имеет
_____________реакцию, так как в растворе
избыток___________________.
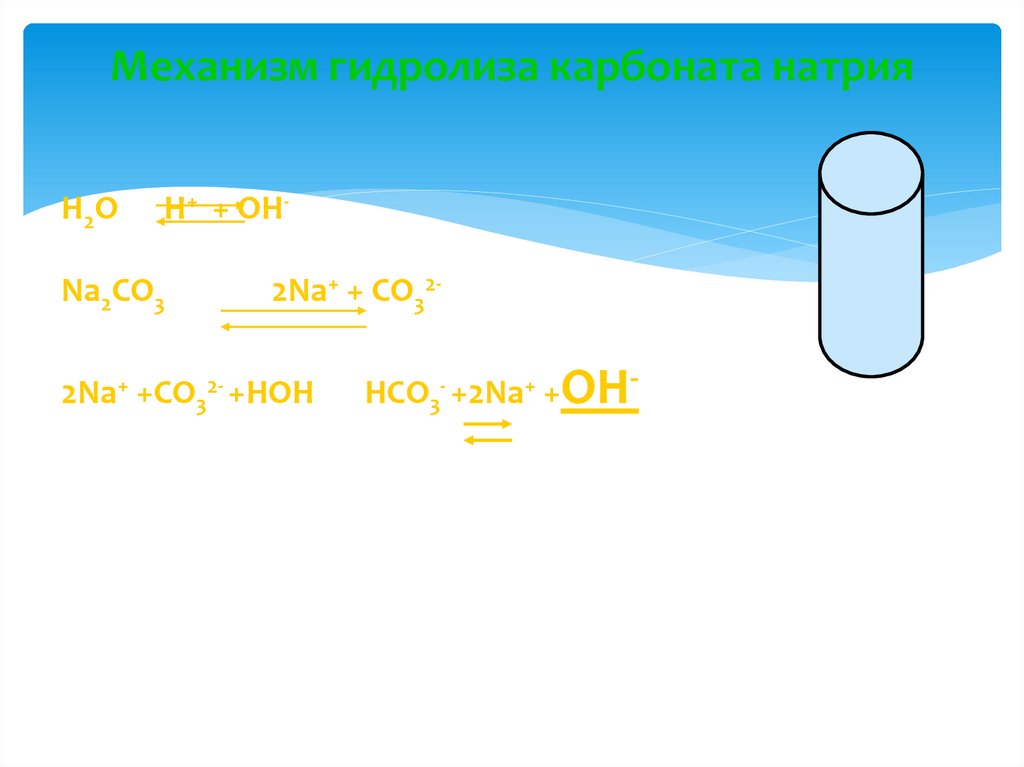
12. Механизм гидролиза карбоната натрия
H 2OH+ + OH-
Na2CO3
2Na+ + CO32-
2Na+ +CO32- +HOH
HCO3- +2Na+ +OH-
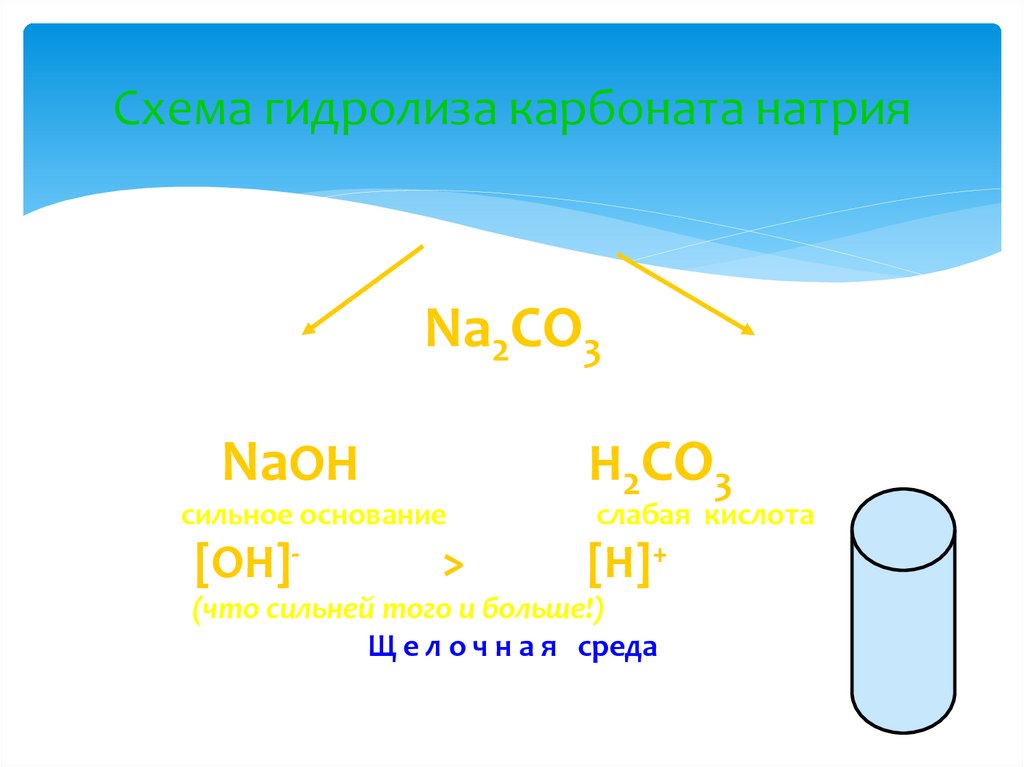
13. Схема гидролиза карбоната натрия
Na2CO3NaOH
сильное основание
[OH]>
H2CO3
слабая кислота
[H]+
(что сильней того и больше!)
Щ е л о ч н а я среда
14. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
Определить состав соли, то есть указать, каким по силеоснованием и какой по силе кислотой образована данная
соль.
Взять ион слабого электролита и написать уравнение
взаимодействия его с составными частями одной
молекулы воды; в результате получить краткое ионное
уравнение гидролиза.
Написать на основании краткого ионного уравнения
молекулярное уравнение.
Исходные вещества известны – соль и вода. Продукты
гидролиза составить, связывая образовавшиеся ионы с
теми ионами соли, которые не участвуют в реакции
гидролиза.
15. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая соль.
CO32- +HOHHCO3- +OHNa2CO3 +H2O NaHCO3 +NaOH
Одним из продуктов данной обменной реакции
является кислая соль.
Сформулируем вывод:
Раствор соли, образованной
________________,
имеет__________реакцию,
так как в растворе избыток ________________.
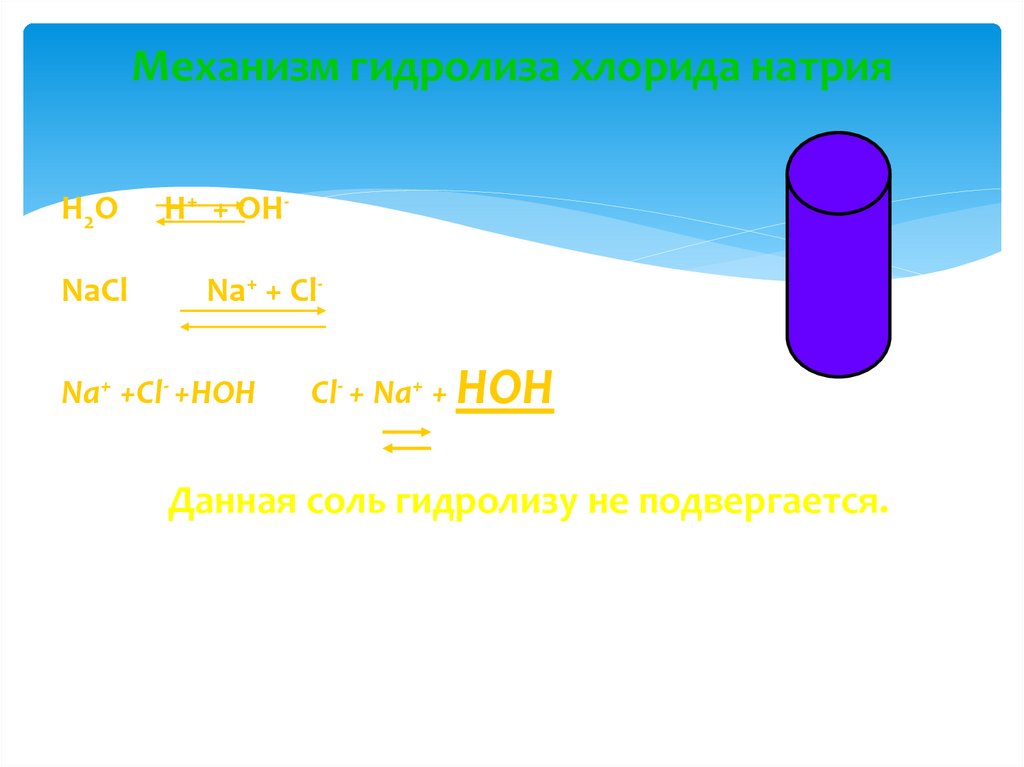
16. Механизм гидролиза хлорида натрия
H 2ONaСl
H+ + OHNa+ + Cl-
Na+ +Cl- +HOH
Cl- + Na+ + HOH
Данная соль гидролизу не подвергается.
17. Схема гидролиза карбоната натрия
NaClNaOH
HCl
сильное основание
[OH]-
=
Н е й т р а л ь н а я среда
сильная кислота
[H]+
18. NaCl + Н2О =
Сформулируем вывод:Раствор
соли,
образованной__________________,
имеет________________________реакцию, так как в
растворе__________________________________.
19. Сформулируем определение понятия «гидролиз»:
К какому типу мы отнесем данные реакции?Какие вещества в них участвуют?
В чем заключается сущность гидролиза?
Какие продукты данных взаимодействий с
точки зрения теории электролитической
диссоциации мы получили
20.
ГИДРОЛИЗ –это реакция обмена между
некоторыми солями и водой
приводящая к образованию слабого
электролита.
21.
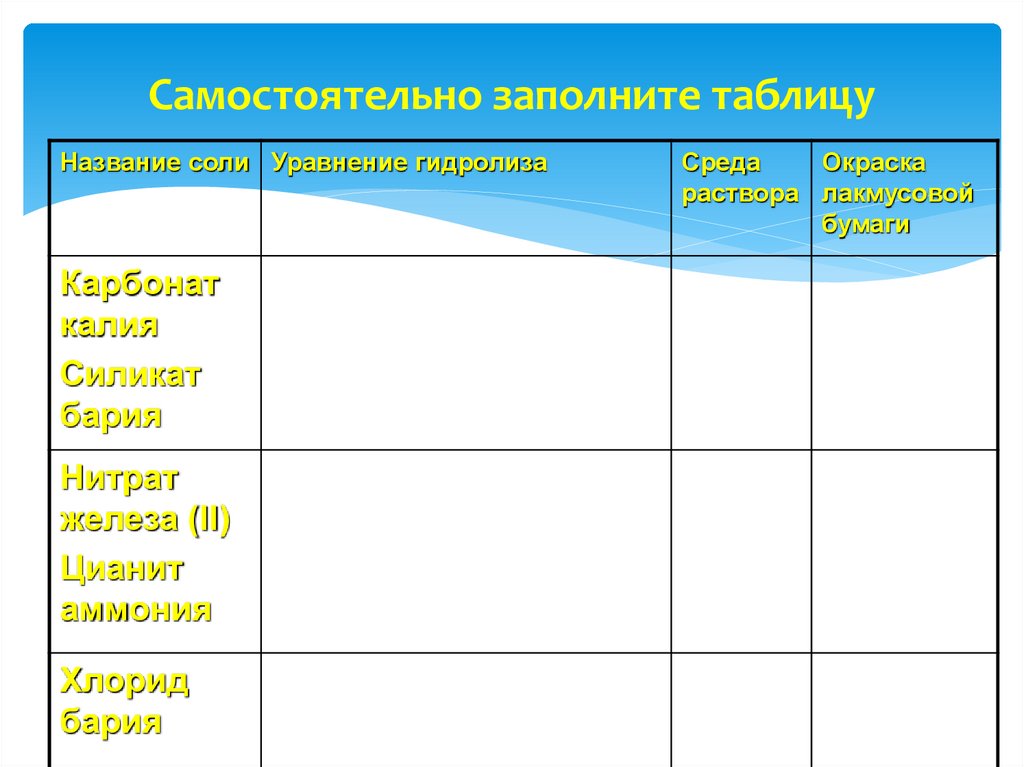
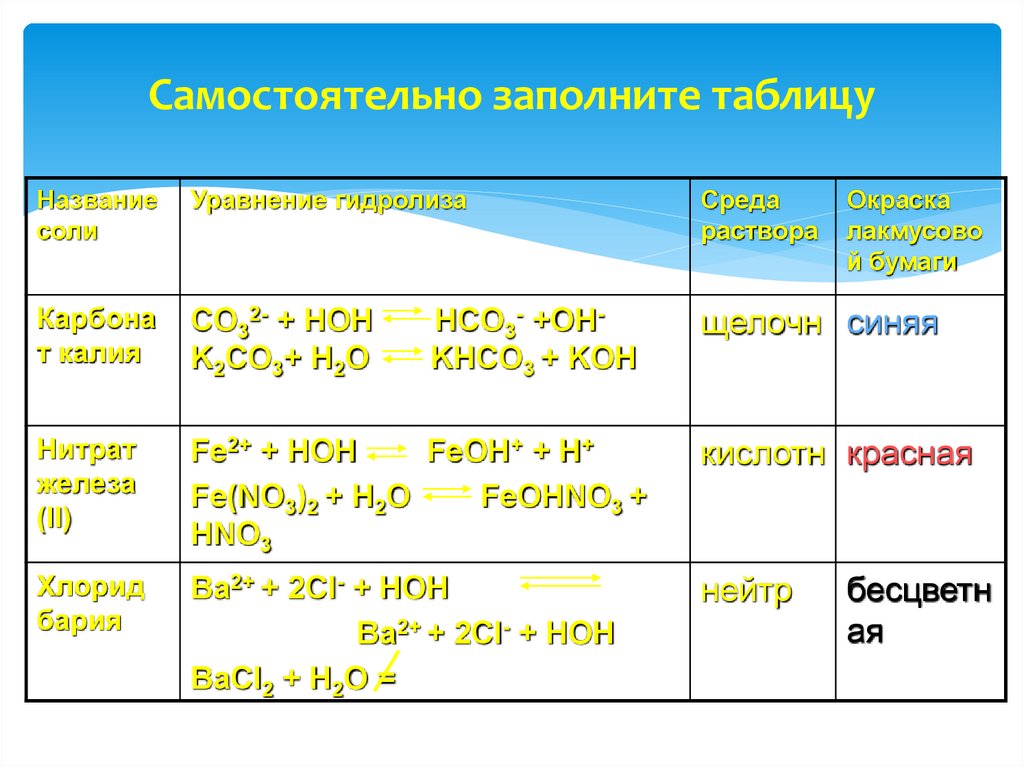
22. Самостоятельно заполните таблицу
Название соли Уравнение гидролизаКарбонат
калия
Силикат
бария
Нитрат
железа (II)
Цианит
аммония
Хлорид
бария
Среда
Окраска
раствора лакмусовой
бумаги
23. Самостоятельно заполните таблицу
Названиесоли
Уравнение гидролиза
Среда
раствора
Карбона
т калия
CO32- + HOH
K2CO3+ H2O
щелочн синяя
Нитрат
железа
(II)
Fe2+ + HOH
FeOH+ + H+
Fe(NO3)2 + H2O
FeOHNO3 +
HNO3
кислотн красная
Хлорид
бария
Ba2+ + 2Cl- + HOH
Ba2+ + 2Cl- + HOH
BaCl2 + H2O =
нейтр
HCO3- +OHKHCO3 + KOH
Окраска
лакмусово
й бумаги
бесцветн
ая
24. Роль гидролиза в природе
Преобразование земной корыОбеспечение слабощелочной среды морской воды
25. Роль гидролиза в народном хозяйстве
Порча производственного оборудованияВыработка из непищевого сырья ценных
продуктов (бумага, мыло, спирт, глюкоза,
белковые дрожжи)
Очистка промышленных стоков и питьевой воды
(сульфат алюминия + вода
гидроксид
алюминия)
Подготовка тканей к окрашиванию
Известкование почв основано на гидролизе
26. Роль гидролиза в повседневной жизни человека
СтиркаМытье посуды
Умывание с мылом
Процессы пищеварения
27. Ключ к оценке качества выполнения теста:
Верные ответы:1 вариант: 1а,
2б, 3а,
S2- + HOH
HS- + OH 2 вариант: 1б, 2в, 3б,
Mg2+ + HOH
MgOH+ + H+
Ключ к оценке качества выполнения теста:
«5» - 0 ошибок;
«4» - 1 ошибка; «3» - 2 ошибки.
28. Тема: Гидролиз солей
Цель: изучить сущность гидролиза солей в водныхрастворах.
Задачи :
сформулировать определение понятия «гидролиз»
научиться
объяснять
химические
процессы,
протекающие в водных растворах солей
записывать уравнения реакций гидролиза
предсказывать и объяснять изменение кислотности
среды и образование кислых и основных солей в этом
процессе
познакомиться с ролью гидролиза солей в природе,
хозяйственной деятельности и повседневной жизни
человека.




















 Химия
Химия








