Похожие презентации:
Химические свойства кислот и оснований в свете ТЭД электролиты
1.
ХИМИЧЕСКИЕ СВОЙСТВАКИСЛОТ И ОСНОВАНИЙ В
СВЕТЕ ТЭД ЭЛЕКТРОЛИТЫ
2.
Кислоты–
электролиты,
которые
при
диссоциации
образуют только один вид катионов – катионы водорода Н+
Уравнение электролитической диссоциации сильных кислот:
HCl ↔ H+ + ClH2SO4 ↔ 2H+ + SO42Слабые многоосновные кислоты диссоциируют ступенчато.
H2CO3 ↔ H+ + HCO3HCO3- ↔ H+ + CO32-
К1 > K2
3.
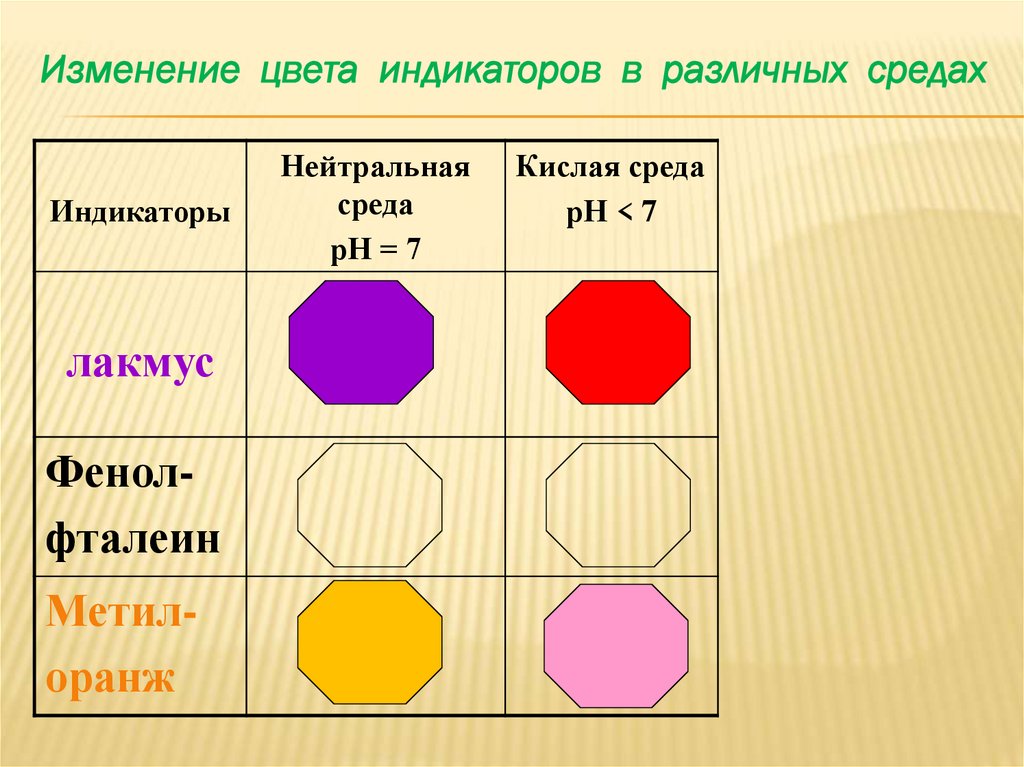
Изменение цвета индикаторов в различных средахИндикаторы
лакмус
Фенолфталеин
Метилоранж
Нейтральная
среда
рН = 7
Кислая среда
рН < 7
4.
Важнейшие общие химические свойства кислот1. Кислоты взаимодействуют с металлами:
Zn + 2HCl = ZnCl2 + H2
Hg + HCl X
HNO3( любая концентрация) и концентрированная H2SO4
реагируют с металлами без образования водорода
2. Кислоты взаимодействуют с основными и амфотерными
оксидами:
MgO + HNO3 = Mg(NO3)2 + H2O
MgO + H2SO4 (изб.) = Mg(HSO4)2 + H2O
3. Кислоты взаимодействуют с основаниями (реакция
нейтрализации):
NaOH + HF = NaF + H2O
Na+ + OH- + H+ + F -=Na+ + F - +H2O; OH- + H+=H2O
5.
4. Кислоты взаимодействуют с солями:AgNO3+ HCl AgCl ↓ + HNO3
Ag ++ NO3- + H+ + Cl- =AgCl↓ + H++NO3Ag + + Cl- =AgCl↓
Необходимые условия реакции:
а ) кислота должна быть более сильной, чем та, что
образовала соль;
в ) в результате должно образоваться нерастворимое или
летучее соединение.
6.
Основания – это сложные вещества, в состав которых входятатомы металла, связанные с одной или несколькими
гидроксогруппами (в зависимости от степени окисления металла)
С точки зрения теории электролитической диссоциации:
Основания – это электролиты, которые при диссоциации
образуют в качестве отрицательных ионов только гидроксиданионы.
В свете протолитической теории Брёнстеда-Лоури:
Основания – это молекулы или ионы, которые служат
акцепторами катионов водорода Н+ (протонов)
7.
Номенклатура оснований.Основания называются следующим образом: сначала произносят
слово «гидроксид», а затем металл, который его образует. Если
металл имеет переменную валентность, то она указывается в
названии.
КОН
– гидроксид калия;
Ca(OH)2 – гидроксид кальция;
Fe(OH)2 – гидроксид железа (II);
Fe(OH)3 – гидроксид железа (III);
При составлении формул оснований исходят из того, что молекула
электронейтральна. Гидроксид – ион всегда имеет заряд (–1). В
молекуле основания их число определяется положительным
зарядом катиона металла. Гидроксогруппа заключается в круглые
скобки, а выравнивающий заряды индекс ставится справа внизу за
скобками:
Ca+2(OH)2–,
Fe3+(OH)3-.
8.
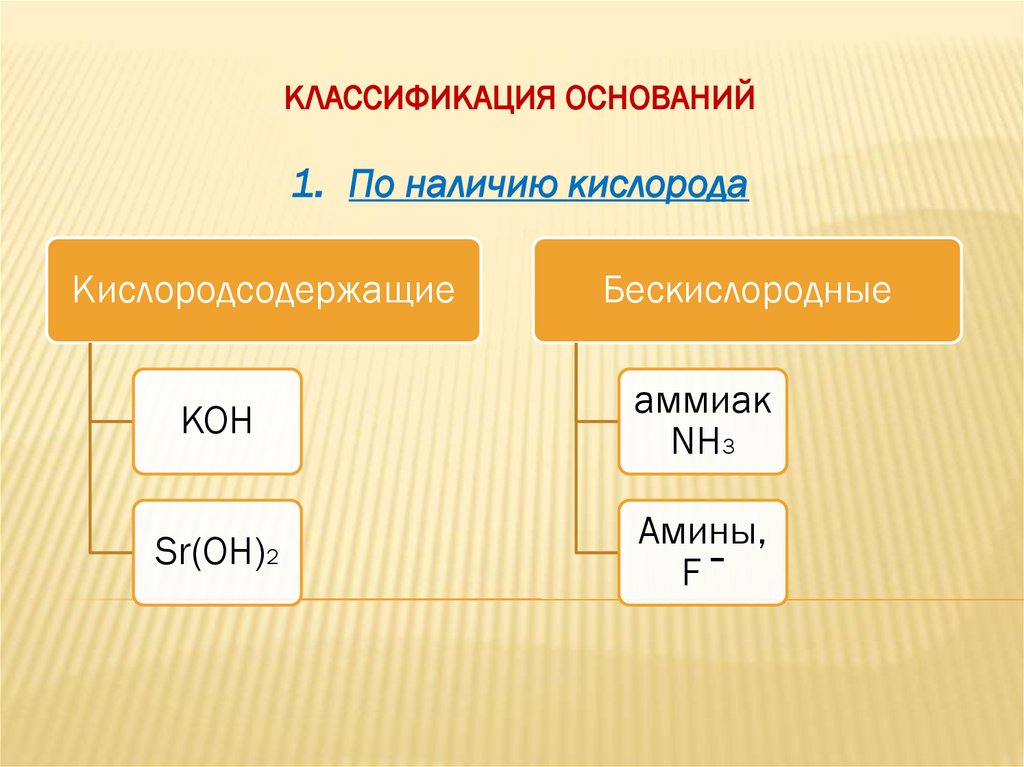
КЛАССИФИКАЦИЯ ОСНОВАНИЙ1. По наличию кислорода
Кислородсодержащие
Бескислородные
KOH
аммиак
NH3
Sr(OH)2
Амины,
F‾
9.
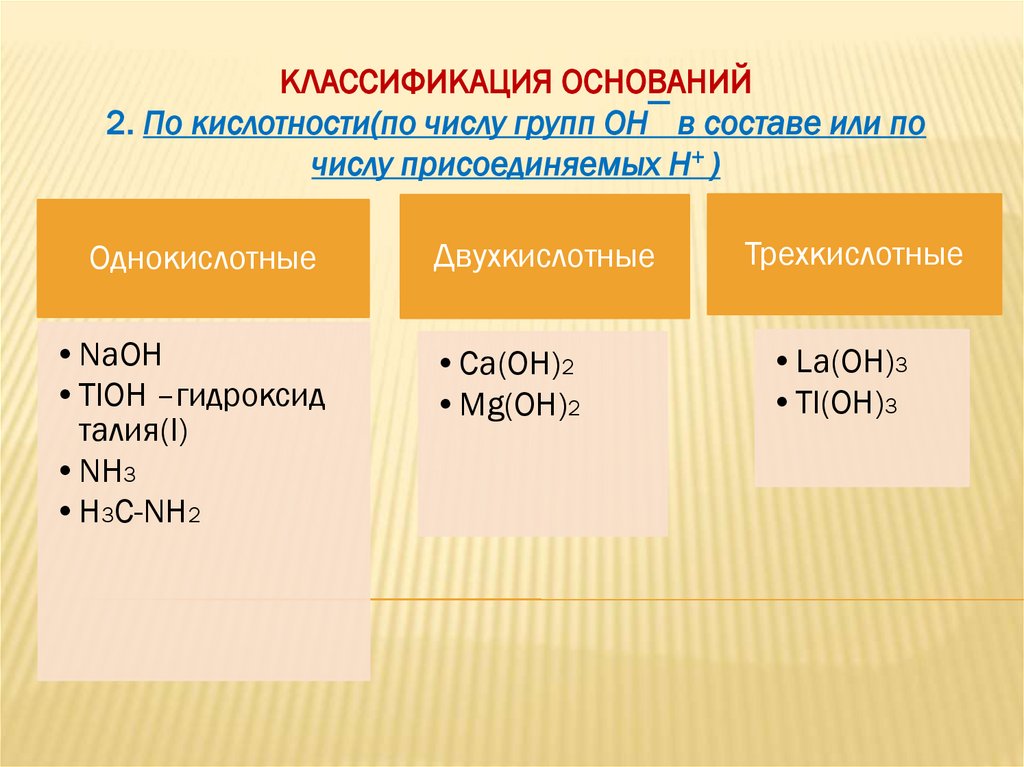
КЛАССИФИКАЦИЯ ОСНОВАНИЙ2. По кислотности(по числу групп ОН‾ в составе или по
числу присоединяемых Н+ )
Однокислотные
•NaOH
•TlOH –гидроксид
талия(I)
•NH3
•H3C-NH2
Двухкислотные
•Ca(OH)2
•Mg(OH)2
Трехкислотные
•La(OH)3
•Tl(OH)3
10.
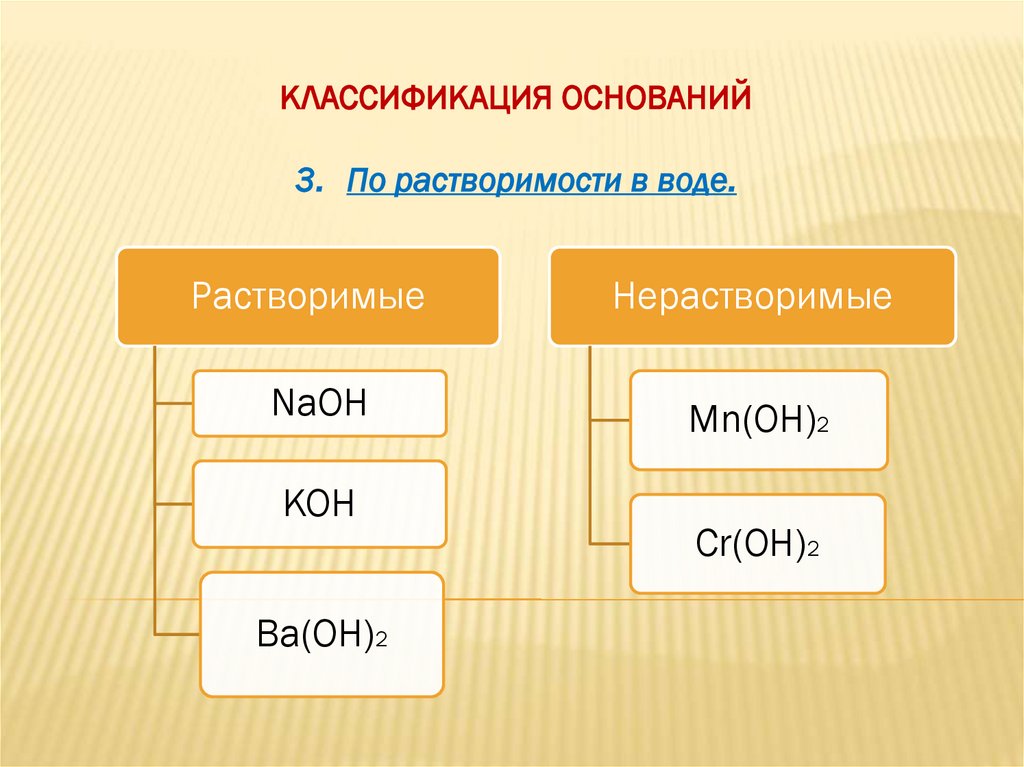
КЛАССИФИКАЦИЯ ОСНОВАНИЙ3. По растворимости в воде.
Растворимые
Нерастворимые
NaOH
Mn(OH)2
KOH
Ba(OH)2
Cr(OH)2
11.
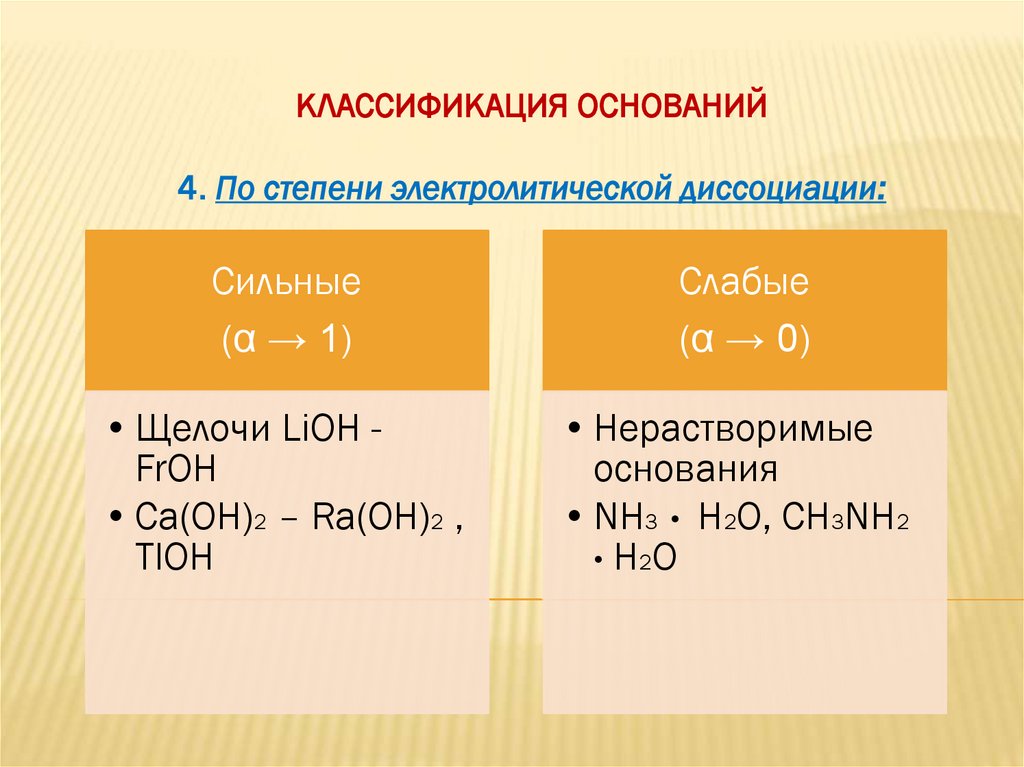
КЛАССИФИКАЦИЯ ОСНОВАНИЙ4. По степени электролитической диссоциации:
Сильные
(α → 1)
Слабые
(α → 0)
• Щелочи LiOH FrOH
• Ca(OH)2 – Ra(OH)2 ,
TlOH
• Нерастворимые
основания
• NH3 • H2O, CH3NH2
• H 2O
12.
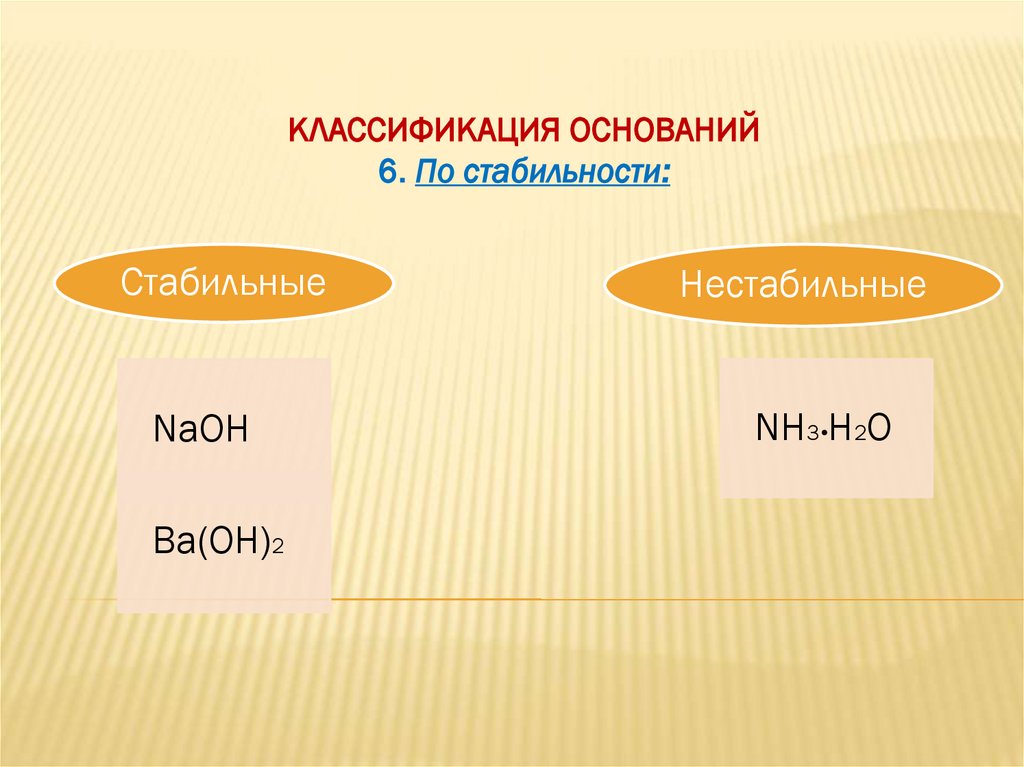
КЛАССИФИКАЦИЯ ОСНОВАНИЙ6. По стабильности:
Стабильные
Нестабильные
NaOH
NH3•H2O
Ba(OH)2






 Химия
Химия








