Похожие презентации:
Типы связей в химии
1.
Типы связей в химииДелятся на 4 категории:
Ковалентная (полярная и неполярная)
Ионная
Металлическая
Водородная
Автор презентации: Крамаров Михаил
Автор озвучки: Табашников Тимур
2.
Ковалентная полярнаяБогданов Артем
• Это связь, возникающая между атомами неметаллов с разной
электроотрицательностью
• Это электронный обмен между двумя атомами в молекуле вещества, при котором
общая пара электронов смещается к одному атому (более электроотрицательному)
В таких молекулах имеется "полюс" - электронная
плотность смещена к более
электроотрицательному элементу
Электроотрицательность:
это способность атомов химического элемента
оттягивать к себе общие электронные пары,
участвующие в образовании химической связи
Примеры:HCl, H2O, NH3, HF, CO
3.
Ковалентная полярнаяБогданов Артем
• Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем
водород => общая пара смещается в его сторону
• У такой химической связи есть полярность
• Атом, принимающий электроны (в данном случае хлор), приобретает условно
отрицательный заряд. Второй же атом, отдающий валентные электроны,
заряжается положительно
4.
Ковалентная полярнаяБогданов Артем
Свойства:
• Чем больше разность электроотрицательностей атомов, тем в большей степени
происходит смещение общей электронной пары, тем выше полярность связи
• Атом, к которому смещена общая электронная пара, приобретает частично
отрицательный заряд (δ-), а связанный с ним атом приобретает равный по
величине, но противоположный по знаку частично положительный заряд (δ+)
• Длина связи — расстояние между ядрами связанных атомов, соответствующее
наименьшей энергии молекулы
• Энергия связи — энергия, которую необходимо затратить, чтобы разрушить связь.
Такое же количество энергии выделяется при образовании химической связи.
Энергия ковалентной связи имеет значение приблизительно от 200 до 1000
кДж/моль
=> Чем меньше длина связи, тем больше энергии выделяется при её образовании и,
следовательно, тем она прочнее
5.
КовалентнаяБирюк Владимир
неполярная
Связь, возникающая в результате образования общих электронных пар между
атомами одного и того же элемента неметалла.
Характеристики неполярной связи:
• общая пара электронов равноудалена от атомных ядер и одинаково принадлежит
обоим атомам
• электронная плотность распределена
равномерно
Примеры веществ с ковалентной
неполярной связью:
• молекулы водорода (H₂)
• кислорода (O₂)
• азота (N₂)
6.
ИоннаяЭльменкин Виктор
Связь, осуществляемая за счёт сил электростатического притяжения. Она возникает
между ионами — электрически заряженными частицами, образующимися в результате
присоединения или утраты электронов атомами или группами атомов.
Ионная связь образуется между элементами, электроотрицательность которых сильно
отличается. При этом один из атомов превращается в положительно заряженный ион
— катион, а второй в отрицательно заряженный — анион.
Чаще всего ионная связь
образуется между металлами и
неметаллами. Чаще всего именно
так связаны в соединениях
щелочные и щелочноземельные
металлы с галогенами.
7.
ИоннаяЭльменкин Виктор
Основные характеристики ионной связи:
• Ненасыщаемость. Ион определённого знака может притягивать к себе переменное
число ионов другого знака
• Ненаправленность. Ион может
притягивать к себе другие ионы
с противоположным знаком в
любом направлении
Основные свойства веществ с
ионной связью: твёрдые, хрупкие,
нелетучие, тугоплавкие,
растворимые в воде.
Пример: NaCl
8.
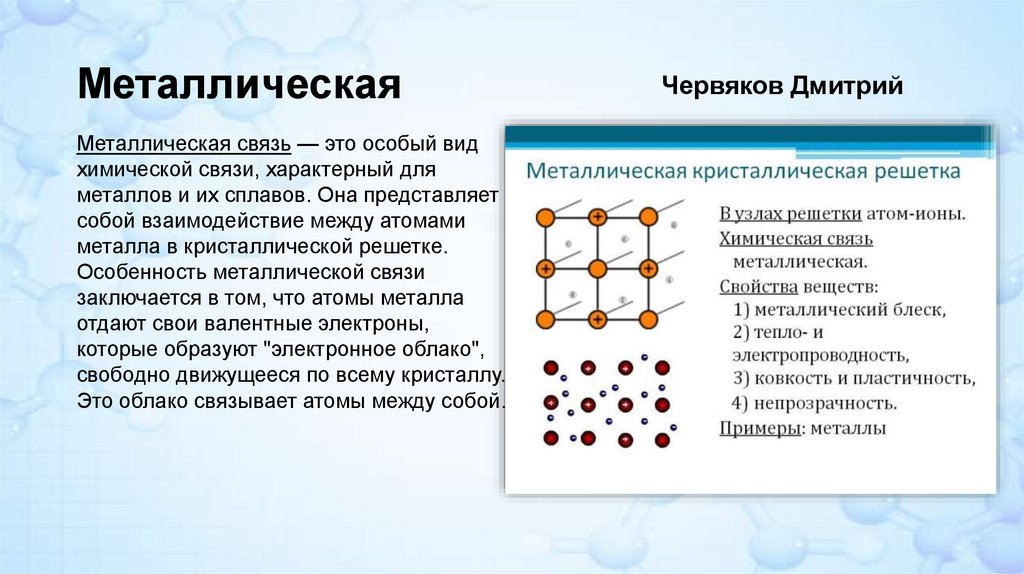
МеталлическаяМеталлическая связь — это особый вид
химической связи, характерный для
металлов и их сплавов. Она представляет
собой взаимодействие между атомами
металла в кристаллической решетке.
Особенность металлической связи
заключается в том, что атомы металла
отдают свои валентные электроны,
которые образуют "электронное облако",
свободно движущееся по всему кристаллу.
Это облако связывает атомы между собой.
Червяков Дмитрий
9.
МеталлическаяЧервяков Дмитрий
Особенности металлической связи:
• Делокализованные электроны: В металлах электроны не привязаны к конкретным
атомам, а движутся по всему кристаллу. Эти электроны называют
делокализованными, и они формируют "электронный газ". Свободное движение
электронов обеспечивает многие физические свойства металлов.
• Энергетическая выгода: Делокализованные электроны обеспечивают устойчивость
структуры, так как уменьшается общая энергия системы. Атомы металлов теряют
электроны, но за счёт этого образуется прочная связь с соседними атомами через
общее "электронное облако".
• Пространственная структура: Металлы имеют плотную упаковку атомов. Атомы
располагаются так, чтобы минимизировать потенциальную энергию, обычно образуя
кристаллическую решетку. Наиболее распространённые типы кристаллических
решёток металлов — кубическая гранецентрированная, кубическая
объёмноцентрированная и гексагональная плотная упаковка.
10.
МеталлическаяЧервяков Дмитрий
Свойства металлов, связанные с металлической связью:
• Высокая электропроводность: Свободные электроны могут свободно перемещаться
по кристаллической решетке под воздействием электрического поля. Это делает
металлы хорошими проводниками электричества.
• Теплопроводность: Электроны, свободно движущиеся в металле, также переносят
тепло, что делает металлы эффективными теплопроводниками.
• Пластичность и ковкость: Атомы металлов могут смещаться относительно друг
друга без разрыва связи, поскольку их связывают делокализованные электроны. Это
обеспечивает такие свойства, как пластичность (способность изменять форму под
давлением) и ковкость (способность растягиваться в проволоку).
• Металлический блеск: Делокализованные электроны поглощают и отражают свет в
широком диапазоне частот, придавая металлам характерный блеск.
• Высокие температуры плавления и кипения: Металлическая связь прочная, что
объясняет высокие температуры плавления и кипения большинства металлов. Чем
больше валентных электронов у металла, тем выше энергия металлической связи.
11.
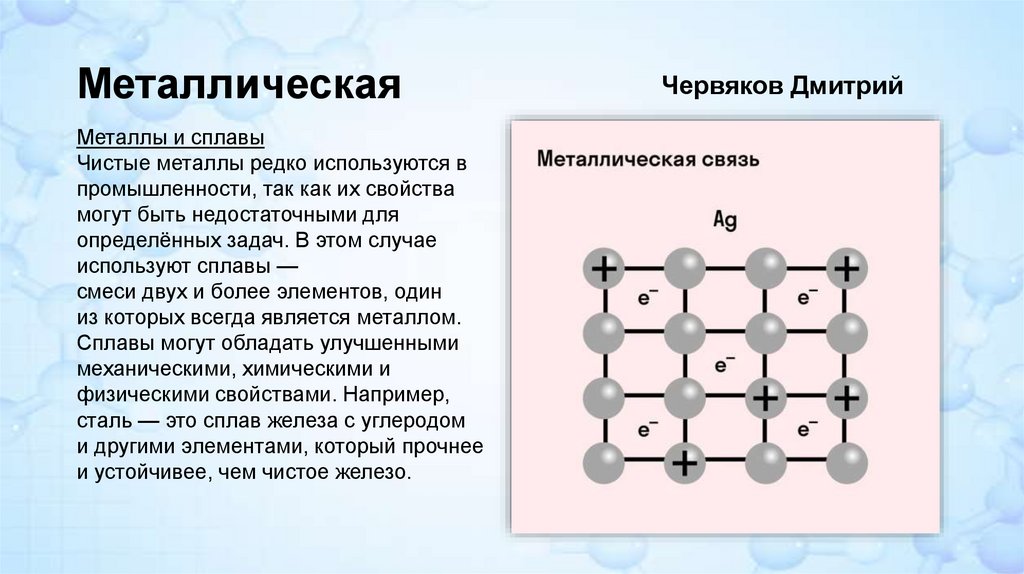
МеталлическаяМеталлы и сплавы
Чистые металлы редко используются в
промышленности, так как их свойства
могут быть недостаточными для
определённых задач. В этом случае
используют сплавы —
смеси двух и более элементов, один
из которых всегда является металлом.
Сплавы могут обладать улучшенными
механическими, химическими и
физическими свойствами. Например,
сталь — это сплав железа с углеродом
и другими элементами, который прочнее
и устойчивее, чем чистое железо.
Червяков Дмитрий
12.
ВодороднаяПолякова Кира
Связь, возникающая между положительно заряженным атомом водорода и намного
более электроотрицательным атомом, чаще всего кислорода, азота или фтора. Это
взаимодействие в несколько раз сильнее межмолекулярных сил, но в десять пятнадцать раз слабее ковалентной связи. Водородная связь образуется за счёт
электростатического притяжения
заряженных атомов, а также некоторый
вклад в её возникновение вносит
донорно-акцепторное взаимодействие.
Из-за поляризации у атома водорода
частично освобождается электронная
орбиталь, а в атомах фтора, кислорода
и азота есть пары электронов. Атом
водорода выступает акцептором
электронов, атом другого неметалла –
их донором.
13.
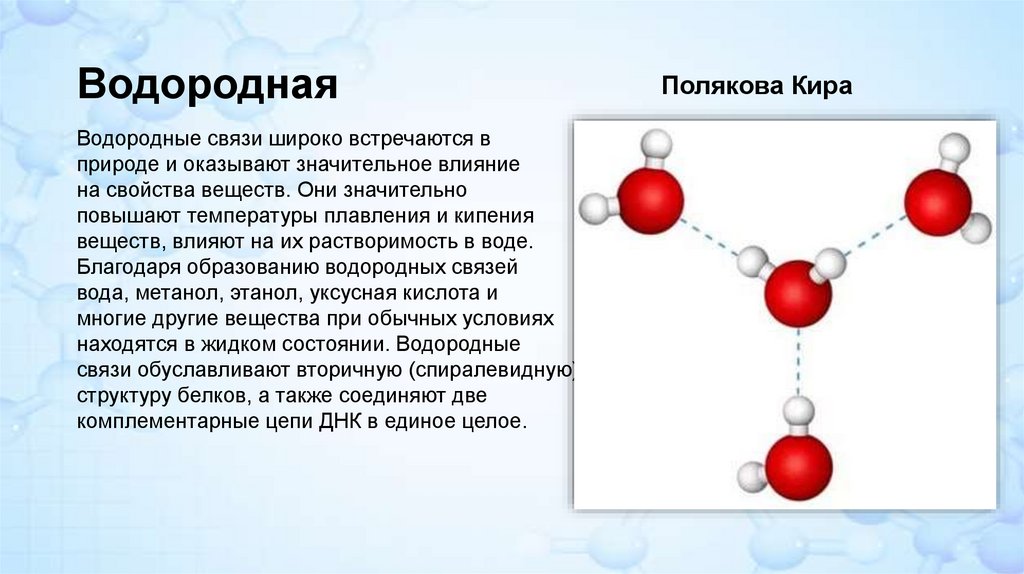
ВодороднаяВодородные связи широко встречаются в
природе и оказывают значительное влияние
на свойства веществ. Они значительно
повышают температуры плавления и кипения
веществ, влияют на их растворимость в воде.
Благодаря образованию водородных связей
вода, метанол, этанол, уксусная кислота и
многие другие вещества при обычных условиях
находятся в жидком состоянии. Водородные
связи обуславливают вторичную (спиралевидную)
структуру белков, а также соединяют две
комплементарные цепи ДНК в единое целое.
Полякова Кира










 Химия
Химия








