Похожие презентации:
Понятие ДМ. История предмета. Основные термины ДМ (лекция № 1)
1. ОДМ. Лекция №1 для студентов 6 курса лечебного факультета
Понятие ДМ. История предмета. Основные термины ДМ.Аргументы критиков ДМ. Виды клинических
исследований и их классификация (6 часов)
2. План лекции
1. Определение понятия ДМ, история предмета2. Доказательная медицина и повседневная клиническая практика
3. Фундаментальные принципы ДМ
4. Аргументы критиков ДМ
5. Основные термины, используемые в ДМ
6. Этапы разработки оригинального ЛС
7. Понятие доклинических исследований
8. Фазы клинических исследований
9. Дизайны клинических исследований
10. Требования к формированию контрольных групп в КИ
3. Определение медицины, основанной на доказательствах
• “ДМ - интеграция лучшихдоказательных исследований с
клинической практикой и оценкой
пациентов”
Sackett DL et al; Churchill
Livingstone, 2000
4. Глубочайший грех против человеческого разума – верить недоказанному
5. ОСНОВНЫЕ АСПЕКТЫ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ и КЛИНИЧЕСКАЯ ПРАКТИКА
•Превращение необходимости в информации по профилактике, диагностике,прогнозу, лечению и этиологии в конкретные вопросы
•Отслеживание лучших доказательств для ответа на эти вопросы
•Критическая оценка доказательств по их обоснованности, размеру эффекта
и полезности
•Интеграция оценки накопленного клинического опыта с индивидуальными
данными пациента
•Применение найденных данных на практике и оценка результатов
проделанной работы
Dave Sackett
6. ДМ и КЛИНИЧЕСКАЯ ПРАКТИКА
• Когда изучение ДМ интегрируется склинической практикой, это
повышает мастерство врача, его
профессиональную позицию и
профессиональное поведение в
такой же степени, как новые знания
по специальности
Khan KS, BMJ, 2004
7.
«Иные врачи двадцать леткряду делают одни и те же
ошибки и называют это
клиническим опытом»
И.Фэбрикант
8. ФУНДАМЕНТАЛЬНЫЕ ПРИНЦИПЫ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ
(Guyatt G, Rennie D. A Manual for Evidence-Based Clinical PracticeAMA. 2003)
Каждое решение в медицинской практике должно
основываться на научных фактах, строго доказанных в
ходе
клинических исследований
Для принятия клинического решения
необходима
интеграция личного клинического опыта с
наилучшими результатами клинических исследований
Достоверность данных, полученных в ходе разных
исследований, различна
9. ОСНОВНЫЕ ПОДХОДЫ, ИСПОЛЬЗУЕМЫЕ ВРАЧАМИ ДЛЯ ПРИНЯТИЯ РЕШЕНИЙ, НЕ ОТНОСЯЩИЕСЯ К ДМ
(на начало 80х г.г. – до 80% медицинских вмешательств)Принятие решений, основанное на коротком рассказе
(«анекдотичная медицина»)
•Принятие решений путем вырезания статей
Принятие решений, основанное на мнении эксперта
(медицина, основанная на знаменитостях, eminence-based medicine)
Принятие решений, основанное на минимизации затрат
10. Выбор терапии должен определяться достоверными сведениями о том, что действительно работает, а не о том, что по-видимому
работает, илидолжно
работать
(Greenhalgh T. How to Read a Paper. BMJ, 2004)
11. Определение клинических исследований (стандарт отрасли ОСТ 42-511-99)
• Клиническое испытание/исследование – этоизучение безопасности и/или эффективности
исследуемого препарата у человека для
выявления или подтверждения его
клинических, фармакологических,
фармакодинамических свойств и побочных
эффектов
12. ПЛАНИРОВАНИЕ ИССЛЕДОВАНИЯ
• Определение цели• Определение научной
обоснованности
• Заключение об этической
допустимости
• Разработка протокола
• Составление регистрационной карты
13. РАЗРАБОТКА НОВОГО ПРЕПАРАТА
1.Синтез потенциально активноговещества
2.Техническая разработка препарата
3.Доклинические исследования
4.Клинические испытания
5.Подача заявки на регистрацию
6.Регистрация нового препарата
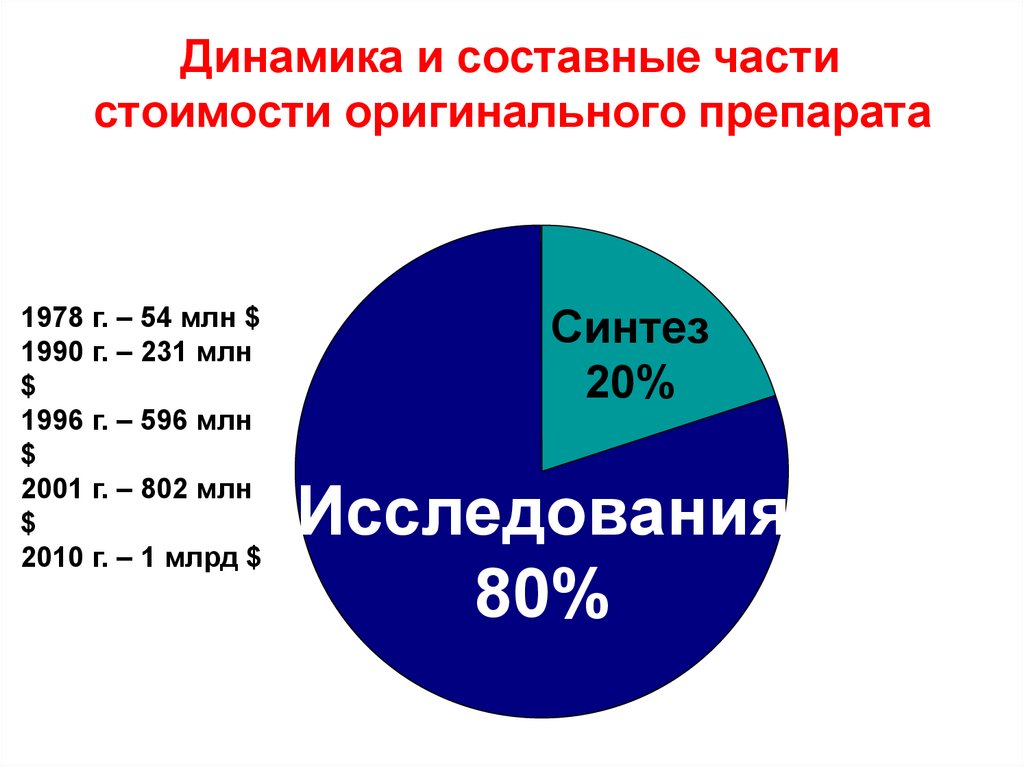
14. стоимости оригинального препарата
Динамика и составные частистоимости оригинального препарата
1978 г. – 54 млн $
1990 г. – 231 млн
$
1996 г. – 596 млн
$
2001 г. – 802 млн
$
2010 г. – 1 млрд $
Синтез
20%
Исследования
80%
15. ОТ ЧЕГО ЗАВИСИТ ЭФФЕКТИВНОСТЬ ЛС (В.Г.КУКЕС)
• Генетические особенности – 50%• Пол
• Возраст
• Тяжесть основного заболевания
• Сопутствующие заболевания (особенно
печени и почек)
• Совместно применяемые ЛС
• Применяемые БАДы
• Особенности питания
• Вредные привычки
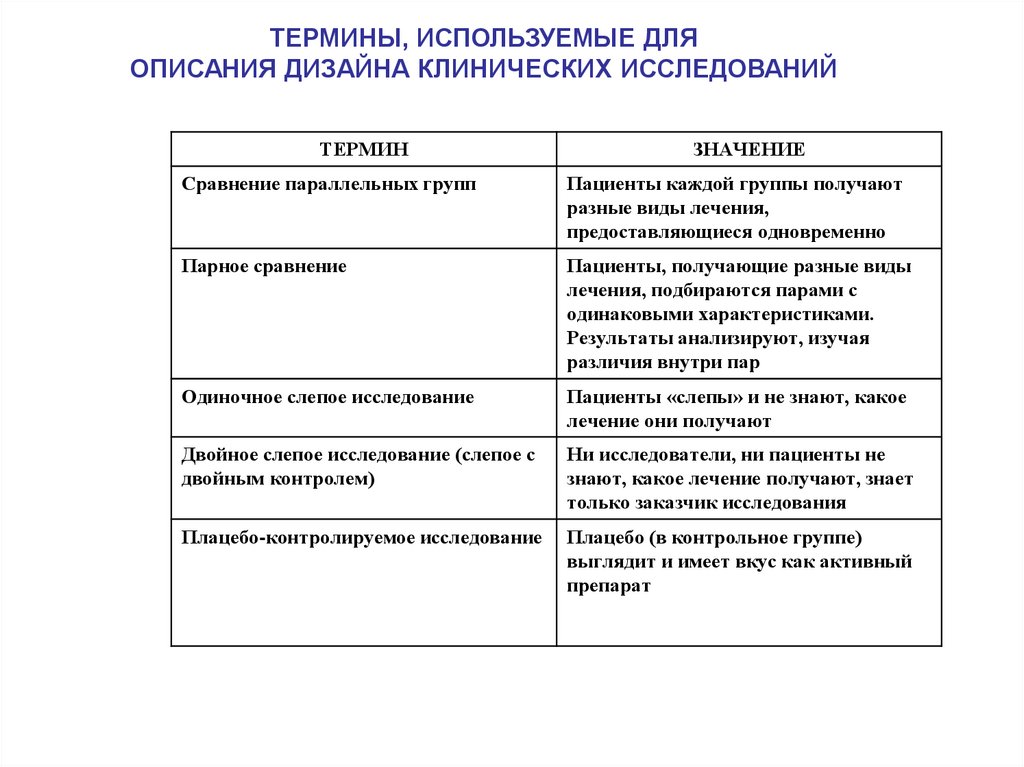
16.
ТЕРМИНЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯОПИСАНИЯ ДИЗАЙНА КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
ТЕРМИН
ЗНАЧЕНИЕ
Сравнение параллельных групп
Пациенты каждой группы получают
разные виды лечения,
предоставляющиеся одновременно
Парное сравнение
Пациенты, получающие разные виды
лечения, подбираются парами с
одинаковыми характеристиками.
Результаты анализируют, изучая
различия внутри пар
Одиночное слепое исследование
Пациенты «слепы» и не знают, какое
лечение они получают
Двойное слепое исследование (слепое с
двойным контролем)
Ни исследователи, ни пациенты не
знают, какое лечение получают, знает
только заказчик исследования
Плацебо-контролируемое исследование
Плацебо (в контрольное группе)
выглядит и имеет вкус как активный
препарат
17. МЕДИЦИНСКАЯ ПРАКТИКА
• Воздействие, единственной цельюкоторого является улучшение
самочувствия или предупреждение
заболевания у конкретного пациента
18. Дизайн КИ
Способ проведения научногоисследования в клинике.
19. ДВА ЭТАПА РАЗРАБОТКИ И ИЗУЧЕНИЯ НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
1. ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ(экспериментальные модели и животные)
ЦЕЛЬ: установление фармакологических свойств,
потенциальной эффективности
и определение токсичности лекарственных средств
Включают в себя:
А. ФАРМАКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Основное действие нового ЛС, его влияние на анатомофизиологические системы,
длительность действия, возможные ПЭ
Б. ФАРМАКОКИНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ
Всасывание, распределение, превращения и выведение
ЛС,
возможные свойства их метаболитов,
предпосылки к определению режимов дозирования
В. ТОКСИКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Характер и выраженность возможного повреждающего
действия препарата.
Острая, хроническая и специфическая (канцерогенность,
мутагенность, тератогенность, способность вызывать
20. ЗНАЧЕНИЕ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
• Поиск эффективных и безопасныхметодов лечения
• Создание методических
рекомендаций для широкого
клинического применения
21. ЦЕЛИ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Оценка терапевтической (профилактической)эффективности
и переносимости нового лекарственного средства
Установление максимальных рациональных
доз и схем его применения
Сравнительная характеристика с уже
существующими препаратами
22. Если доклинические исследования:
УСЛОВИЯ, ПРИ КОТОРЫХ ЛС ВЫХОДИТ ИЗДОКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ
Если доклинические
исследования:
• Дали положительный эффект
• Не представляли угрозы
• Не вызывали пристрастия
23.
ПРЕДМЕТЫИССЛЕДОВАНИЙ
•Исследования по лечению
•Исследования по
профилактике
•Исследования по
диагностике
•Скрининговые исследования
•Исследования качества
жизни
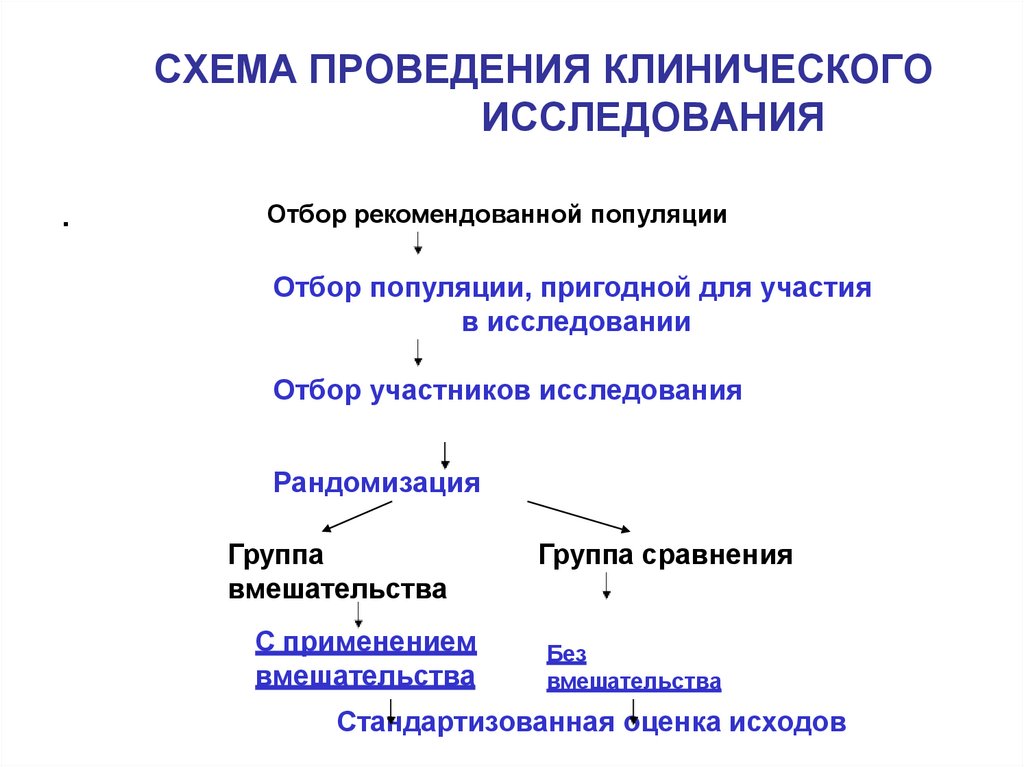
24. СХЕМА ПРОВЕДЕНИЯ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ
.Отбор рекомендованной популяции
Отбор популяции, пригодной для участия
в исследовании
Отбор участников исследования
Рандомизация
Группа
вмешательства
С применением
вмешательства
Группа сравнения
Без
вмешательства
Стандартизованная оценка исходов
25. КЛАССИФИКАЦИЯ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ПО НАЛИЧИЮ КОНТРОЛЬНОЙ ГРУППЫ, ВРЕМЕННОМУ ФАКТОРУ И МАСКИРОВАННОСТИ
ПО НАЛИЧИЮ КОНТРОЛЬНОЙ ГРУППЫКонтролируемые
Неконтролируемые
ПО ВРЕМЕННОМУ ФАКТОРУ
Ретроспективные
Проспективные (продольные)
Одномоментные (поперечные)
ПО МАСКИРОВАННОСТИ
Открытые
Слепые (простые, двойные)
Двойное слепое исследование – золотой стандарт качества
исследований клинической эффективности лечения
26. ПЕРВИЧНЫЕ И ВТОРИЧНЫЕ ИССЛЕДОВАНИЯ
А. ПЕРВИЧНЫЕ ИССЛЕДОВАНИЯБ. ВТОРИЧНЫЕ ИССЛЕДОВАНИЯ
А. КАТЕГОРИИ ПЕРВИЧНЫХ ИССЛЕДОВАНИЙ:
•Эксперименты (опыты на животных
в искусственных и контролируемых условиях)
•Клинические испытания (clinical trail)
– вмешательства на группе пациентов с последующим наблюдением
Б. КАТЕГОРИИ ВТОРИЧНЫХ ИССЛЕДОВАНИЙ:
а) несистематические обзоры б) систематические обзоры в) мета-анализы
г) клинические рекомендации д) экономический анализ
27. ФАЗЫ КЛИНИЧЕСКИХ 1 фаза. КЛИНИИКОС-ФСАРЛМАЕКОДЛООГВИЧАЕСНКИИЕ ЙИССЛЕДОВАНИЯ
ФАЗЫ КЛИНИЧЕСКИХ1 фаза. КЛИНИИКОС-ФСАРЛМАЕКОДЛООГВИЧАЕСНКИИЕЙИССЛЕДОВАНИЯ
Первое изучение препарата на людях.
Служит для изучения фармакокинетических свойств и подтверждения
безопасности нового ЛС у добровольцев
(20-100 взрослых здоровых мужчин) продолжительностью
6
месяцев при отсутствии контрольной группы
ЦЕЛИ:
• Оценить переносимость и безопасность ЛС
•Установить наличие терапевтического действия
•Создать рациональную основу для выбора доз и схем применения
Устанавить длительность действия,
наибольшую переносимую и наименьшую эффективную дозу
•Идентифицировать побочные эффекты
•Стоит ли продолжать работу над новым препаратом
При невозможности проведения I фазы у здоровых
добровольцев из-за токсичности препарата
(онкологические заболевания, СПИД) проводятся нетерапевтические
исследования с участием пациентов с этой патологией
в специализированных учреждениях
28. ФАЗЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ 2 фаза: пилотные исследования
• Первые контролируемые исследования у небольшогочисла пациентов (200-400 человек)
• Цель: установление эффективности, безопасности и
переносимости нового ЛС по сравнению с контролем при
определенной патологии
• Обеспечивают предварительную информацию об
эффективности разных доз и о соотношении
доза/эффективность и устанавливают оптимальные
режимы дозирования
• Продолжительность 6-18 месяцев
• Возможно ослепление
• Выявляются наиболее частые ПЭ
29. ФАЗЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
3 фаза. РАСШИРЕННЫЕ КИОкончательное выяснение идеальной эффективности и обычных ПЭ
ЦЕЛЬ:
Получить дополнительную информацию о новых ЛС
в условиях, максимально приближенных к обычной медицинской
практике в сравнении
с плацебо или апробированными вмешательствами.
Изучается действие ЛС у больных с сопутствующими
заболеваниями, ХСН, ХПН,
выявляются
ПЭ, особенности взаимодействия с другими ЛС,
фармакоэкономические аспекты.
Это многоцентровые исследования на сотнях
и тысячах пациентов (чаще двойные слепые рандомизированные),
которые завершаются
регистрацией препарата
Продолжительность 1-4 года
Могут включаться «подисследования»
30. ФАЗЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
4 ФАЗА – ПОСТРЕГИСТРАЦИОННЫЕ(ПОСТМАРКЕТИНГОВЫЕ) ИССЛЕДОВАНИЯ
•Проводятся после регистрации и начала продажи
препарата
•Цели: выявить дополнительную информацию об
эффективности и безопасности, редкие НЯ, новые
показания к применению и оптимальные сферы
использования ЛС
•Количество испытуемых от тысяч до сотен тысяч
31.
• Если ЛС собираются применять поновому показанию, еще не
зарегистрированному, проводятся
дополнительные исследования,
начиная с фазы II
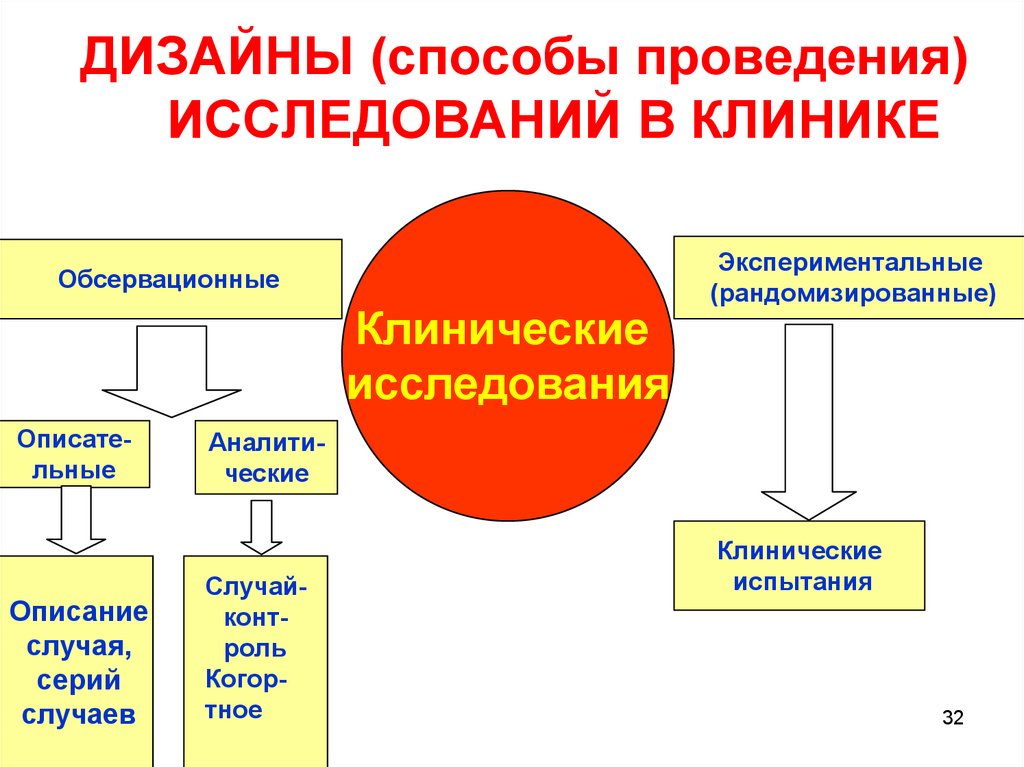
32. ДИЗАЙНЫ (способы проведения) ИССЛЕДОВАНИЙ В КЛИНИКЕ
ОбсервационныеКлинические
исследования
Описательные
Описание
случая,
серий
случаев
Экспериментальные
(рандомизированные)
Аналитические
Случайконтроль
Когортное
Клинические
испытания
32
33. КОГОРТЫ И ИХ НАЗНАЧЕНИЯ
Признак, покоторому
составлена
когорта
Для оценки чего
используется
Пример
Воздействие
Фактора риска
Рак легкого у курильщика
Заболевание
Прогноза
Выживаемость больных
раком легкого
Профилактическое лечение
профилактики
Снижение заболеваемости
пневмонией после
применения
пневмококковой вакцины
Лечебное вмешательство
Лечения
Повышение выживаемости
больных лейкозом после
комбинированной ПХТ
34. НАЧАЛО НАБЛЮДЕНИЯ В КОГОРТНОМ ИССЛЕДОВАНИИ
• Наблюдение за когортаминачинается с так называемого
«нулевого времени». Эта точка
должна быть детально объяснена и
четко определена в течение
заболевания для каждого пациента
Например: возникновение
симптомов, дата постановки
диагноза, начало лечения
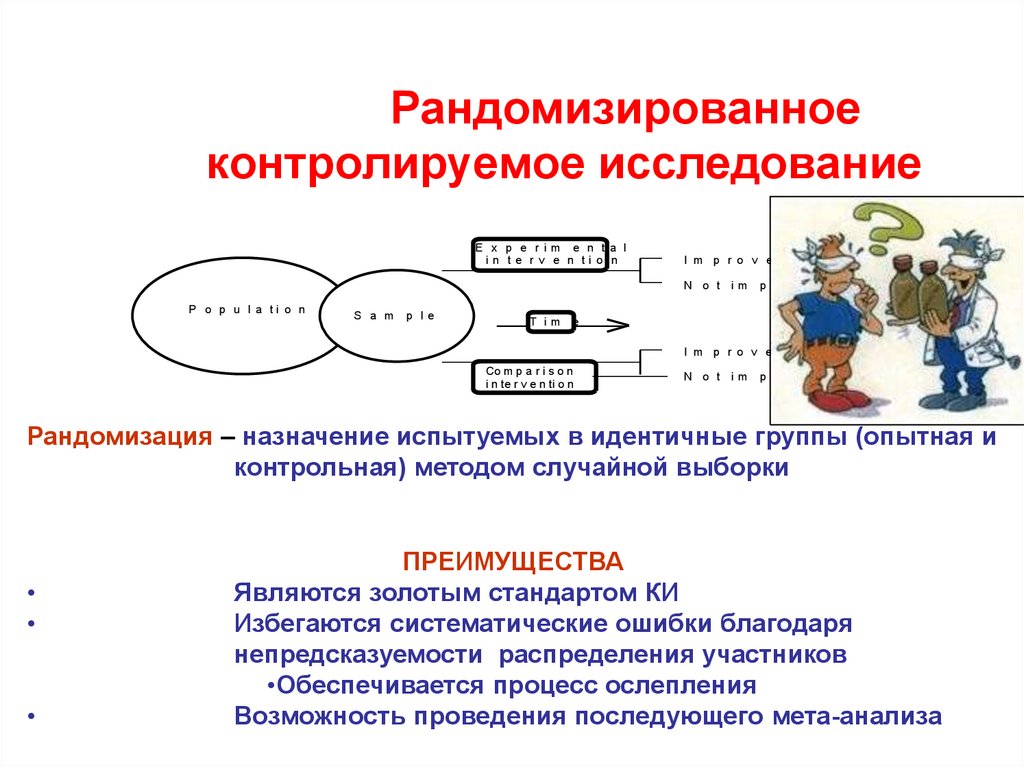
35. Рандомизированное контролируемое исследование
E x p e r i m e n t a li n t e r v e n ti o n
I m p r o v e d
N o t im
P o p u l a ti o n
S a m
p le
T im
p r o v e
e
I m p r o v e d
Co m p a r i s o n
i n te r v e n ti o n
N o t im
p r o v e
Рандомизация – назначение испытуемых в идентичные группы (опытная и
контрольная) методом случайной выборки
ПРЕИМУЩЕСТВА
Являются золотым стандартом КИ
Избегаются систематические ошибки благодаря
непредсказуемости распределения участников
• Обеспечивается процесс ослепления
Возможность проведения последующего мета-анализа
36. РАНДОМИЗИРОВАННЫЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ (продолжение)
НЕДОСТАТКИБольшинство исследований оплачивают крупные компании,
которые диктуют свои направления
Вместо клинических исходов часто используются суррогатные
точки
•Обычно не участвуют дети и беременные женщины
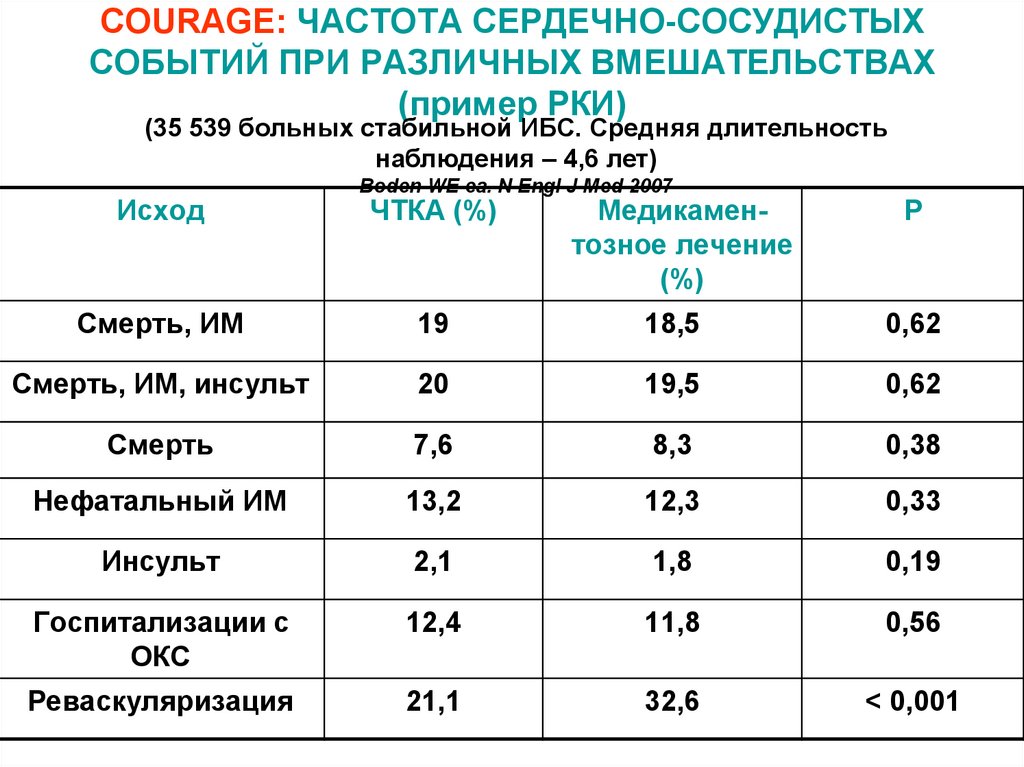
37. COURAGE: ЧАСТОТА СЕРДЕЧНО-СОСУДИСТЫХ СОБЫТИЙ ПРИ РАЗЛИЧНЫХ ВМЕШАТЕЛЬСТВАХ (пример РКИ)
(35 539 больных стабильной ИБС. Средняя длительностьнаблюдения – 4,6 лет)
Исход
Boden WE ea. N Engl J Med 2007
ЧТКА (%)
Медикаментозное лечение
(%)
Р
Смерть, ИМ
19
18,5
0,62
Смерть, ИМ, инсульт
20
19,5
0,62
Смерть
7,6
8,3
0,38
Нефатальный ИМ
13,2
12,3
0,33
Инсульт
2,1
1,8
0,19
Госпитализации с
ОКС
12,4
11,8
0,56
Реваскуляризация
21,1
32,6
< 0,001
38. ЧТО НАДО СКАЗАТЬ ИСПЫТУЕМЫМ ПЕРЕД ПРОВЕДЕНИЕМ РКИ?
• О 50% вероятности получения одного издвух видов лечения, которые при
конкретном заболевании считаются
благотворными
• Что один из видов лечения является
стандартным, а второй
экпериментальным
• Что экспериментальное лечение
считается, по меньшей мере, таким
хорошим, как и стандартное
• Что их лечащий врач не будет определять,
какое именно лечение они получат
39. LIFE. ПРИМЕР ДИЗАЙНА РАНДОМИЗИРОВАННОГО ИССЛЕДОВАНИЯ
LIFE. ПРИМЕР ДИЗАЙНАРАНДОМИЗИРОВАННОГО
* Титрация до целевого уровня АД: <140
/ 90 мм рт.ст.
ИССЛЕДОВАНИЯ
Лозартан 100 мг + ГХТЗ 12.5 - 25 мг + другие Лозартан 100 мг + ГХТЗ 12.5 мг*
Лозартан 50 мг + ГХТЗ 12.5 мг*
Плацебо
Лозартан 50 мг
Атенолол 50 мг
Атенолол 50 мг + ГХТЗ 12.5 мг* Атенолол 100 мг + ГХТЗ 12.5 мг*
Атенолол 100 мг + ГХТЗ 12.5 - 25 мг + другие*
День ДеньДень Мсц
14 7
1
1
Мсц Мсц Мсц
2
4
6
Год Год
1 1.5
Год Год Год Год Год Год
2
2.5
3
3.5
4
5
* Титрация рекомендовалась, если ДАД (сидя) >90 мм рт.ст. или САД (сидя) >140 мм рт.ст. была
обязательной, если АД (сидя) >160 / 95 мм рт.ст.
**Другие гипотензивные, за исключением ИАПФ, антагонистов A II, бета блокаторов
Dahlöf B et al Am J Hypertens 1997;10:705 713.
40. КОГДА НЕОБХОДИМО РАЗОСЛЕПЛЕНИЕ?
• Влияние на прогноз у пациента (например –необходимость использования специфического
антидота)
• Наступление беременности при известном
тератогенезе препарата
Вопрос разослепления должен согласовываться с
монитором исследования за исключением
случаев, когда на это нет времени
41. ПРЕДОСТЕРЕЖЕНИЯ ПО ИСПОЛЬЗОВАНИЮ ДОКАЗАТЕЛЬСТВ, ПОЛУЧЕННЫХ В РКИ, В
МЕДИЦИНСКИХ РУКОВОДСТВАХ1. Тенденции по
применению новых
подходов к группам
пациентов,
отличающихся от тех, на
которых были получены
данные результаты
2. Экстраполирование
полученных
результатов на
препараты
аналогичных
классов, но
непроверенных при
определенных
состояниях
42. ИЕРАРХИЯ ВИДОВ ИССЛЕДОВАНИЯ ДЛЯ ПРИНЯТИЯ КЛИНИЧЕСКИХ РЕШЕНИЙ
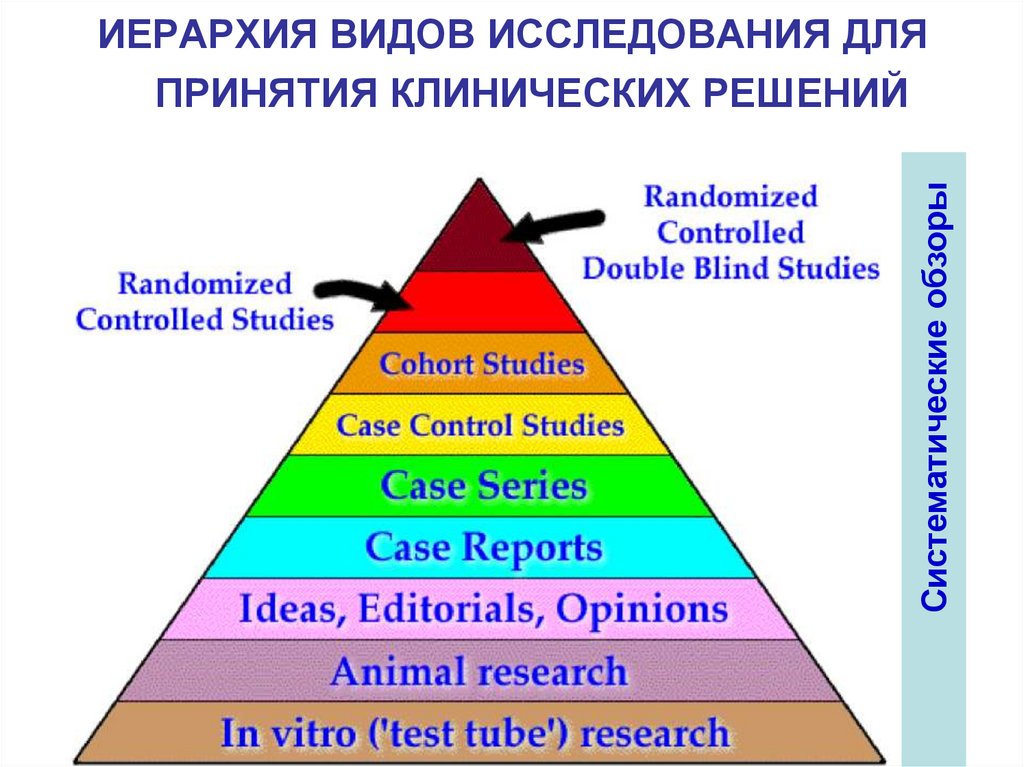
Систематические обзорыИЕРАРХИЯ ВИДОВ ИССЛЕДОВАНИЯ ДЛЯ
ПРИНЯТИЯ КЛИНИЧЕСКИХ РЕШЕНИЙ
43. ОПТИМАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ПРИМЕНИТЕЛЬНО К РАЗНЫМ КЛИНИЧЕСКИМ ВОПРОСАМ
ВопросМетод исследования
Диагностика
Одномоментное КИ
Распространенность
То же
Частота возникновения новых случаев,
заболеваний, исходов
Когортное КИ
Риск
То же, КИ «случай-контроль»
Прогнозирование
Когортное КИ
Лечение
РКИ
Профилактика
Когортное КИ
Этиология
КИ «случай-контроль»
44. ДЛЯ ОЦЕНКИ ДОКАЗАТЕЛЬНОСТИ КЛИНИЧЕСКИХ ИСПЫТАНИЙ И ЭФФЕКТИВНОСТИ ЛС НЕОБХОДИМО:
Четкая формулировка целей и задач исследования
Наличие контрольной группы
Характеристика препарата сравнения
Метод установления эффективных доз препарата
Четкие критерии включения и исключения пациентов, метода
распределения больных в группы, числа пациентов в каждой группе
Определение длительности испытания (она не должна превышать
периода, определенного на основании токсикологических испытаний на
животных)
«Ослепление»
Определение методов количественной оценки действия препарата
Рандомизация
Информация об осложнениях и побочных эффектах
Информация о качестве жизни пациентов
Информация о числе «потерянных» пациентов в ходе исследования
Адекватный статистический анализ
45. ВРЕМЕННЫЕ ТОЧКИ ИССЛЕДОВАНИЯ
• Разработка протокола• Получение разрешения на проведение
исследования
• Отбор исследовательских центров
• Стартовое совещание
• Инициализация центров
• Мониторирование
• Закрытие центров
• Обработка результатов, публикации
• Регистрация препарата
• Начало продаж
46. ОЦЕНКА СОБЛЮДЕНИЯ ПРОТОКОЛА КИ ВКЛЮЧАЕТ ПРОВЕРКУ:
• Критериев включения и исключения• Графика и полноты методов
обследований
• Процедуры рандомизации, если таковая
применялась
• Процедур хранения, подготовки и
назначения препарата
• Критериев эффективности и безопасности
• Сопутствующей терапии
47.
CASE REPORT FORM (CRF)ИНДИВИДУАЛЬНАЯ
РЕГИСТРАЦИОННАЯ КАРТА
(ИРК)
•Бумажный или электронный
документ для записи требуемой
протоколом информации о
каждом субъекте исследования
•За точное, полное, достоверное
и своевременное
представление
данных в CRF несет
ответственность
48.
49. ТИПЫ КОНТРОЛЬНЫХ ГРУПП
• Активный препарат• Плацебо
• Группа без лечения
• Различные дозы одного препарата
• Традиционная терапия
• Историческое сравнение
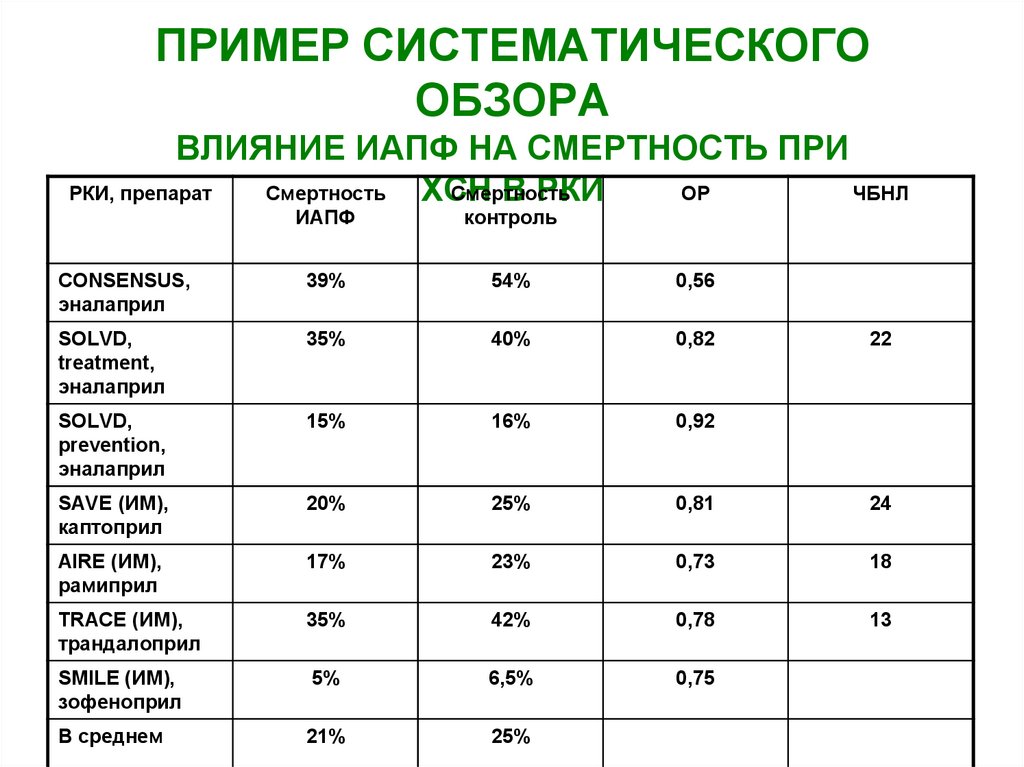
50. ПРИМЕР СИСТЕМАТИЧЕСКОГО ОБЗОРА ВЛИЯНИЕ ИАПФ НА СМЕРТНОСТЬ ПРИ ХСН В РКИ
ПРИМЕР СИСТЕМАТИЧЕСКОГООБЗОРА
ВЛИЯНИЕ ИАПФ НА СМЕРТНОСТЬ ПРИ
РКИ, препарат
Смертность
Смертность
ОР
ЧБНЛ
ХСН
В РКИ
ИАПФ
контроль
CONSENSUS,
эналаприл
39%
54%
0,56
SOLVD,
treatment,
эналаприл
35%
40%
0,82
SOLVD,
prevention,
эналаприл
15%
16%
0,92
SAVE (ИМ),
каптоприл
20%
25%
0,81
24
AIRE (ИМ),
рамиприл
17%
23%
0,73
18
TRACE (ИМ),
трандалоприл
35%
42%
0,78
13
SMILE (ИМ),
зофеноприл
5%
6,5%
0,75
В среднем
21%
25%
22
51. МЕТА-АНАЛИЗ (МА)
Это объединение результатов нескольких КИ,проведенных в одинаковых условиях
и расчет общих (средних) показателей с целью
преодоления «слабости» малых исследований
ВОПРОСЫ, ПРИМЕНИМЫЕ К МЕТААНАЛИЗУ:
Все ли исследования
по изучаемому
вопросу выявлены?
Включает ли МА только строгие научно
обоснованные КИ?
•Однородны ли включенные
КИ?
52.
УРОВНИ НАДЕЖНОСТИ СВЕДЕНИЙ,ПРЕДОСТАВЛЯЕМЫХ В КЛИНИЧЕСКИХ
РЕКОМЕНДАЦИЯХ
• Мета-анализ многих хорошо
организованных КИ
• По крайней мере одно хорошо
организованное экспериментальное
КИ
• Хорошо организованные
нерандомизированные
контролируемые испытания,
когортные исследования,
исследования серий случаев
• Описание клинических случаев
53.
НАИБОЛЕЕ ЧАСТЫЕ ПРИЧИНЫ НИЗКОГОКАЧЕСТВА КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
• Отсутствие связи между КР и научными
доказательствами
• Отражение мнения заинтересованных
экспертов в ущерб научным фактам
• Отсутствие информации о процессе
разработки, заказчиках, способах
внедрения в практику
• Отсутствие реальной практической
помощи
54. СИСТЕМАТИЧЕСКИЕ ОШИБКИ
Систематическая ошибка (смещение результатов) –систематическое (неслучайное) отклонение результатов
от истинных значений
Виды систематических ошибок:
1.СО, обусловленная отбором – сравниваемые группы
пациентов различаются по факторам, влияющим на
исход
2.СО, обусловленная использованием в сравниваемых
группах разных методов измерения
3.СО, обусловленная вмешивающимся фактором
4.СО, обусловленная неправильно проведенным
статистическим анализом
5.СО, обусловленная эффектом плацебо
55.
ПРИЧИНЫ ВЫПАДЕНИЯ БОЛЬНЫХ ИЗКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В
ПРОЦЕССЕ ИХ ПРОВЕДЕНИЯ
•Неправильное включение пациентов в
испытание
•Подозрение на побочные эффекты
•Снижение мотивации у пациента
•Исключение по клиническим
показаниям (беременность,
сопутствующие
заболевания и т. д.)
•Невозможность последующего
наблюдения
•Смерть
56.
ОСНОВНЫЕ КРИТЕРИИ, ОГРАНИЧИВАЮЩИЕВКЛЮЧЕНИЕ ПАЦИЕНТОВ В КЛИНИЧЕСКИЕ
ИССЛЕДОВАНИЯ
•Нетипичный характер заболевания
•Наличие других болезней
•Необычно плохой прогноз
•Высокая вероятность несоблюдения
предписанного лечения
•Противопоказания к одному из видов
предполагаемого лечения
•Отказ пациента
57. ТИПИЧНЫЕ ОШИБКИ В МЕДИЦИНСКИХ ИССЛЕДОВАНИЯХ
1. Отсутствие контрольной группы или некорректное ееформирование
2. Формирование гипотезы для КИ после получения данных
или изменение организации КИ в ходе обработки данных
3. Смешение понятий «частота новых случаев» (отношение
числа лиц, у которых в течение определенного времени
развилось интересующее состояние ко всем
обследованным в группе, где исходно этого состояния никто
не имел (определяется когортным исследованием), и
«распространенность» (доля лиц с изучаемым
заболеванием в определенной популяции в данный момент
времени)
4. Смешение понятий «статистическая значимость» и
«клиническая значимость»
5. Систематические ошибки

















































 Медицина
Медицина








