Похожие презентации:
Ферменты. Расщепление белков (лекция 7)
1.
Лекция 7Ферменты 2
Расщепление белков
2.
Регуляция активности ферментовУже имеющийся фермент в клетке
- влияние разных факторов (рН,
температура) (обсуждаете с преподавателями)
- фосфорилирование и
дефосфорилирование
- влияние ингибиторов и активаторов
- аллостерическая регуляция
Через синтез фермента заново (de novo)
- активация экспрессии генов
фермента
- регуляция стабильности и времени
жизни мРНК фермента
- регуляция скорости трансляции
будем обсуждать в декабре
3.
Для уже имеющегося фермента в клеткеРегуляция фосфорилированием - дефосфорилированием
Фосфорная группа (чаще всего из АТФ) присоединяется к
- серину или треонину,
- гистидину или аспарагину
- тирозину
Это делают
- Серин/треониновые протеинкиназы,
- Гистидин/аспарагиновые протеинкиназы
- Тирозиновые протеинкиназы
- Фосфорные группы отщепляют фосфатазы
- Киназы чаще всего активируют белки,
- Фосфатазы чаще всего ингибируют белки
4.
Для уже имеющегося фермента в клеткеЭти вещества связываются с белком
5.
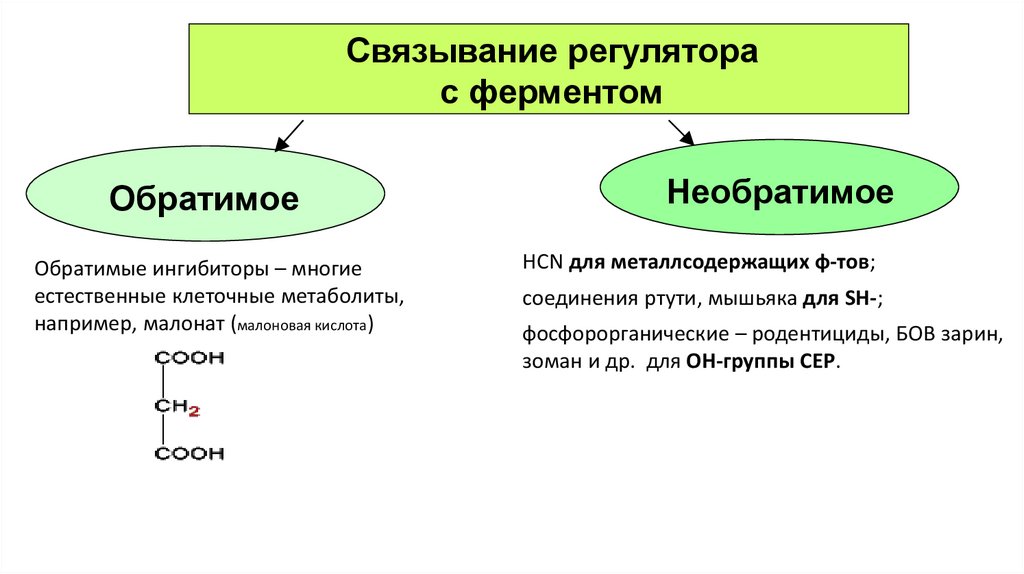
Связывание регуляторас ферментом
Обратимое
Обратимые ингибиторы – многие
естественные клеточные метаболиты,
например, малонат (малоновая кислота)
Необратимое
HCN для металлсодержащих ф-тов;
соединения ртути, мышьяка для SH-;
фосфорорганические – родентициды, БОВ зарин,
зоман и др. для ОН-группы СЕР.
6.
Механизмы ингибирования:1. Конкурентное – аналог субстрата, связывание в АЦ
Примеры: Малонат для сукцинатдегидрогеназы (в ЦТК)
малонат
2. БЕСконкурентное – ингибитор не способен связаться со свободным
ферментом, действует на фермент-субстратный комплекс
Встречается в сложных многосубстратных реакциях
3. НЕконкурентное – ингибитор НЕ аналог субстрата, связывание ВНЕ АЦ
Мальтоза и сульфат меди – для α-амилазы
7.
Неконкурентное ингибирование (или активация)Аллостерическая регуляция (или аллостерический контроль) — это регуляция фермента
путем связывания эффекторной (регуляторной) молекулы в сайте, отличном от активного сайта фермента
Такой сайт называется аллостерическим
Термин (предложен Жаком Люсьеном Моно для
обозначения НЕКОНКУРЕНТНЫХ
ингибиторов (“-” эффекторов)
“аllos” – иной, “stereos” - пространственный
Аллостерическая регуляция происходит
через конформационные изменения
всего белка и активного центра
Может быть и активацией:
8.
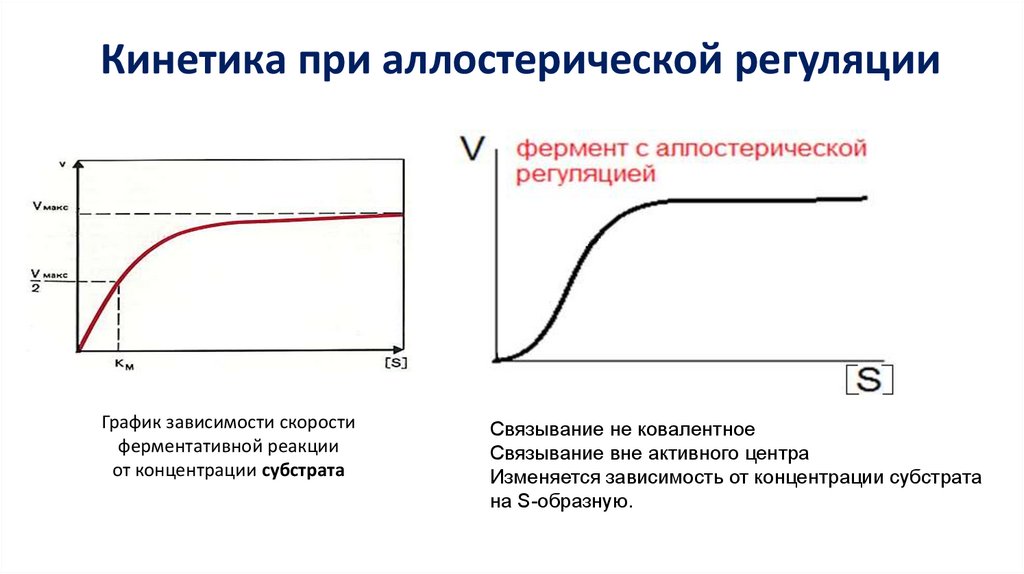
Кинетика при аллостерической регуляцииГрафик зависимости скорости
ферментативной реакции
от концентрации субстрата
Связывание не ковалентное
Связывание вне активного центра
Изменяется зависимость от концентрации субстрата
на S-образную.
9.
Классификация ферментов10.
7 классов ферментовКЛАСС
Катализируемая реакция
Основные подклассы
1. ОКСИДОРЕДУКТАЗЫ
Окислительно-восстановительные реакции
Авосст + Вокисл ↔ Аокисл + Ввосст
оксидазы, редуктазы, гидроксилазы
2. ТРАНСФЕРАЗЫ
Перенос группировок
ацилтрансферазы, гликозилтрансферазы,
аминотрансферазы, киназы
(фосфаттрансферазы) и др.
А-С + В ↔ А + В-С
3. ГИДРОЛАЗЫ
Гидролиз связей с помощью воды
От субстрата отщепляется группа, и на ее место встает ОН- и Н- из расщепляемой воды
А-В + Н2О ↔ А-Н + В-ОН
Эстеразы, фосфатазы, протеазы, липазы,
нуклеазы, тиолазы, гликозидазы
4. ЛИАЗЫ (синтазы)
Образование двойной связи или присоединение по двойной связи.
А-Х-В ↔ А=Х + В
А=В + Х ↔ А-Х-В
Альдегидлиазы (альдолаза), углеродкислородлиазы (фумараза), дегидротазы
(енолазы), декарбоксилазы
5. ИЗОМЕРАЗЫ
Взаимопревращение изомеров
А ↔ изоА
Изомеразы, мутазы
6. ЛИГАЗЫ (синтетазы)
Соединяют две молекулы, используя энергию АТФ (или ГТФ, УТФ).
А + В + АТФ ↔ А-В + АДФ + Фн
Карбоксилазы, синтетазы
7. ТРАНСЛОКАЗЫ
Катализируют перенос ионов или молекул через мембраны или их
разделение в мембранах
Транслокация протонов H+;
неорганических катионов и анионов;
аминокислот и пептидов; углеводов и их
производных и др.
Пример – АТФ-синтаза митохондрий
11.
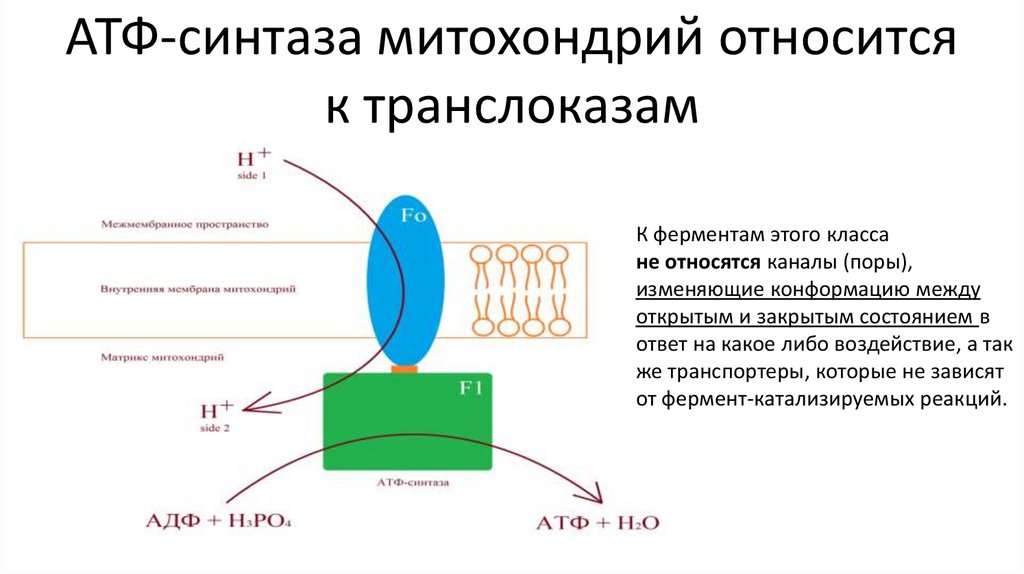
АТФ-синтаза митохондрий относитсяк транслоказам
К ферментам этого класса
не относятся каналы (поры),
изменяющие конформацию между
открытым и закрытым состоянием в
ответ на какое либо воздействие, а так
же транспортеры, которые не зависят
от фермент-катализируемых реакций.
12.
Класс 1. Оксидоредуктазы21 подкласс – по химизму донора и акцептора:
КФ 1.1 включает ферменты, взаимодействующие с CH—OH группой доноров;
КФ 1.2 включает ферменты, взаимодействующие с альдегидной или оксо-группой доноров;
КФ 1.3 включает ферменты, взаимодействующие с CH2—CH2 группой доноров;
КФ 1.4 включает ферменты, взаимодействующие с CH—NH2 группой доноров;
КФ 1.5 включает ферменты, взаимодействующие с CH=NH группой доноров;
и д.р
Дегидрогеназы (ДГ) – переносят водород от донора к акцептору
По акцептору водорода ДГ:
не установлен – “редуктаза”,
O2 – оксидаза,
Н2О2 – пероксидаза (подкласс 1.11).
Оксигеназы (подкласс 1.13)– действуют на единственную молекулу донора и осуществляют прямое
присоединение О (монооксигеназы) или О2 (диоксигеназы) к субстрату
13.
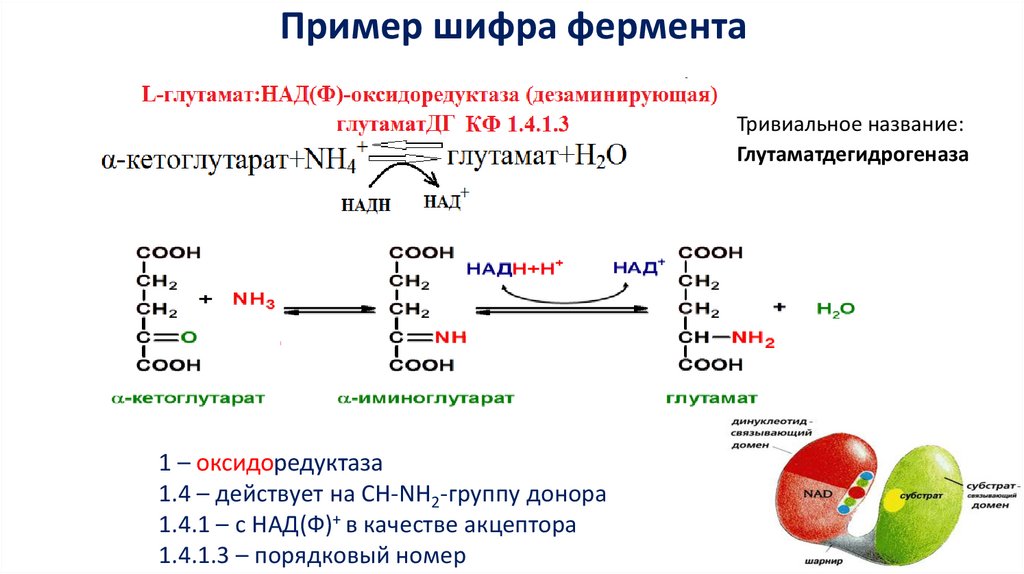
Пример шифра ферментаТривиальное название:
Глутаматдегидрогеназа
1 – оксидоредуктаза
1.4 – действует на СН-NH2-группу донора
1.4.1 – с НАД(Ф)+ в качестве акцептора
1.4.1.3 – порядковый номер
14.
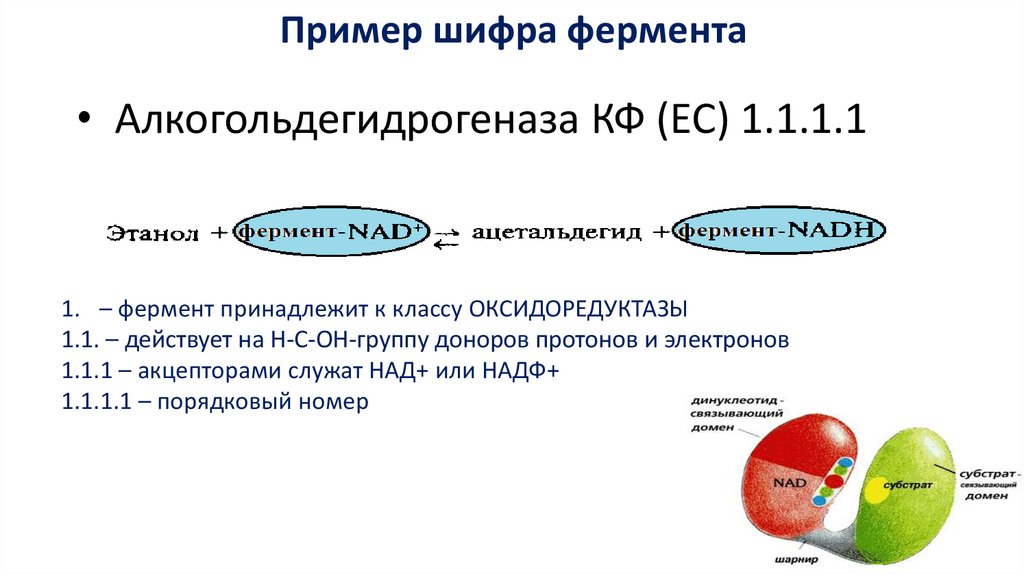
Пример шифра фермента• Алкогольдегидрогеназа КФ (EC) 1.1.1.1
1. – фермент принадлежит к классу ОКСИДОРЕДУКТАЗЫ
1.1. – действует на Н-С-ОН-группу доноров протонов и электронов
1.1.1 – акцепторами служат НАД+ или НАДФ+
1.1.1.1 – порядковый номер
15.
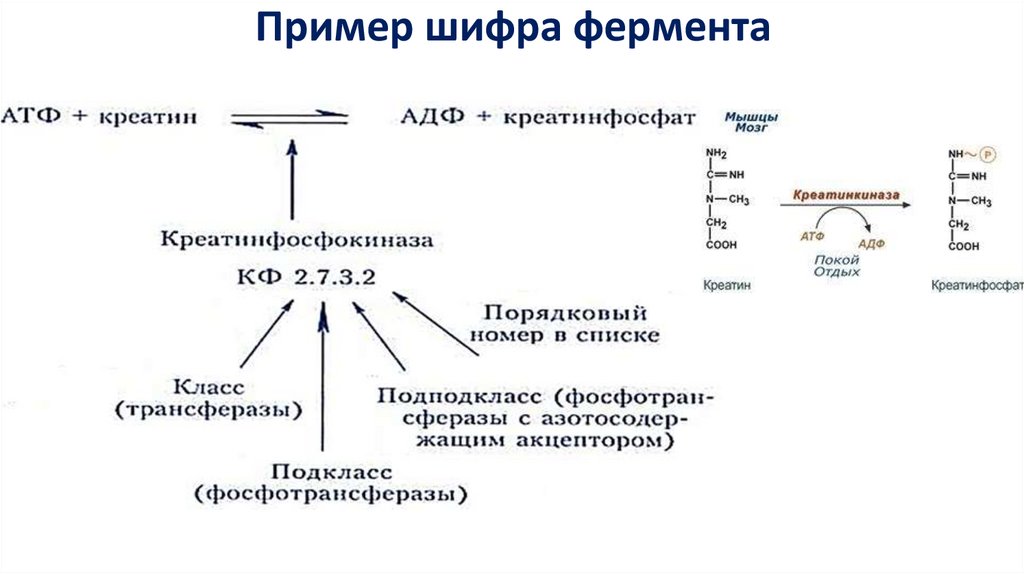
Пример шифра фермента16.
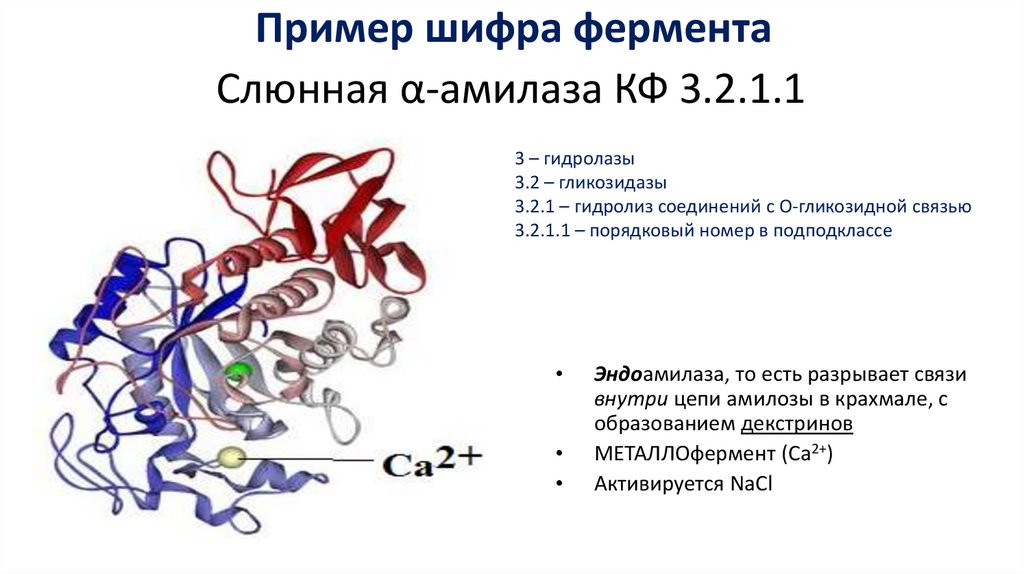
Пример шифра ферментаСлюнная α-амилаза КФ 3.2.1.1
3 – гидролазы
3.2 – гликозидазы
3.2.1 – гидролиз соединений с О-гликозидной связью
3.2.1.1 – порядковый номер в подподклассе
Эндоамилаза, то есть разрывает связи
внутри цепи амилозы в крахмале, с
образованием декстринов
МЕТАЛЛОфермент (Са2+)
Активируется NaCl
17.
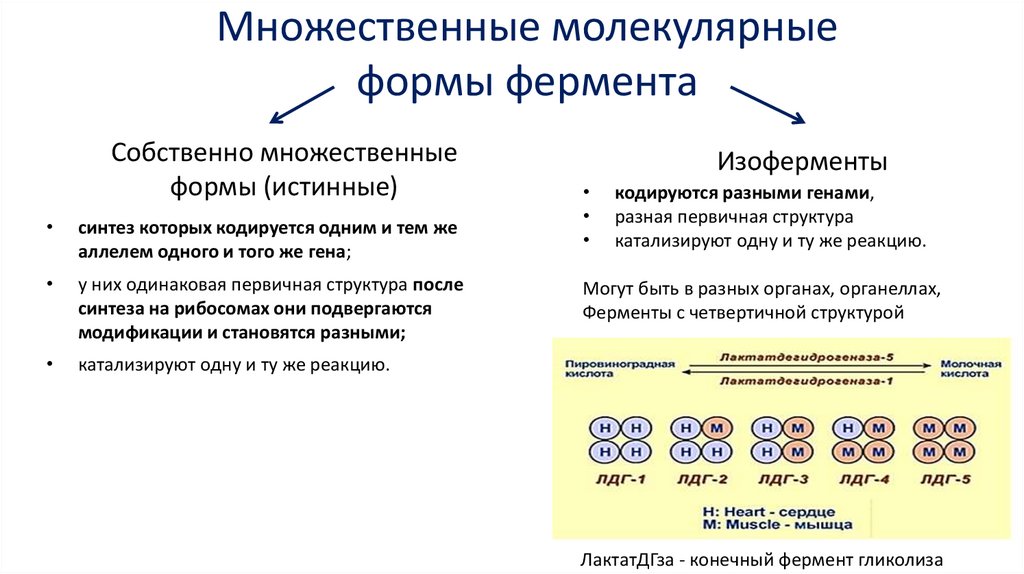
Множественные молекулярныеформы фермента
Собственно множественные
формы (истинные)
синтез которых кодируется одним и тем же
аллелем одного и того же гена;
у них одинаковая первичная структура после
синтеза на рибосомах они подвергаются
модификации и становятся разными;
катализируют одну и ту же реакцию.
Изоферменты
кодируются разными генами,
разная первичная структура
катализируют одну и ту же реакцию.
Могут быть в разных органах, органеллах,
Ферменты с четвертичной структурой
ЛактатДГза - конечный фермент гликолиза
18.
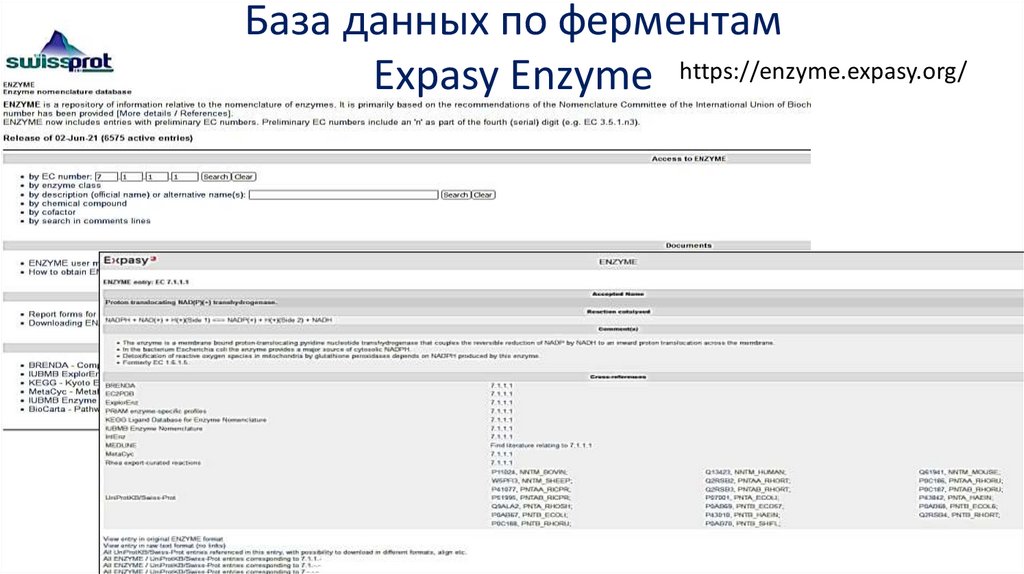
База данных по ферментамExpasy Enzyme https://enzyme.expasy.org/
19.
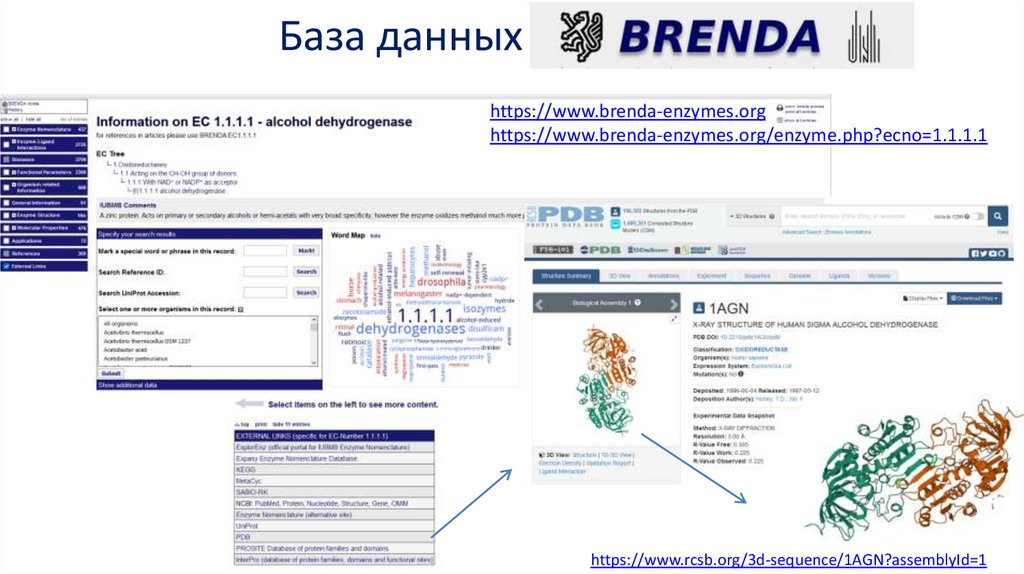
База данныхhttps://www.brenda-enzymes.org
https://www.brenda-enzymes.org/enzyme.php?ecno=1.1.1.1
https://www.rcsb.org/3d-sequence/1AGN?assemblyId=1
20.
База данныхhttps://www.enzyme-database.org/index.php
21.
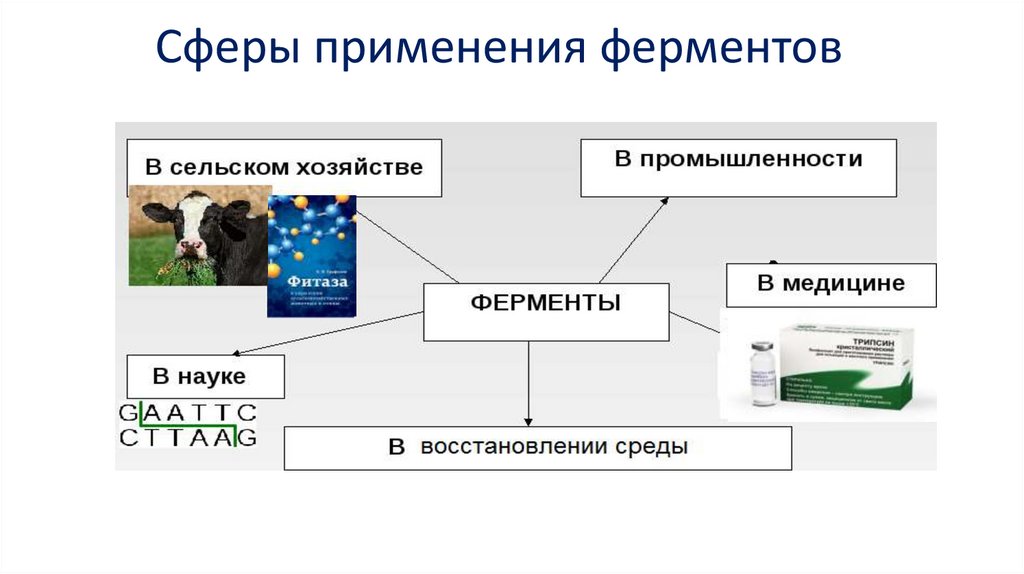
Сферы применения ферментов22.
Ферменты (энзимы) в медицинеЭнзимотерапия - ферменты для лечения.
Пепсин назначают в качестве заместительной терапии при болезнях желудка,
Трипсин - для разжижения мокроты при ингаляциях
Энзимопатология - изучает заболевания, вызванные отсутствием или снижением активности ферментов
(часто - наследственные болезни из-за генетических нарушений). Например:
• фенилпировиноградная олигофрения из-за нарушения обмена фенилаланина при снижении активности
фенилаланингидроксилазы
• галактоземия из-за дефекта галактозо-1-фосфат-уридилтрансферазы;
• гликогенозы из-за дефектов ферментов обмена гликогена;
Энзимодиагностика – ферменты пациента диагностируют о заболевании.
повышение активности аланинаминотрансферазы (АлАТ) и ЛДГ5 в сыворотке крови - при поражении печени
(гепатиты),
повышение активности сывороточной аспартатаминотрансферазы (АсАТ) и ЛДГ1 - при инфаркте миокарда,
повышение активности амилазы в моче – при остром панкреатите.
23.
Пищевая промышленность:Хлебопечение, сыроварение, виноделие, пивоварение...
Производство пива: бета-глюканазы, целлюлазы, протеазы
Для увеличения выхода соков и их осветления используют пектиназы, амилазы,
целлюлазы, др.
Для улучшения вкуса соков из цитрусовых - нарингиназа для разрушения нарингина
(7-рамнозидо- ß-глюкозидо-4,5,7-тригидрокси-флавонон), придающего соку горький вкус.
Для получение безлактозного молока – лактаза
Папаин из папайи, бромелаин из ананаса, фицин из инжира
– для смягчения мяса
Ускорение созревания соленой сельди
– протеиназы микроскопических грибов
24.
Другие отрасли промышленности• Целлюлозно-бумажная (биоотбеливание пульпы, удаление тонеров и чернил при
вторичной переработке бумаги/макулатуры):
ксиланазы, маннаназы, целлюлазы, фенолоксидазы (лакказы)
• Текстильная – мочка льна, биоскоринг (биоварка) тканей и биополировка поверхностей
пектиназы, целлюлазы, протеазы, кутиназы, эстеразы
• Разрушение загрязнений, придание свежести (моющие средства)
- щелочные протеазы, щелочные липазы, щелочные амилазы, щелочные целлюлазы,
щелочные пектиназы
• Получение новых материалов, в том числе полимеров –
широкий набор ферментов
25.
Ферменты в охране и восстановлении среды• В основном – ферментные электроды для мониторинга
ксенобиотиков и токсичных соединений
• иммобилизованные ферменты и
микроорганизмы на биофильтрах и
очистных сооружениях
26.
Особенности окраски сиамских кошек:Акромеланизм связан с температурными
особенностями живого организма: в теплых частях тела
вырабатывается меньше меланина (темного пигмента),
чем в холодных, поэтому уши, лапы, хвост и морда
окрашены в более тёмный по сравнению с остальным
телом цвет.
Это обусловлено активностью фермента тирозиназы,
участвующей в синтезе меланина.
Она активна только при температуре ниже 37оС.
27.
Расщепление белковВ процессе пищеварения
Потребность человека в белке
– 80-100 г/cутки,
из них животного происхождения – 50-70 г.
Внутриклеточное
(собственные белки организма)
Белки расщепляются в результате гидролиза протеиназами (протеазами).
Пептиды расщепляются - пептидазами (амино-, карбокси-, ди-)
это – ферменты класса гидролаз
28.
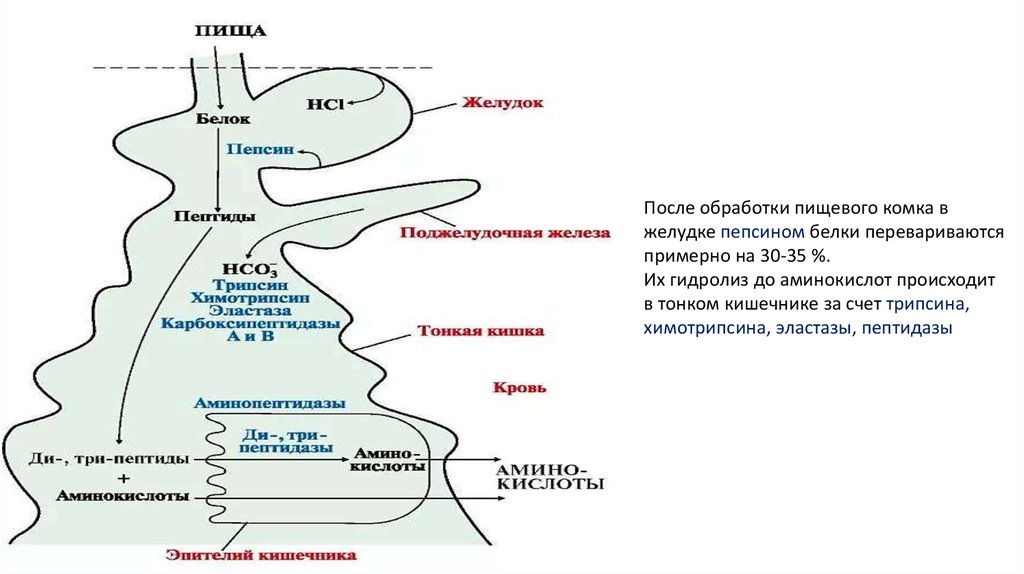
После обработки пищевого комка вжелудке пепсином белки перевариваются
примерно на 30-35 %.
Их гидролиз до аминокислот происходит
в тонком кишечнике за счет трипсина,
химотрипсина, эластазы, пептидазы
29.
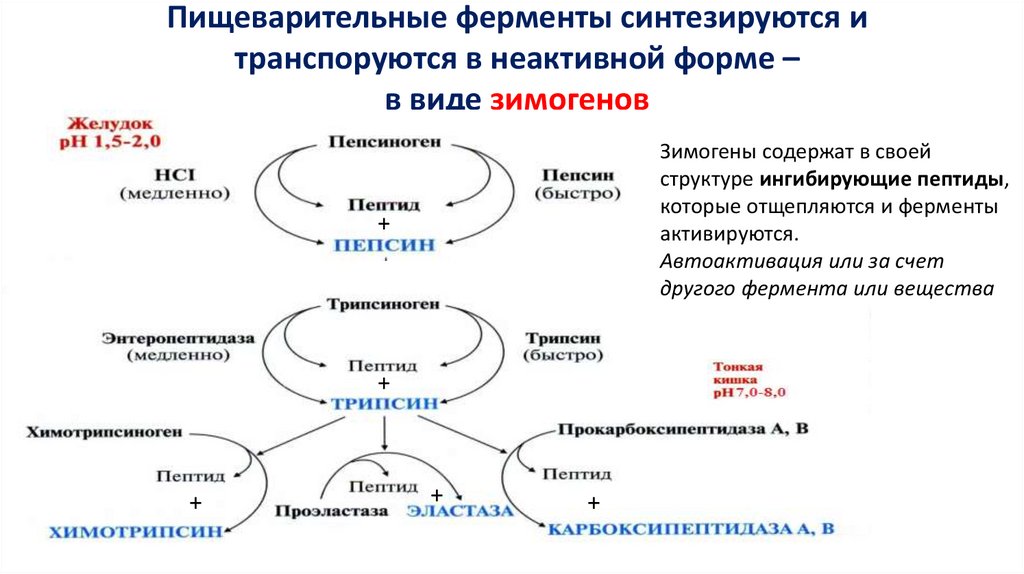
Пищеварительные ферменты синтезируются итранспоруются в неактивной форме –
в виде зимогенов
Зимогены содержат в своей
структуре ингибирующие пептиды,
которые отщепляются и ферменты
активируются.
Автоактивация или за счет
другого фермента или вещества
+
+
+
+
+
30.
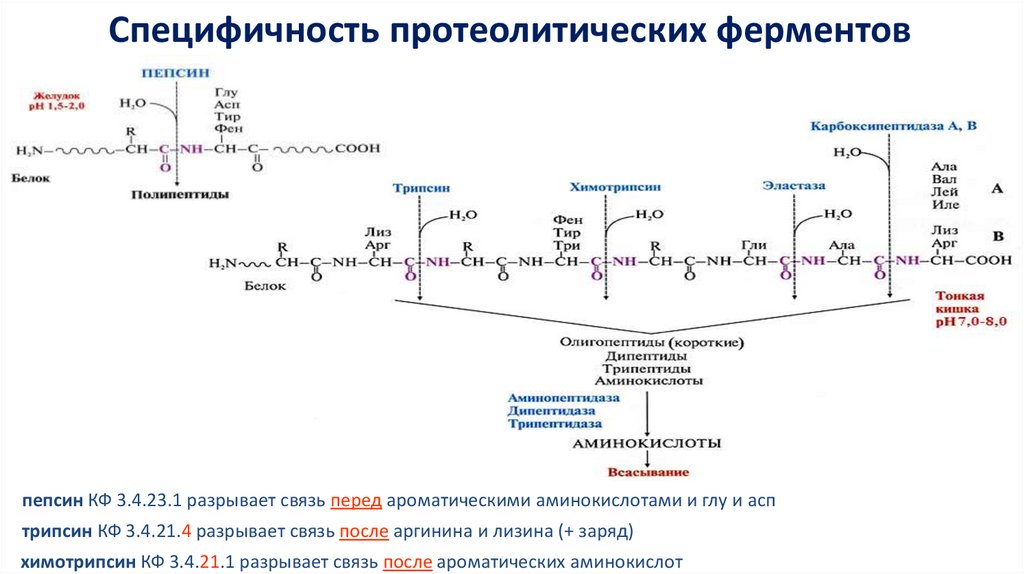
Специфичность протеолитических ферментовпепсин КФ 3.4.23.1 разрывает связь перед ароматическими аминокислотами и глу и асп
трипсин КФ 3.4.21.4 разрывает связь после аргинина и лизина (+ заряд)
химотрипсин КФ 3.4.21.1 разрывает связь после ароматических аминокислот
31.
Субстратсвязывающий сайтопределяет субстратную специфичность фермента
гидрофобный карман
химотрипсина
Химотрипсин разрывает пептидную
связь после ароматических
аминокислот
трипсин связывает “+” заряженные
Трипсин разрывает пептидную связь
после диаминомонокарбоновых
аминокислот
32.
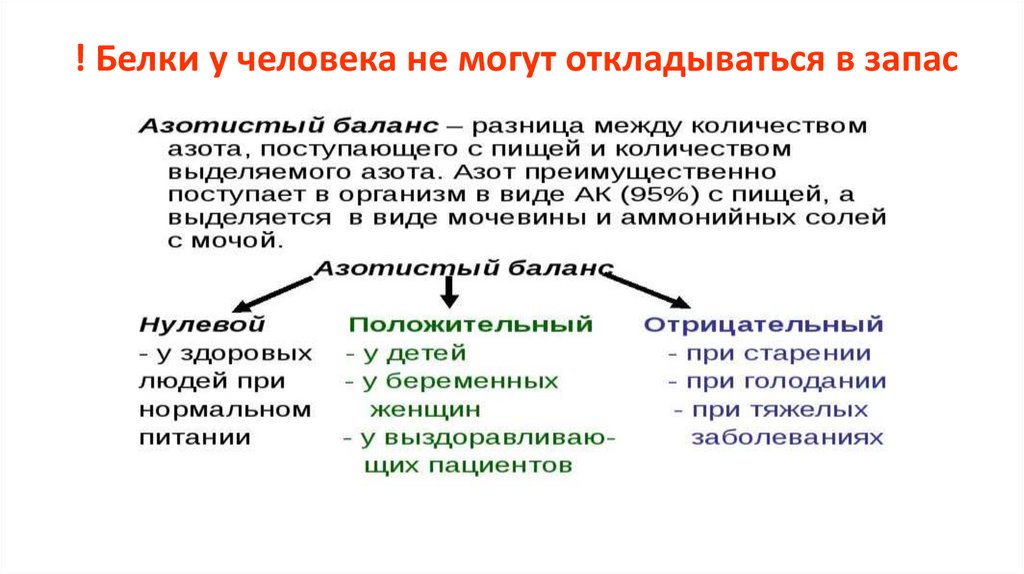
! Белки у человека не могут откладываться в запас33.
Продолжительность существования белка1) описывается временем полужизни – периодом, за который распадется 50% молекул данного белка.
2) задается:
-
N-концевой аминокислотой (стабилизируют - Met, Ser, Thr, Ala, Val, Cys, Gly, и Pro, остальные 12 вызывают
протеолитическую атаку);
-
аминокислотными последовательностями в первичной структуре;
-
защитой:
а) углеводным компонентом
(гликопротеин церулоплазмин существует в крови до в крови 50 ч, после отщепления от углеводной части концевой углевода
(сиаловой к-ты) – удаляется в печени за минуты);
б) белками-шаперонами ;
в) специальными структурами (сигналраспознающая частица);
г) быстрым транспортом в защищенные компартменты.
34.
4 группы белков (животных) по времениполужизни:
1) очень быстро обновляющиеся (1-2ч),
2) быстро обновляющиеся (1-24 ч),
3) медленно обновляющиеся (1-5 дней),
4) очень медленно обновляющиеся (время полужизни >5 дней)
Время полужизни зависит от функции: структурные белки
живут дольше, регуляторные - быстро обновляются
35.
Внутриклеточное расщепление белков-
в лизосомах (рН менее 4.5, большое количество протеолитических ферментов
(в основном – это катепсины) и других гидролитических ферментов);
- свободными цитозольными протеиназами (каспазы - протеолитические ферменты,
относящихся к семейству цистеиновых протеаз (цистин в активном центре), расщепляющих белки
исключительно после аспартата. Каспазы играют важную роль в процессах гибели клетки (апоптоза,
некроза и воспалительных процессах).
- в протеасомах (80-90% внутриклеточных белков, убиквитин-зависимым
или убиквитин-независимым способом)
36.
Подготовка к опросу на занятии иколлоквиуму
• Отличие и сходство ферментов с небиологическими катализаторами
• Строение ферментов. Особенности активного центра.
• Кофакторы сложных ферментов. Строение НАД, ФАД, КоА
• Энергия активации и кинетика ферментативной реакции. Константа
Михаэлиса.
• Регуляция работы ферментов. Аллостерический центр.
• Классификация ферментов и множественные молекулярные формы.
• Расщепление белков при пищеварении. Активация и специфичность
протеолитических ферментов ЖКТ.
37.
Единицы активности фермента1971, Комиссия по ферментам Международного Союза биохимиков (IUB)
1 МЕ (IU или U) = кол-во фермента, обеспечивающее превращение субстрата со
скоростью 1 мкмоль в минуту в определенных условиях реакции.
CИ: 1 Катал (кат) = ..., со скоростью 1 моль субстрата в секунду
1 МЕ = 0, 000 000 016 667 кат
1 кат = 60 000 000 МЕ
На промышленно выпускаемых препаратах ферментов указывают МЕ (обычно от 100 до
10000)
Удельная активность
Это количество единиц активности фермента, приходящееся на 1 мг белка
(любого, не только этого фермента) в ферментативном препарате.






















 Биология
Биология








