Похожие презентации:
Белки, ферменты
1. Биохимия белков и ферментов
2. Структурные единицы белков – аминокислоты Классификация аминокислот
1.2.
3.
4.
5.
6.
Неполярные (гидрофобные)
Полярные (гидрофильные)
Ароматические
(главным образом неполярные)
Отрицательно заряженные
Положительно заряженные
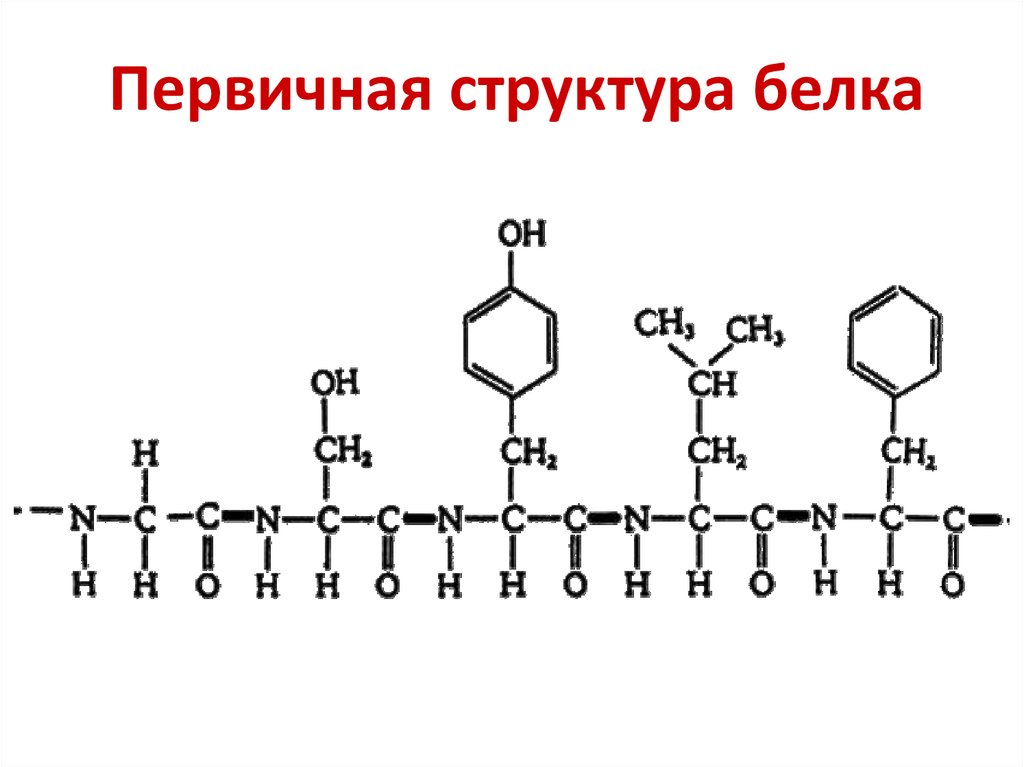
3. Первичная структура белка
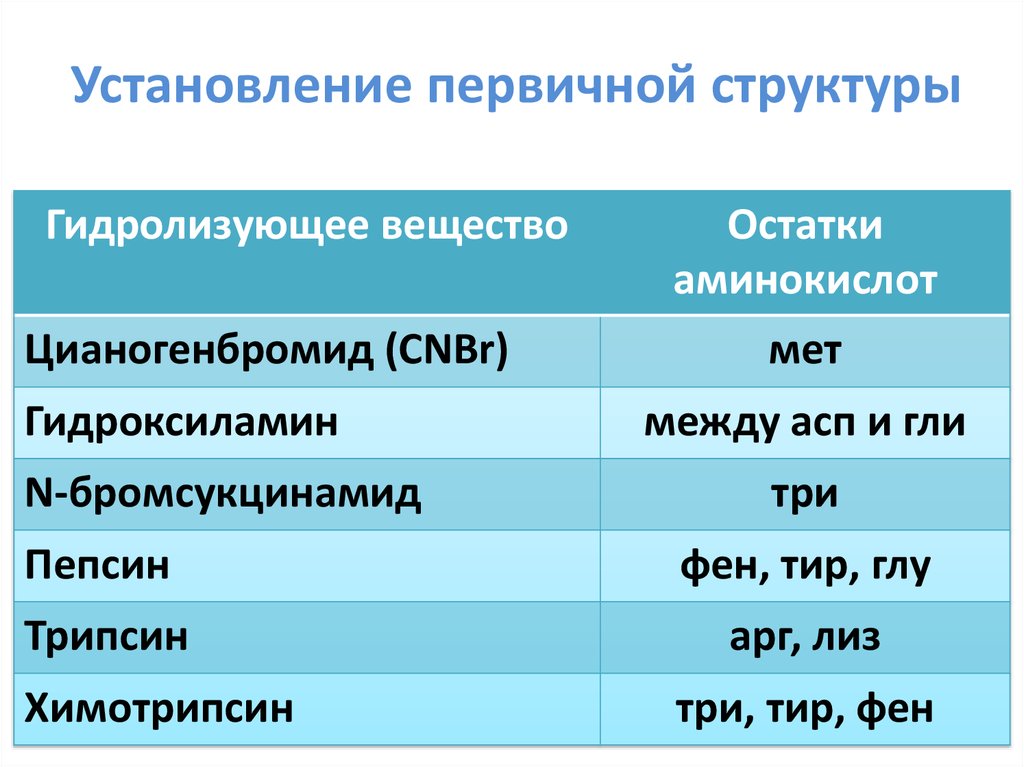
4. Установление первичной структуры
Гидролизующее веществоЦианогенбромид (CNBr)
Гидроксиламин
N-бромсукцинамид
Остатки
аминокислот
мет
между асп и гли
три
Пепсин
фен, тир, глу
Трипсин
арг, лиз
Химотрипсин
три, тир, фен
5. Вторичная структура белка
-спиральβ-складчатый слой
6. Третичная структура белка
7. Типы связей
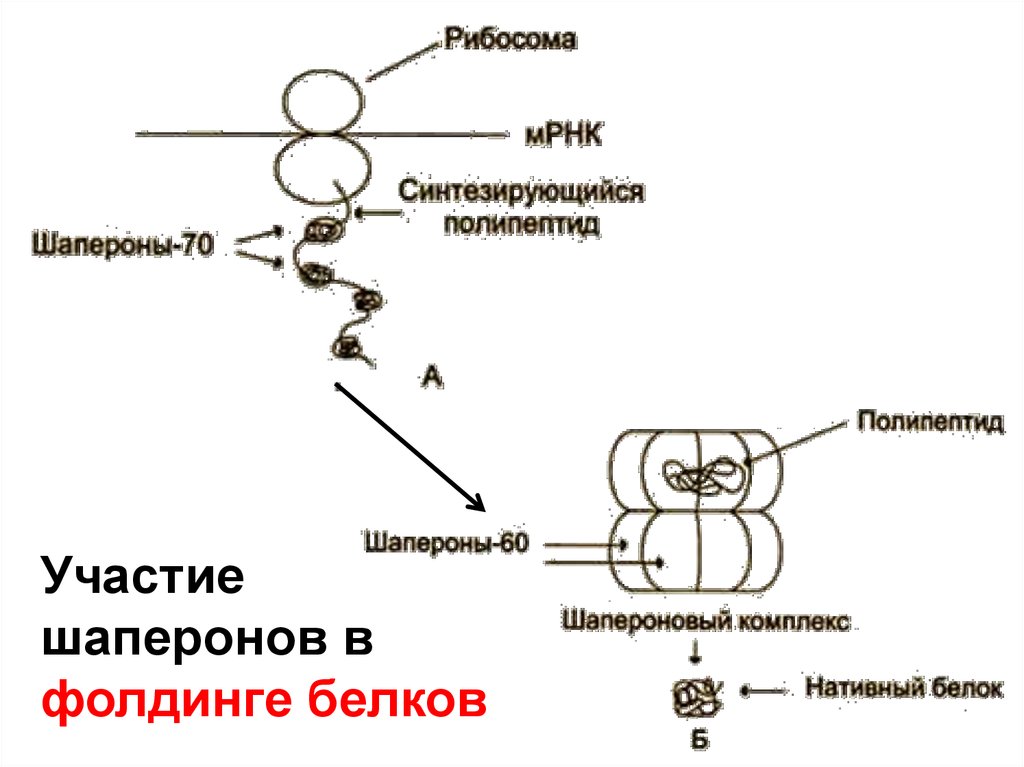
8.
Участиешаперонов в
фолдинге белков
9.
Глобулярные домены в gкристаллине (белке хрусталика глаза)10. Четвертичная структура гемоглобина
11.
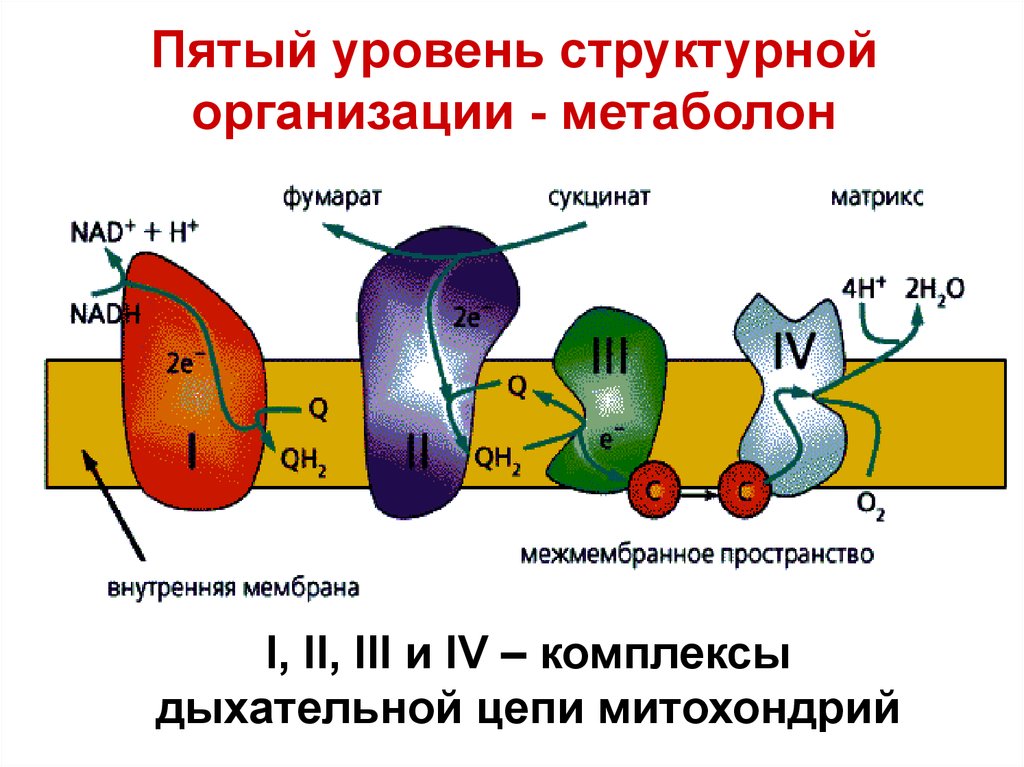
Пятый уровень структурнойорганизации - метаболон
I, II, III и IV – комплексы
дыхательной цепи митохондрий
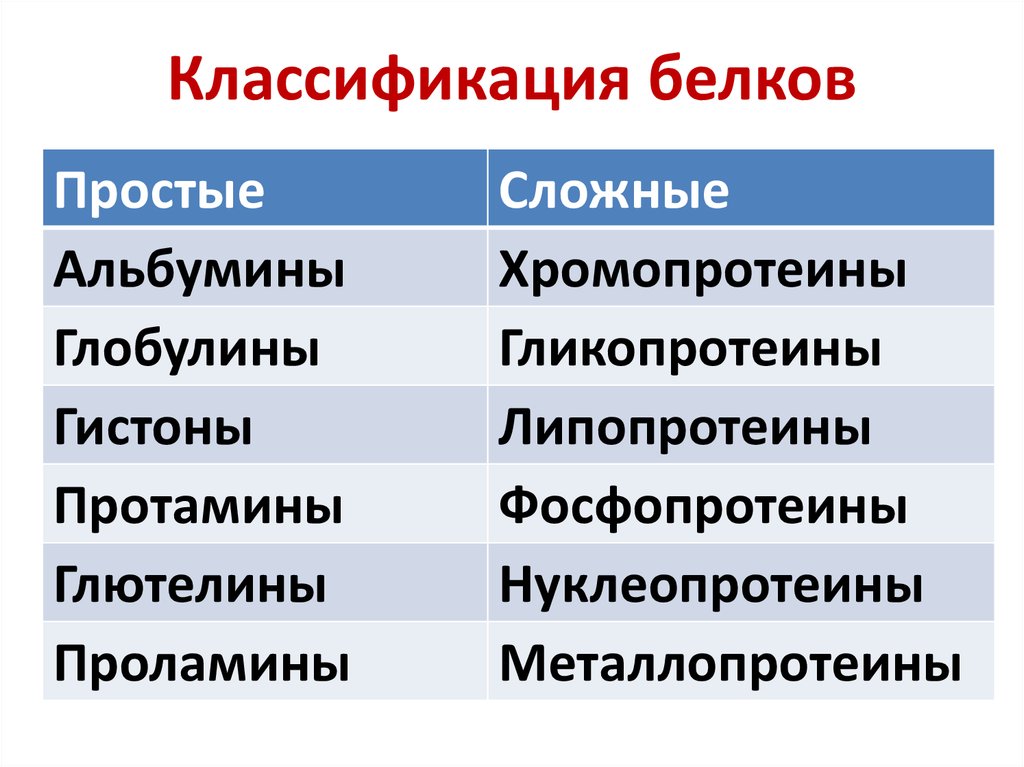
12. Классификация белков
ПростыеАльбумины
Глобулины
Гистоны
Протамины
Глютелины
Проламины
Сложные
Хромопротеины
Гликопротеины
Липопротеины
Фосфопротеины
Нуклеопротеины
Металлопротеины
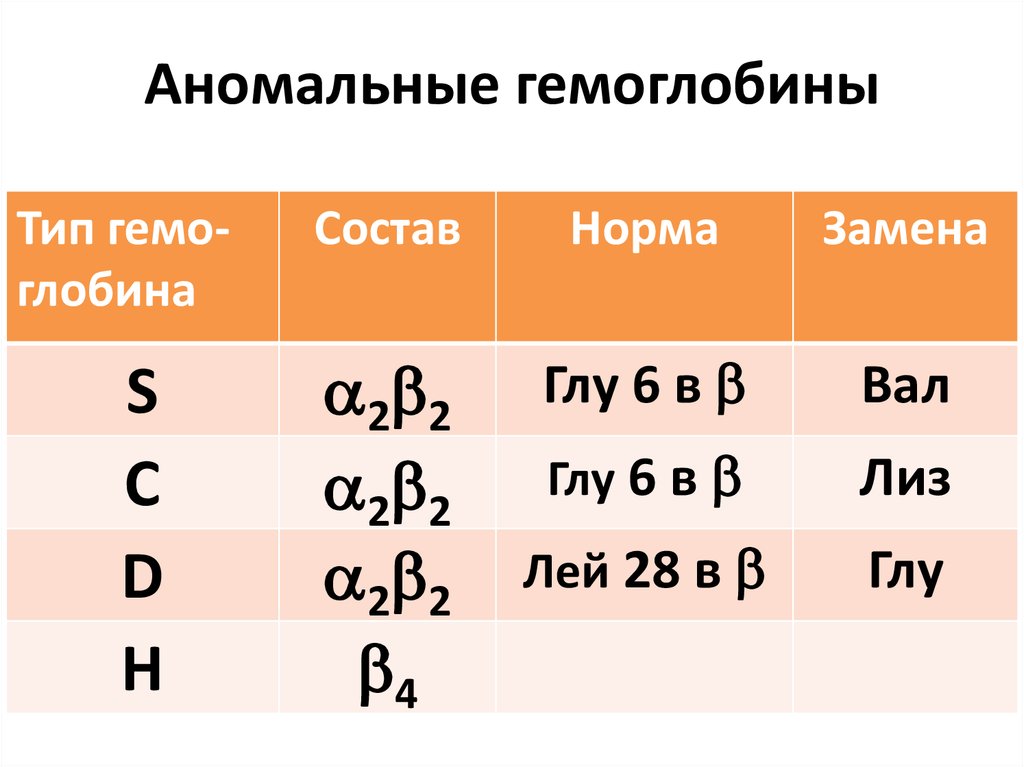
13. Аномальные гемоглобины
Тип гемоглобинаS
С
D
Н
Состав
Норма
Замена
2 2
2 2
2 2
4
Глу 6 в
Вал
Глу 6 в
Лиз
Лей 28 в
Глу
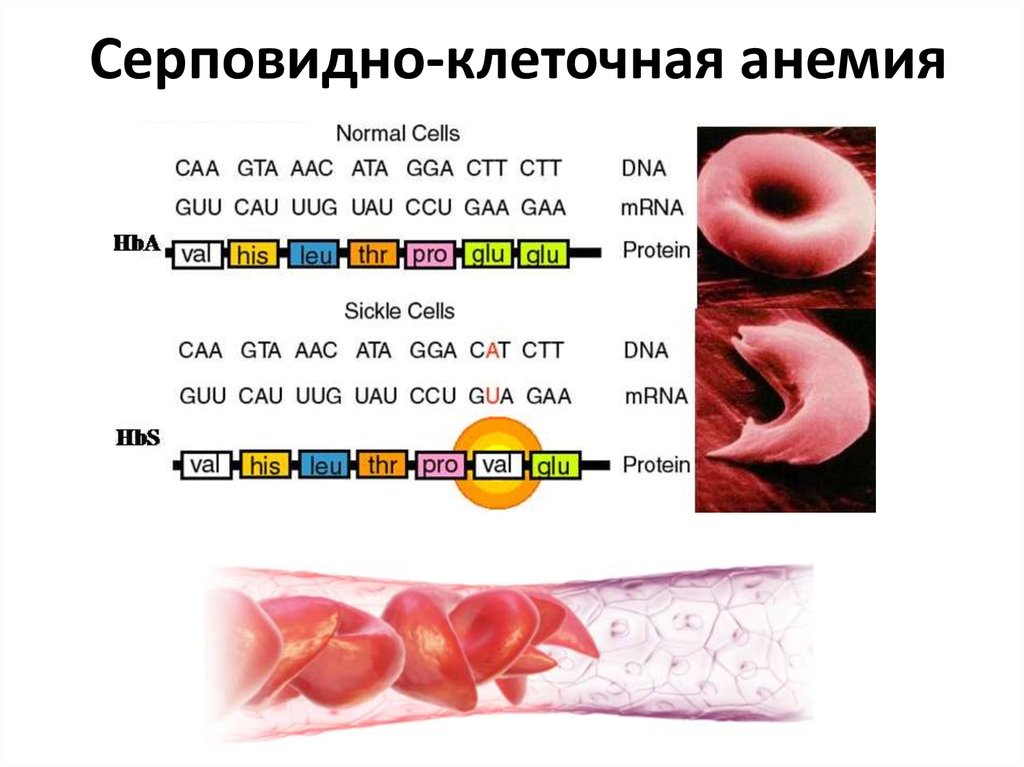
14. Серповидно-клеточная анемия
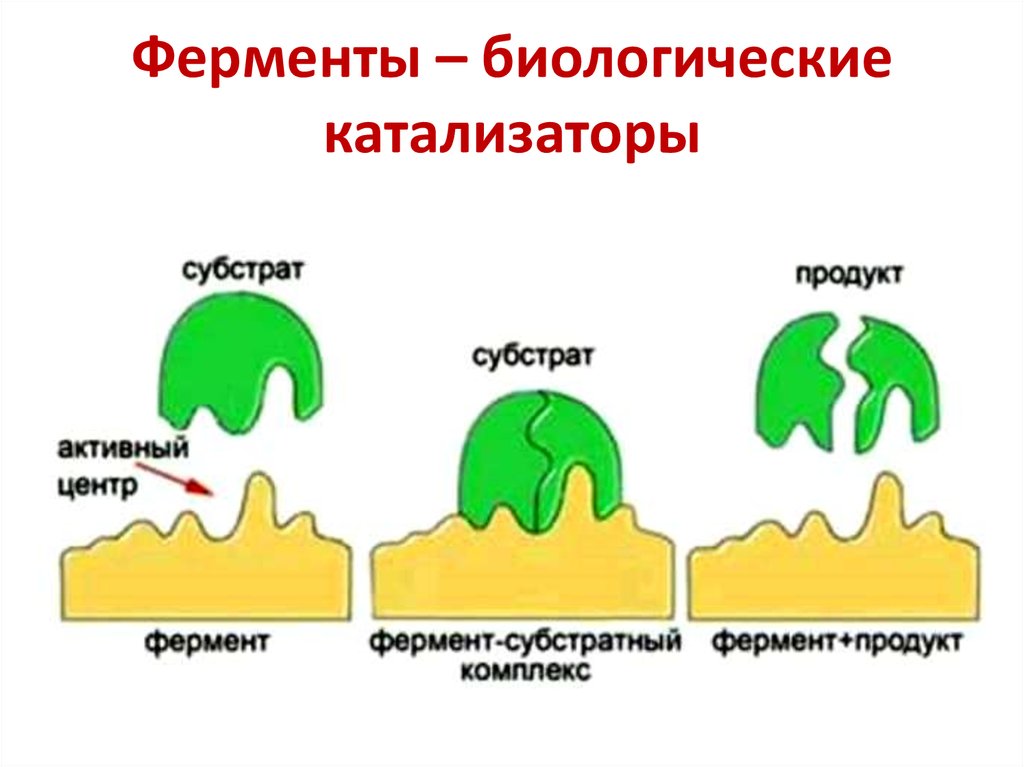
15. Ферменты – биологические катализаторы
16. Классификация ферментов
1. Оксидоредуктазы2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы
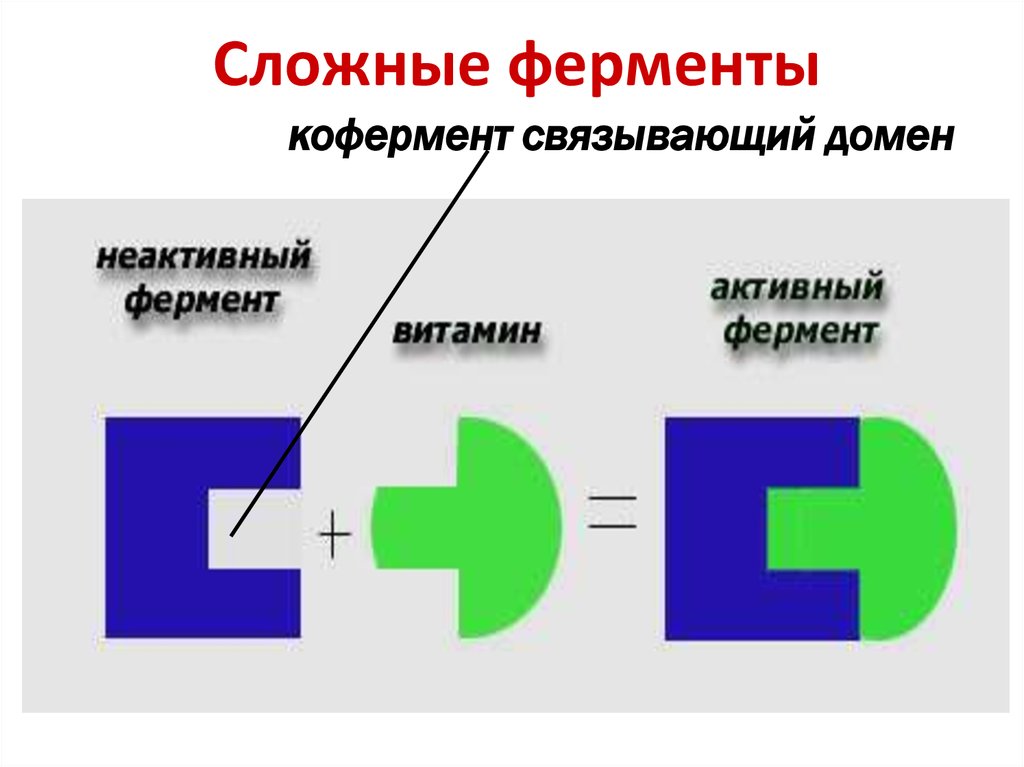
17. Сложные ферменты
кофермент связывающий домен18.
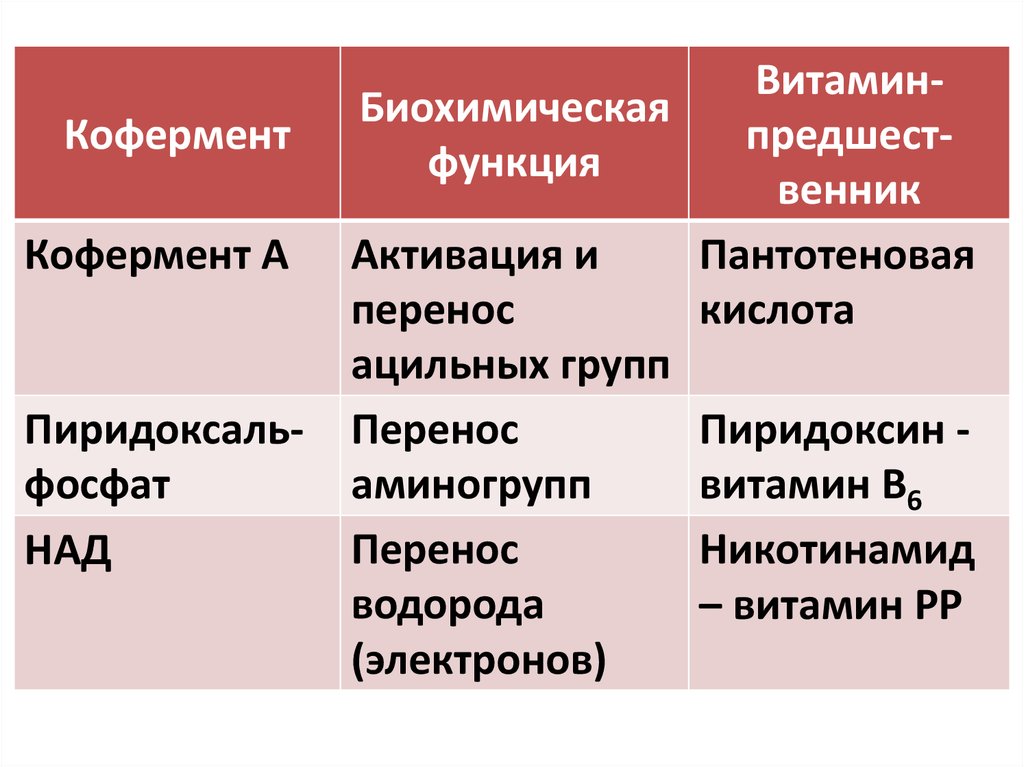
КоферментКофермент А
Пиридоксальфосфат
НАД
ВитаминБиохимическая
предшестфункция
венник
Активация и
Пантотеновая
перенос
кислота
ацильных групп
Перенос
Пиридоксин аминогрупп
витамин В6
Перенос
Никотинамид
водорода
– витамин РР
(электронов)
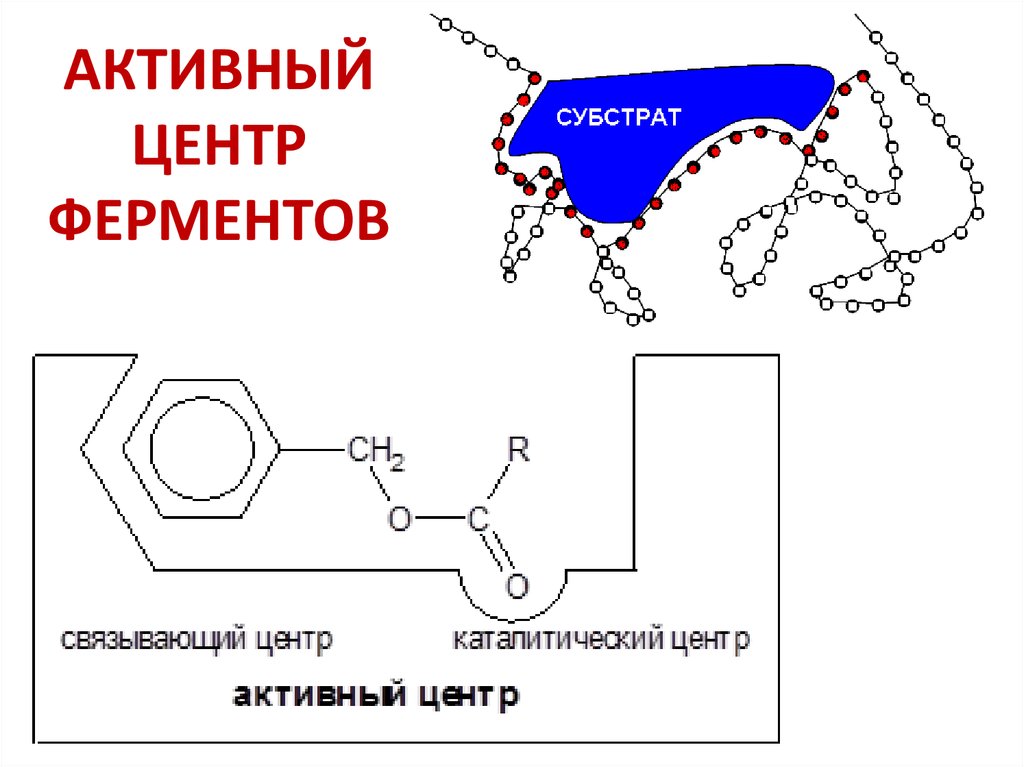
19. АКТИВНЫЙ ЦЕНТР ФЕРМЕНТОВ
20. Аллостерический фермент
Активныйцентр
Аллостерический
центр
21. Полифункциональный фермент
Киназный доменФосфатазный домен
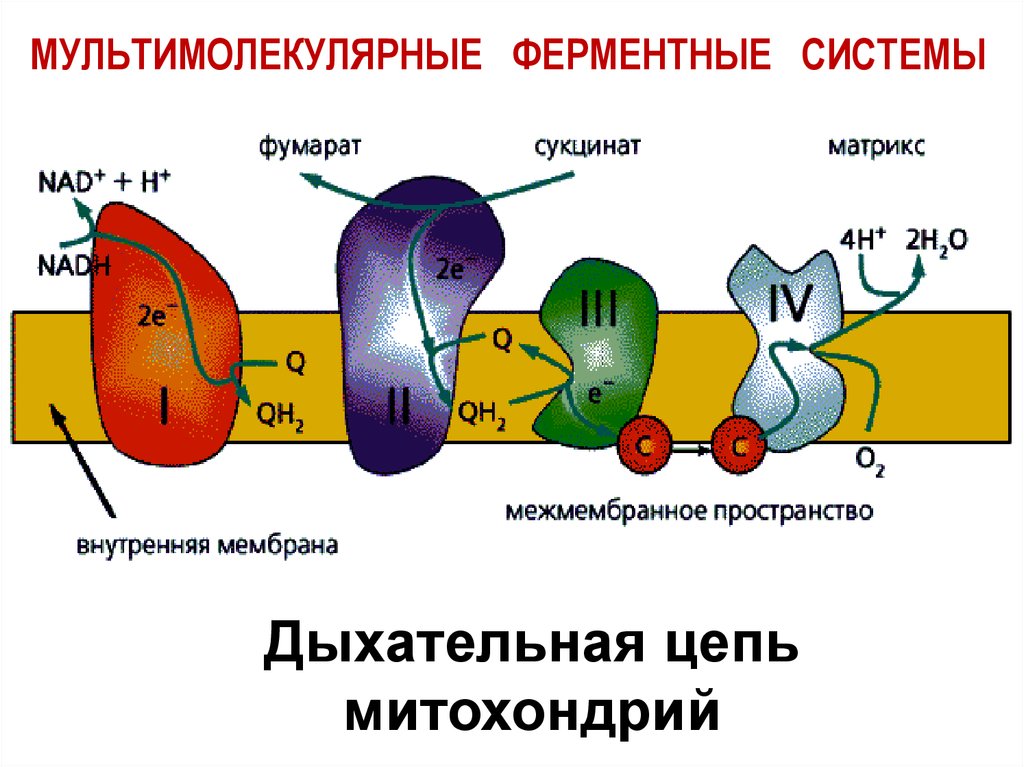
22. МУЛЬТИМОЛЕКУЛЯРНЫЕ ФЕРМЕНТНЫЕ СИСТЕМЫ
Дыхательная цепьмитохондрий
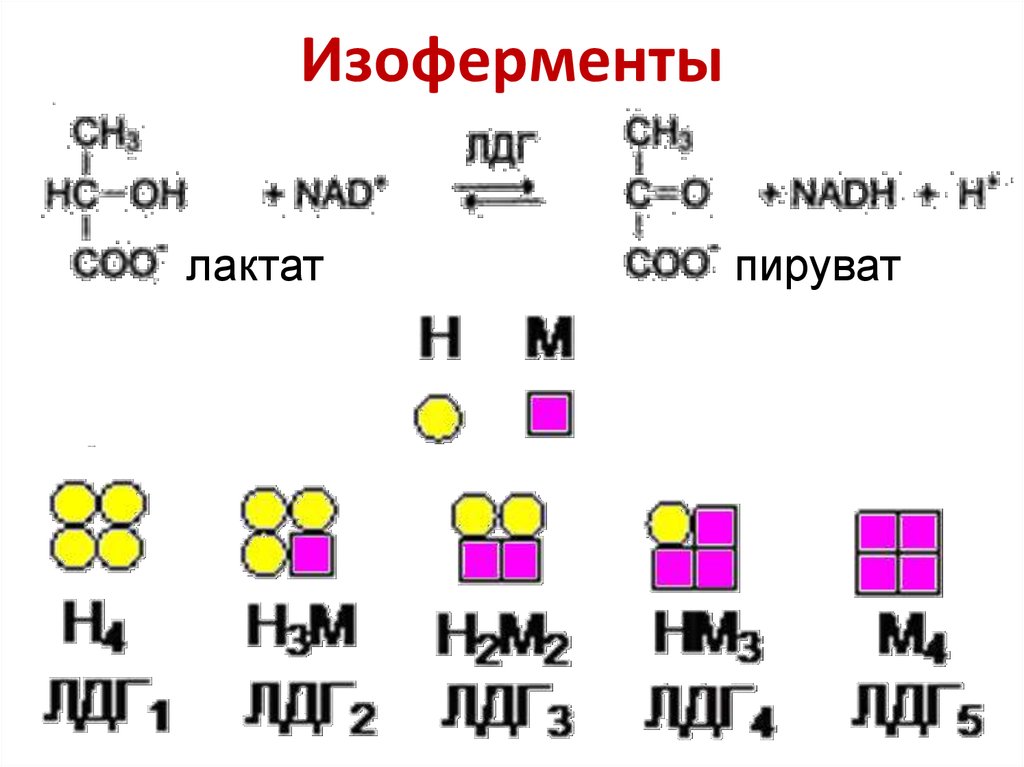
23. Изоферменты
лактатпируват
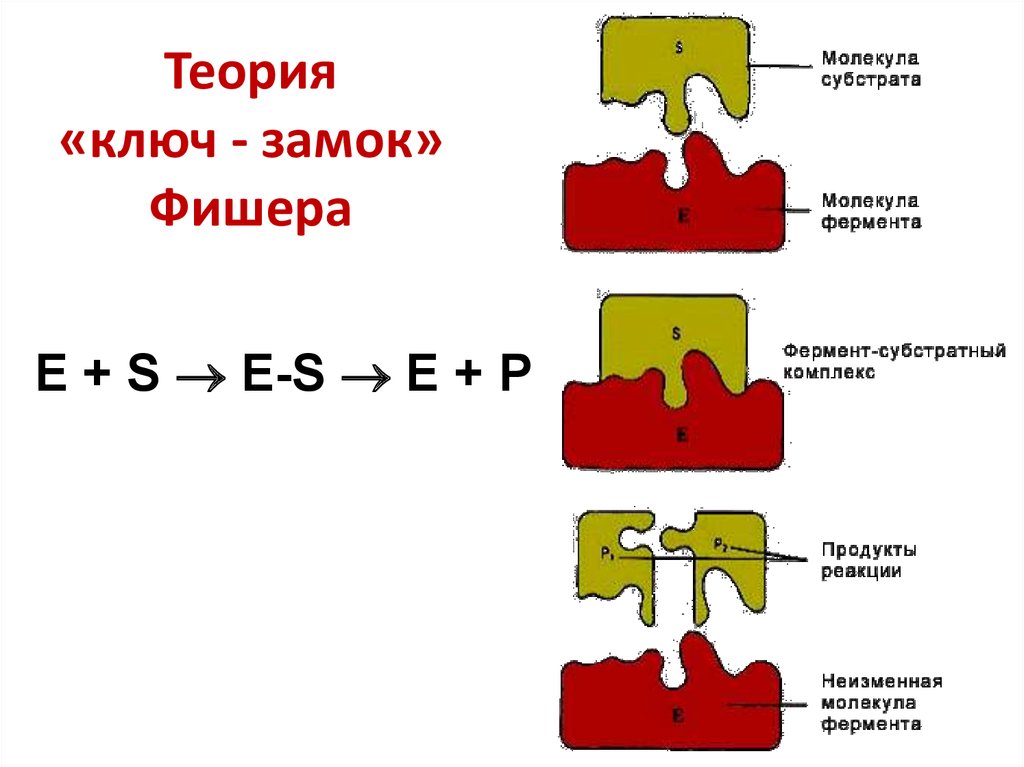
24. Теории ферментативного катализа Герман Эмиль Фишер (1852 – 1919)
25. Теория «ключ - замок» Фишера
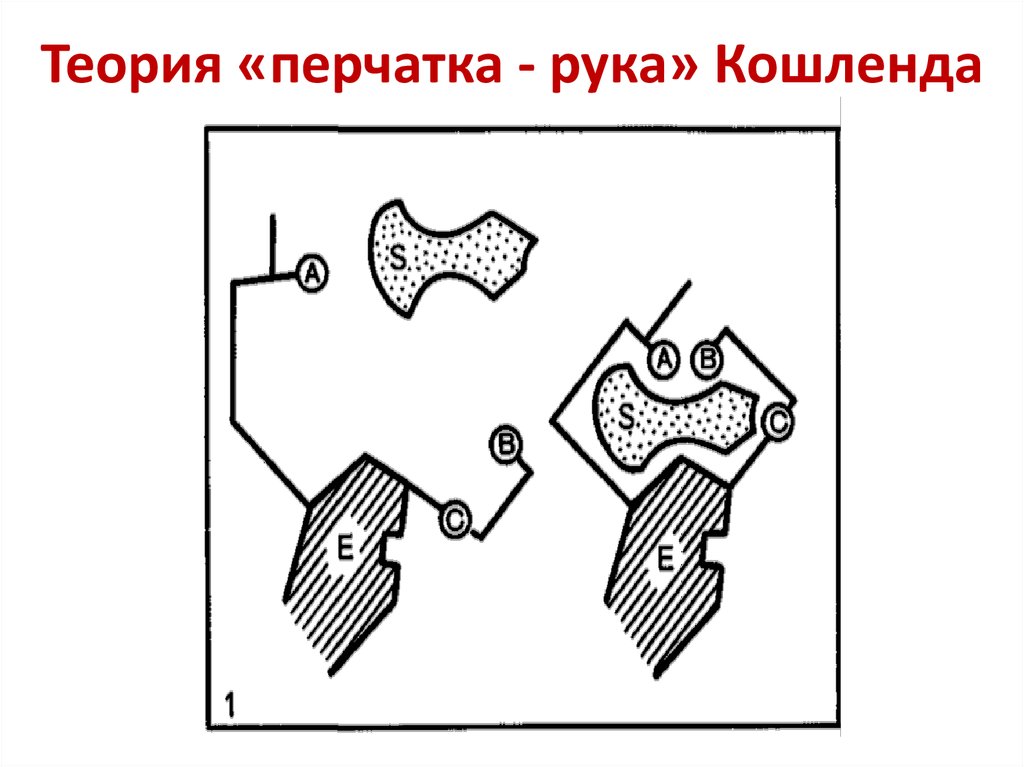
E + S E-S E + P26. Дэниел Кошланд (1920 – 2007)
27. Теория «перчатка - рука» Кошленда
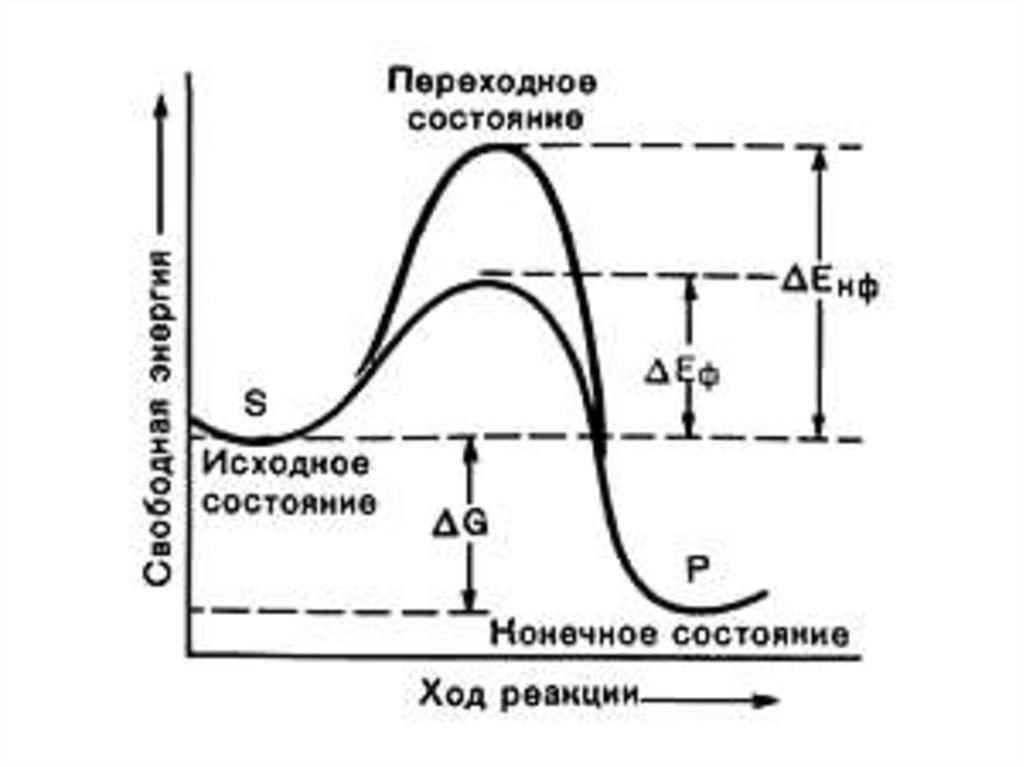
28.
Гипотеза топохимическогосоответствия
29.
Ферментативнаякинетика
30.
31. МИХАЭЛИС Леонор
МЕНТЕН Мод Леонора32.
УравнениеМихаэлиса-Ментен
Уравнение
Бриггса-Холдейна
max [ S ]
K m [S ]
Vmax [ S ]
KS [ S ]
33.
Зависимость скорости ферментативнойреакции от концентрации субстрата
34.
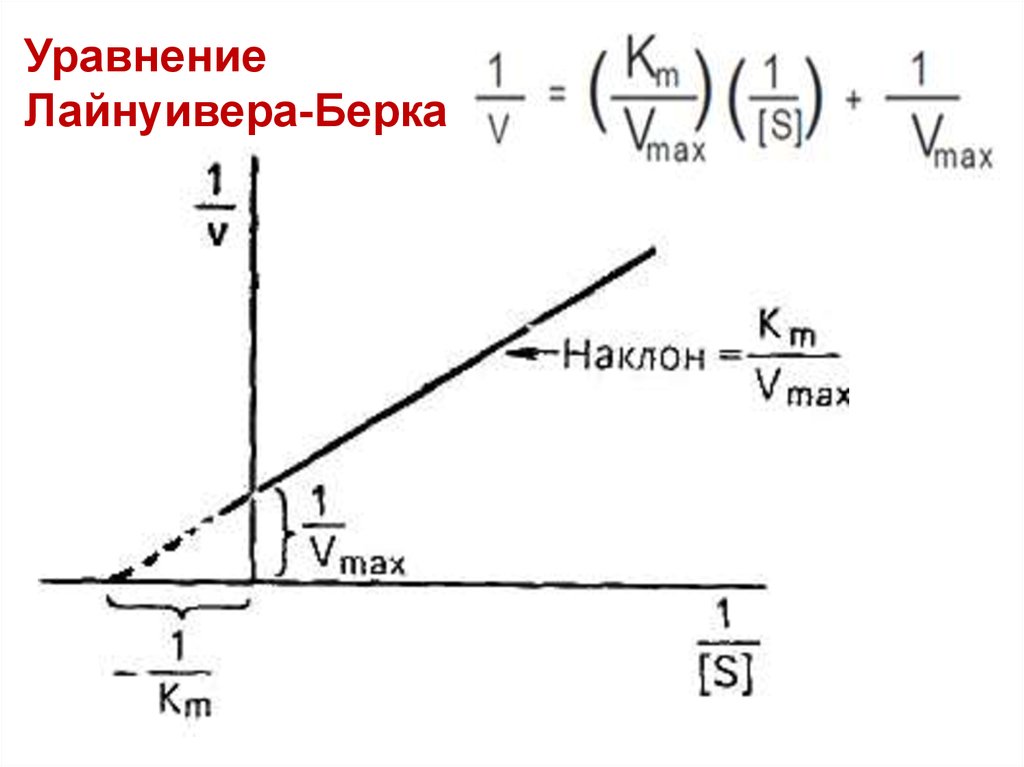
УравнениеЛайнуивера-Берка
35.
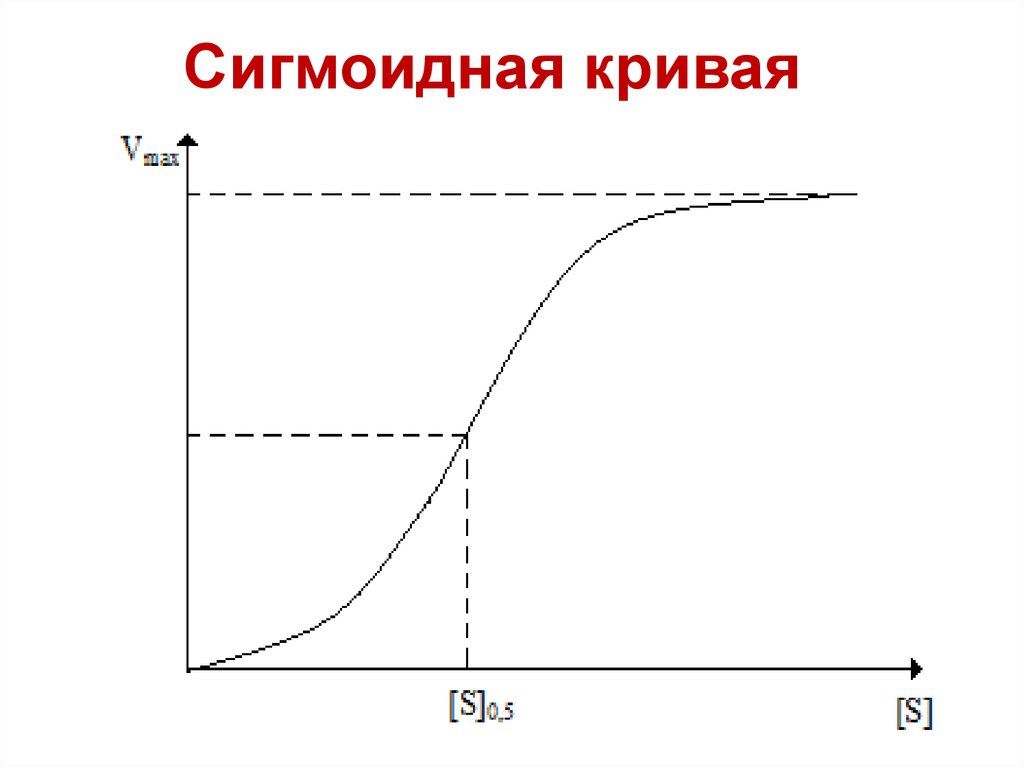
Сигмоидная кривая36.
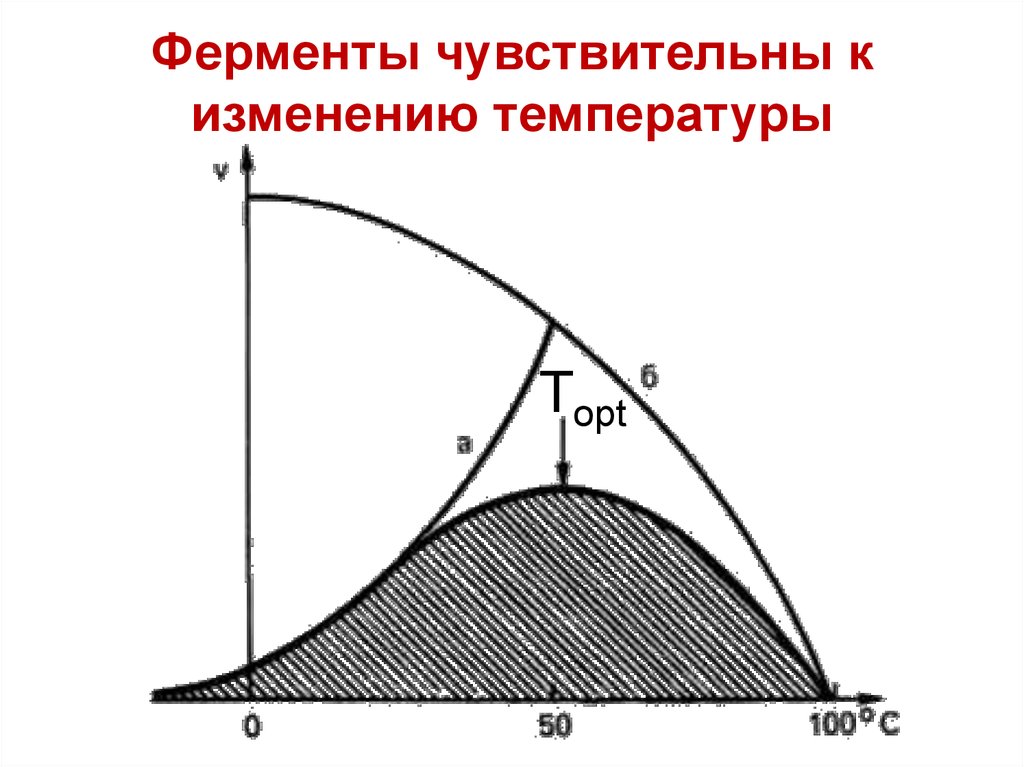
Ферменты чувствительны кизменению температуры
Тopt
37.
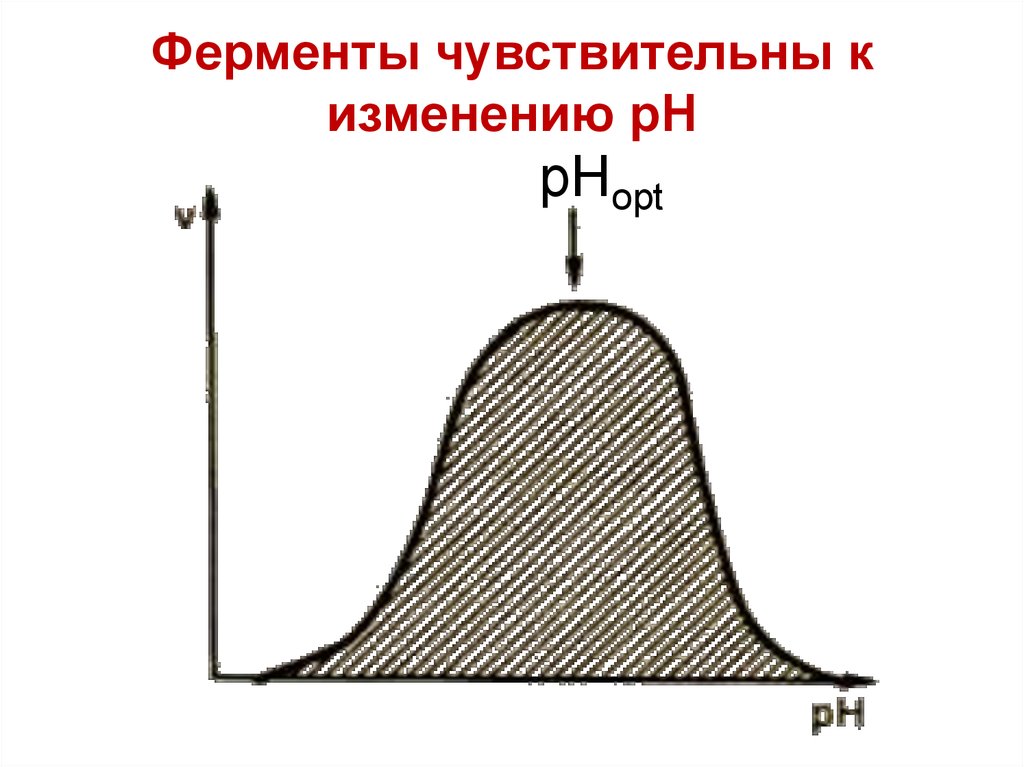
Ферменты чувствительны кизменению рН
pHopt
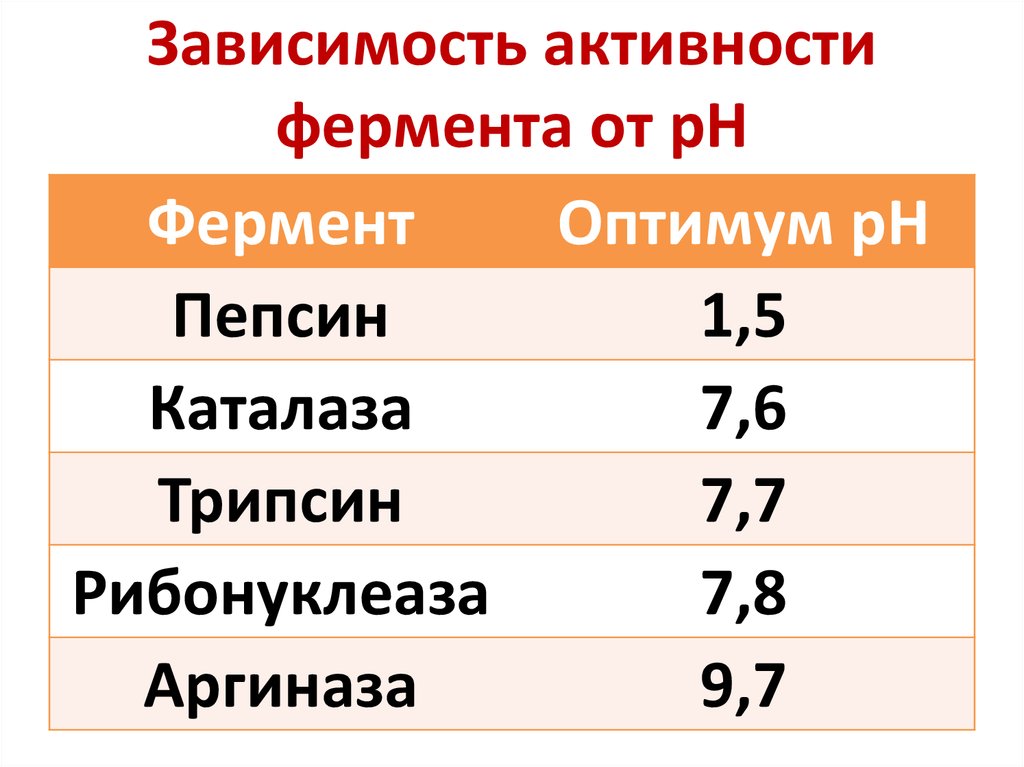
38. Зависимость активности фермента от рН
ФерментОптимум рН
Пепсин
1,5
Каталаза
7,6
Трипсин
7,7
Рибонуклеаза
7,8
Аргиназа
9,7
39. Ферменты специфичны (действуют только на определенный субстрат)
40. Уреаза
Абсолютная специфичностьУреаза
CO(NH2)2 + 2H2O = H2O + CO2 + 2NH3
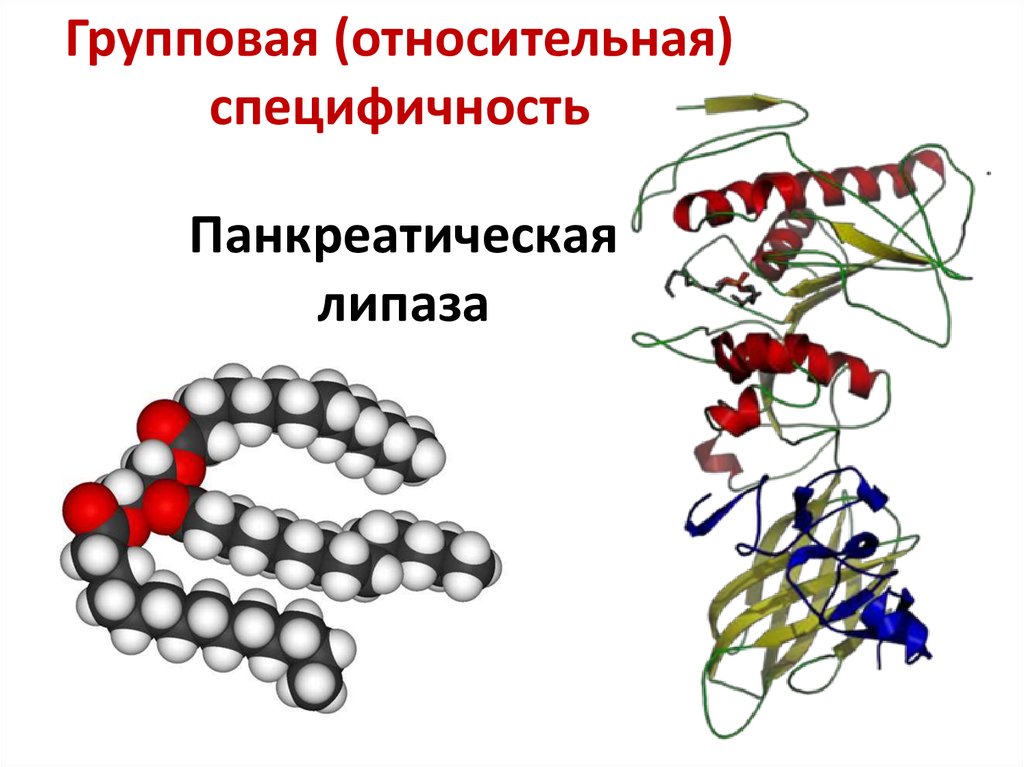
41. Панкреатическая липаза
Групповая (относительная)специфичность
Панкреатическая
липаза
42. Фумараза (малатдегидрогеназа)
СтереоспецифичностьФумараза
(малатдегидрогеназа)
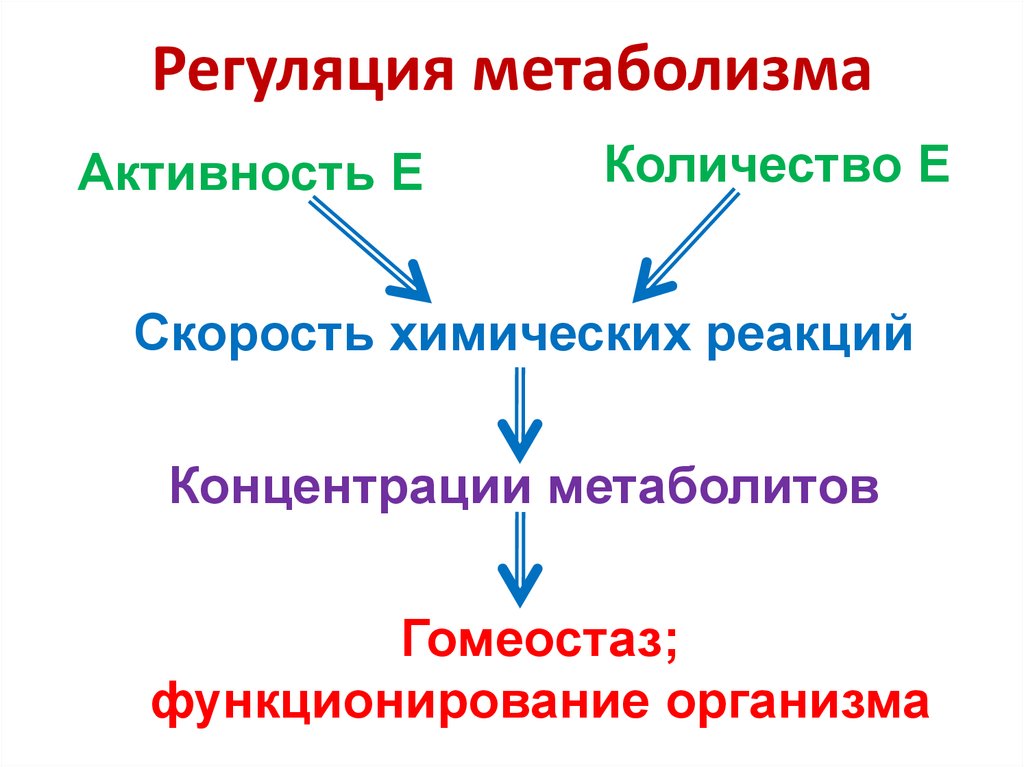
43. Регуляция метаболизма
Активность ЕКоличество Е
Скорость химических реакций
Концентрации метаболитов
Гомеостаз;
функционирование организма
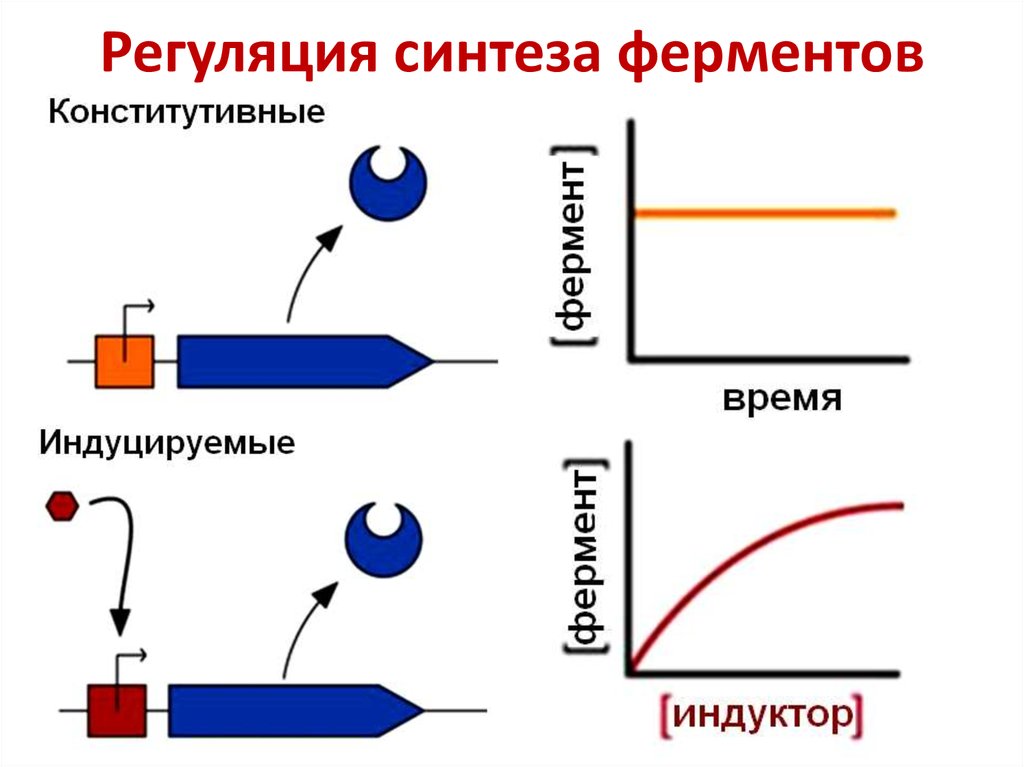
44. Регуляция синтеза ферментов
45. Регуляция активности ферментов
46. Единицы ферментативной активности
Е (U) =1мкмоль/мин
1 кат = 1 моль/с
47. Активаторы ферментов
ФерментАктиватор
2+
Цитохромы
Fe
2+
Холинэстераза
Mn
Амилаза
Сl
Желчные
Липаза
кислоты
48. Типы ингибирования
неспецифическое
специфическое
необратимое
обратимое
конкурентное
неконкурентное
бесконкурентное
























 Биология
Биология








