Похожие презентации:
Термодинамика и кинетика
1.
Термодинамика и кинетикаТермодинамика
Кинетика
принципиальная
Возможность возможность
реакции
(возможна ли
реакция вообще)
если протекает, то
быстро или
медленно
не важен,
Путь реакции
не учитывается
механизм реакции
Величины
скорость реакции
энергия
2NO (г) + O2(г) = 2NO2 (г); G0298= -70 кДж
2H2 (г) + O2(г) = 2H2O(г); G0298 = -447 кДж
2. Термодинамика и кинетика
Химическая кинетикаизучает скорости химических реакций, их
зависимость от различных факторов и механизмы
реакций
Механизм реакции – последовательность и
характер стадий химической реакции
3. Химическая кинетика
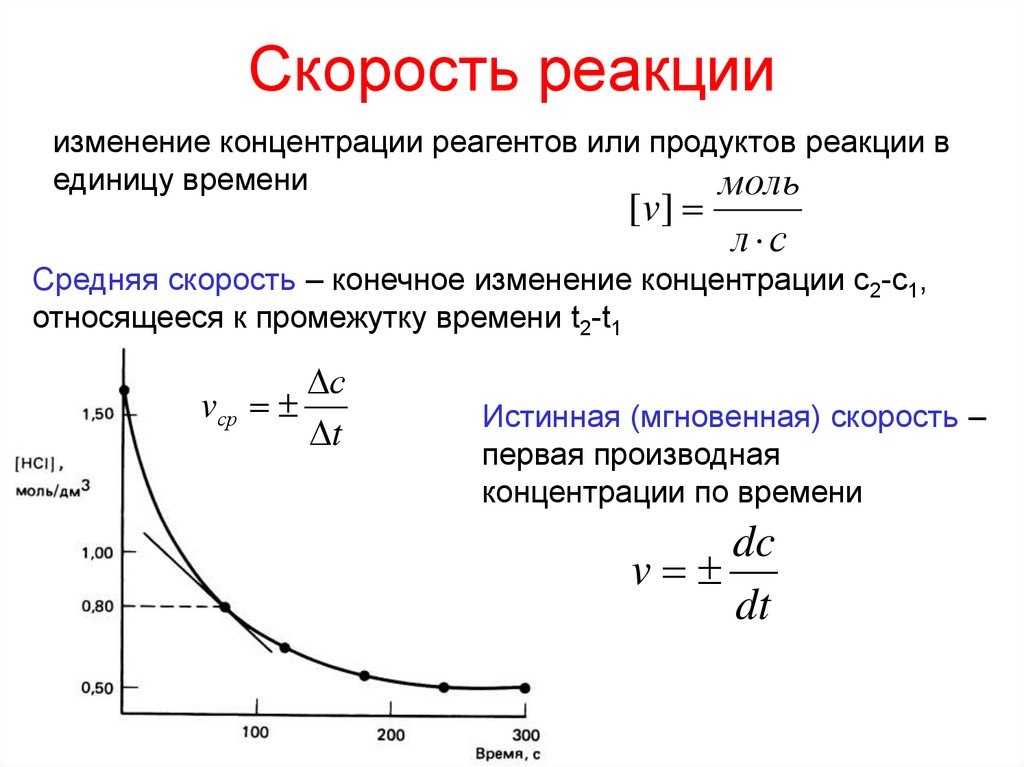
Скорость реакцииизменение концентрации реагентов или продуктов реакции в
единицу времени
моль
[v ]
л с
Средняя скорость – конечное изменение концентрации с2-с1,
относящееся к промежутку времени t2-t1
с
vср
t
Истинная (мгновенная) скорость –
первая производная
концентрации по времени
dc
v
dt
4. Скорость реакции
зависит• от природы реагирующих веществ
• от температуры
• от концентрации
• от давления (для газов)
• от катализатора
• от площади соприкосновения (для гетерогенных реакций)
• от среды (для реакций в растворах)
• от формы сосуда (для цепных реакций)
5. Скорость реакции зависит
Основной постулатхимической кинетики
1867 г. Гульдберг, Вааге – закон действующих масс:
скорость элементарной реакции пропорциональна
произведению концентраций реагирующих веществ
в степенях их стехиометрических коэффициентов
aA + bB → сС + dD
v k[ A] [ B]
a
b
6. Основной постулат химической кинетики
Влияние температуры на скоростьПравило Вант-Гоффа – при увеличении температуры
на 10 С скорость реакции увеличивается в 2-4 раза.
kT2 kT1
T2 T1
10
,
температурный коэффициен т
2 4
7. Влияние температуры на скорость
Уравнение Аррениусаk Ae
Ea
RT
Энергия активации – минимальная энергия, которой
должны обладать молекулы, чтобы их столкновение могло
привести к химическому взаимодействию
Ea
ln k ln A
RT
Ea
tg
R
Ea
ln k1 ln A
RT1
Ea
ln k 2 ln A
RT2
k 2 Ea 1 1
ln
( )
k1
R T1 T2
8. Уравнение Аррениуса
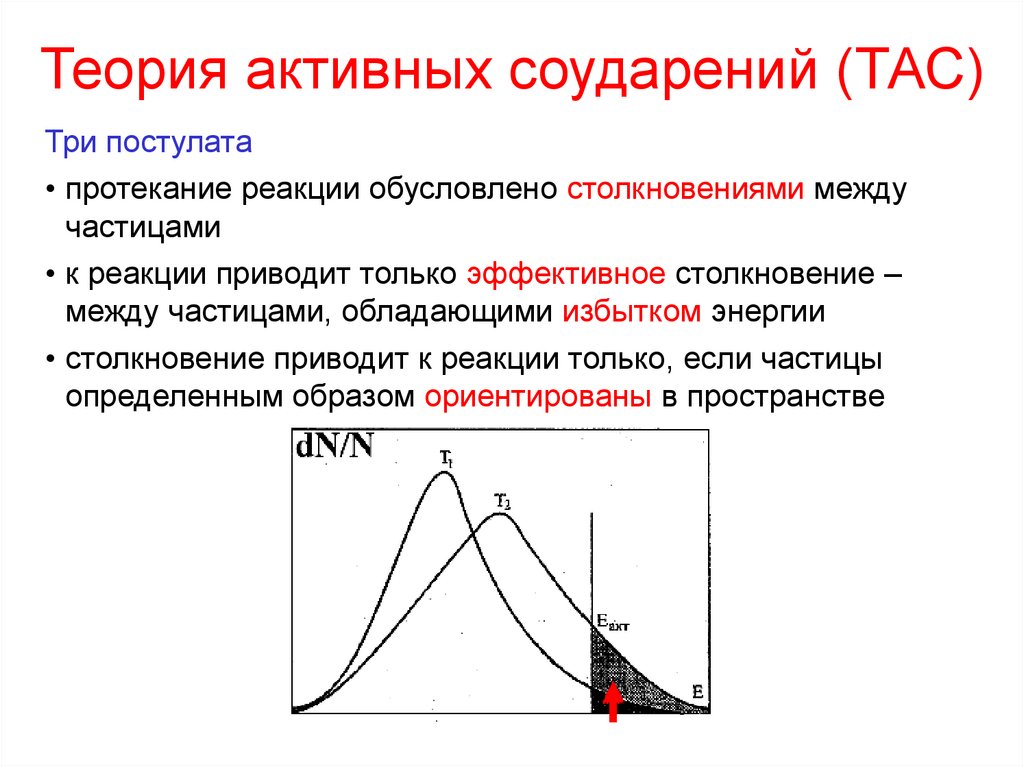
Теория активных соударений (ТАС)Три постулата
• протекание реакции обусловлено столкновениями между
частицами
• к реакции приводит только эффективное столкновение –
между частицами, обладающими избытком энергии
• столкновение приводит к реакции только, если частицы
определенным образом ориентированы в пространстве
9. Теория активных соударений (ТАС)
Стерический фактор (Р)k k0 e
Ea
RT
k0 P Z
Z – число всех соударений
P – стерический фактор, доля соударений, благоприятных в
пространственном отношении (для осуществления реакции
д.б. определенная ориентация молекул)
exp (-Ea/RT) – доля соударений, благоприятных в
энергетическом отношении
10. Стерический фактор (Р)
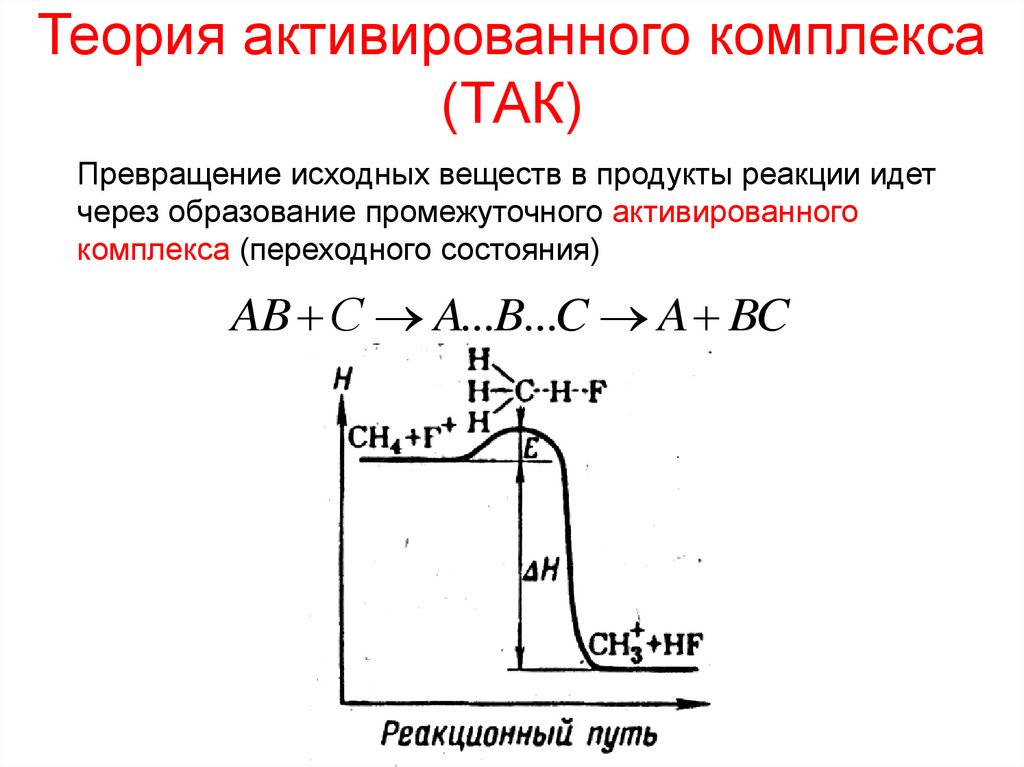
Теория активированного комплекса(ТАК)
Превращение исходных веществ в продукты реакции идет
через образование промежуточного активированного
комплекса (переходного состояния)
AB С A...B...C A BC
11. Теория активированного комплекса (ТАК)
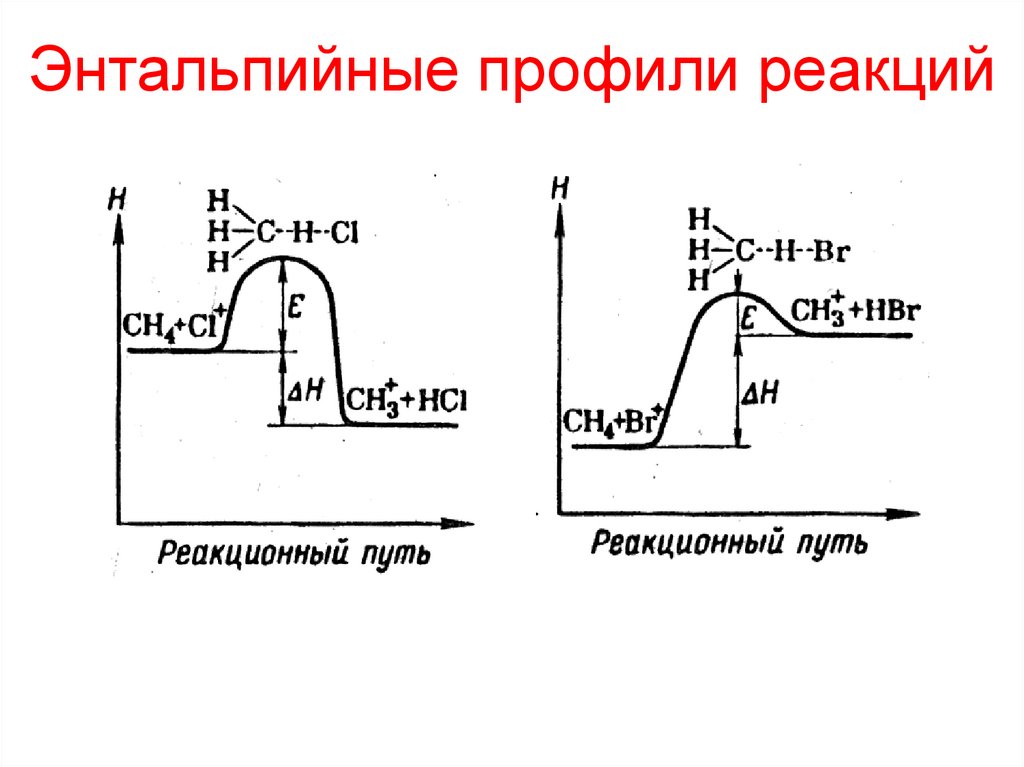
Энтальпийные профили реакций12. Энтальпийные профили реакций
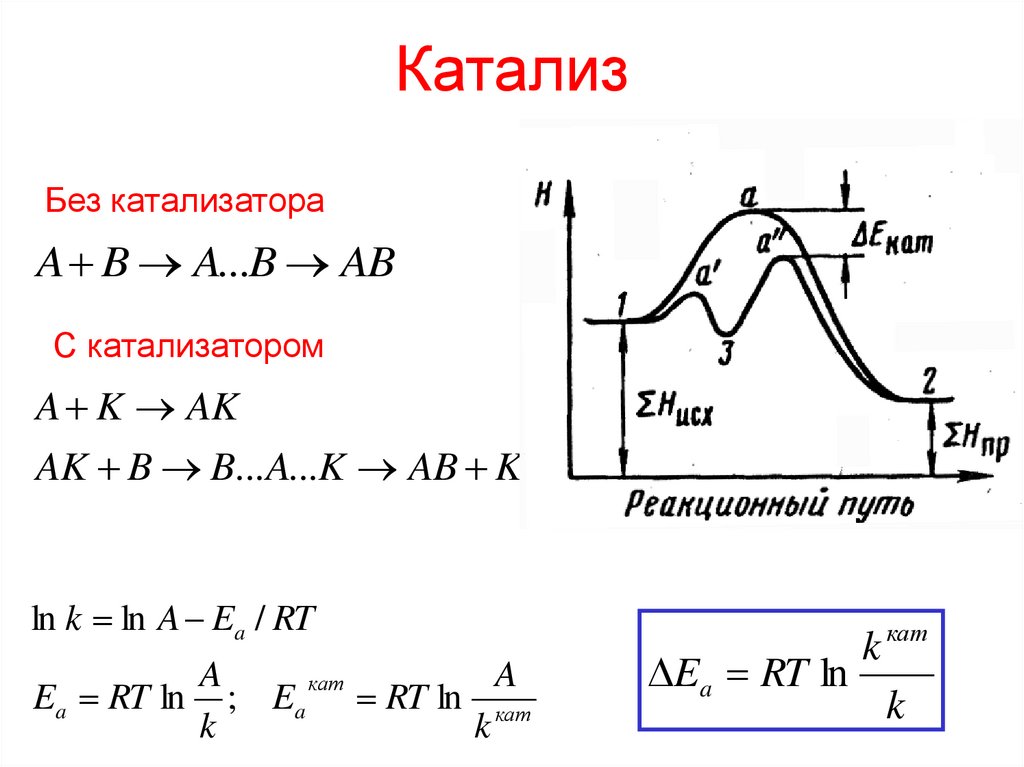
КатализКатализаторы – вещества, ускоряющие химическую реакцию.
Ингибиторы – вещества, замедляющие химическую реакцию.
Катализ – изменение скорости реакции под действием
катализатора.
Катализатор
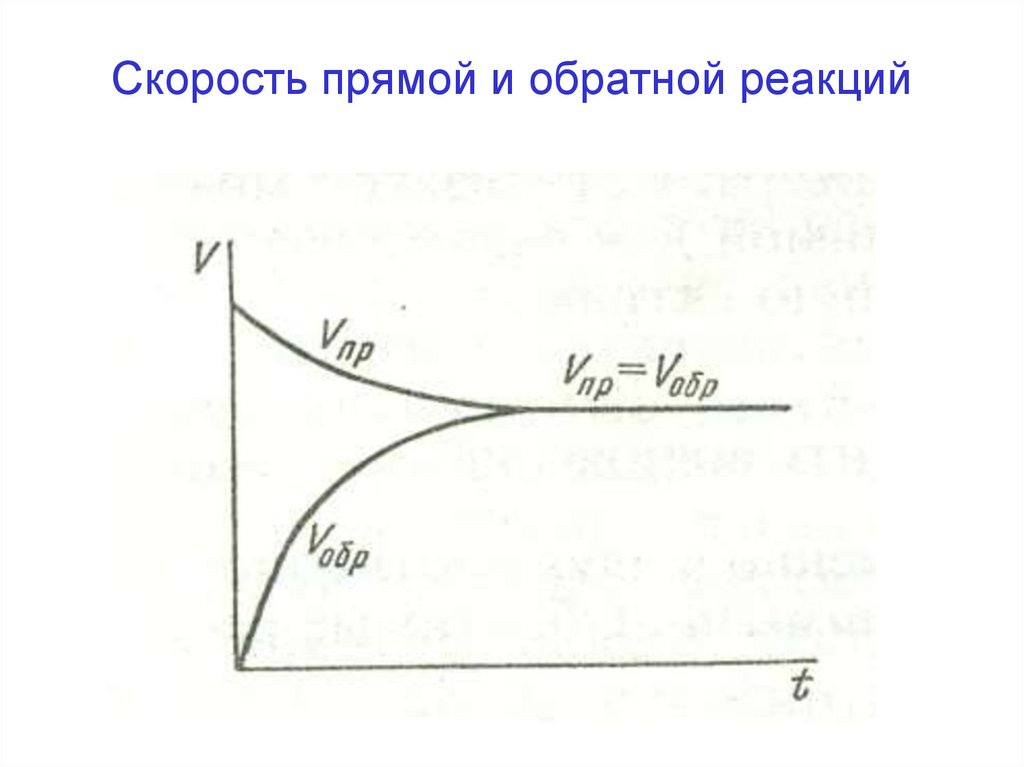
• ускоряет как прямую реакцию, так и обратную,
не смещает равновесие, но способствует его установлению
• не расходуется в реакции
13. Катализ
Без катализатораA B A...B AB
С катализатором
A K AK
AK B B... A...K AB K
ln k ln A Ea / RT
A
A
кат
Ea RT ln ; Ea RT ln кат
k
k
k кат
Ea RT ln
k
14. Катализ
Химическое равновесиеaA +bB cC + dD
[C ]c [ D ]d
Kc
[ A]a [ B ]b
– для растворов
pcC p d D
Kp a b
p Ap B
– для газов
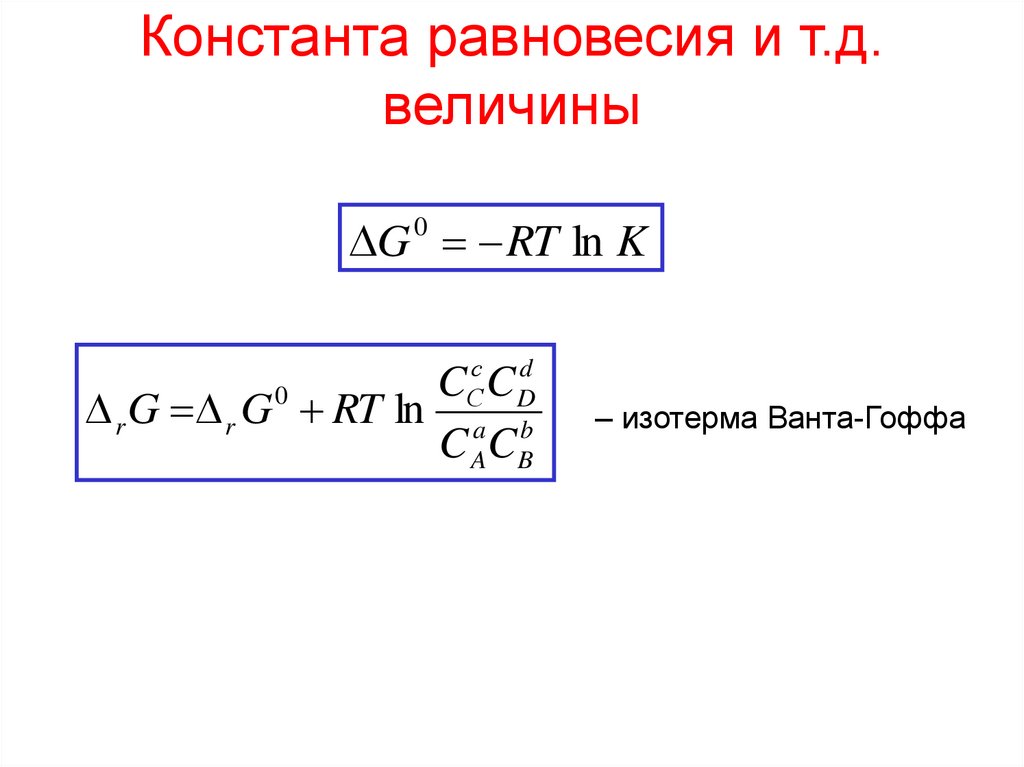
Константа равновесия (К) –
мера глубины протекания процесса
(степени превращения исходных веществ в конечные)
15. Гетерогенный катализ
Скорость прямой и обратной реакций16. Химическое равновесие
Константа равновесия и т.д.величины
G RT ln K
0
с d
C
0
С CD
r G r G RT ln a b
C AC B
– изотерма Ванта-Гоффа









 Химия
Химия








