Похожие презентации:
Растворы. Способы выражения концентраций растворов
1.
РастворыДисциплина Химия
2.
Основные понятияРаствор – гомогенная система, состоящая из двух
или более компонентов, в которой одно или несколько
веществ равномерно распределены в другом
веществе.
Растворитель – это вещество, которое в чистом виде
находится в том же агрегатном состоянии, что и
раствор.
3.
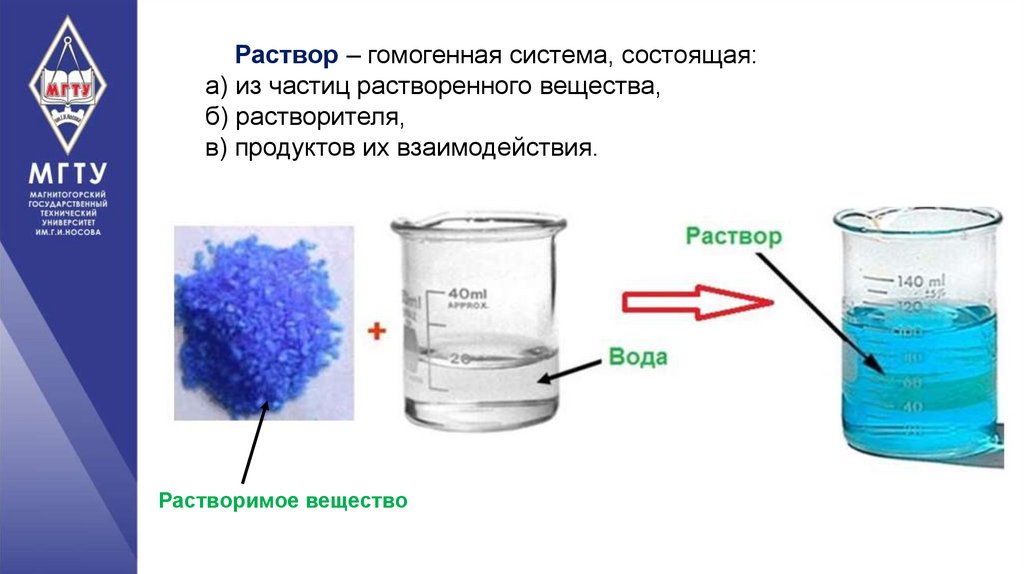
Раствор – гомогенная система, состоящая:а) из частиц растворенного вещества,
б) растворителя,
в) продуктов их взаимодействия.
Растворимое вещество
4.
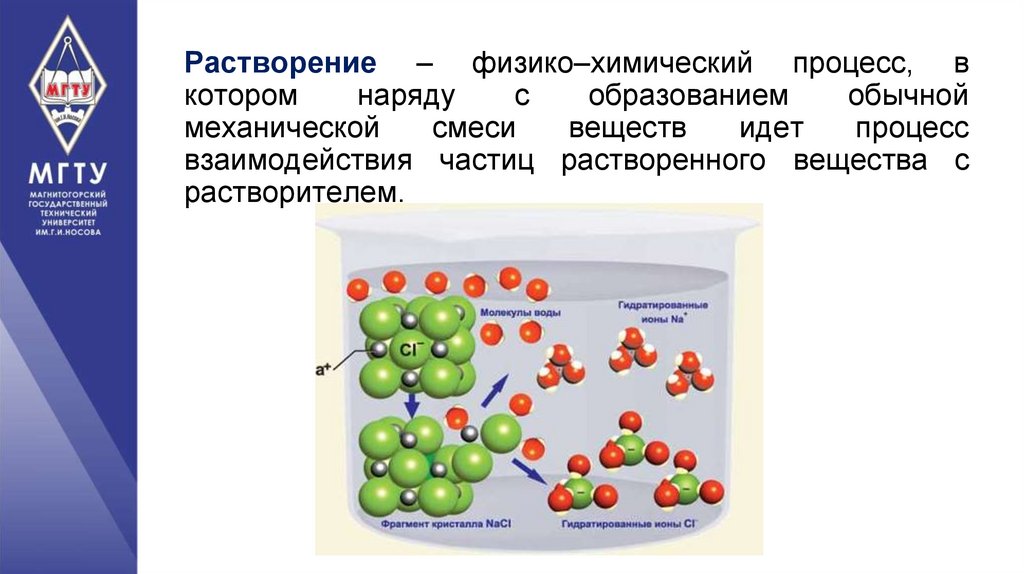
Растворение – физико–химический процесс, вкотором
наряду
с
образованием
обычной
механической
смеси
веществ
идет
процесс
взаимодействия частиц растворенного вещества с
растворителем.
5.
Раствор, находящийся в фазовом равновесиирастворяемым веществом, называется насыщенным.
с
Пересыщенные растворы – это растворы, в которых
содержание растворенного вещества больше, чем в
насыщенном растворе этого же вещества при этих же
значениях температуры и давления.
Ненасыщенные растворы – это растворы, в которых при
данных температуре и давлении возможно дальнейшее
растворение уже содержащегося в нем вещества.
6.
Наибольшеепрактическое
ненасыщенные растворы.
значение
имеют
Растворы с низким содержанием растворенного
вещества называются разбавленными, а с высоким –
концентрированными.
Для определения содержания растворенного вещества
в растворе используют концентрации.
7.
Главная характеристика растворовКонцентрацией раствора называется количественная
характеристика,
определяющая
относительное
содержание в нем
растворенного вещества и
растворителя.
8.
Способы выражения концентраций растворов1. Процентная концентрация (массовая доля).
Массовая
доля
растворенного
вещества
показывает, какую часть масса растворенного
вещества составляет от массы раствора.
где m в-ва – масса растворенного вещества, г;
mр – масса раствора, г.
9.
Массу раствора можно найти:mp = mв-ва+ mH2O.
Массу раствора mр можно найти, зная объем
раствора Vp (мл) и его плотность (г/мл):
mp = Vp
.
10.
Например:раствор NaCl с ω=10 % – это значит, что в 100 г
раствора содержится 10 г NaCl и 90 г воды.
11.
2. Молярная концентрация (молярность)Молярная концентрация показывает сколько молей
растворенного вещества содержится в 1 литре
раствора.
где nв-ва – количество вещества, моль,
Vр – объем раствора, л.
12.
где Мв-ва– молярная масса вещества, г/моль.Например,
2М раствор – двухмолярный раствор, в 1 л которого
содержится 2 моль растворенного вещества.
13.
3. Молярная концентрация эквивалента(нормальность)
Молярная концентрация эквивалента показывает,
какое количество моль эквивалентов растворенного
вещества содержится в одном литре раствора.
14.
Например,2н раствор – двухнормальный раствор - означает,
что в 1 л раствора содержится 2 моль эквивалентов
растворенного вещества.
15.
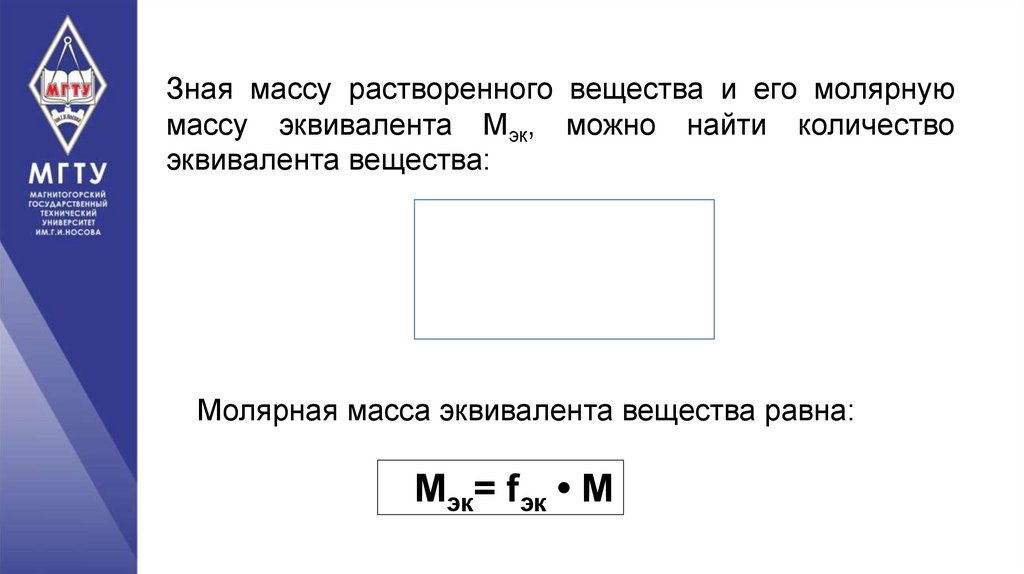
Зная массу растворенного вещества и его молярнуюмассу эквивалента Мэк, можно найти количество
эквивалента вещества:
Молярная масса эквивалента вещества равна:
Мэк= fэк • М
16.
Фактор эквивалентностиЭквивалент – это реальная или условная частица
вещества, которая может взаимодействовать с ионом
Н+, или замещать его.
Фактор эквивалентности – число, показывающее,
какую часть от реальной частицы (молекулы, атома, иона и
т.д.) вещества составляет эквивалент этого вещества.
fэк =
1
.
заряд иона·число ионов
17.
Примеры:fэк (H3PO4) = 1 = 1
1·3
3
fэк (Ва(ОН)2) = 1 = 1
2·1 2
fэк (Al2(SO4)3) = 1 = 1
3·2
6
18.
Законэквивалентов
растворах:
для
реакций
в
Вещества взаимодействуют друг с другом в
количествах,
пропорциональных
их
эквивалентам.
nэк (В1) = nэк (В2)
Сэк(В1)· V1 = Сэк(В2)· V2
19.
Взаимосвязь между молярной концентрациейи
молярной
концентрацией
эквивалента
отражена в следующей формуле:
Сэк = СМ / fэк
20.
4. Моляльная концентрация вещества (моляльность)Моляльная концентрация вещества показывает, какое
количество растворенного вещества находится в 1 кг
растворителя:
mр-ля = mр-ра - mв-ва
21.
.Например:
2m NaOH – двухмоляльный раствор - означает, что в 1 кг
растворителя содержится 2 моль вещества NaOH.
22.
5. Титр раствораТитр раствора – это величина, показывающая, сколько
граммов растворенного вещества содержится в 1 мл
раствора.
23.
6. Мольная доля растворенного веществаМольная доля растворенного вещества показывает,
какую часть от суммарного количества всех веществ,
входящих в состав раствора, составляет количество
растворенного вещества.
.
N=
nв-ва
nв-ва + n р-ля
24.
ЗадачиПример. Определите массовую долю соляной
кислоты, если в 100 мл раствора плотностью
1,098 г/мл содержится 20 г кислоты.
25.
Решение.Масса раствора mp = Vp
;
mp=100•1,098=109,8 г.
Массовая доля соляной кислоты в растворе составляет:
26.
Пример.В 500 мл раствора содержится 8,5 г нитрата натрия.
Определите молярную концентрацию раствора.
Решение.
M(NaNO3) = 85 г/моль.
или 0,2М NaNO3.
27.
Пример.Определите титр раствора соляной кислоты с
массовой долей 0,2. Плотность раствора 1,098 г/мл.
Решение.
=0,2 или 20%. Это значит, что в 100 г раствора
содержится 20 г соляной кислоты.
28.
Пример 4. Вычислите молярную концентрациюэквивалента хлорида железа (III) в растворе,
полученном при растворении 40 г FeCl3 в 200 мл воды.
Плотность раствора 1,182 г/мл.
29.
Молярная масса хлорида железа (III):M(FeCl3) = 162 г/моль.
Фактор эквивалентности fэк = 1/3.
Молярная масса эквивалента
Mэк(FeCl3) = fэк(FeCl3)•M(FeCl3) = 162 • (1/3) = 54
г/моль.
Количество эквивалента вещества, содержащегося
в 40 г хлорида железа (III), составляет:
30.
Масса раствора:mp = m(FeCl3) + m(H2O);
(H2O) = 1 г/мл; m(H2O) = 200 • 1 = 200 г;
mp = 40 + 200 = 240 г.
Объем раствора:
Находим молярную концентрацию эквивалента:
31.
Пример 5. В 300 мл раствора плотностью1,019 г/мл Содержится
6 г сульфата меди.
Определите моляльную концентрацию раствора.
Решение.
Молярная масса сульфата меди M(CuSO4)=160 г/моль.
Количество вещества, содержащегося в 6 г CuSO4,
составляет:
32.
Масса раствора: mp = Vp= 300 • 1,019 = 305,7 г.
Масса растворителя (воды): mH2O = mp – mв-ва;
m(H2O) = mp – m(CuSO4)=305,7 – 6 = 299,7 г = 0,2997 кг.
Моляльная концентрация раствора составляет:
33.
Пример 6. Сколько миллилитров раствора сернойкислоты с массовой долей 0,96 плотностью 1,84 г/мл
потребуется для приготовления 500 мл 0,5н. раствора.
Решение.
Молярная масса серной кислоты
M(H2SO4) = 98 г/моль.
Фактор эквивалентности: fэк(H2SO4) = 1/2.
Молярная масса эквивалента: Мэк(H2SO4)=98•1/2=49 г/моль.
34.
Найдем массу серной кислоты, содержащейся в 500 мл 0,5н. раствора:35.
Найдем массу 96%-го раствора серной кислоты,содержащего 12,25 г.
Отсюда
36.
Найдем объем 96%-го раствора серной кислотымассой 12,76 г.
Ответ: для приготовления 500 мл 0,5 н раствора
серной кислоты потребуется 6,9 мл раствора серной
кислоты с массовой долей 0,96.

































 Химия
Химия








