Похожие презентации:
Способы выражения концентрации растворов
1.
2.
• Раствор, в котором данное вещество приданной температуре больше не
растворяется, называется насыщенным.
• Раствор, в котором данное вещество при
данной температуре ещё растворяется,
называется ненасыщенным
3.
• Растворимость вещества (коэффициентрастворимости) S - максимальная масса вещества,
способная раствориться в 100 г воды при данной температуре
с образованием насыщенного раствора.
Или: - определяется массой вещества, способной раствориться в
1000 мл(1л) растворителя при данной температуре.
• При записи коэффициента растворимости обязательно
указывается вещество, температура.
например:
Растворимость KNO3при 20oС равна 25 г в 100 г воды
или растворимость KNO3 в воде при 20oС равна 250 г/ л
mр-ра = m(KNO3) + m(Н2О) = 25г + 100г = 125г
4.
Если в определенном объеме раствора содержится малорастворенного вещества, то такой раствор называют разбавленным,
если много – концентрированным.
Содержание вещества в растворе выражают в массовых долях
Массовая доля растворённого вещества (концентрация
раствора) — это величина, равная отношению массы
растворённого вещества к массе раствора.
Wв-ва
mв-ва
= m
• 100%
р-ра
Wв-ва =
mв-ва
= mр-ра • Wв-ва
Wв-ва : 0 - 100%
mв-ва
mр-ра
Wв-ва : 0 - 1
mр-ра
m
= Wв-ва
в-ва
5.
Wв-ва показывает сколько грамм вещества содержится в 100 граммахраствора:
W(NaCl) =30% => в 100г раствора содержится 30 г NaCl и
6.
Wв-ва показывает сколько грамм вещества содержится в 100 граммахраствора:
W(NaCl) =30% => в 100г раствора содержится 30г NaCl и 70г Н2О
m(Н2О) = mр-ра - mв-ва
mр-ра = mв-ва + m(Н2О)
Для приготовления раствора взяли 15г соли и 235г воды.
Определить концентрацию раствора (массовую долю вещества в
растворе).
7.
Для приготовления раствора взяли 15г соли и 235г воды.Определить концентрацию раствора (массовую долю вещества в
растворе).
Дано:
Решение:
mв-ва = 15г
mв-ва
Wв-ва =
m(Н2О) =235г
mр-ра
Wв-ва - ?
1. mр-ра = mв-ва + m(Н2О) = 15г + 100г = 250г
2. Wв-ва =
15г
250г
= 0,06 или 6%
8.
Приготовить 300г 15% раствора вещества.Приготовить раствор – значит найти массу вещества и массу растворителя.
Дано:
mр-ра = 300г
Wв-ва = 15%= 0,15
mв-ва - ?
m(Н2О) - ?
Решение:
m
Wв-ва = m в-ва
р-ра
1. mв-ва = mр-ра • Wв-ва = 300г • 0,15 = 45 г
2. m(Н2О) = mр-ра - mв-ва = 300г – 45 г = 255 г
9.
Растворимость KNO3при 20oС равна 25 г в 100 г воды. Определитьконцентрацию раствора (массовую долю вещества в растворе).
Дано:
S200 = 25г/100гН2О
Wв-ва - ?
Решение:
Wв-ва =
mв-ва
mр-ра
S200 = 25г/100гН2О: значит - mв-ва= 25г, m(Н2О) = 100г
1. mр-ра = mв-ва + m(Н2О) = 25г + 100г = 125г
2. Wв-ва =
25г
125г
= 0,2 или 20%
10.
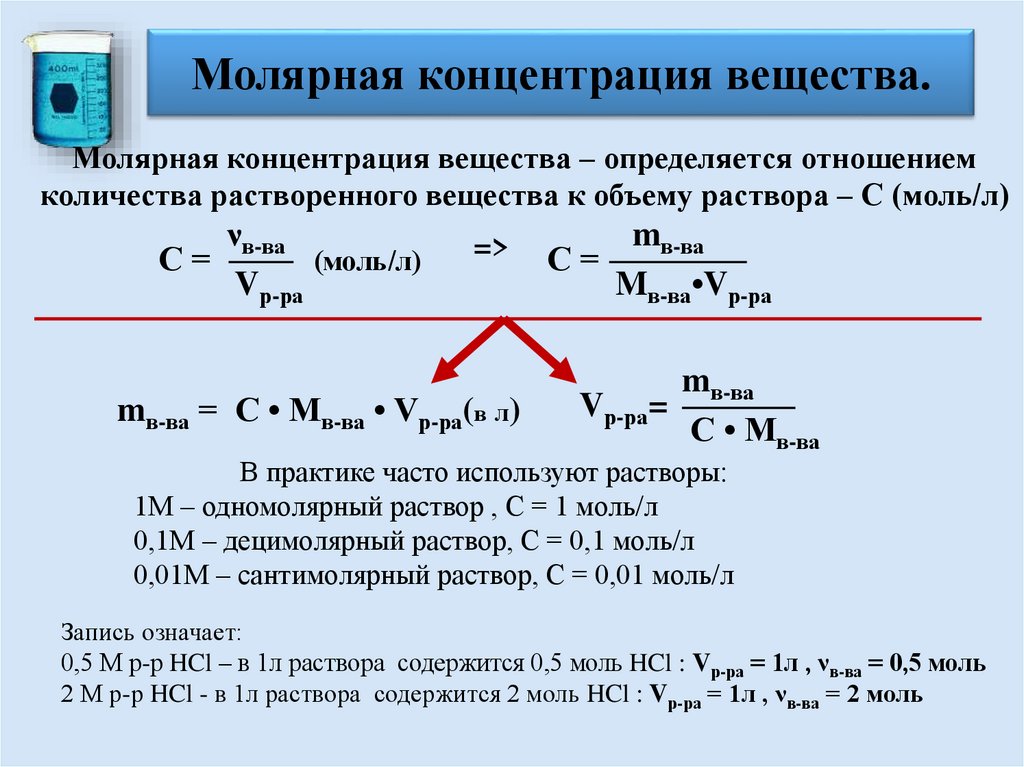
Молярная концентрация вещества.Молярная концентрация вещества – определяется отношением
количества растворенного вещества к объему раствора – С (моль/л)
νв-ва
С=
(моль/л)
Vр-ра
=>
mв-ва = С • Mв-ва • Vр-ра(в л)
mв-ва
С=
Mв-ва•Vр-ра
mв-ва
Vр-ра=
С • Mв-ва
В практике часто используют растворы:
1М – одномолярный раствор , С = 1 моль/л
0,1М – децимолярный раствор, С = 0,1 моль/л
0,01М – сантимолярный раствор, С = 0,01 моль/л
Запись означает:
0,5 М р-р HCl – в 1л раствора содержится 0,5 моль HCl : Vр-ра = 1л , νв-ва = 0,5 моль
2 М р-р HCl - в 1л раствора содержится 2 моль HCl : Vр-ра = 1л , νв-ва = 2 моль
11.
Молярная концентрация вещества.Молярная концентрация вещества связана с массовой долей
растворенного вещества соотношением:
Wв-ва• ρ р-ра• 1000
С=
Mв-ва
- • г/мл • 1000
моль
=
г/моль
л(1000мл)
Определить молярную концентрацию 30,78% раствора гидроксида натрия ( ρ = 1,34 г/мл)
Дано:
W(NaOH) = 30,78%
= 0, 3078
ρ р-ра(NaOH) = 1,34 г/мл
С(NaOH) -?
Решение:
С=
Wв-ва• ρ р-ра• 1000 0, 3078 • 1,34 г/мл • 1000
=
Mв-ва
40 г/моль
= 10,3 моль/ л
12.
Молярная концентрация вещества.Приготовить 250мл 2М раствора азотной кислоты ( ρ = 0,66 г/мл)
Дано:
Решение:
Vр-ра = 250мл
С(HNO3) = 2моль/л
1. m (HNO3) = С • Mв-ва • Vр-ра(л) = 2моль/л • 63г/моль•0,25л=
= 31,5г
ρр-ра (HNO3) = 0,66 г/мл
m (HNO3) -?
m (H2O) -?
2. m(Н2О) = mр-ра - mв-ва = Vр-ра(мл)• ρр-ра - mв-ва =
= 250мл • 0,66 г/мл - 31,5г = 266,5г – 31,5г =235г
13.
Решить задачи:1.
2.
3.
4.
5.
6.
7.
Растворимость вещества при 700С составляет 130г на 100г воды.
Определите массовую долю вещества в растворе.
В 255 г воды растворили 15 г соли. Определите массовую долю соли в
растворе.
Рассчитайте массу соли и массу воды, необходимые для приготовления
500г 20% раствора соли.
Приготовить 500мл 0,1М раствора бромида калия ( ρ = 1,2 г/мл)
Определить молярную концентрацию 98,2% раствора серной кислоты ( ρ
= 1,844 г/мл)
К 80 г 15%-го раствора сульфата калия добавили 20 г воды. Определите
массовую долю соли в полученном растворе.
К 150 г 20%-го раствора нитрата серебра добавили 50 г этой же соли.
Определите массовую долю нитрата серебра в полученном растворе.












 Химия
Химия








