Похожие презентации:
Оптическая изомерия. Гидрокси – и оксокислоты
1.
Оптическая изомерия.Гидрокси – и оксокислоты.
1
2.
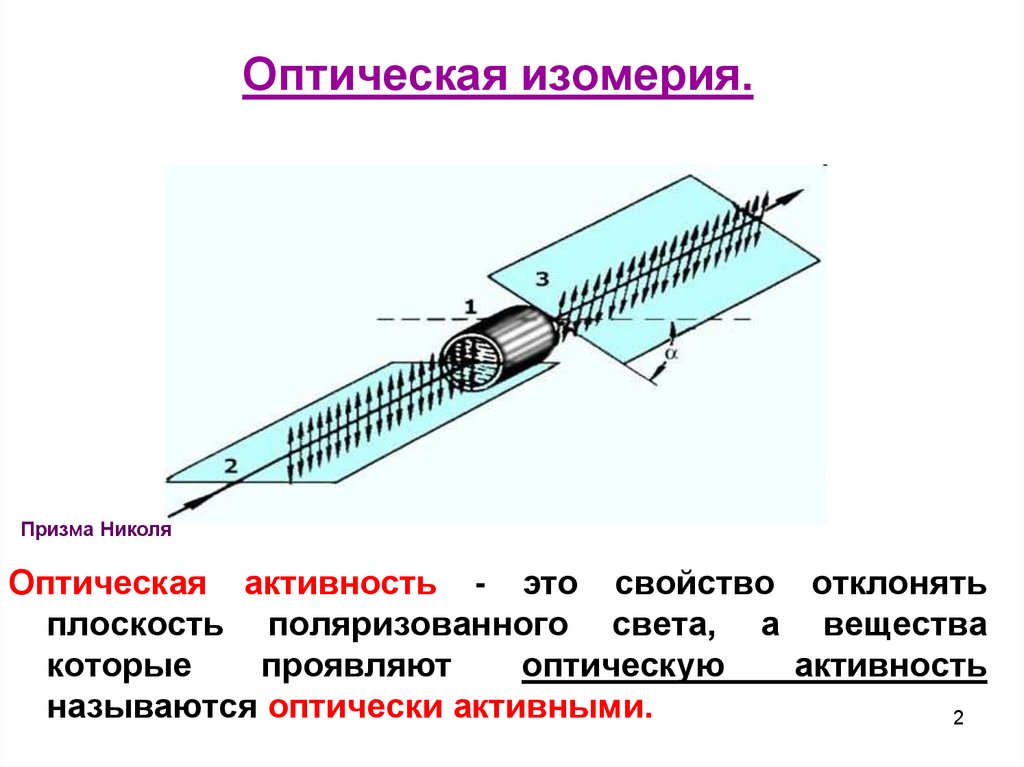
Оптическая изомерия.Призма Николя
Оптическая активность - это свойство отклонять
плоскость поляризованного света, а вещества
которые
проявляют
оптическую
активность
называются оптически активными.
2
3.
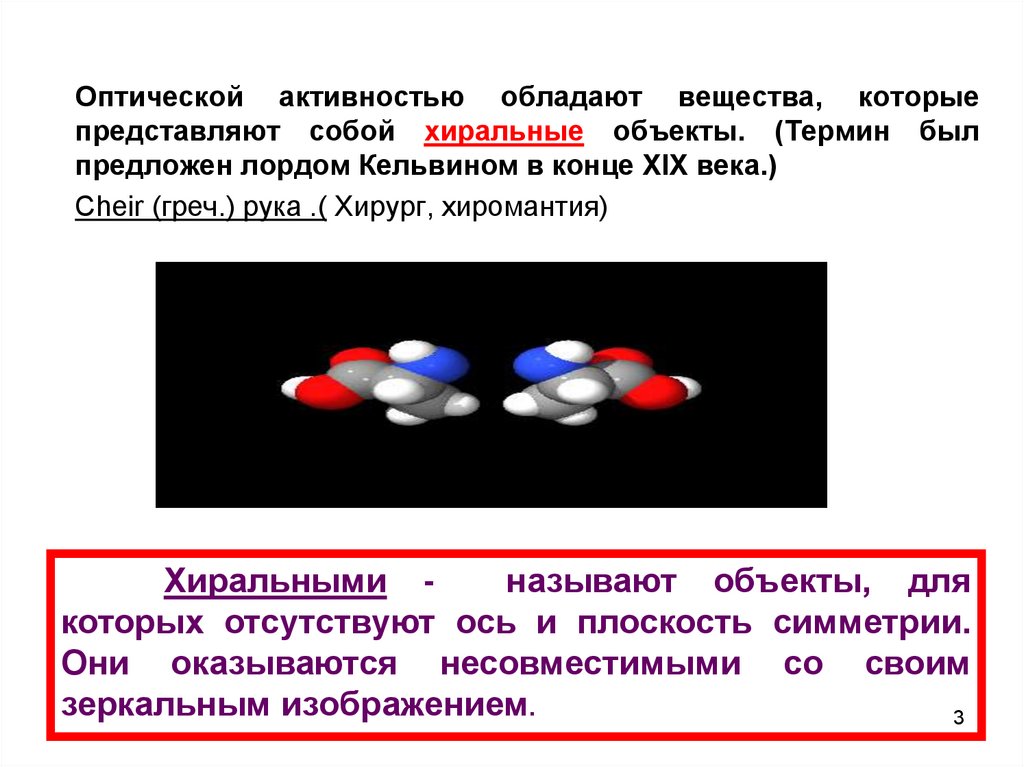
Оптической активностью обладают вещества, которыепредставляют собой хиральные объекты. (Термин был
предложен лордом Кельвином в конце XIX века.)
Cheir (греч.) рука .( Хирург, хиромантия)
Хиральными называют объекты, для
которых отсутствуют ось и плоскость симметрии.
Они оказываются несовместимыми со своим
зеркальным изображением.
3
4. ХИРАЛЬНОСТЬ
свойство молекулыбыть
несовместимой
со своим
зеркальным
отражением
любой
комбинацией
вращений и
перемещений в
трёхмерном
пространстве.
5.
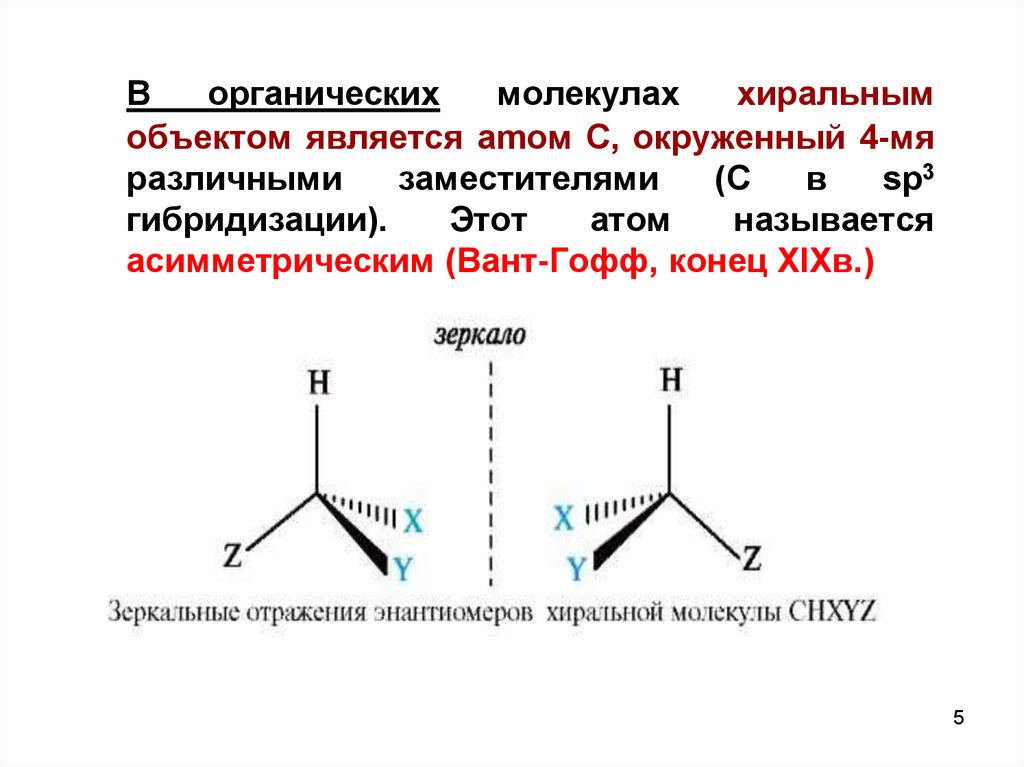
Ворганических
молекулах
хиральным
объектом является amом С, окруженный 4-мя
различными
заместителями
(С
в
sp3
гибридизации).
Этот
атом
называется
асимметрическим (Вант-Гофф, конец XIXв.)
5
6.
Лорд Кельвин(Вильям Томсон)
(1824 - 1907)
В круг научных интересов Томсона
входили термодинамика,
гидродинамика, электромагнетизм,
теория упругости, теплота,
математика, техника.
Якоб Хендрик Вант-Гофф
(1852—1911)
Был первым Нобелевским
лауреатом(1901) по химии за
открытие законов химической
динамики и осмотического
давления
6
7.
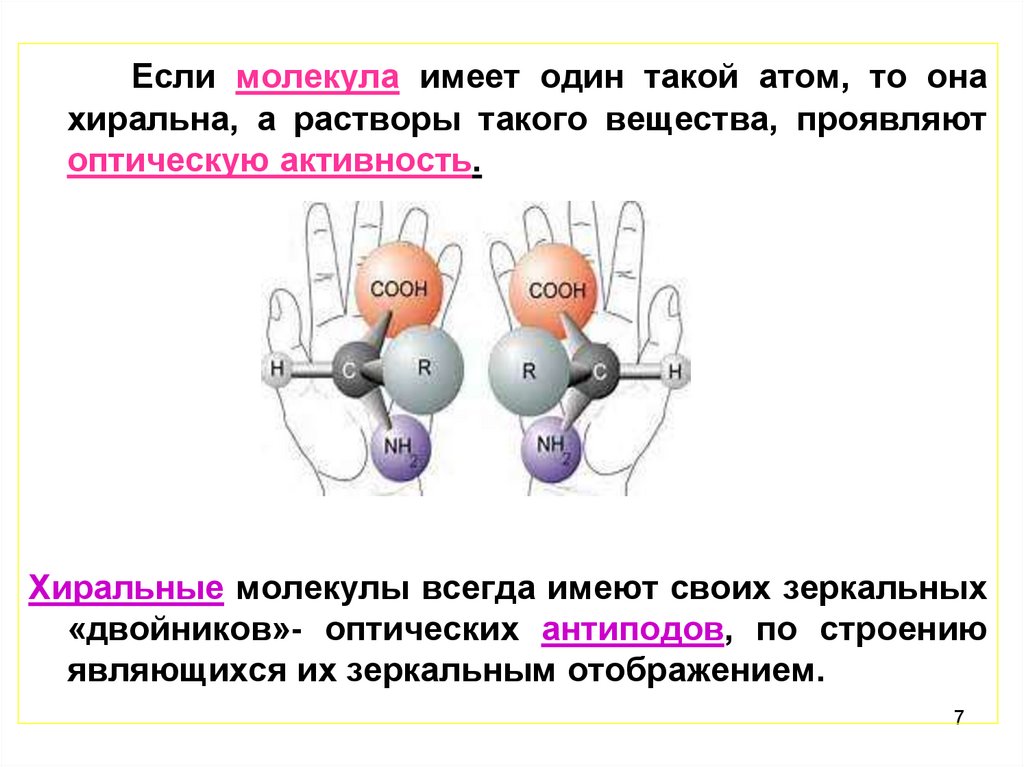
Если молекула имеет один такой атом, то онахиральна, а растворы такого вещества, проявляют
оптическую активность.
Хиральные молекулы всегда имеют своих зеркальных
«двойников»- оптических антиподов, по строению
являющихся их зеркальным отображением.
7
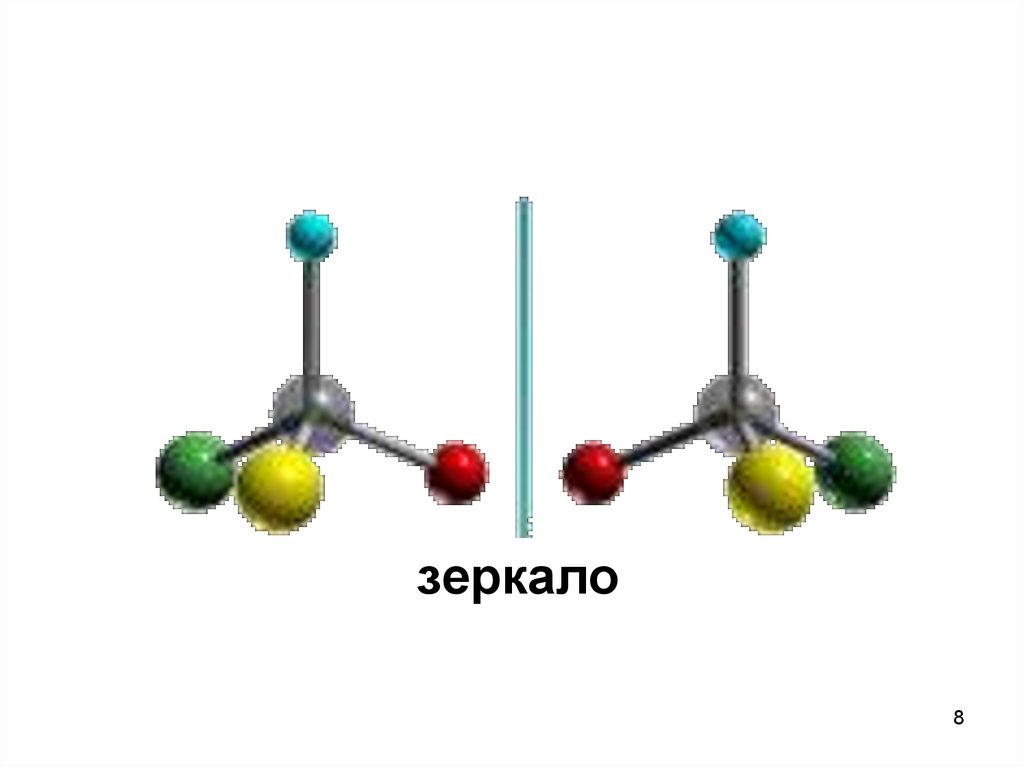
8.
зеркало8
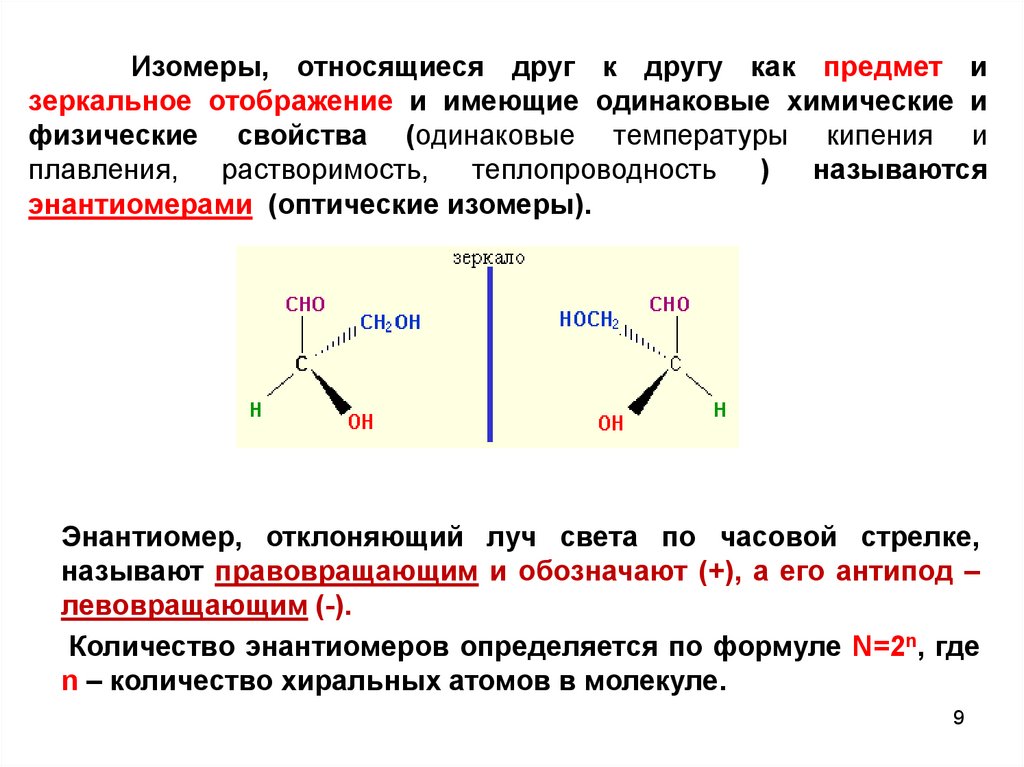
9.
Изомеры, относящиеся друг к другу как предмет изеркальное отображение и имеющие одинаковые химические и
физические свойства (одинаковые температуры кипения и
плавления, растворимость,
теплопроводность
)
называются
энантиомерами (оптические изомеры).
Энантиомер, отклоняющий луч света по часовой стрелке,
называют правовращающим и обозначают (+), а его антипод –
левовращающим (-).
Количество энантиомеров определяется по формуле N=2n, где
n – количество хиральных атомов в молекуле.
9
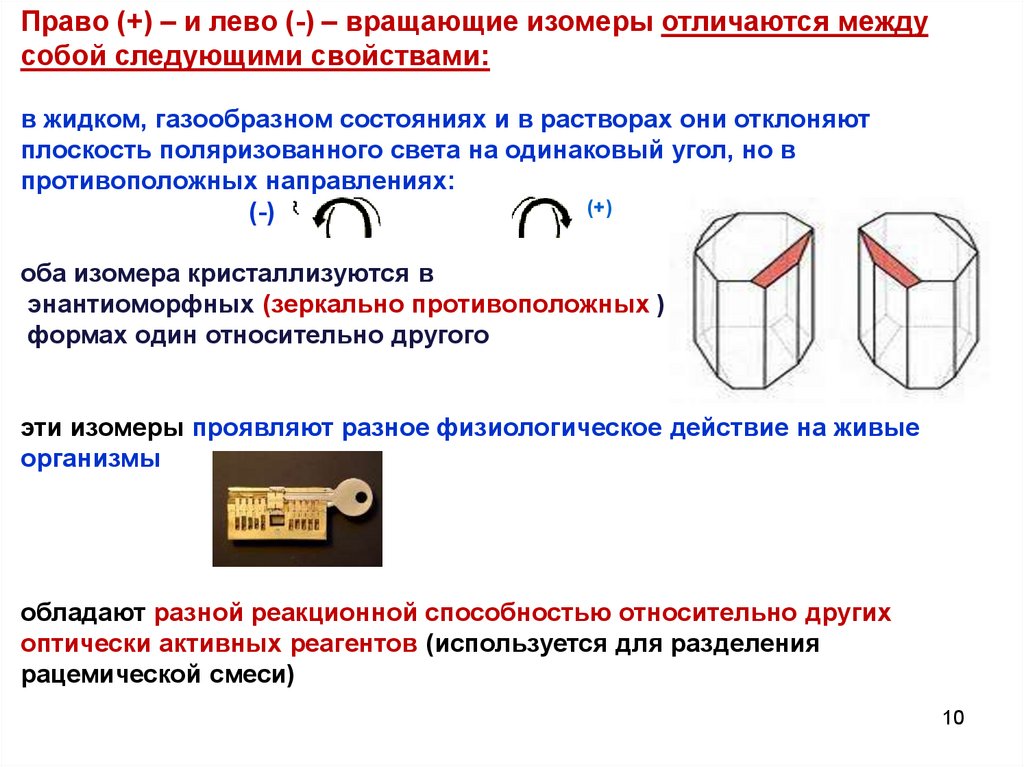
10.
Право (+) – и лево (-) – вращающие изомеры отличаются междусобой следующими свойствами:
в жидком, газообразном состояниях и в растворах они отклоняют
плоскость поляризованного света на одинаковый угол, но в
противоположных направлениях:
(+)
(-)
оба изомера кристаллизуются в
энантиоморфных (зеркально противоположных )
формах один относительно другого
эти изомеры проявляют разное физиологическое действие на живые
организмы
обладают разной реакционной способностью относительно других
оптически активных реагентов (используется для разделения
рацемической смеси)
10
11.
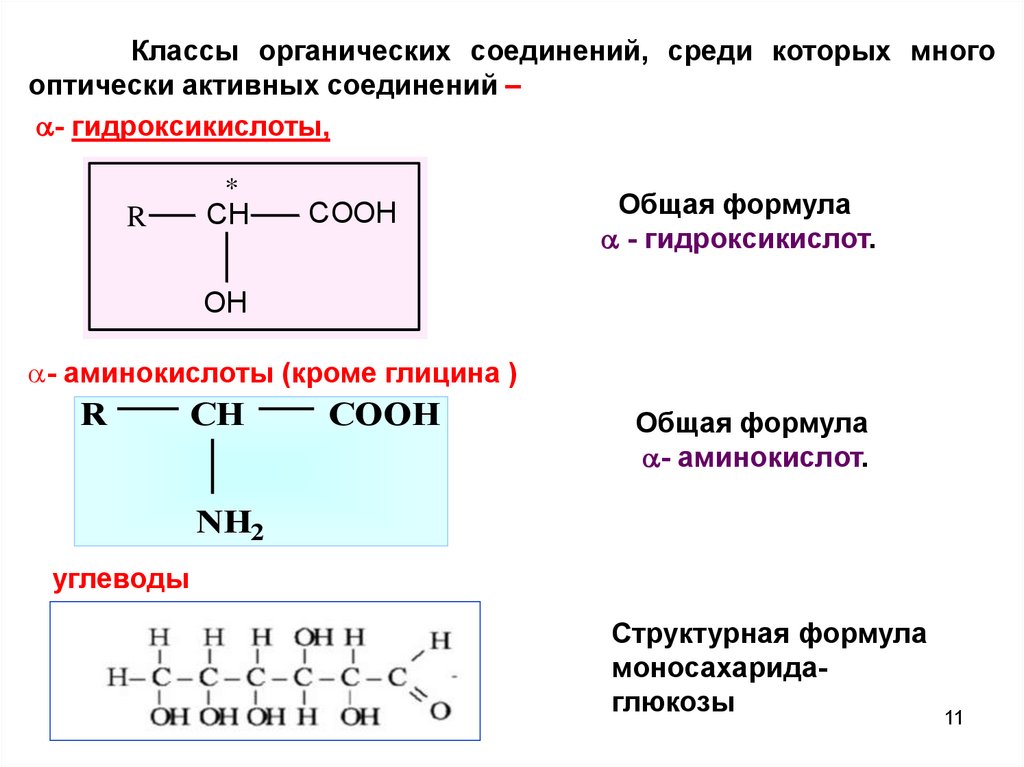
Классы органических соединений, среди которых многооптически активных соединений –
- гидроксикислоты,
*
R
CH
COOH
Общая формула
- гидроксикислот.
OH
- аминокислоты (кроме глицина )
R
CH
COOH
Общая формула
- аминокислот.
NH2
углеводы
Структурная формула
моносахаридаглюкозы
11
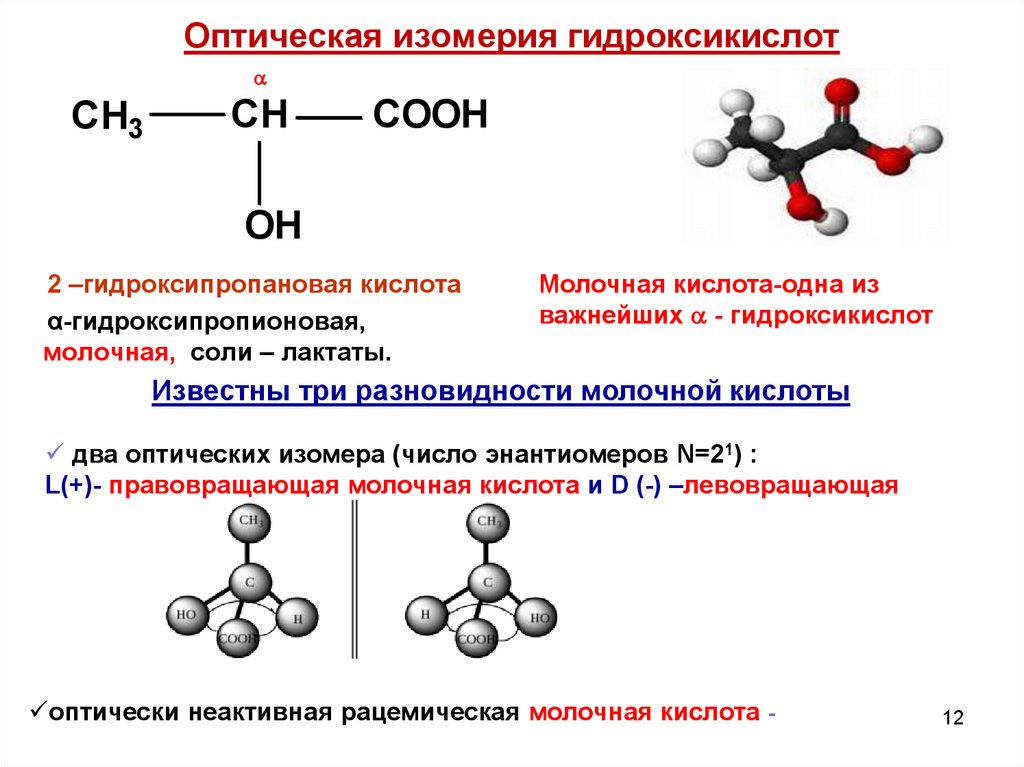
12. Оптическая изомерия гидроксикислот
CH3CH
COOH
OH
2 –гидроксипропановая кислота
α-гидроксипропионовая,
молочная, соли – лактаты.
Молочная кислота-одна из
важнейших - гидроксикислот
Известны три разновидности молочной кислоты
два оптических изомера (число энантиомеров N=21) :
L(+)- правовращающая молочная кислота и D (-) –левовращающая
оптически неактивная рацемическая молочная кислота -
12
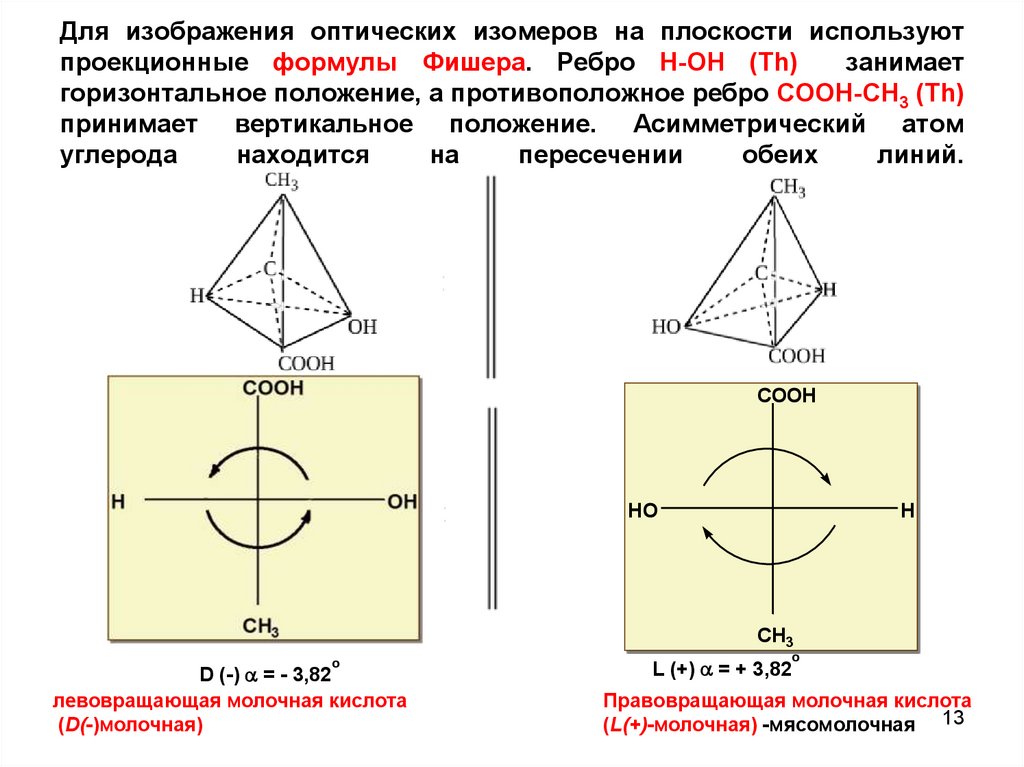
13. Для изображения оптических изомеров на плоскости используют проекционные формулы Фишера. Ребро Н-ОH (Th) занимает
горизонтальное положение, а противоположное ребро COOH-СН3 (Th)принимает вертикальное положение. Асимметрический атом
углерода
находится
на
пересечении
обеих
линий.
COOH
HO
H
CH3
о
D (-) = - 3,82
левовращающая молочная кислота
(D(-)молочная)
о
L (+) = + 3,82
Правовращающая молочная кислота
(L(+)-молочная) -мясомолочная 13
14.
Правовращающая L(+)-молочнаякислота открыта Либихом (1847) и
получила название мясомолочной
кислоты
Она всегда присутствует в организме
человека, является конечным
продуктом гликолиза – распада
глюкозы с образованием молочной
кислоты и источника энергии – АТФ.
Образуется в мышцах при
физической нагрузке.
Молочная кислота – это показатель
обмена углеводов, отражающий
степень насыщения мышц и тканей
кислородом
14
15.
Чистая левовращающая молочная D(-) кислота может бытьполучена брожением сахаристых веществ при посредстве особого
возбудителя брожения (Bacillus acidi laevolactici)
Рацемическая молочная кислота - оптически неактивная, не вращает
плоскость поляризации, так как она состоит из смеси равных количеств
двух зеркальных изомеров.Один из них вызывает правое вращение,
второй - на такой угол-левое.
Такой является молочная кислота, полученная под действием
молочнокислых бактерий при скисании молока, квашении капусты,
солении огурцов, помидоров.
15
16.
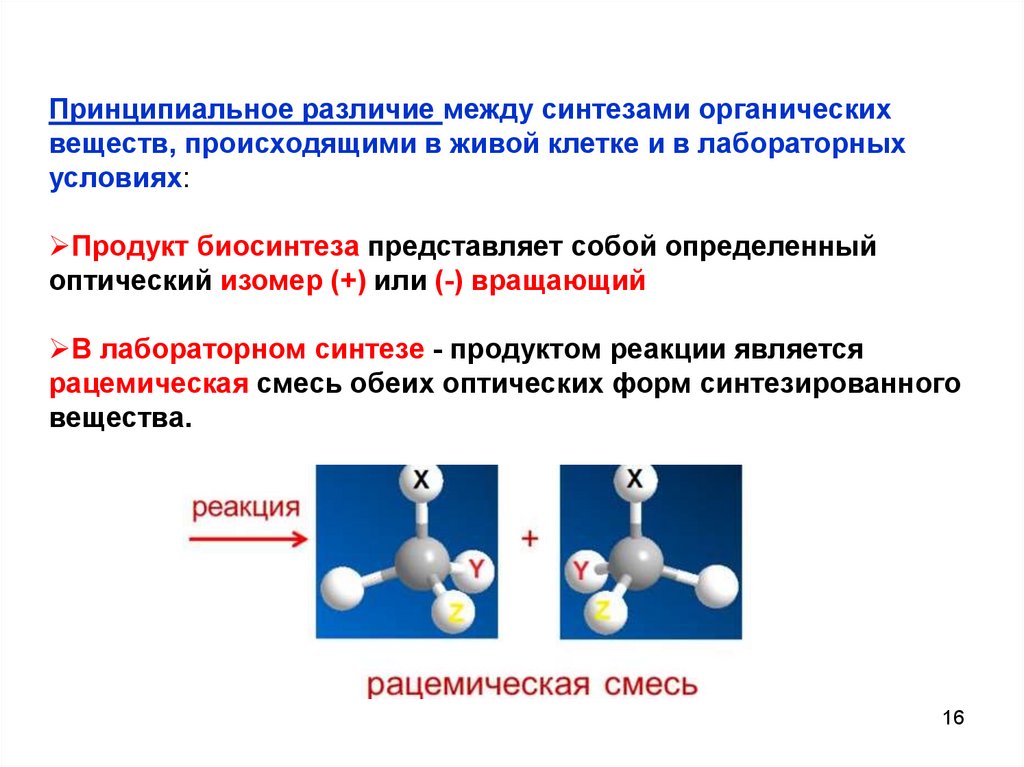
Принципиальное различие между синтезами органическихвеществ, происходящими в живой клетке и в лабораторных
условиях:
Продукт биосинтеза представляет собой определенный
оптический изомер (+) или (-) вращающий
В лабораторном синтезе - продуктом реакции является
рацемическая смесь обеих оптических форм синтезированного
вещества.
16
17. Способы разделения рацемической смеси:
Механический – отбор кристаллов по внешнемувиду (кристаллы имеют зеркально-скошенные
грани).
Биохимический – (+) и (-) антиподы оказывают разное
физиологическое действие на микроорганизмы, которые
избирательно поглощают один энантиомер.
Хроматографический – расщепление рацематов на
оптически активных сорбентах (афинная хроматография).
Химический - основан на химической реакции антипода с
оптически деятельным веществом.
17
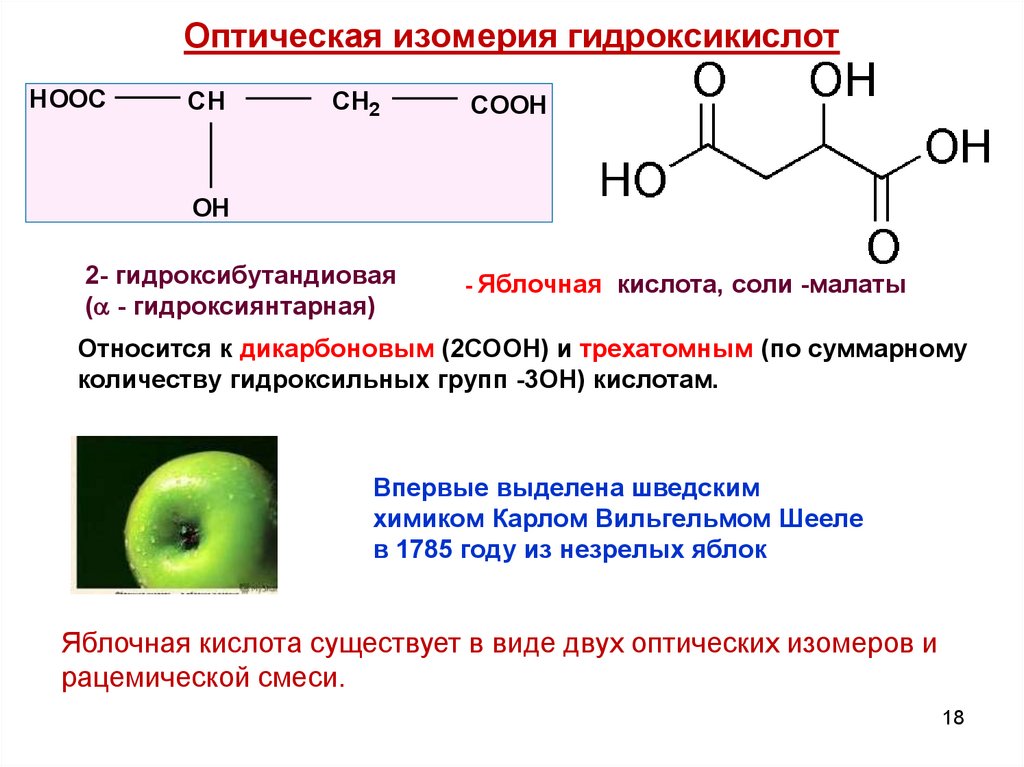
18. Оптическая изомерия гидроксикислот
HOOCCH
CH2
COOH
OH
2- гидроксибутандиовая
( - гидроксиянтарная)
- Яблочная
кислота, соли -малаты
Относится к дикарбоновым (2СООН) и трехатомным (по суммарному
количеству гидроксильных групп -3ОН) кислотам.
Впервые выделена шведским
химиком Карлом Вильгельмом Шееле
в 1785 году из незрелых яблок
Яблочная кислота существует в виде двух оптических изомеров и
рацемической смеси.
18
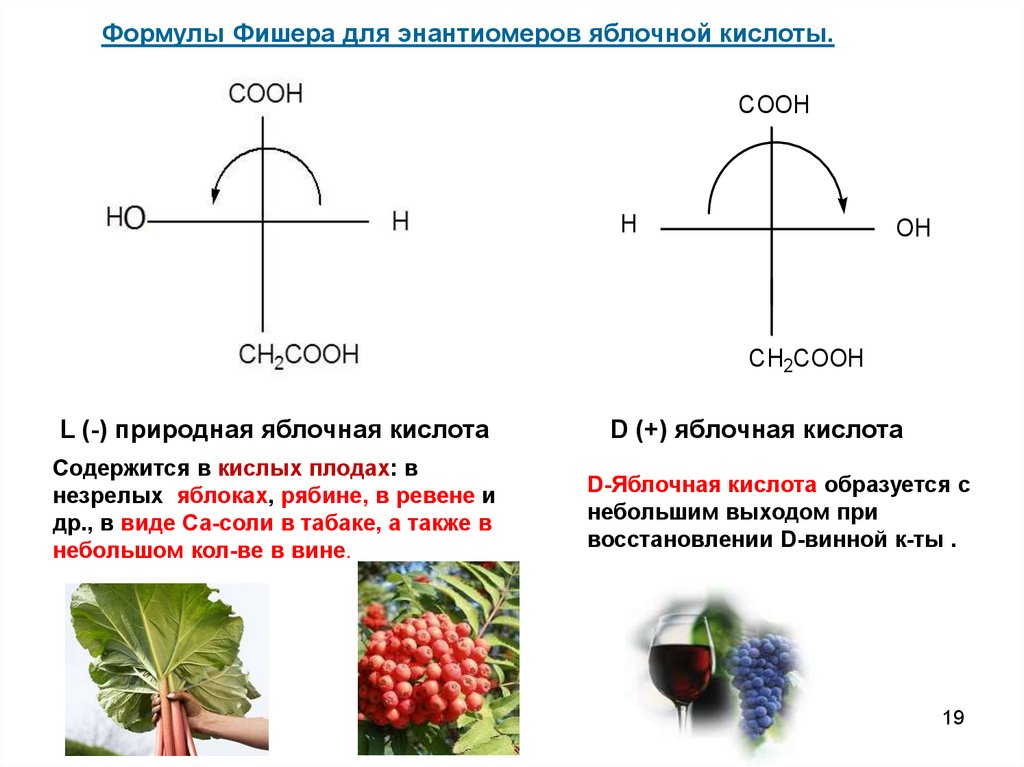
19.
Формулы Фишера для энантиомеров яблочной кислоты.COOH
H
OH
CH2COOH
L (-) природная яблочная кислота
Содержится в кислых плодах: в
незрелых яблоках, рябине, в ревене и
др., в виде Са-соли в табаке, а также в
небольшом кол-ве в вине.
D (+) яблочная кислота
D-Яблочная кислота образуется с
небольшим выходом при
восстановлении D-винной к-ты .
19
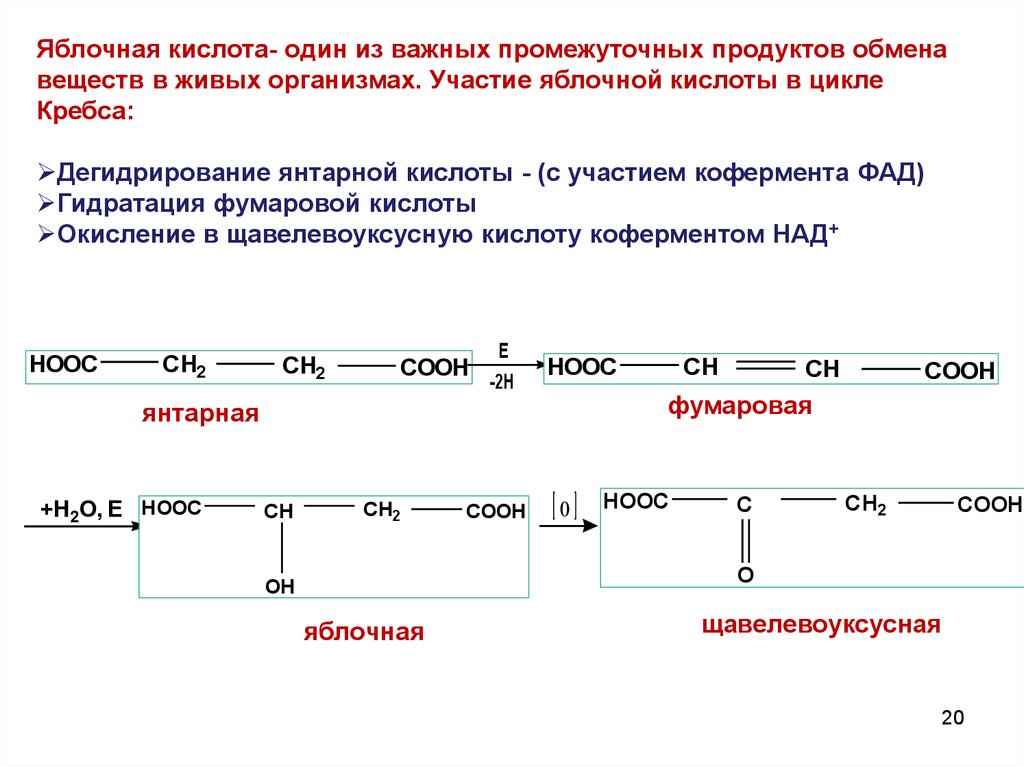
20.
Яблочная кислота- один из важных промежуточных продуктов обменавеществ в живых организмах. Участие яблочной кислоты в цикле
Кребса:
Дегидрирование янтарной кислоты - (с участием кофермента ФАД)
Гидратация фумаровой кислоты
Окисление в щавелевоуксусную кислоту коферментом НАД+
HOOC
CH2
CH2
COOH
E
-2H
HOOC
CH
CH2
COOH
CH
COOH
фумаровая
янтарная
+H2O, E HOOC
CH
O
HOOC
C
CH2
COOH
O
OH
яблочная
щавелевоуксусная
20
21. Применение яблочной кислоты
Применяется как пищевая добавка (Е296) при изготовлениифруктовых вод и кондитерских изделий.
В медицине для производства слабительного и лекарств от
хрипоты;
Один из компонентов косметических препаратов.
21
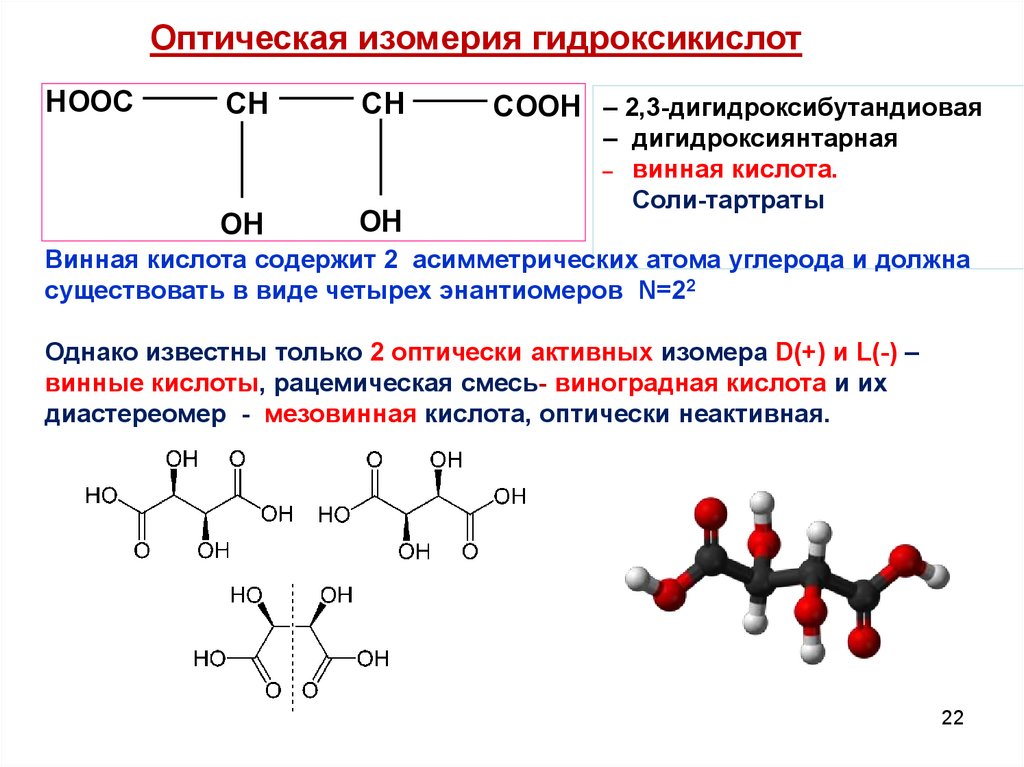
22.
Оптическая изомерия гидроксикислотHOOC
CH
OH
CH
OH
COOH – 2,3-дигидроксибутандиовая
– дигидроксиянтарная
_ винная кислота.
Соли-тартраты
Винная кислота содержит 2 асимметрических атома углерода и должна
существовать в виде четырех энантиомеров N=22
Однако известны только 2 оптически активных изомера D(+) и L(-) –
винные кислоты, рацемическая смесь- виноградная кислота и их
диастереомер - мезовинная кислота, оптически неактивная.
22
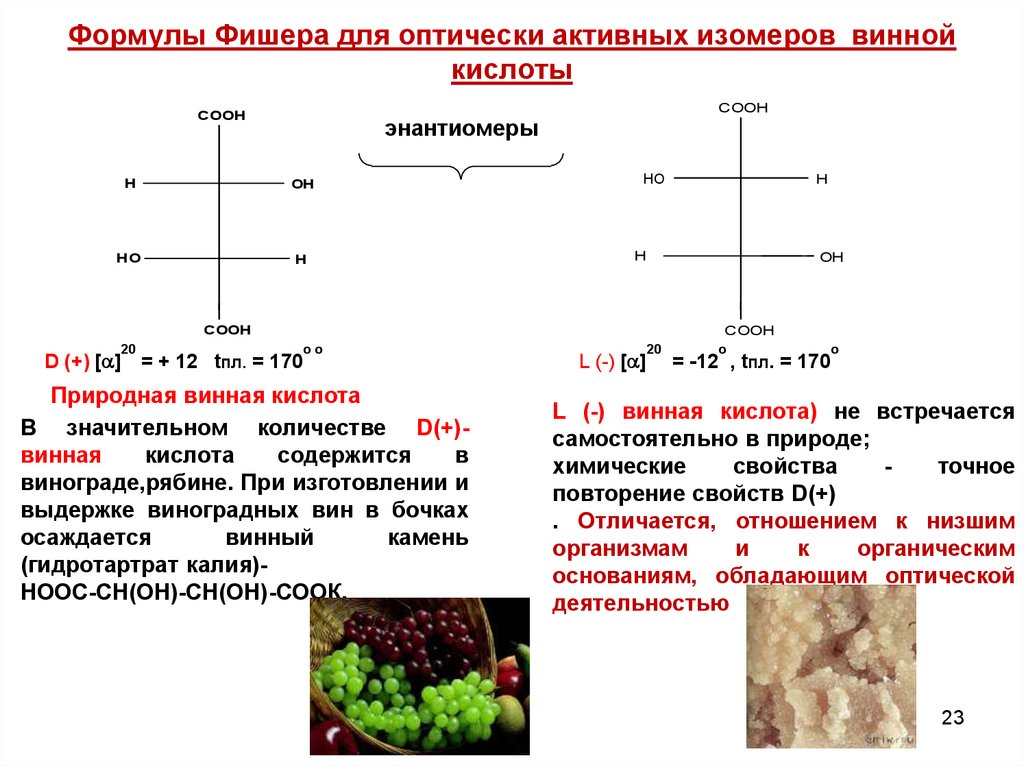
23. Формулы Фишера для оптически активных изомеров винной кислоты
COOHCOOH
энантиомеры
H
OH
HO
H
OH
HO
HHOHOO
H
COOH
D (+) [ ]
20
оо
= + 12 tпл. = 170
Природная винная кислота
В значительном количестве D(+)винная
кислота
содержится
в
винограде,рябине. При изготовлении и
выдержке виноградных вин в бочках
осаждается
винный
камень
(гидротартрат калия)НOOC-СН(ОН)-СН(ОН)-СООК.
H
L (-) [ ]
20
OH
COOH
о
о
= -12 , tпл. = 170
L (-) винная кислота) не встречается
самостоятельно в природе;
химические
свойства
точное
повторение свойств D(+)
. Отличается, отношением к низшим
организмам
и
к
органическим
основаниям, обладающим оптической
деятельностью
23
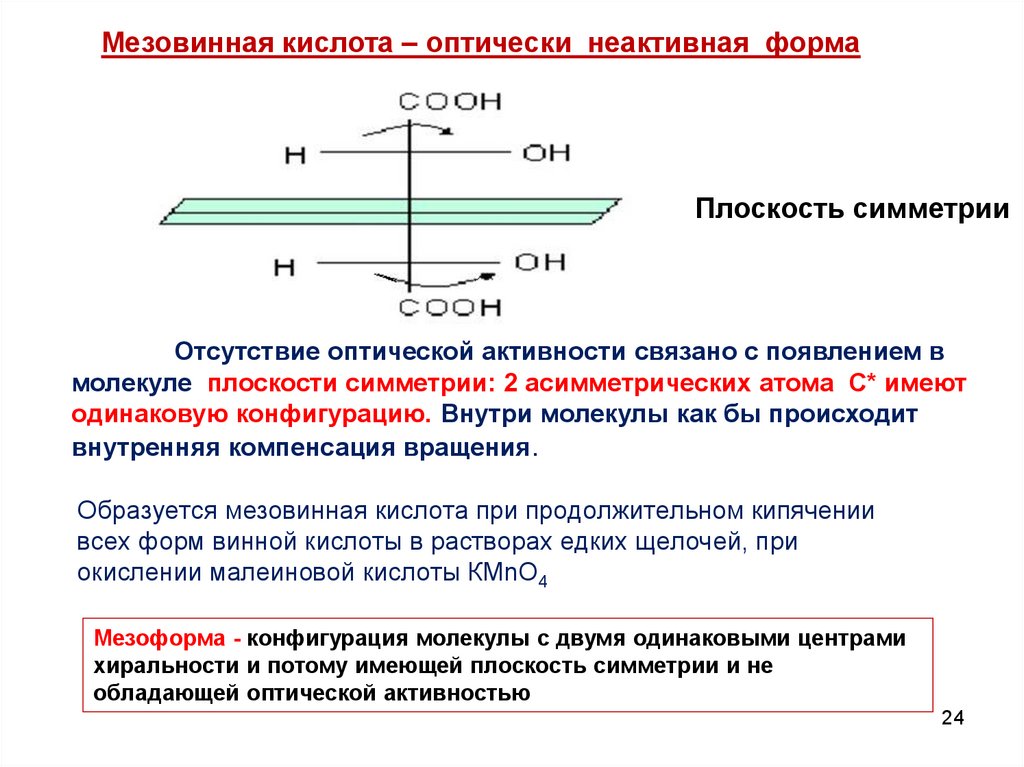
24.
Мезовинная кислота – оптически неактивная формаПлоскость симметрии
Отсутствие оптической активности связано с появлением в
молекуле плоскости симметрии: 2 асимметрических атома С* имеют
одинаковую конфигурацию. Внутри молекулы как бы происходит
внутренняя компенсация вращения.
Образуется мезовинная кислота при продолжительном кипячении
всех форм винной кислоты в растворах едких щелочей, при
окислении малеиновой кислоты КМnО4
Мезоформа - конфигурация молекулы с двумя одинаковыми центрами
хиральности и потому имеющей плоскость симметрии и не
обладающей оптической активностью
24
25. Применение винной кислоты
В пищевой промышленности в качестве консерванта и подкислителявкуса(Е334)
Является компонентом многих кремов и лосьонов для тела и лица;
В фармацевтической промышленности, где ее широко применяют при
производстве различных растворимых медикаментов, а также
шипучих таблеток и некоторых других лекарств;
В аналитической химии – для обнаружения альдегидов и сахаров.
25
26. Виноградная кислота - рацемическая смесь винных кислот
Виноградная кислота была открыта в 1822 какпобочный продукт при получении винной кислоты
В 1830 году Берцелиус
установил, что она имеет тот же
элементный состав, что и винная
кислота.
.
Йенс Якоб Берцелиус (1779-1848)
экспериментально подтвердил закон кратных отношений разработал
современную химическую нотацию, электрохимическую теорию сродства,
открыл церий селен, торий и впервые выделил в чистом виде кремний,титан26
,тантал и цирконий.
27.
Виноградная кислота - рацемическая смесь винных кислотЛуи Пастером были проведены
классические
исследования
с
виноградной и винной кислотами .
Он выяснил природу
соединений .
рацемических
Разработал методы их разделения
на составляющие их оптические
изомеры.
Луи Пастер (Louis Pasteur) (1822 1895) - выдающийся французский
микробиолог и химик
27
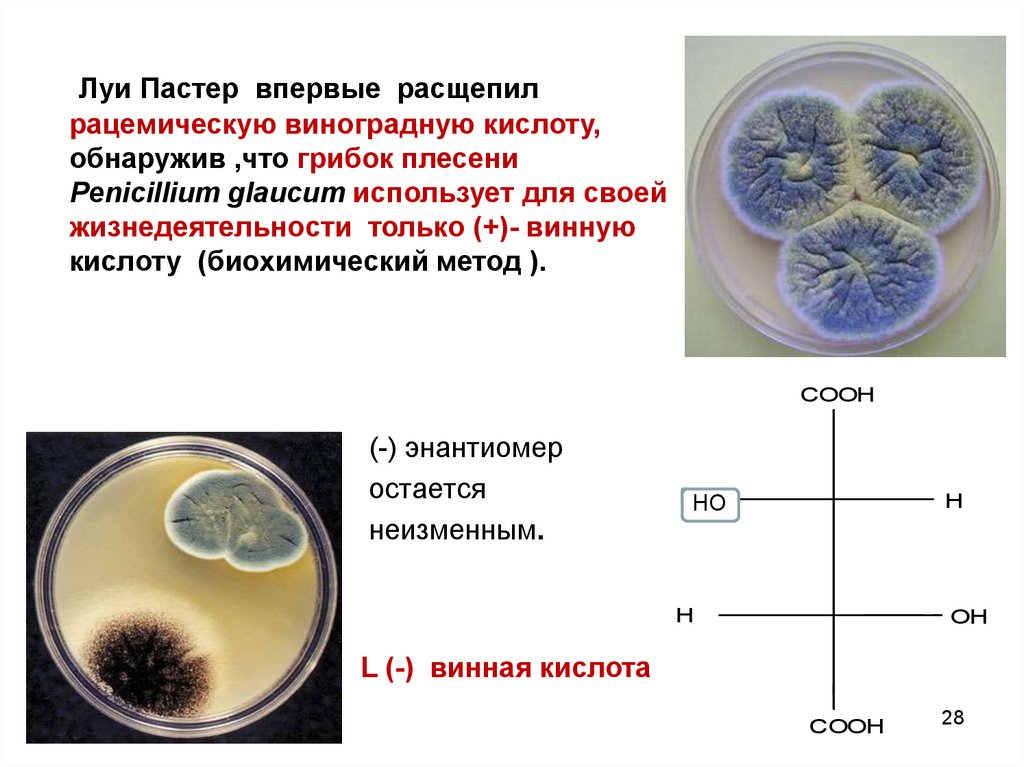
28.
Луи Пастер впервые расщепилрацемическую виноградную кислоту,
обнаружив ,что грибок плесени
Penicillium glaucum использует для своей
жизнедеятельности только (+)- винную
кислоту (биохимический метод ).
COOH
(-) энантиомер
остается
неизменным.
OH
HO
H
H
OH
L (-) винная кислота
COOH
28
29.
Виноградная кислота - рацемическая смесь винных кислотВиноградная кислота получается
длительным нагреванием водных
растворов D - или L-винной
кислоты ( рацемизация).
В
промышленных
масштабах
виноградную кислоту выделяют из
отходов
виноделия:
винного
камня,
виннокислой
извести,
сушёных винных дрожжей.
Свойства виноградной кислоты
отличаются от свойств чистых
оптических
изомеров
винной
кислоты t пл.=2050С. Очевидно, что
это не просто смесь изомеров, а
молекулярное
соединение
(рацемическое).
29
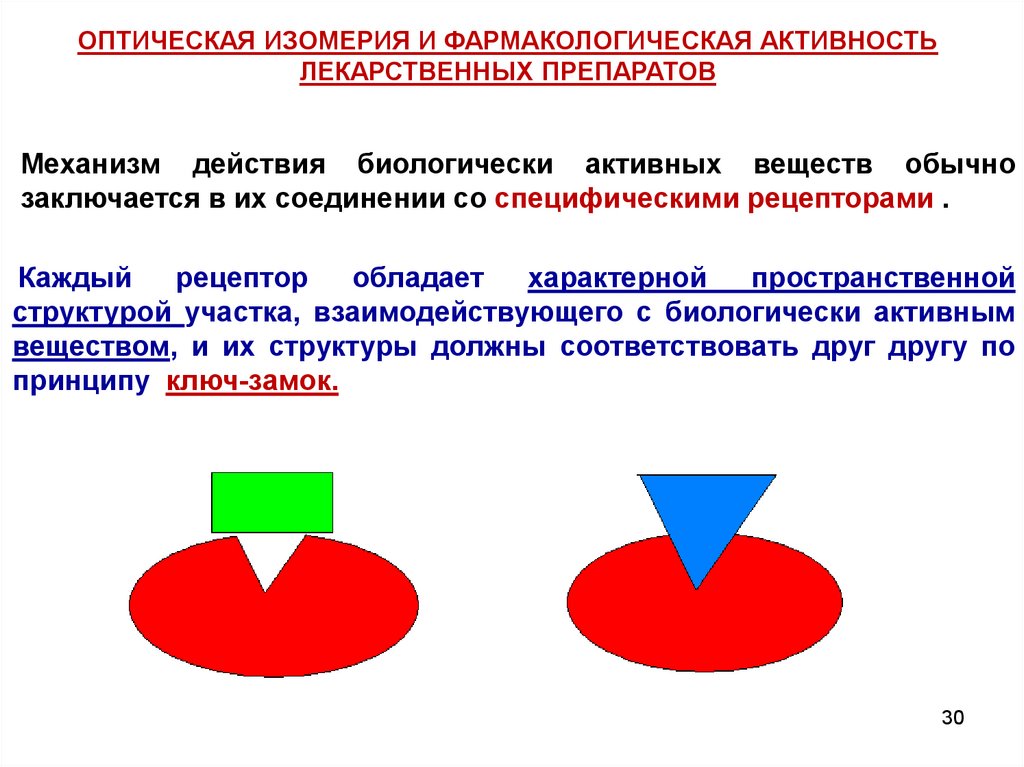
30.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Механизм действия биологически активных веществ обычно
заключается в их соединении со специфическими рецепторами .
Каждый
рецептор
обладает
характерной
пространственной
структурой участка, взаимодействующего с биологически активным
веществом, и их структуры должны соответствовать друг другу по
принципу ключ-замок.
30
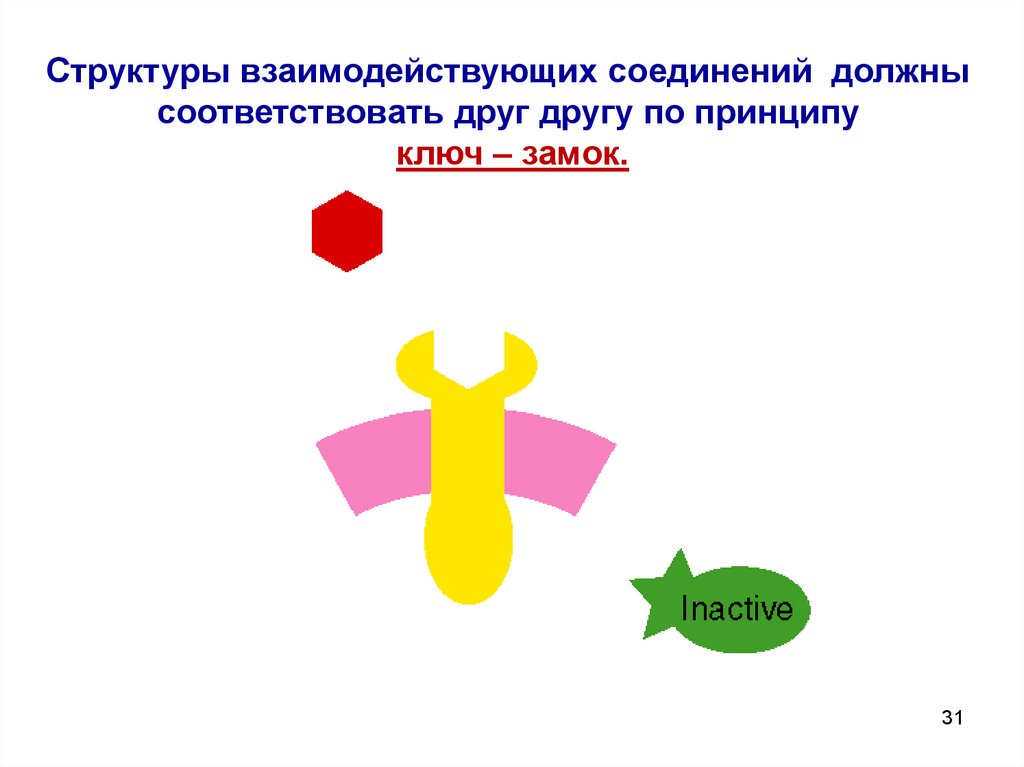
31.
Структуры взаимодействующих соединений должнысоответствовать друг другу по принципу
ключ – замок.
31
32.
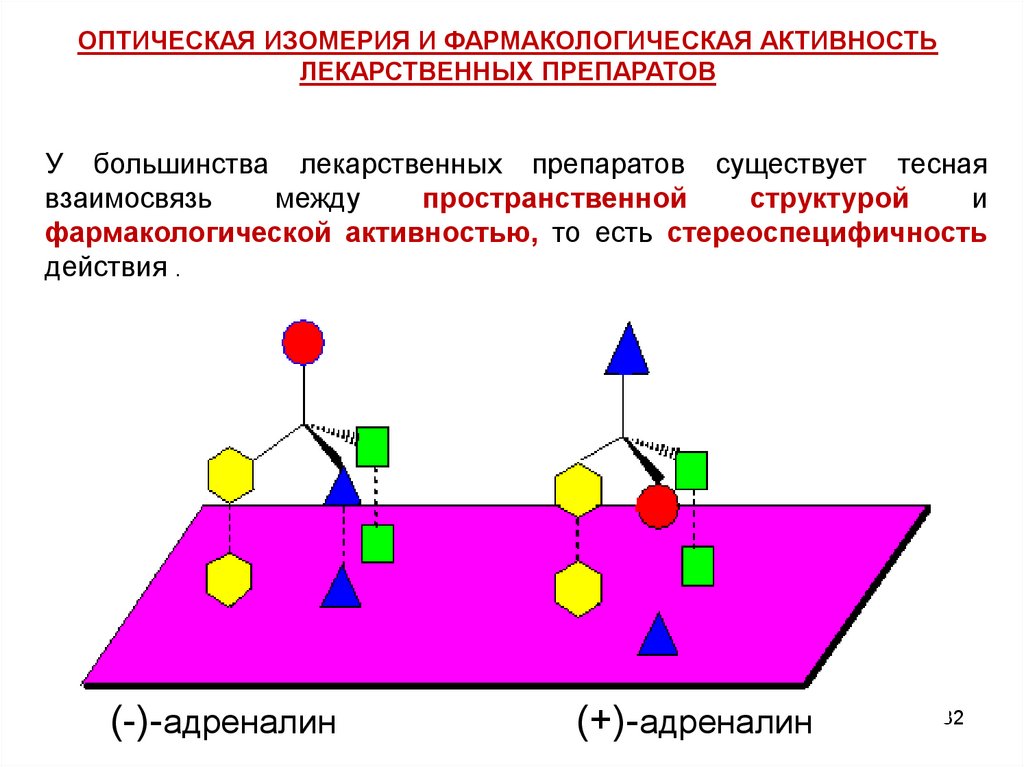
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
У большинства лекарственных препаратов существует тесная
взаимосвязь
между
пространственной
структурой
и
фармакологической активностью, то есть стереоспецифичность
действия .
(-)-адреналин
(+)-адреналин
32
33.
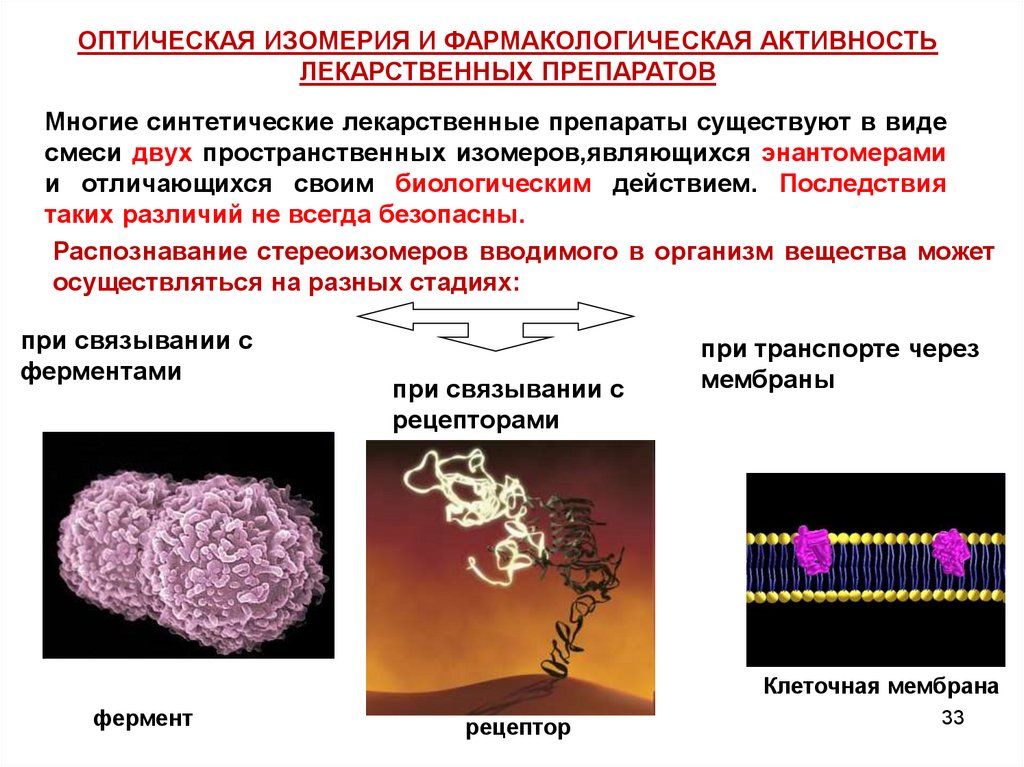
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Многие синтетические лекарственные препараты существуют в виде
смеси двух пространственных изомеров,являющихся энантомерами
и отличающихся своим биологическим действием. Последствия
таких различий не всегда безопасны.
Распознавание стереоизомеров вводимого в организм вещества может
осуществляться на разных стадиях:
при связывании с
ферментами
при связывании с
рецепторами
при транспорте через
мембраны
Клеточная мембрана
фермент
рецептор
33
34.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Основная фармакологическая активность рацемических лекарственных
препаратов обычно связана с действием лишь одного энантиомера.
Известны примеры использования в терапевтической практике
рацемических препаратов, когда один из стереоизомеров обладал
сильным токсическим эффектом. Это приводило к трагическим случаям.
(+)Талидомид вызывал
недоразвитие конечностей у
новорожденных
(-)Талидомид - мощный
транквилизатор
34
35.
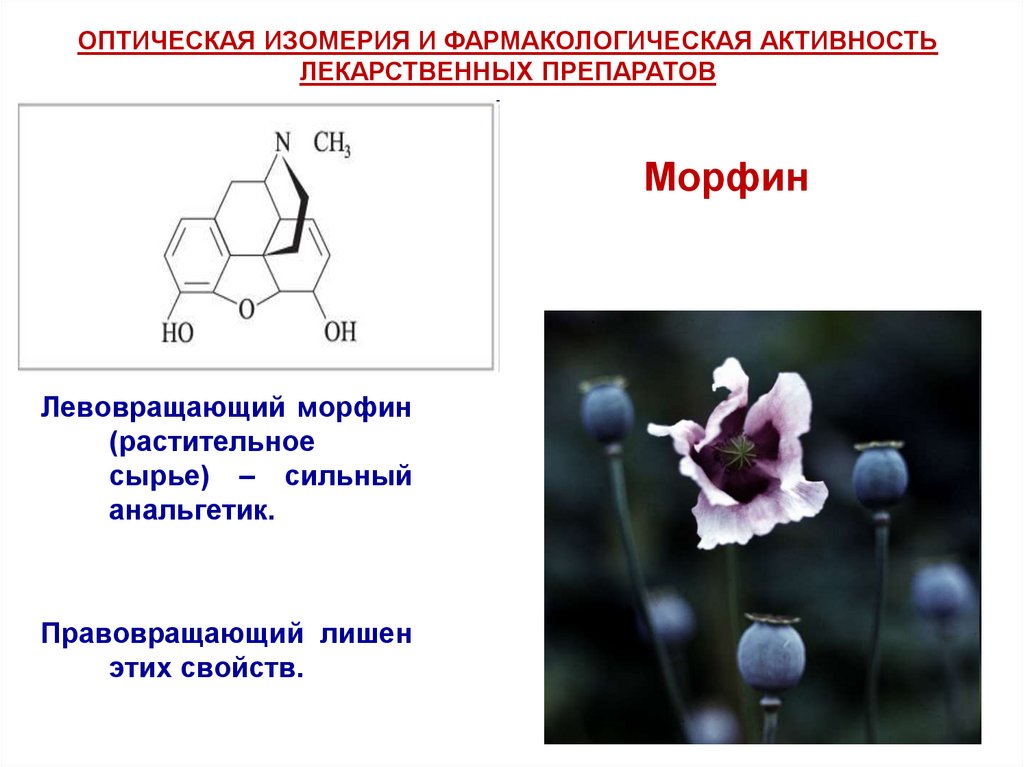
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Морфин
Левовращающий морфин
(растительное
сырье) – сильный
анальгетик.
Правовращающий лишен
этих свойств.
36.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
(-)-5-(1,3-диметилбутил)-5-этилбарбитуровая кислота проявляет
обычное для барбитуратов успокаивающее действие, в то время,как
(+)-антипод вызывает конвульсии
Me
Me
O
Me
NH
Et
O
N
H
O
36
37.
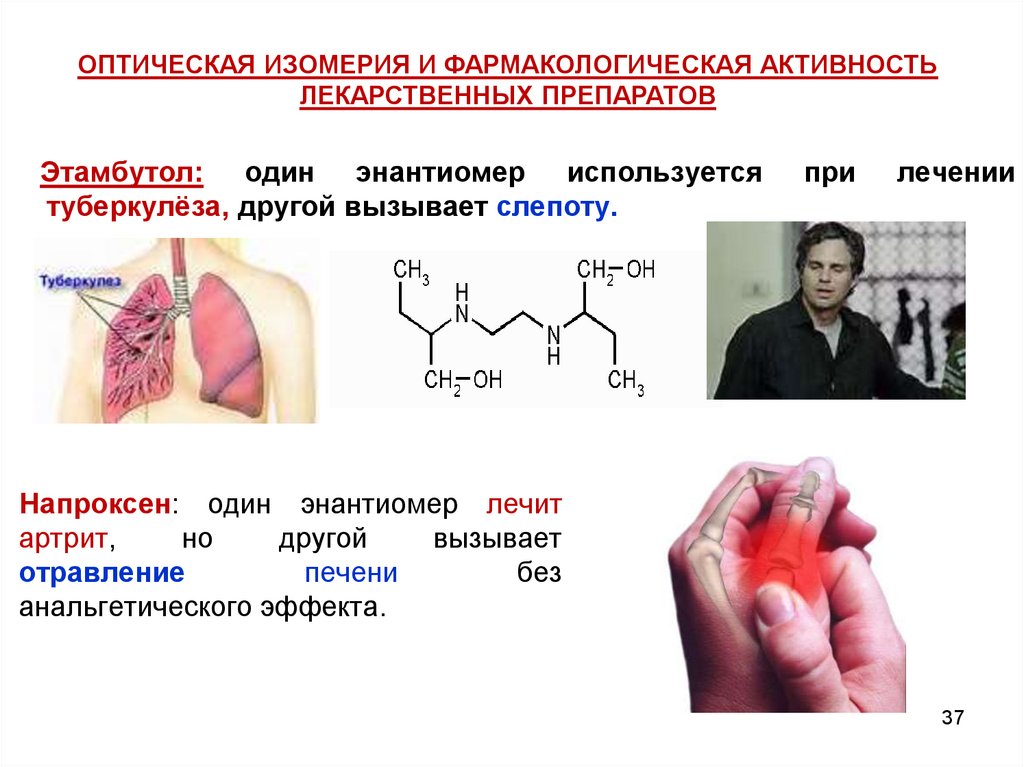
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Этамбутол: один энантиомер используется
туберкулёза, другой вызывает слепоту.
при
лечении
Напроксен: один энантиомер лечит
артрит,
но
другой
вызывает
отравление
печени
без
анальгетического эффекта.
37
38.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ И ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
В течение
нескольких последних десятилетий велись
интенсивные
исследования
по
развитию
методов
предпочтительного синтеза одного из энантиомеров..
В 2001 году Нобелевская премия была присуждена японскому
ученому Риоджи Нойори, и двум американским – Уильяму Ноулзу
и
Бэрри
Шарплессу.
Ученые
разработали
хиральные
катализаторы для двух важных классов реакций органической
химии: гидрирования и окисления.
Нобелевские луреаты сделали возможным промышленный синтез
таких
фармакологических
продуктов,
как
антибиотики,
противовоспалительные и сердечные средства, а также других
веществ, среди которых кондитерские отдушки, подсластители и
инсектициды
38
39. Нобелевская премия 2001года
Риоджи НойориБарри Шарплесс
Уильям Нойлес
Открытия ученых в области хиральных катализаторов
позволили наладить производство более безопасных
лекарств.
40.
Гидроксикислоты гетерофункциональные соединения40
41.
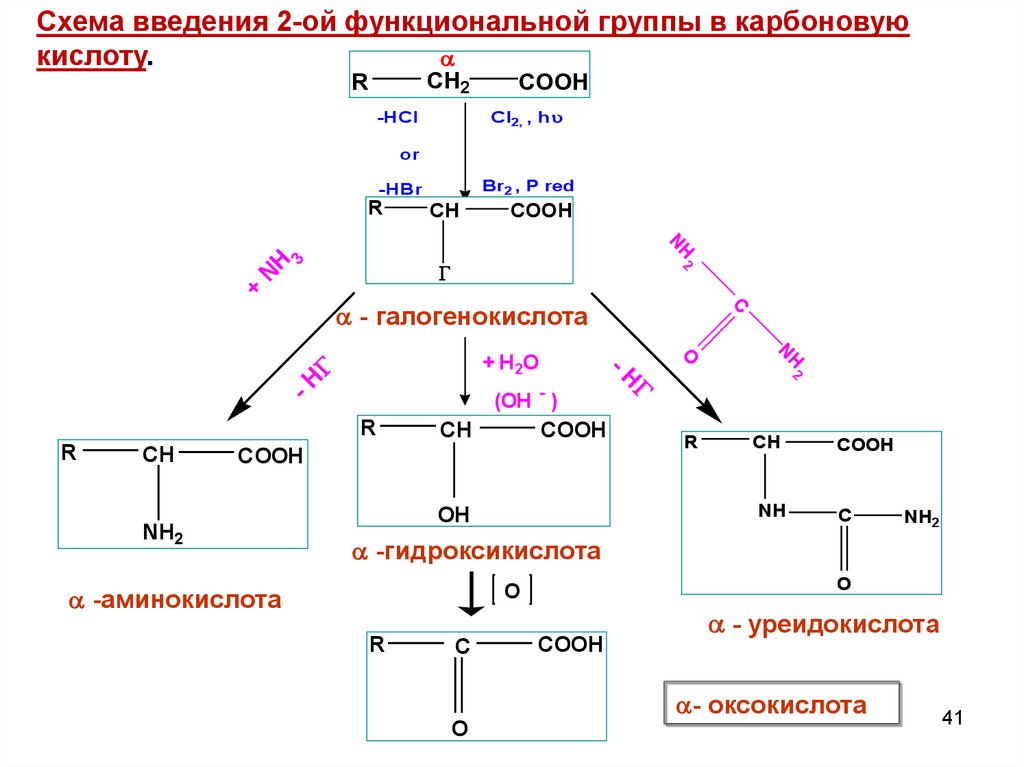
Схема введения 2-ой функциональной группы в карбоновуюкислоту.
CH2
R
COOH
Cl2, , h
-HCl
or
Br2 , P red
-HBr
NH
CH
COOH
2
NH
3
R
+
-H
CH
CH
COOH
COOH
NH2
OH
2
NH
R
(OH - )
-H
R
O
+ H2O
C
- галогенокислота
R
CH
COOH
NH
C
NH2
-гидроксикислота
O
O
-аминокислота
R
C
O
COOH
- уреидокислота
- оксокислота
41
42.
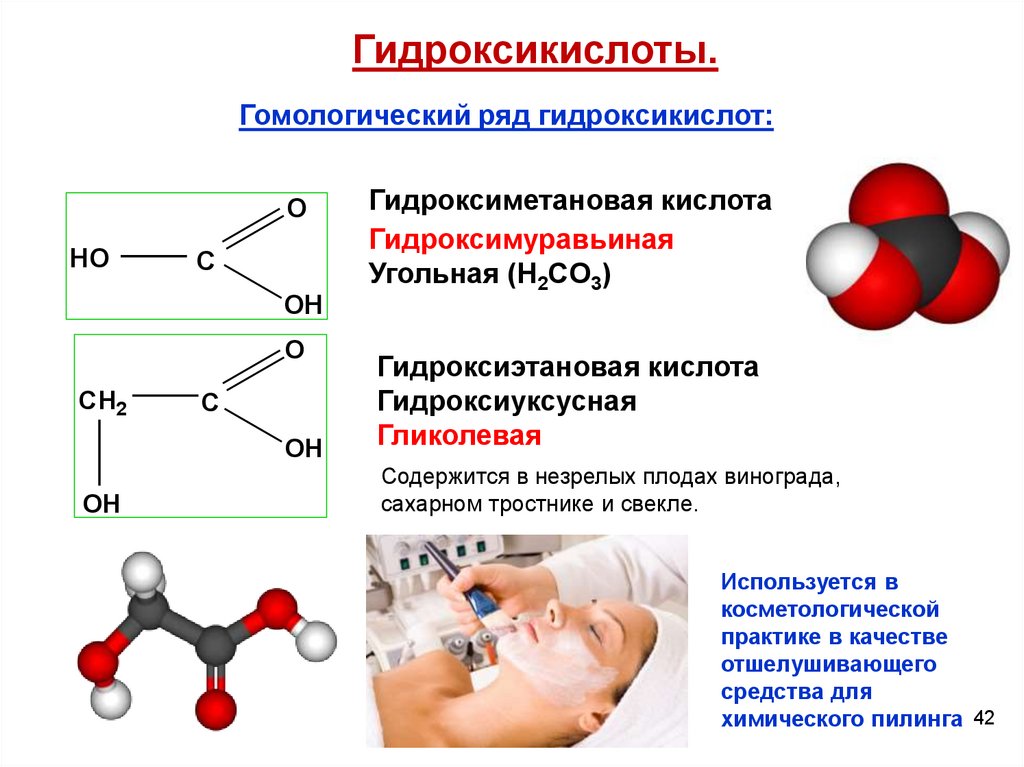
Гидроксикислоты.Гомологический ряд гидроксикислот:
O
HO
C
OH
O
CH2
C
OH
OH
Гидроксиметановая кислота
Гидроксимуравьиная
Угольная (H2CO3)
Гидроксиэтановая кислота
Гидроксиуксусная
Гликолевая
Содержится в незрелых плодах винограда,
сахарном тростнике и свекле.
Используется в
косметологической
практике в качестве
отшелушивающего
средства для
химического пилинга 42
43.
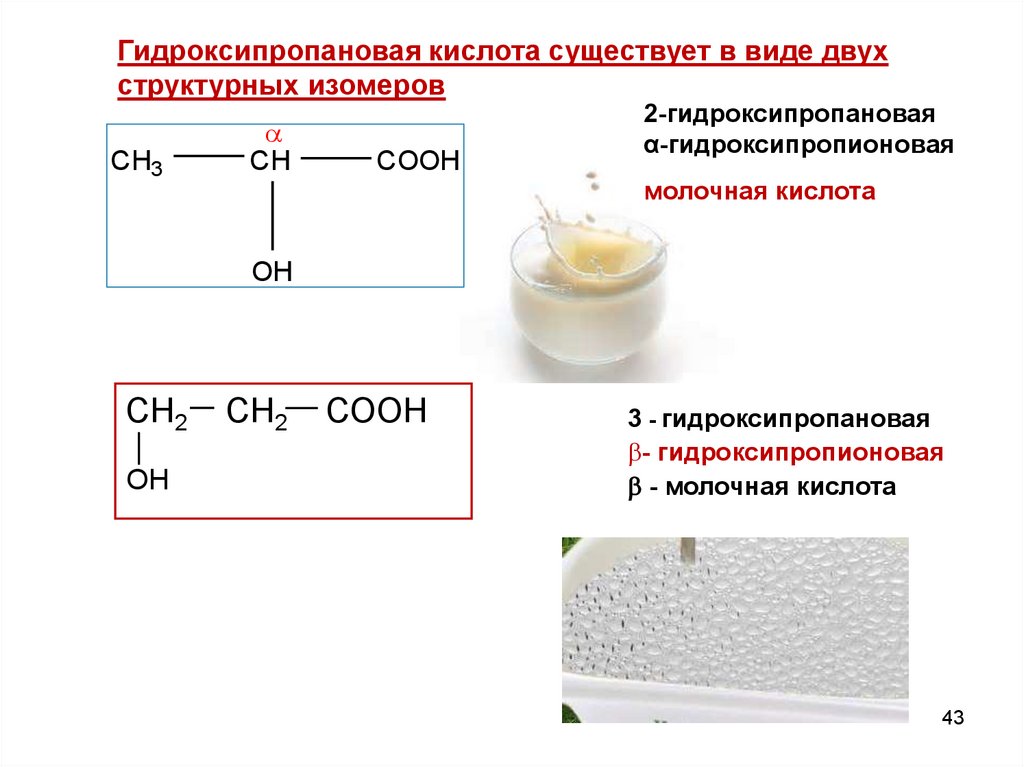
Гидроксипропановая кислота существует в виде двухструктурных изомеров
CH3
CH
COOH
2-гидроксипропановая
α-гидроксипропионовая
молочная кислота
OH
СН2
ОН
СН2
СООН
3 - гидроксипропановая
- гидроксипропионовая
- молочная кислота
43
44.
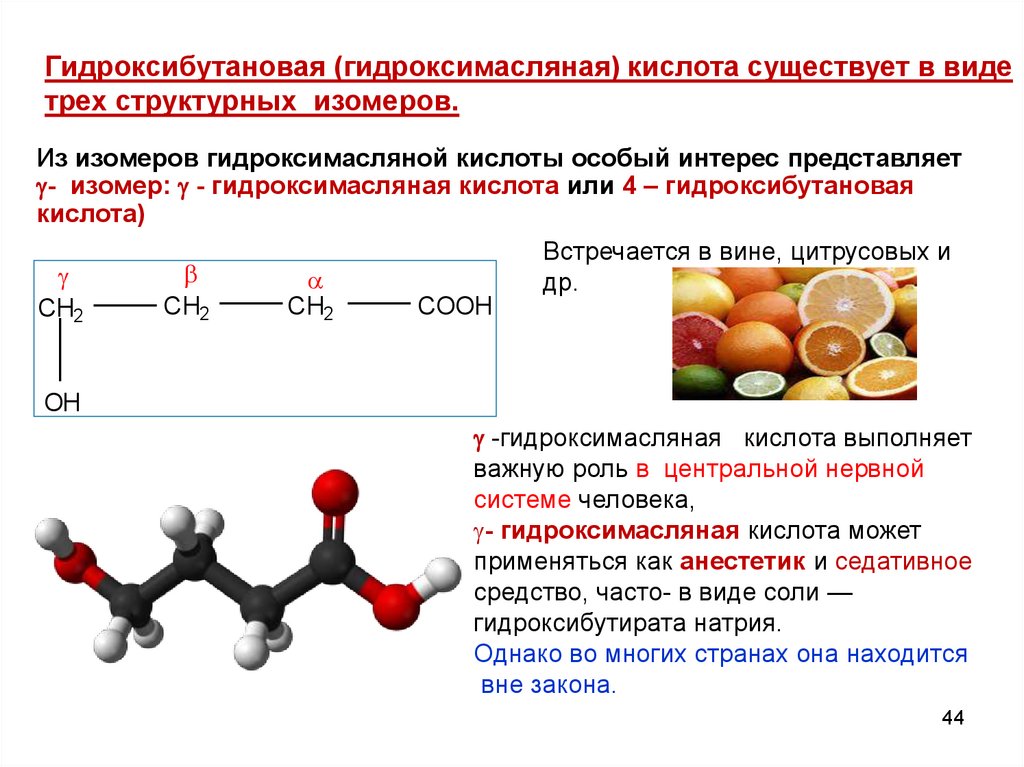
Гидроксибутановая (гидроксимасляная) кислота существует в видетрех структурных изомеров.
Из изомеров гидроксимасляной кислоты особый интерес представляет
- изомер: - гидроксимасляная кислота или 4 – гидроксибутановая
кислота)
Встречается в вине, цитрусовых и
др.
CH2
CH2
COOH
CH2
OH
-гидроксимасляная кислота выполняет
важную роль в центральной нервной
системе человека,
- гидроксимасляная кислота может
применяться как анестетик и седативное
средство, часто- в виде соли —
гидроксибутирата натрия.
Однако во многих странах она находится
вне закона.
44
45.
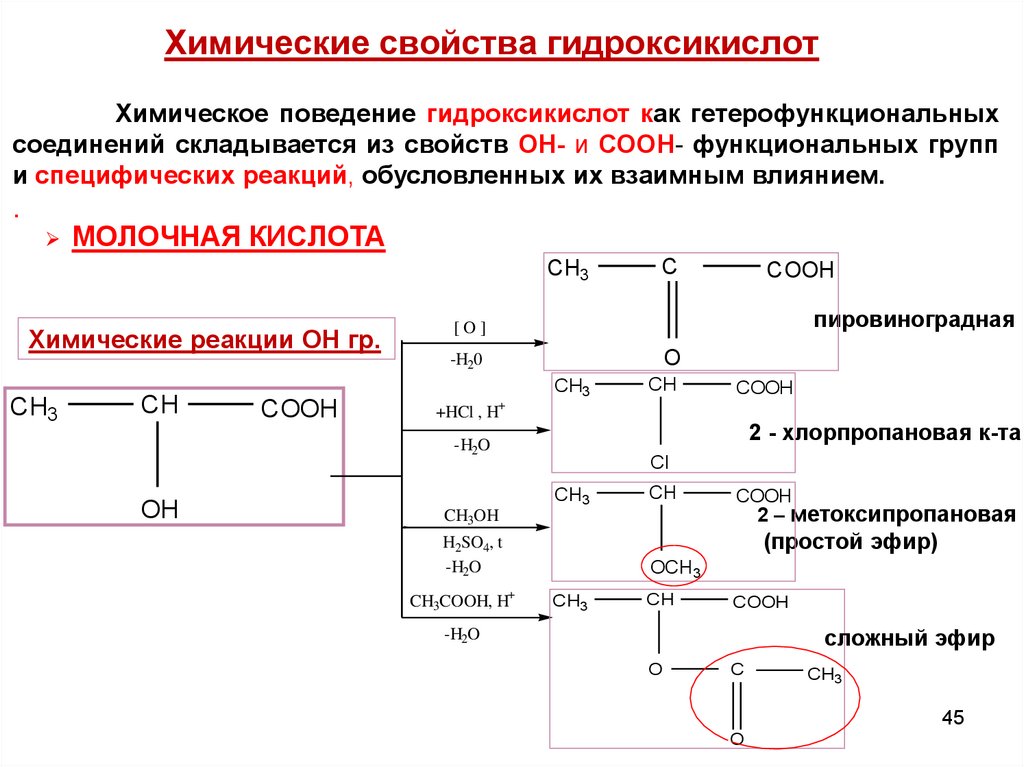
Химические свойства гидроксикислотХимическое поведение гидроксикислот как гетерофункциональных
соединений складывается из свойств ОН- и СООН- функциональных групп
и специфических реакций, обусловленных их взаимным влиянием.
.
МОЛОЧНАЯ КИСЛОТА
CH3
Химические реакции ОН гр.
CH3
CH
COOH
COOH
пировиноградная
[O]
O
-H20
CH3
CH
COOH
+
+HCl , H
2 - хлорпропановая к-та
-H2O
OH
C
Cl
CH3
CH
COOH
CH3OH
2 – метоксипропановая
H2SO4, t
-H2O
(простой эфир)
CH3COOH, H+
OCH3
CH3
CH
COOH
сложный эфир
-H2O
O
C
CH3
45
O
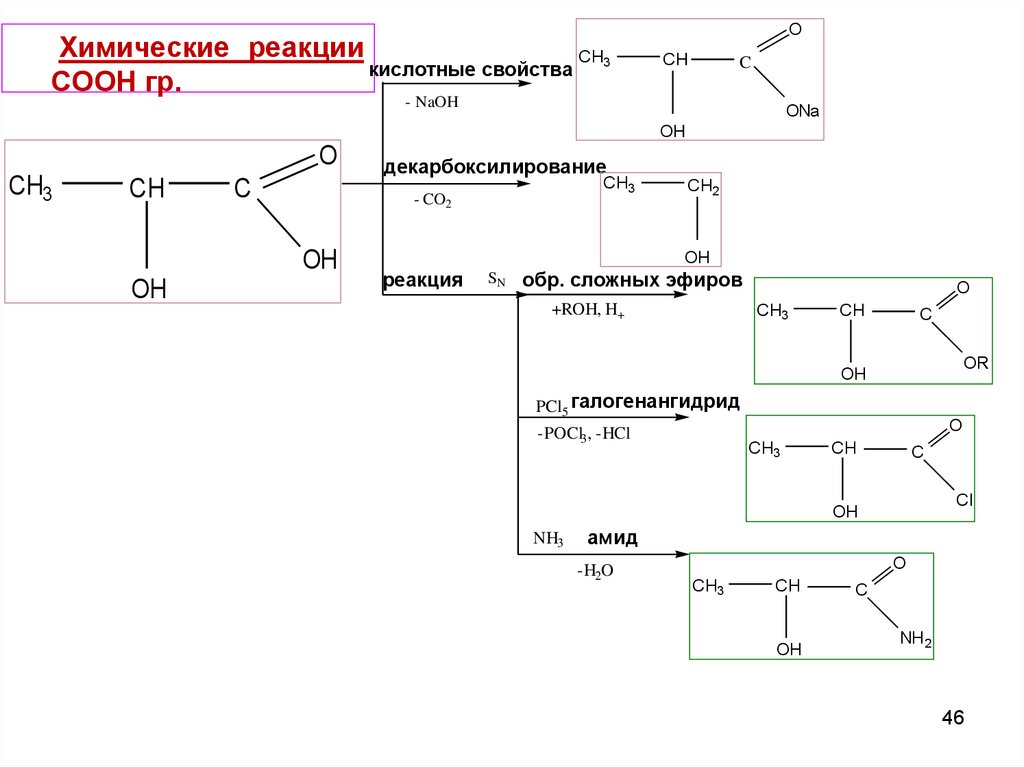
46.
Химические реакцииCH3
кислотные свойства
СООН гр.
O
CH
C
- NaOH
O
CH3
CH
OH
C
ONa
OH
декарбоксилирование
CH3
- CO2
OH
CH2
OH
реакция
SN
обр. сложных эфиров
O
CH3
+ROH, H+
CH
C
OR
OH
PCl5 галогенангидрид
-POCl3, -HCl
O
CH3
CH
C
Cl
OH
NH3
амид
-H2O
O
CH3
CH
OH
C
NH 2
46
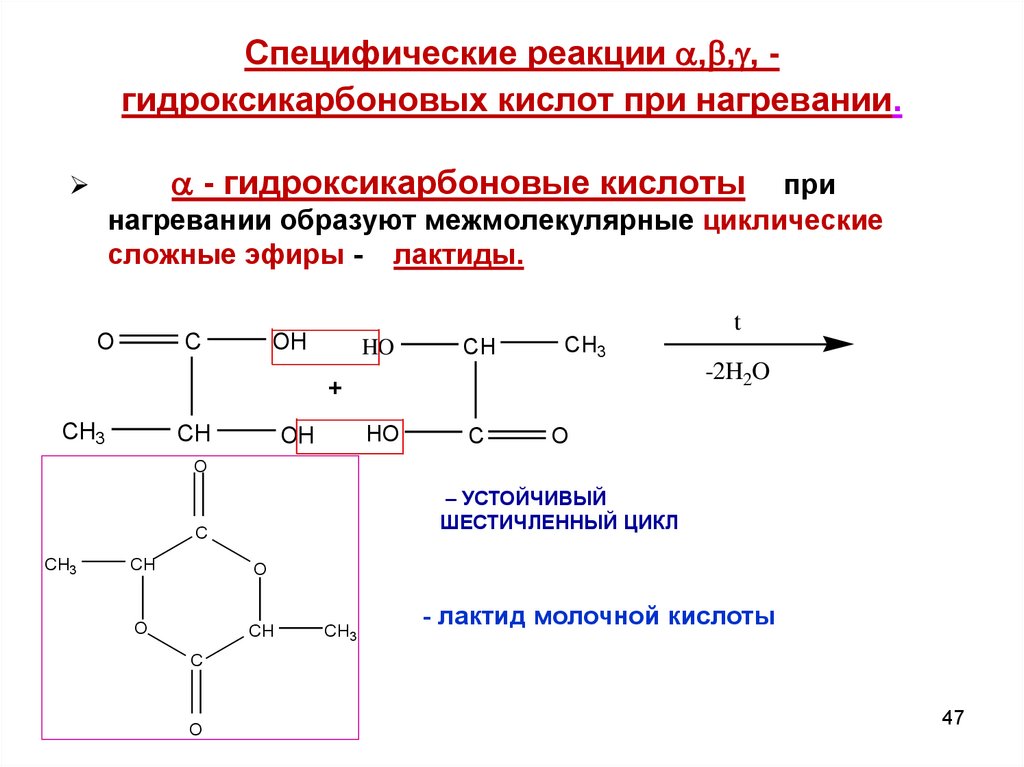
47. Специфические реакции ,,, - гидроксикарбоновых кислот при нагревании.
Специфические реакции , , , гидроксикарбоновых кислот при нагревании.- гидроксикарбоновые кислоты
при
нагревании образуют межмолекулярные циклические
сложные эфиры - лактиды.
O
C
OH
HO
CH
CH3
-2H2O
+
CH3
CH
HO
OH
t
C
O
O
– УСТОЙЧИВЫЙ
ШЕСТИЧЛЕННЫЙ ЦИКЛ
C
CH3
CH
O
O
CH
CH3
- лактид молочной кислоты
C
O
47
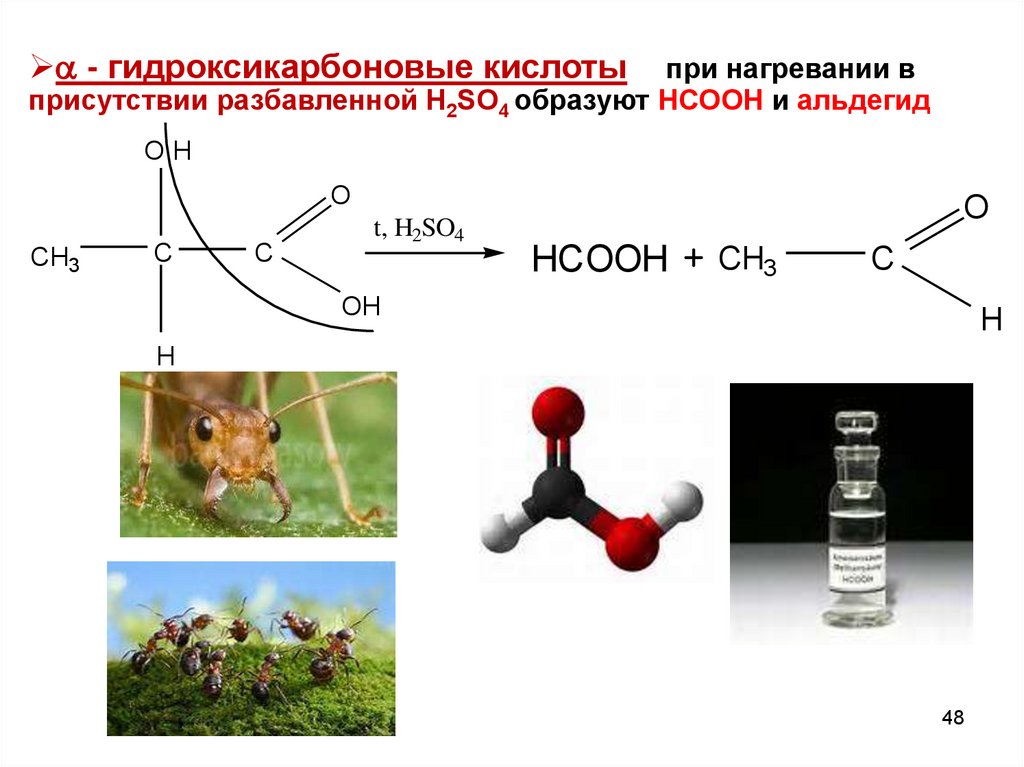
48.
- гидроксикарбоновые кислотыпри нагревании в
присутствии разбавленной Н2SO4 образуют НСООН и альдегид
OH
O
CH3
C
C
t, H2SO4
O
HCOOH
CH3
C
OH
H
H
48
49.
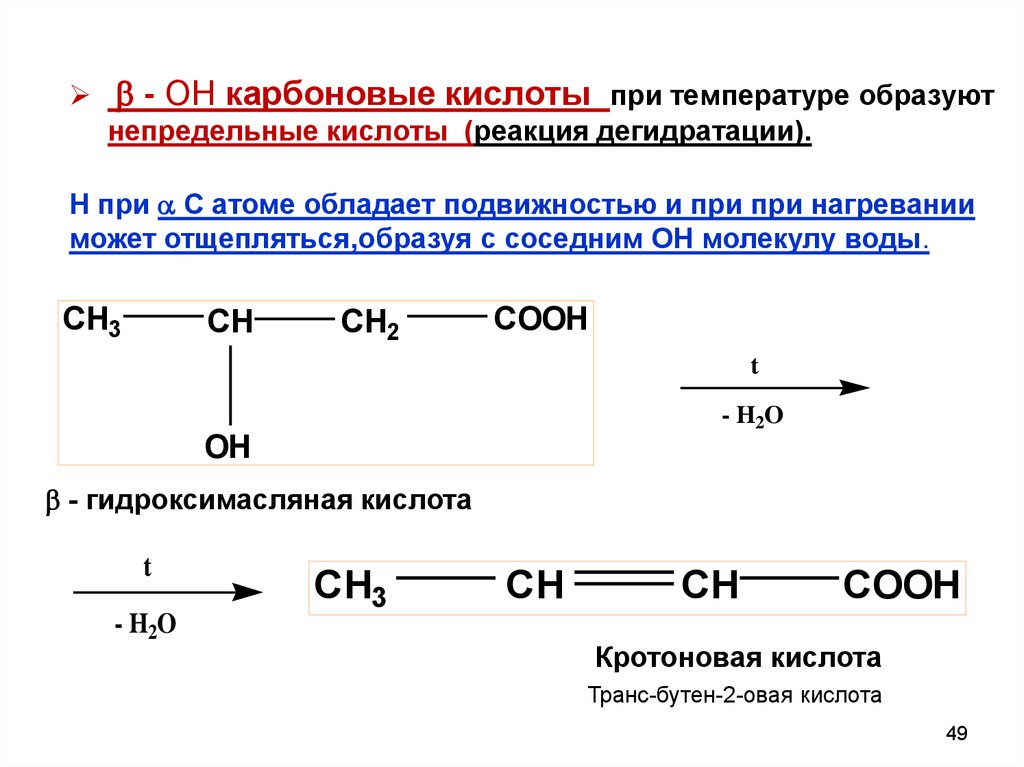
- ОН карбоновые кислоты при температуре образуютнепредельные кислоты (реакция дегидратации).
Н при С атоме обладает подвижностью и при при нагревании
может отщепляться,образуя с соседним ОН молекулу воды.
CH3
CH
CH2
COOH
t
- H2O
OH
- гидроксимасляная кислота
t
- H2O
CH3
CH
CH
COOH
Кротоновая кислота
Транс-бутен-2-овая кислота
49
50.
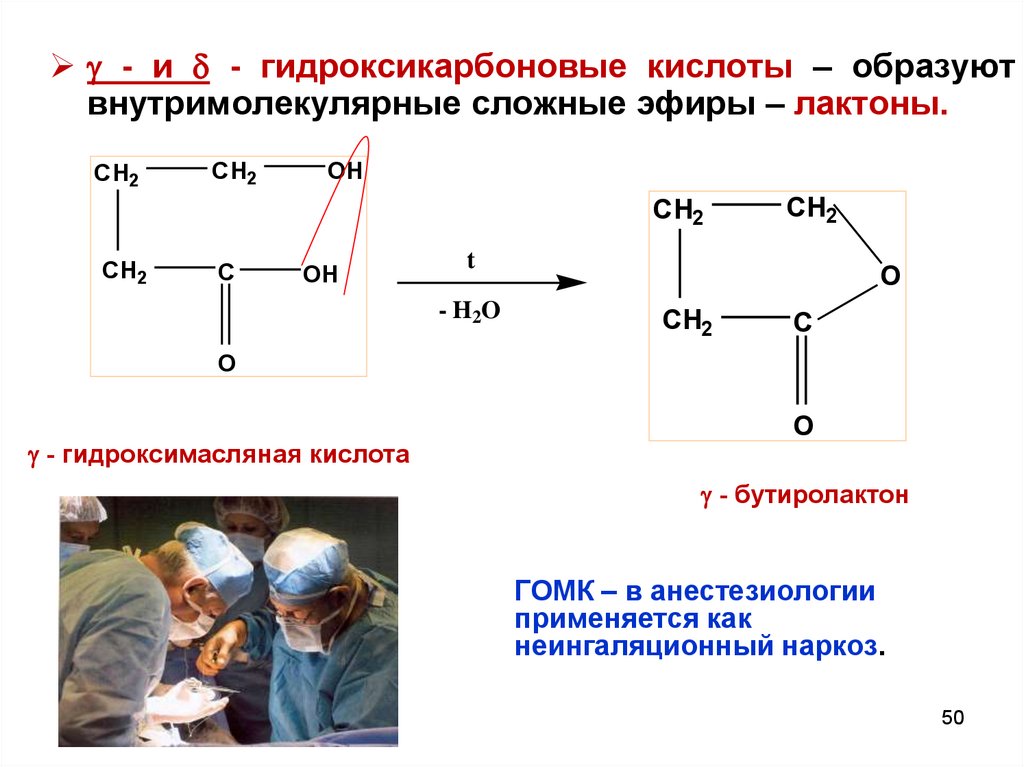
- и - гидроксикарбоновые кислоты – образуютвнутримолекулярные сложные эфиры – лактоны.
CH2
CH2
OH
CH2
CH2
C
OH
CH2
t
- H2O
O
CH2
C
O
- гидроксимасляная кислота
O
- бутиролактон
ГОМК – в анестезиологии
применяется как
неингаляционный наркоз.
50
51.
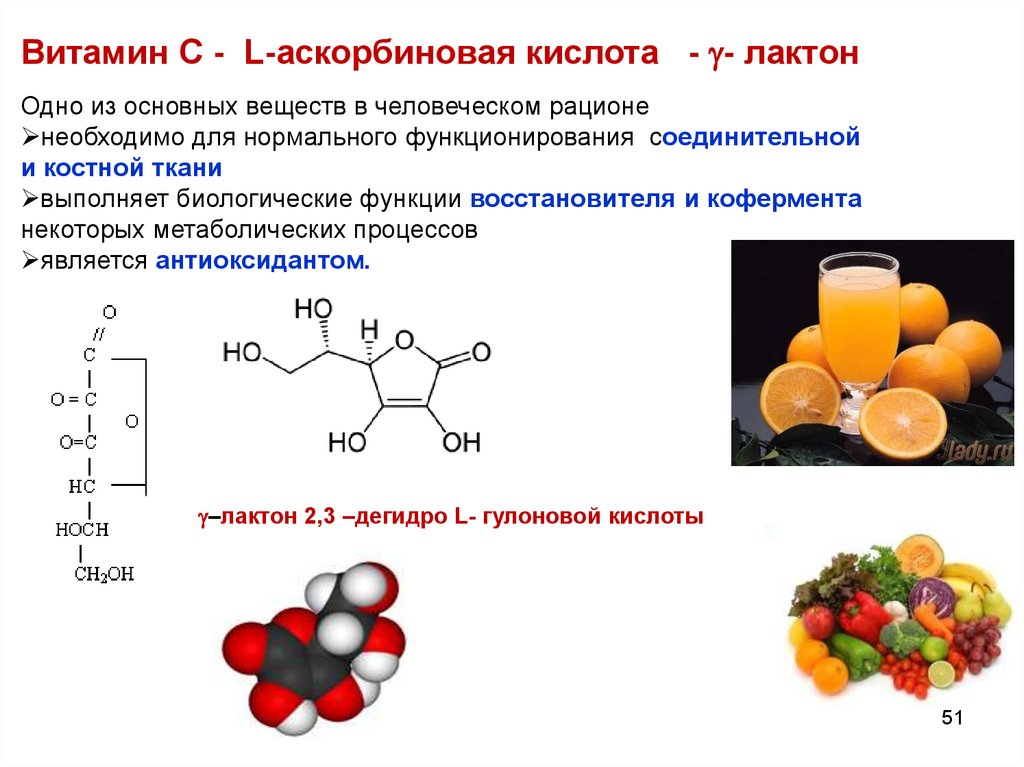
Витамин С - L-аскорбиновая кислота - - лактонОдно из основных веществ в человеческом рационе
необходимо для нормального функционирования соединительнойтельной
и костной ткани
выполняет биологические функции восстановителя и кофермента
некоторых метаболических процессов
является антиоксидантом.
–лактон 2,3 –дегидро L- гулоновой кислоты
51
52.
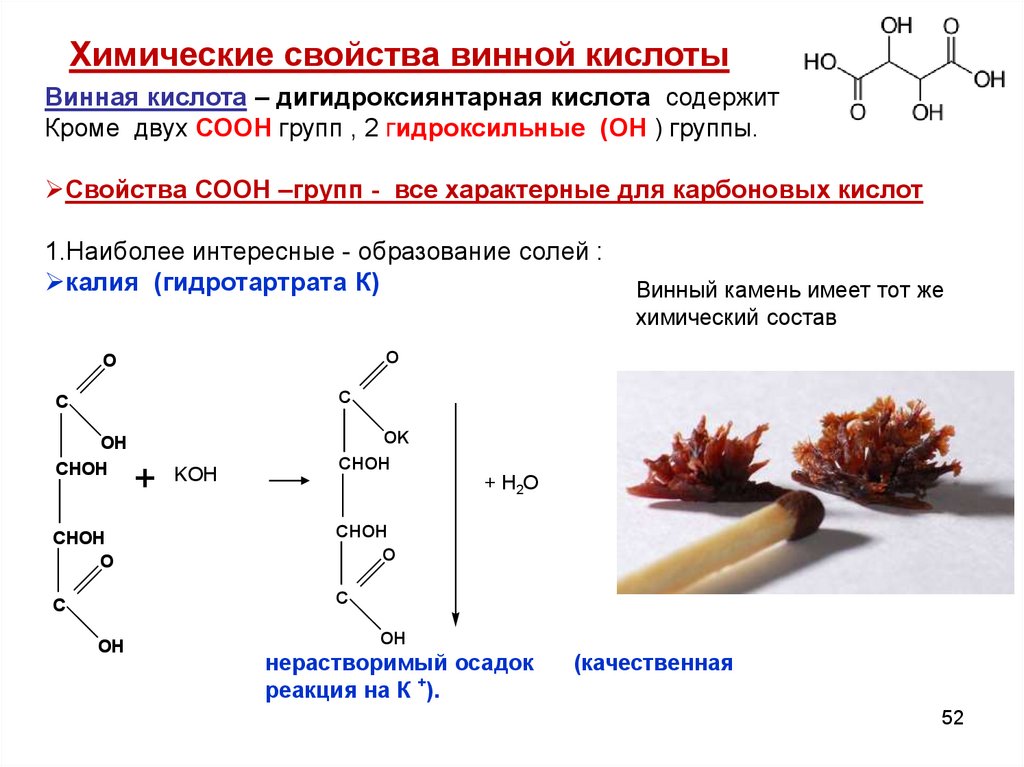
Химические свойства винной кислотыВинная кислота – дигидроксиянтарная кислота содержит
Кроме двух СООН групп , 2 гидроксильные (ОН ) группы.
Свойства СООН –групп - все характерные для карбоновых кислот
1.Наиболее интересные - образование солей :
калия (гидротартрата К)
O
O
C
C
OH
CHOH
OK
CHOH
+ KOH
CHOH
O
CHOH
O
C
C
OH
Винный камень имеет тот же
химический состав
+ Н2О
OH
нерастворимый осадок
реакция на К +).
(качественная
52
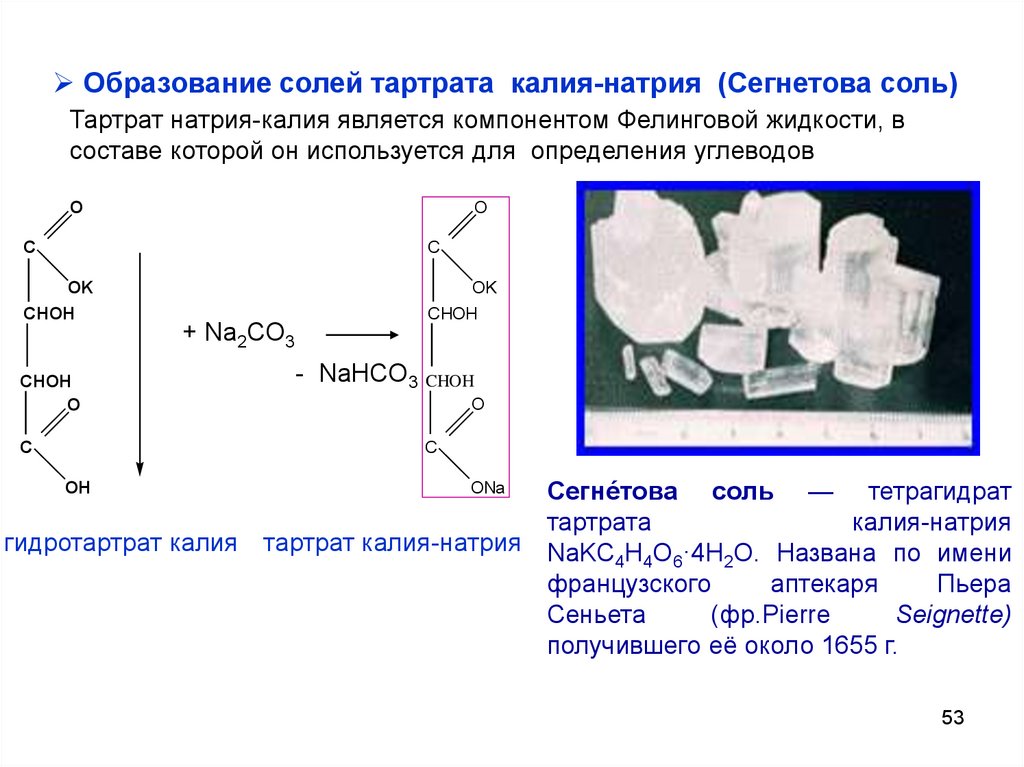
53.
Образование солей тартрата калия-натрия (Сегнетова соль)Тартрат натрия-калия является компонентом Фелинговой жидкости, в
составе которой он используется для определения углеводов
O
O
C
C
OK
CHOH
OK
CHOH
CHOH
O
+ Na2CO3
- NaHCO3 CHOH
O
C
C
Сегне́това соль — тетрагидрат
тартрата
калия-натрия
гидротартрат калия тартрат калия-натрия NaKC H O ·4H O. Названа по имени
4 4 6
2
французского
аптекаря
Пьера
Сеньета
(фр.Pierre
Seignette)
получившего её около 1655 г.
OH
ONa
53
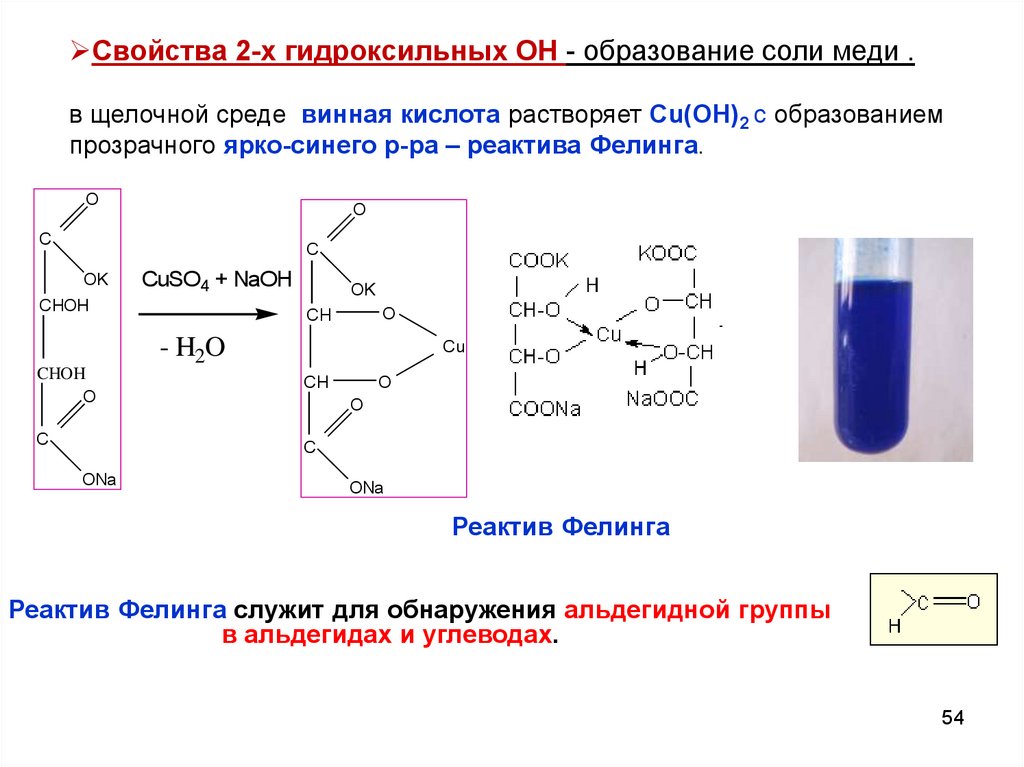
54.
Свойства 2-х гидроксильных ОН - образование соли меди .в щелочной среде винная кислота растворяет Сu(ОН)2 с образованием
прозрачного ярко-синего р-ра – реактива Фелинга.
O
O
C
C
OK
CHOH
CuSO4 + NaOH
OK
O
CH
Cu
- H2O
CHOH
O
CH
C
C
ONa
O
O
ONa
Реактив Фелинга
Реактив Фелинга служит для обнаружения альдегидной группы
в альдегидах и углеводах.
54
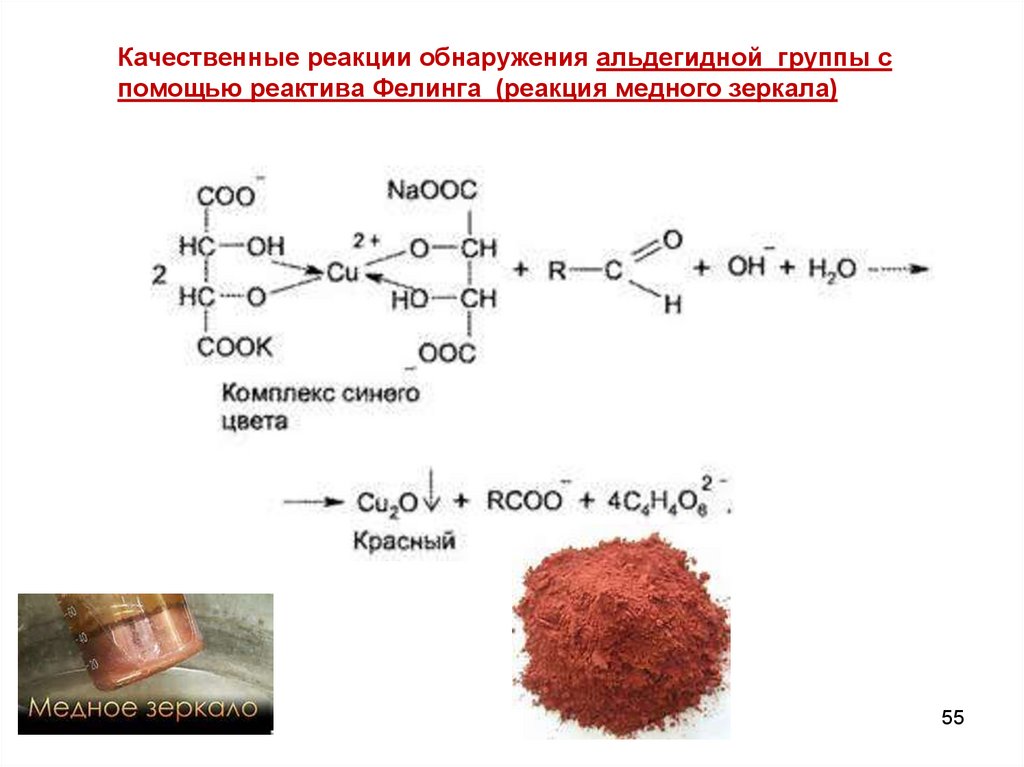
55.
Качественные реакции обнаружения альдегидной группы спомощью реактива Фелинга (реакция медного зеркала)
55
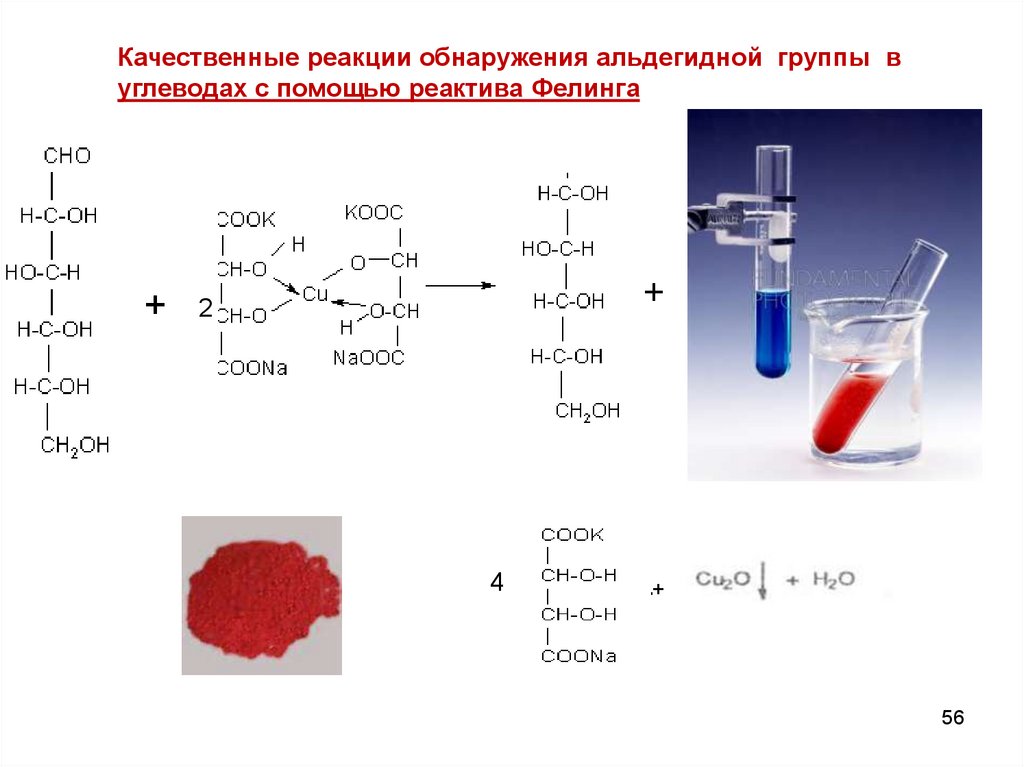
56.
Качественные реакции обнаружения альдегидной группы вуглеводах с помощью реактива Фелинга
2
4
+
56
57.
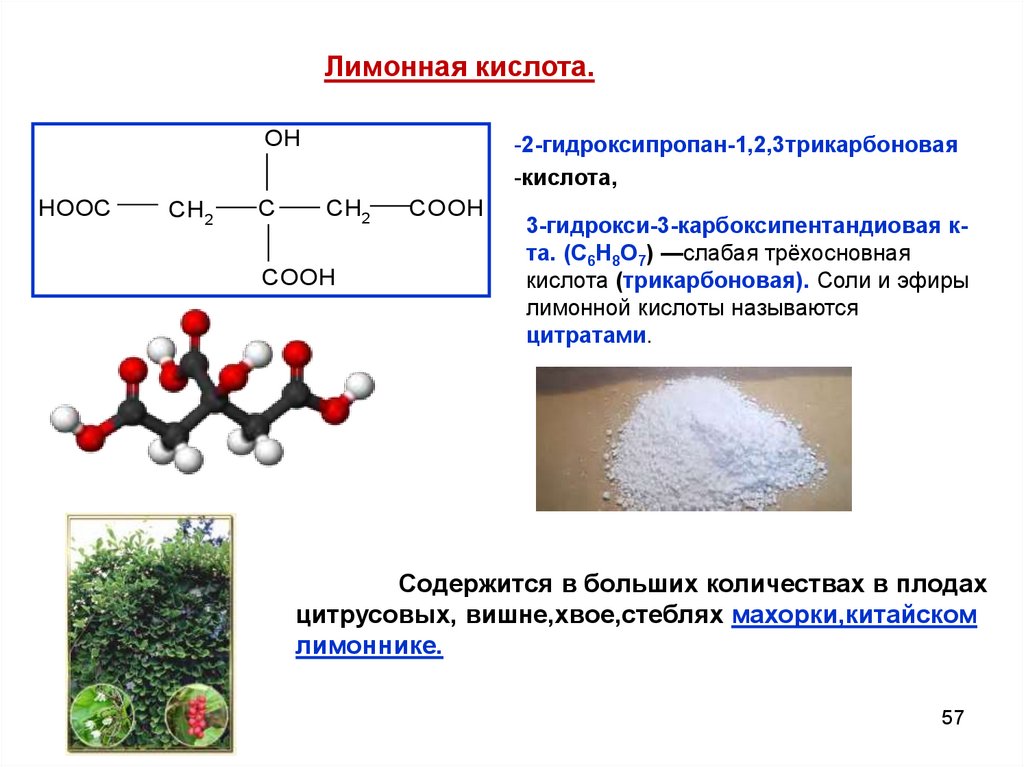
Лимонная кислота.OH
HOOC
CH2
C
-2-гидроксипропан-1,2,3трикарбоновая
-кислота,
CH2
COOH
COOH
3-гидрокси-3-карбоксипентандиовая кта. (C6H8O7) —слабая трёхосновная
кислота (трикарбоновая). Соли и эфиры
лимонной кислоты называются
цитратами.
Содержится в больших количествах в плодах
цитрусовых, вишне,хвое,стеблях махорки,китайском
лимоннике.
57
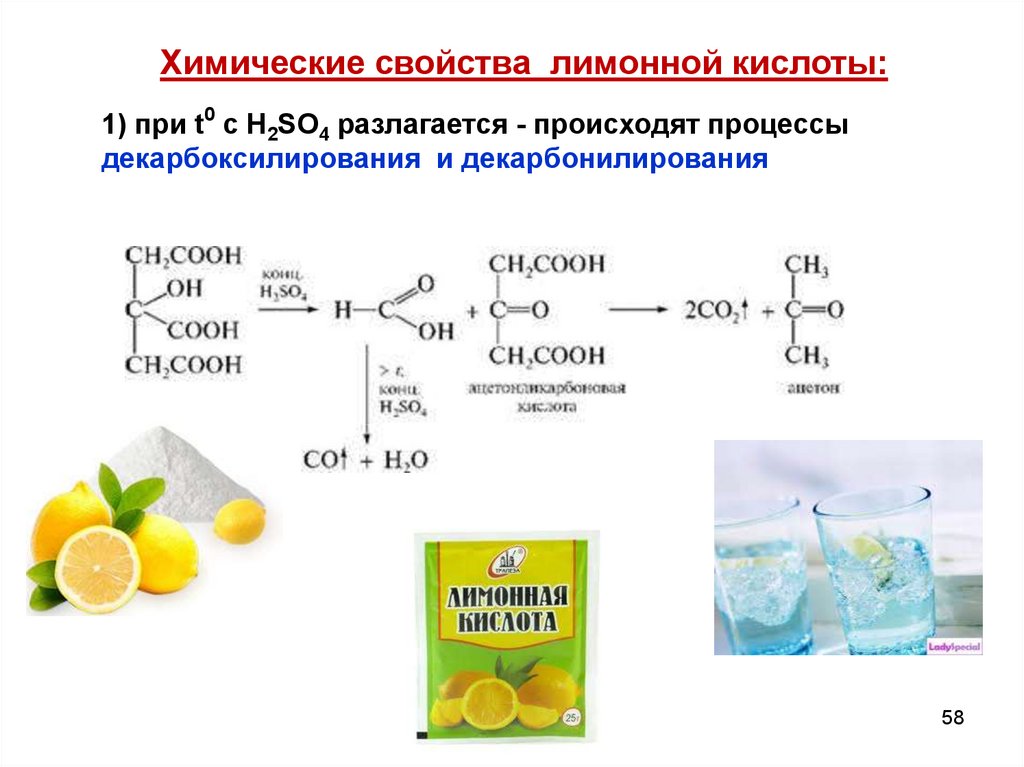
58.
Химические свойства лимонной кислоты:1) при t0 с Н2SО4 разлагается - происходят процессы
декарбоксилирования и декарбонилирования
58
59.
Получение лимонной кислотыЛимонную кислоту раньше получали из сока лимона и биомассы махорки.
В настоящее время основной путь промышленного производства —
биосинтез из сахара или сахаристых веществ (меласса) промышленными
штаммами плесневого гриба Aspergillus niaer
59
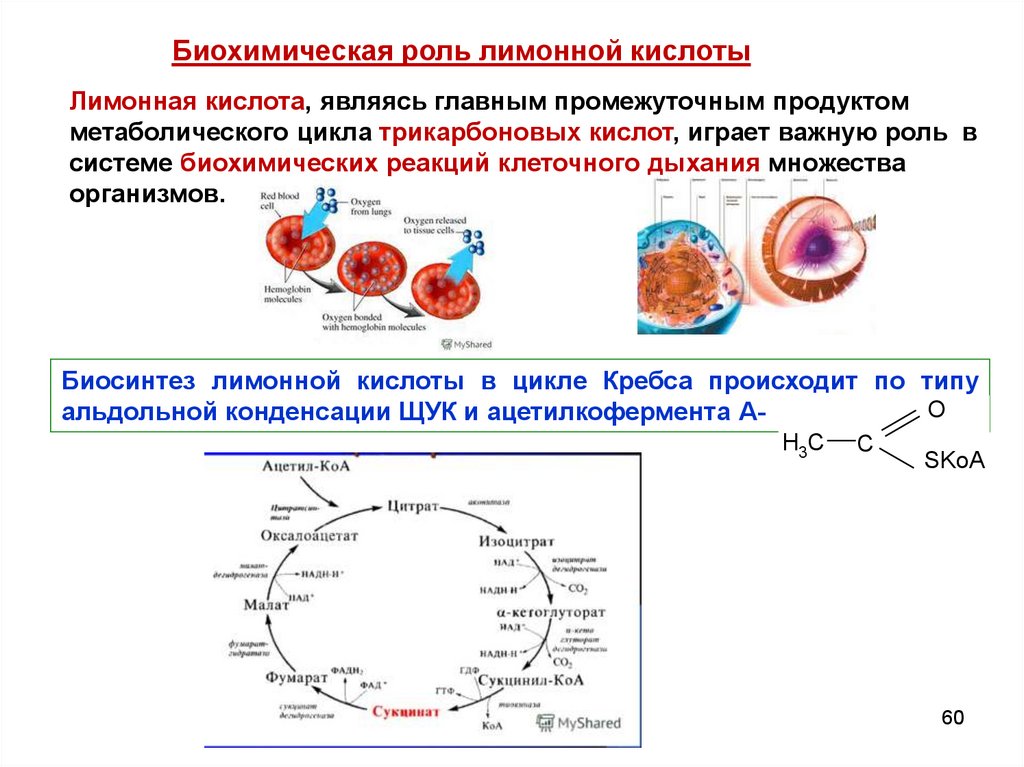
60.
Биохимическая роль лимонной кислотыЛимонная кислота, являясь главным промежуточным продуктом
метаболического цикла трикарбоновых кислот, играет важную роль в
системе биохимических реакций клеточного дыхания множества
организмов.
Биосинтез лимонной кислоты в цикле Кребса происходит по типу
O
альдольной конденсации ЩУК и ацетилкофермента АH3C
C
SKoA
60
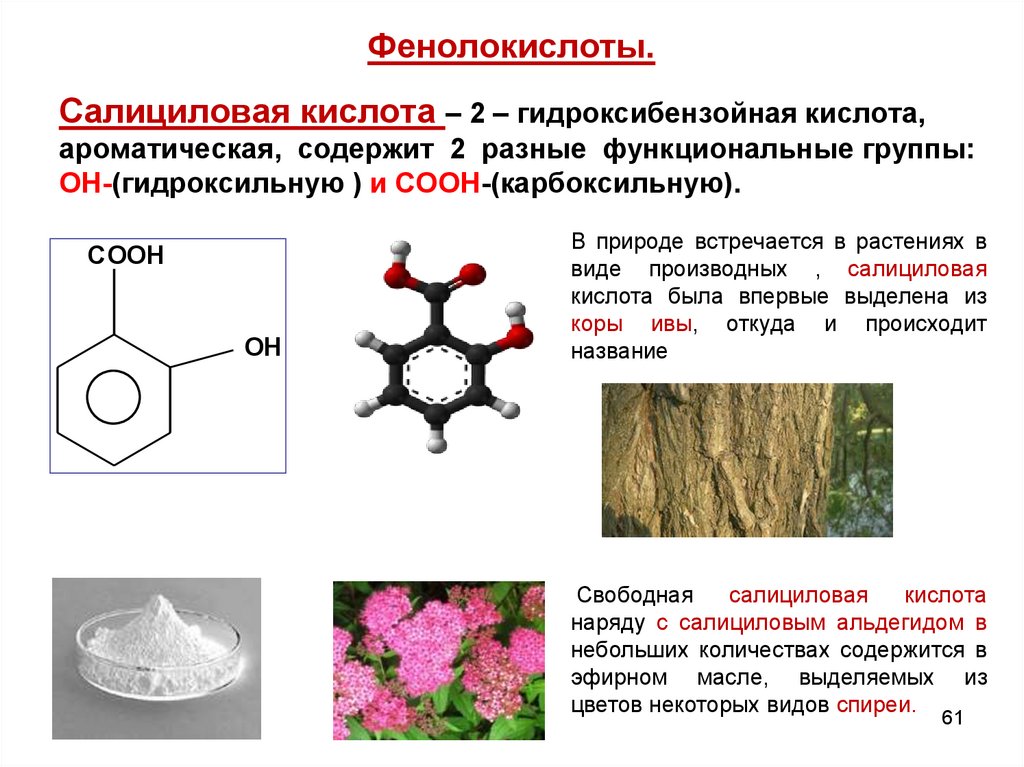
61. Фенолокислоты.
Салициловая кислота – 2 – гидроксибензойная кислота,ароматическая, содержит 2 разные функциональные группы:
ОН-(гидроксильную ) и СООН-(карбоксильную).
COOH
OH
В природе встречается в растениях в
виде производных , салициловая
кислота была впервые выделена из
коры ивы, откуда и происходит
название
Свободная
салициловая
кислота
наряду с салициловым альдегидом в
небольших количествах содержится в
эфирном масле, выделяемых из
цветов некоторых видов спиреи.
61
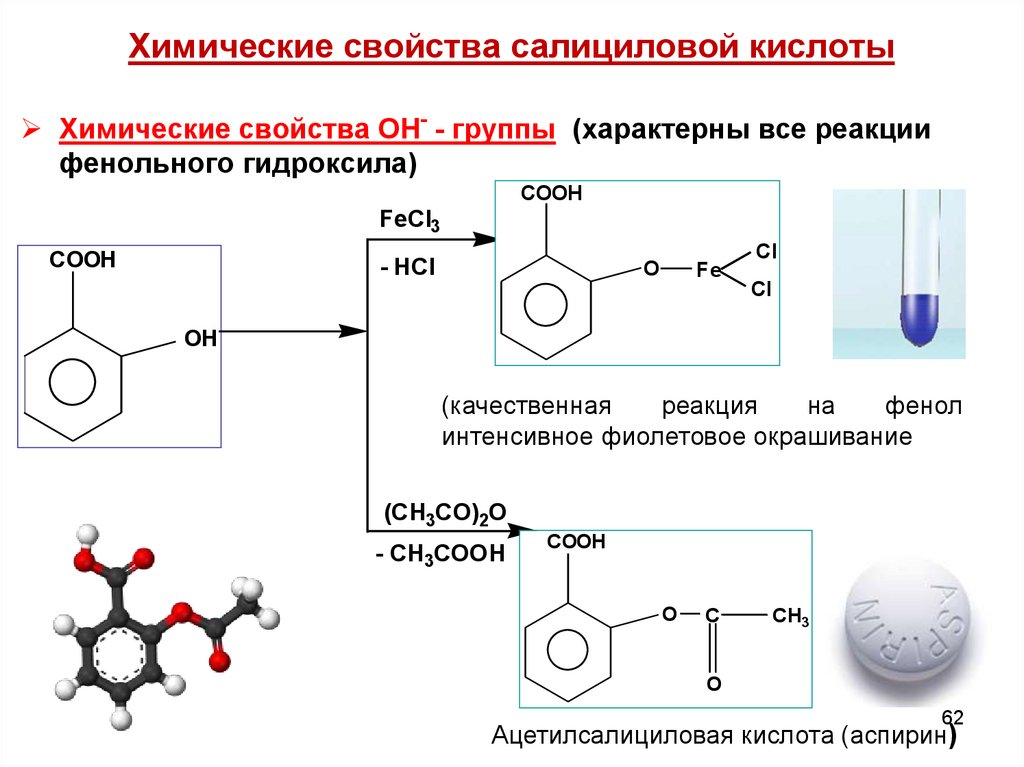
62. Химические свойства салициловой кислоты
Химические свойства ОН- - группы (характерны все реакциифенольного гидроксила)
COOH
FeCl3
COOH
- HCl
O
Fe
Cl
Cl
OH
(качественная
реакция
на
фенол
интенсивное фиолетовое окрашивание
(CH3CO)2O
- CH3COOH
COOH
O
C
CH3
O
62
Ацетилсалициловая кислота (аспирин)
63.
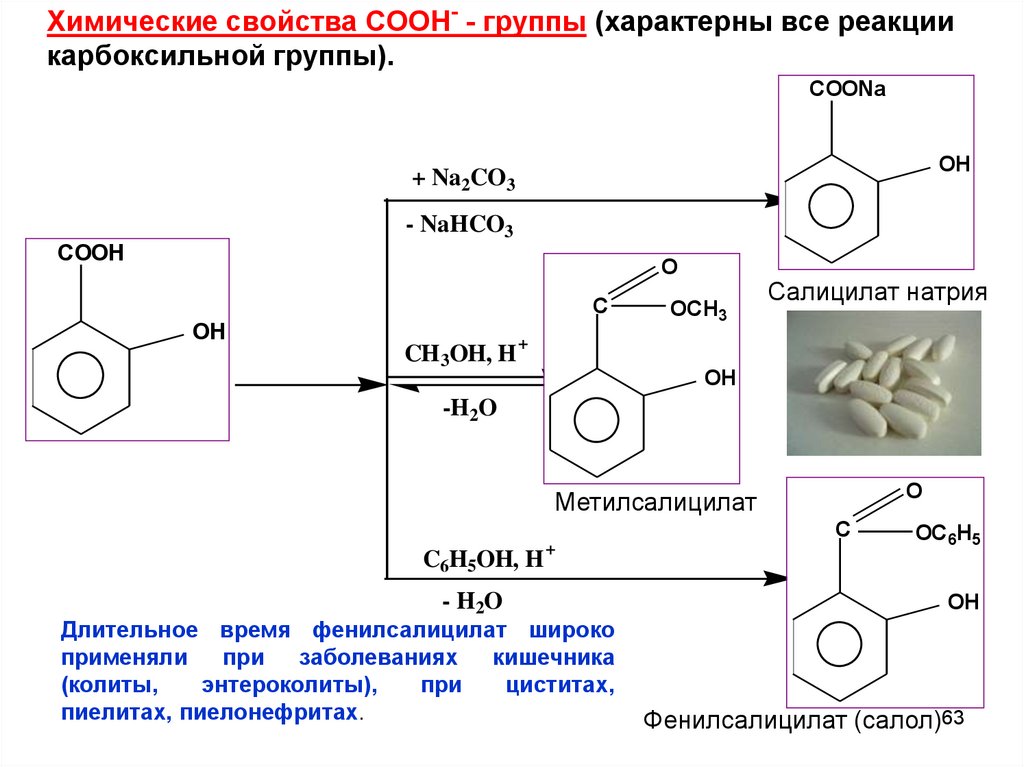
Химические свойства СООН- - группы (характерны все реакциикарбоксильной группы).
COONa
OH
+ Na2CO3
- NaHCO3
COOH
O
C
OH
CH 3OH, H +
OCH3
Салицилат натрия
OH
-H2O
O
Метилсалицилат
C
C6H5OH, H
- H2O
+
Длительное время фенилсалицилат широко
применяли
при
заболеваниях
кишечника
(колиты,
энтероколиты),
при
циститах,
пиелитах, пиелонефритах.
OC6H5
OH
Фенилсалицилат (салол)63
64.
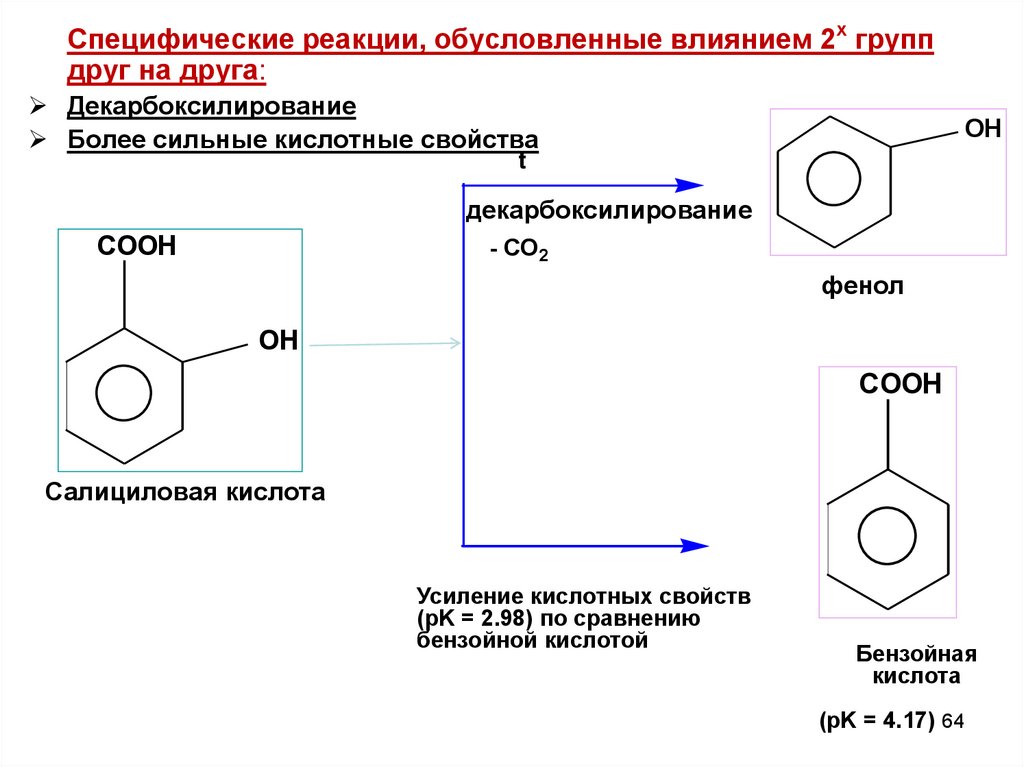
Специфические реакции, обусловленные влиянием 2х группдруг на друга:
Декарбоксилирование
Более сильные кислотные свойства
OH
t
декарбоксилирование
COOH
- CO2
фенол
OH
COOH
Салициловая кислота
Усиление кислотных свойств
(pK = 2.98) по сравнению
бензойной кислотой
Бензойная
кислота
(pK = 4.17) 64
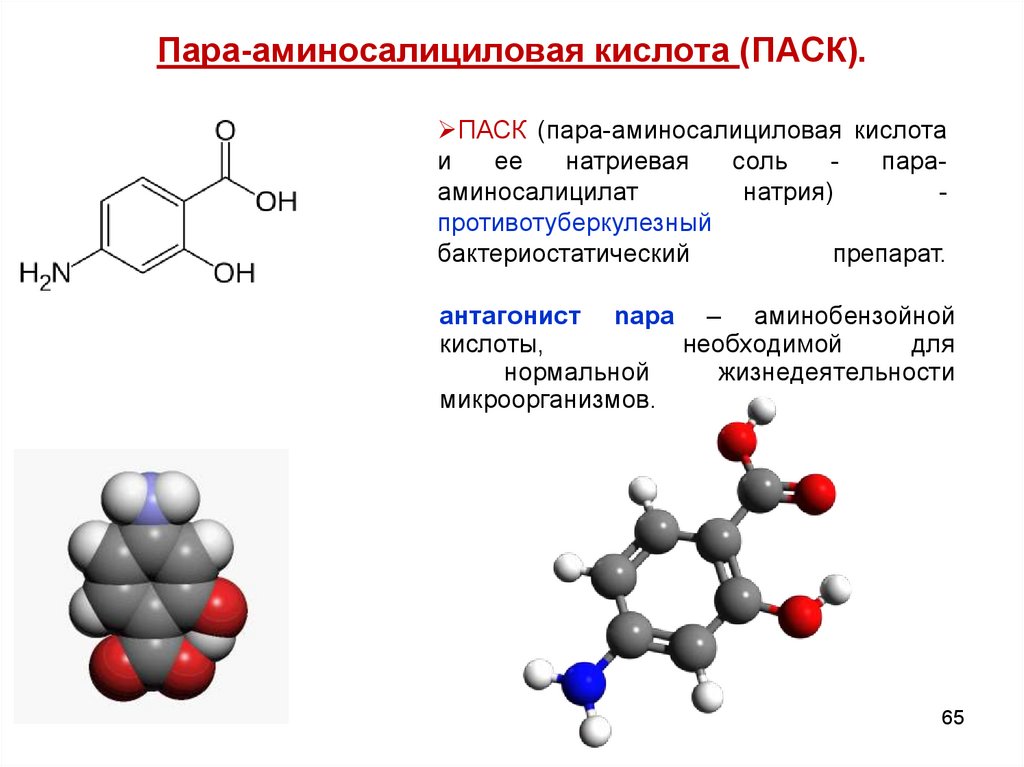
65. Пара-аминосалициловая кислота (ПАСК).
ПАСК (пара-аминосалициловая кислотаи
ее
натриевая
соль
парааминосалицилат
натрия)
противотуберкулезный
бактериостатический
препарат.
антагонист nара – аминобензойной
кислоты,
необходимой
для
нормальной
жизнедеятельности
микроорганизмов.
65
66.
кизилОКСОКИСЛОТЫ
66
67.
Оксокислоты.Оксокислоты – карбоновые кислоты, СОДЕРЖАЩИЕ ОКСО группу:
альдегидо –
C
кетокислоты
O
Альдегидокислоты - органические соединения, совмещающие в
себе свойства альдегидов и кислот из-за присутствия в их
молекуле как альдегидной, так и карбоксильной групп.
Альдегидокислот известно немного.
67
68.
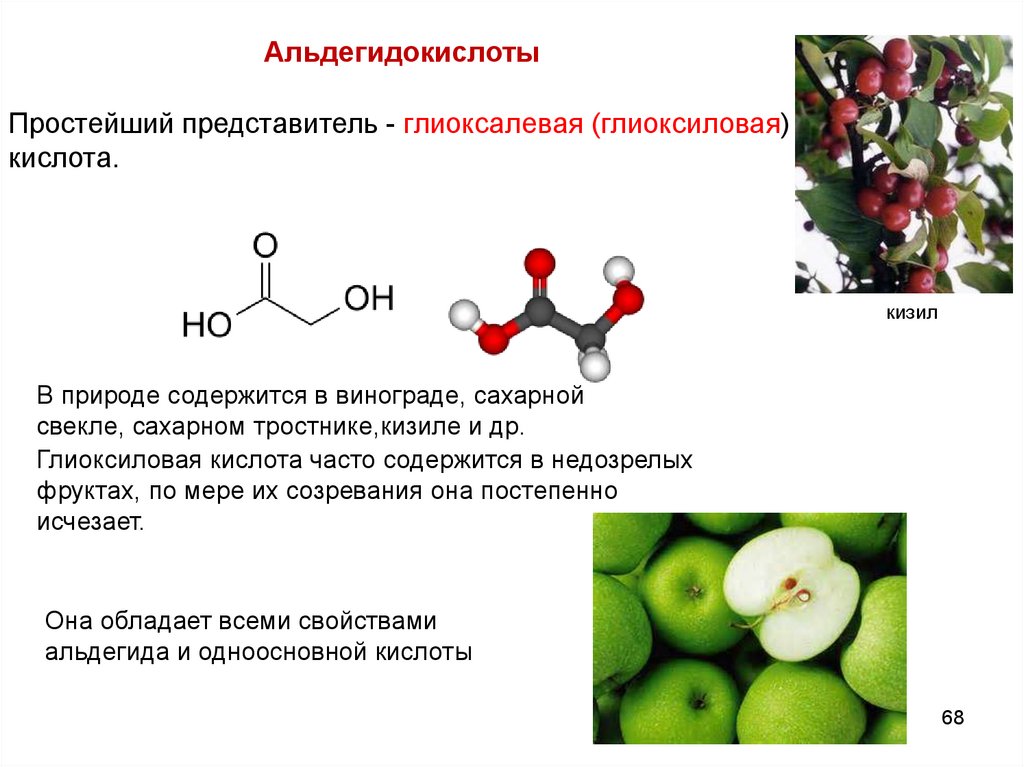
АльдегидокислотыПростейший представитель - глиоксалевая (глиоксиловая)
кислота.
кизил
В природе содержится в винограде, сахарной
свекле, сахарном тростнике,кизиле и др.
Глиоксиловая кислота часто содержится в недозрелых
фруктах, по мере их созревания она постепенно
исчезает.
Она обладает всеми свойствами
альдегида и одноосновной кислоты
68
69.
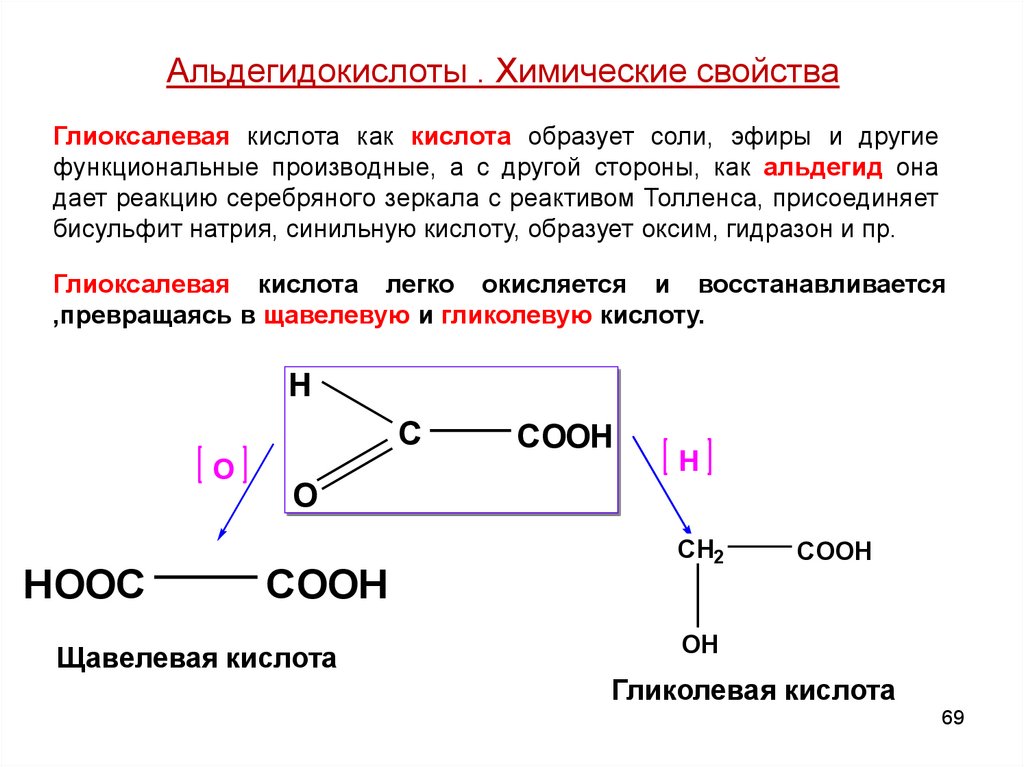
Альдегидокислоты . Химические свойстваГлиоксалевая кислота как кислота образует соли, эфиры и другие
функциональные производные, а с другой стороны, как альдегид она
дает реакцию серебряного зеркала с реактивом Толленса, присоединяет
бисульфит натрия, синильную кислоту, образует оксим, гидразон и пр.
Глиоксалевая кислота легко окисляется и восстанавливается
,превращаясь в щавелевую и гликолевую кислоту.
H
C
O
HOOC
COOH
H
O
COOH
Щавелевая кислота
CH2
COOH
OH
Гликолевая кислота
69
70.
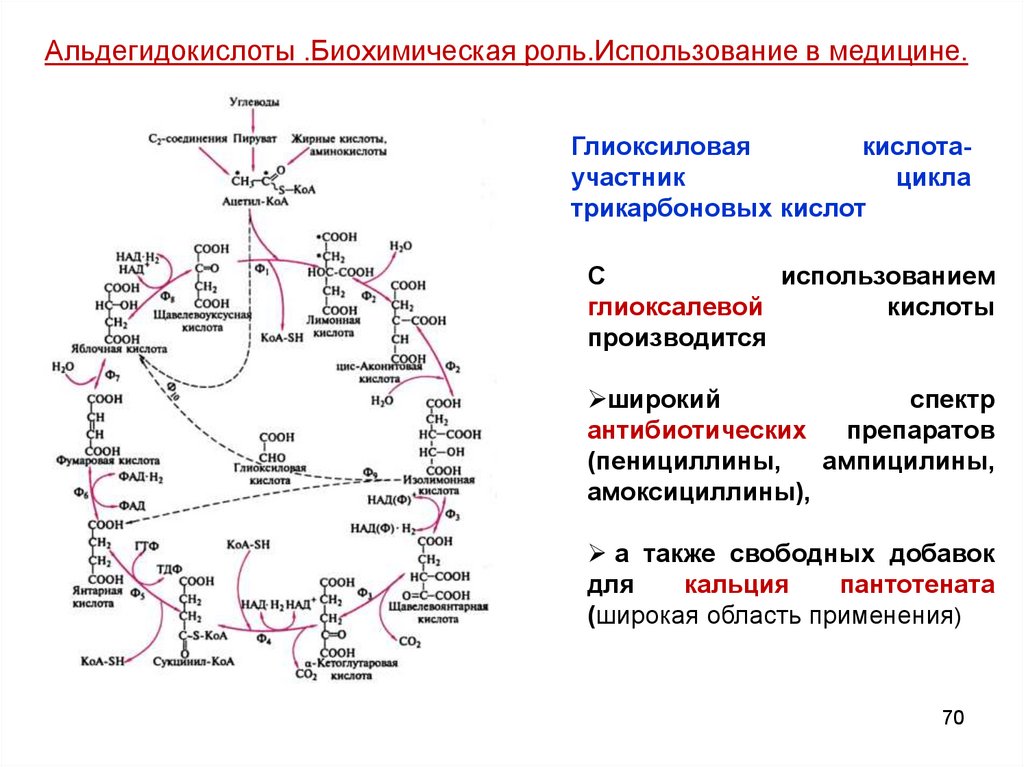
Альдегидокислоты .Биохимическая роль.Использование в медицине.Глиоксиловая
кислотаучастник
цикла
трикарбоновых кислот
С
использованием
глиоксалевой
кислоты
производится
широкий
спектр
антибиотических
препаратов
(пенициллины,
ампицилины,
амоксициллины),
а также свободных добавок
для
кальция
пантотената
(широкая область применения)
70
71.
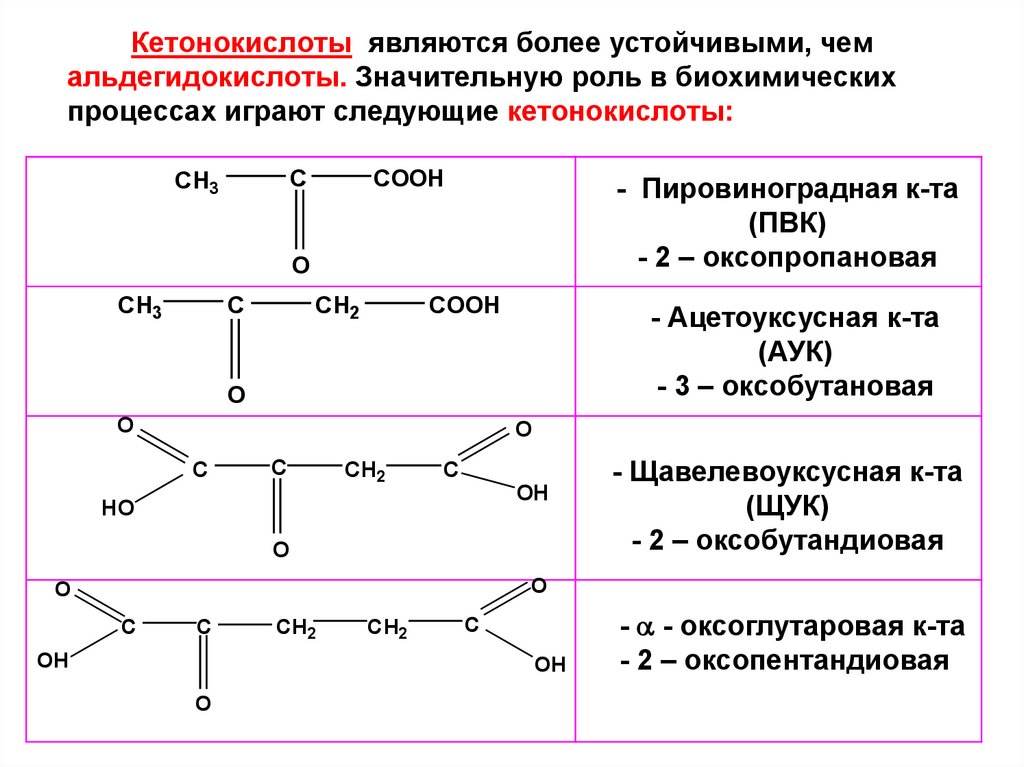
Кетонокислоты являются более устойчивыми, чемальдегидокислоты. Значительную роль в биохимических
процессах играют следующие кетонокислоты:
C
CH3
COOH
- Пировиноградная к-та
(ПВК)
- 2 – оксопропановая
O
CH3
C
CH2
COOH
- Ацетоуксусная к-та
(АУК)
- 3 – оксобутановая
O
O
O
C
C
CH2
C
OH
HO
O
- Щавелевоуксусная к-та
(ЩУК)
- 2 – оксобутандиовая
O
O
C
C
OH
CH2
CH2
C
OH
O
- - оксоглутаровая к-та
- 2 – оксопентандиовая
71
72.
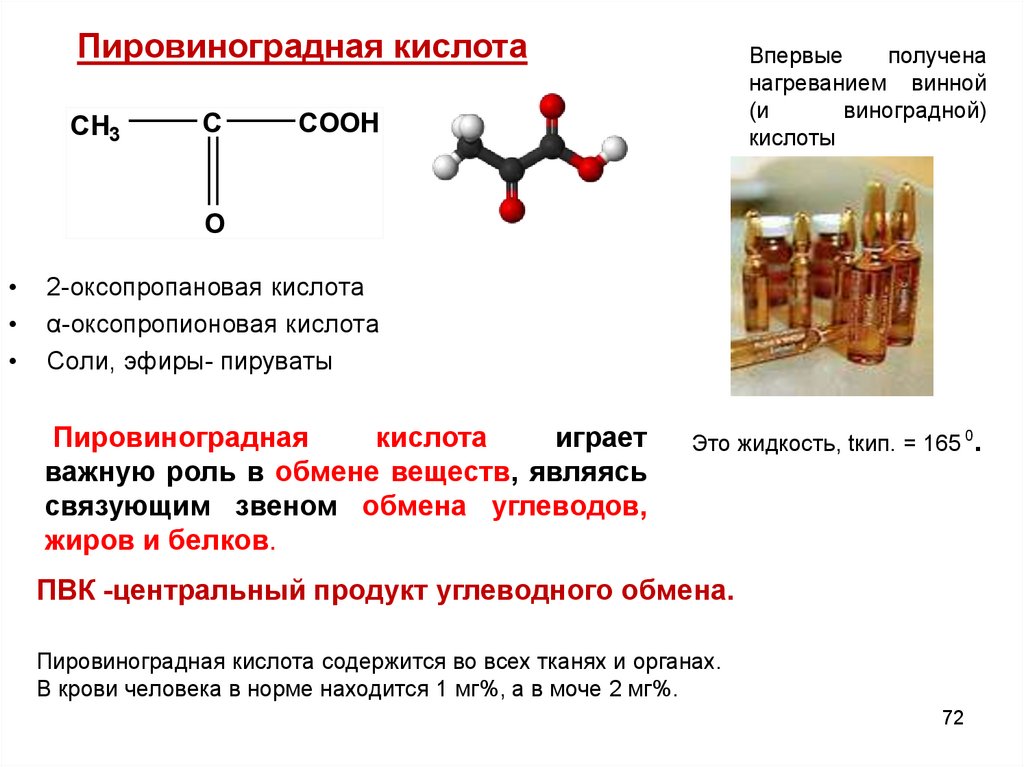
Пировиноградная кислотаПировиноградная
к9 (ПВК)
CH3
C
Впервые
получена
нагреванием винной
(и
виноградной)
кислоты
COOH
O
2-оксопропановая кислота
α-оксопропионовая кислота
Соли, эфиры- пируваты
Пировиноградная
кислота
играет
важную роль в обмене веществ, являясь
связующим звеном обмена углеводов,
жиров и белков.
Это жидкость, tкип. = 165 0.
ПВК -центральный продукт углеводного обмена.
Пировиноградная кислота содержится во всех тканях и органах.
В крови человека в норме находится 1 мг%, а в моче 2 мг%.
72
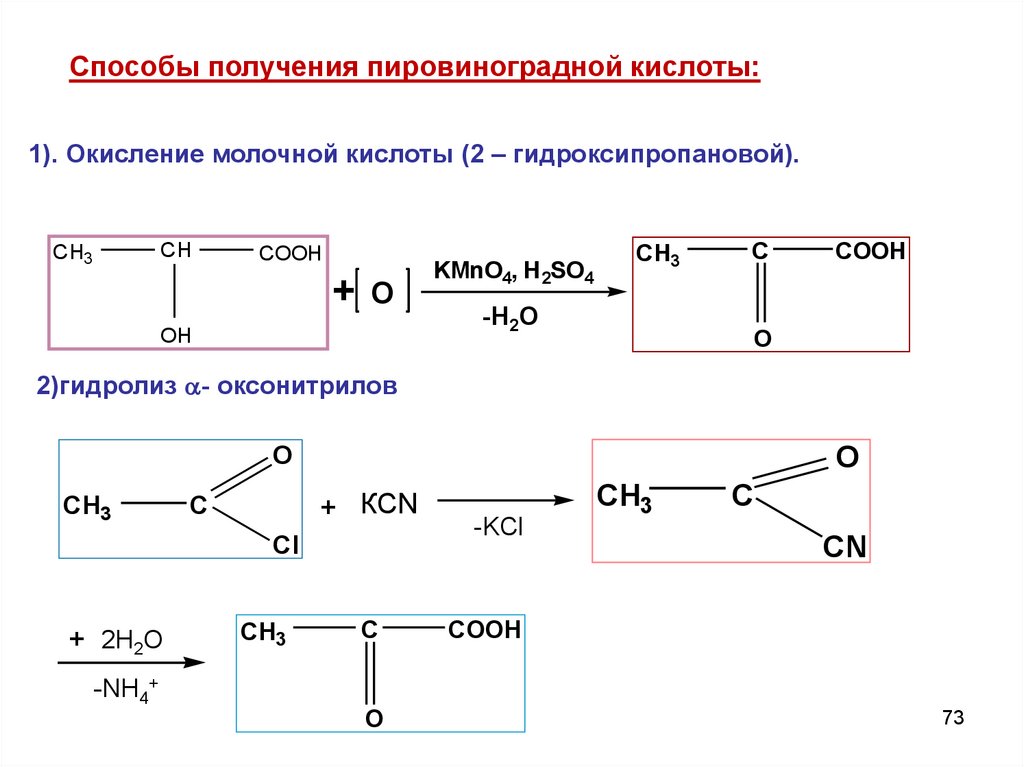
73.
Cпособы получения пировиноградной кислоты:1). Окисление молочной кислоты (2 – гидроксипропановой).
CH
CH3
COOH
+O
OH
KMnO4, H 2SO4
CH3
C
-H2O
COOH
O
2)гидролиз - оксонитрилов
O
CH3
O
+ КCN
C
Cl
+ 2Н2О
-NH4+
CH3
C
O
-KCl
CH3
C
CN
COOH
73
74.
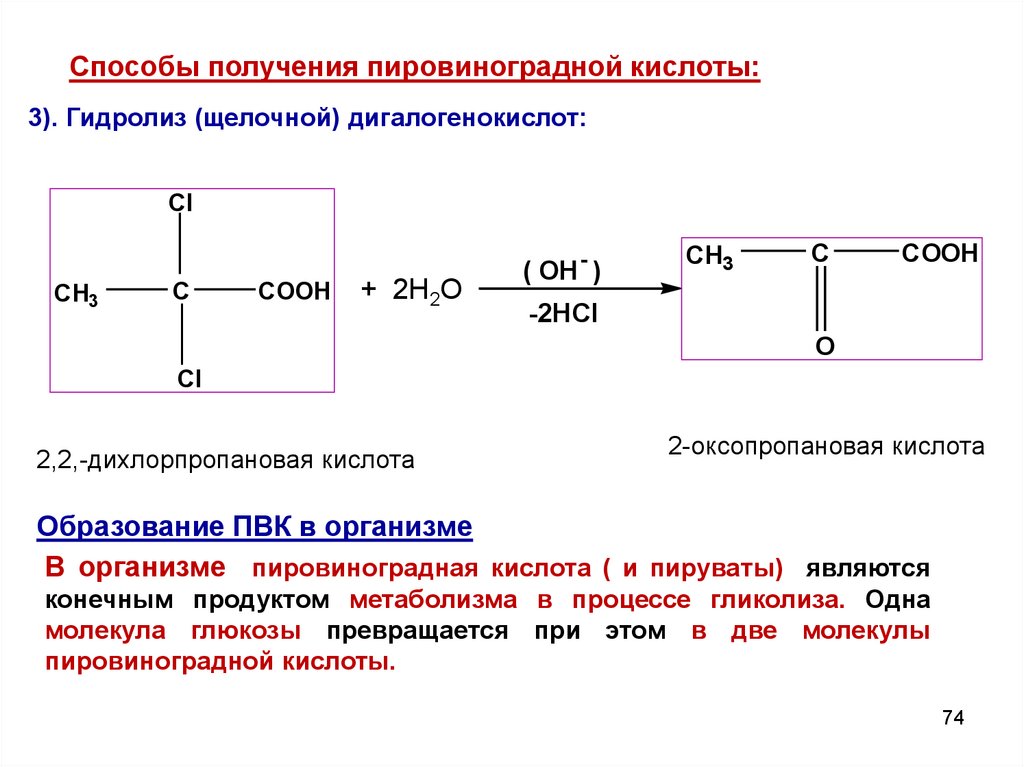
Cпособы получения пировиноградной кислоты:3). Гидролиз (щелочной) дигалогенокислот:
Cl
CH3
C
COOH
+ 2Н2О
( OH - )
CH3
C
COOH
-2HCl
O
Cl
2,2,-дихлорпропановая кислота
2-оксопропановая кислота
Образование ПВК в организме
В организме пировиноградная кислота ( и пируваты) являются
конечным продуктом метаболизма в процессе гликолиза. Одна
молекула глюкозы превращается при этом в две молекулы
пировиноградной кислоты.
74
75.
Химические свойства оксокислот:Химические свойства оксокислот определяются
наличием 2-х различных функциональных групп.
>С=О
Для карбонильной группы характерны реакции АN,
восстановления.
-СООН
Для карбоксильной группы характерны реакции SN,
образования солей.
Специфические реакции – обусловлены взаимным влиянием 2х групп:
Реакции декарбоксилирования протекают легче,чем в карбоновых кислотах
Более сильные кислотные свойства, чем у карбоновых кислот.
75
76.
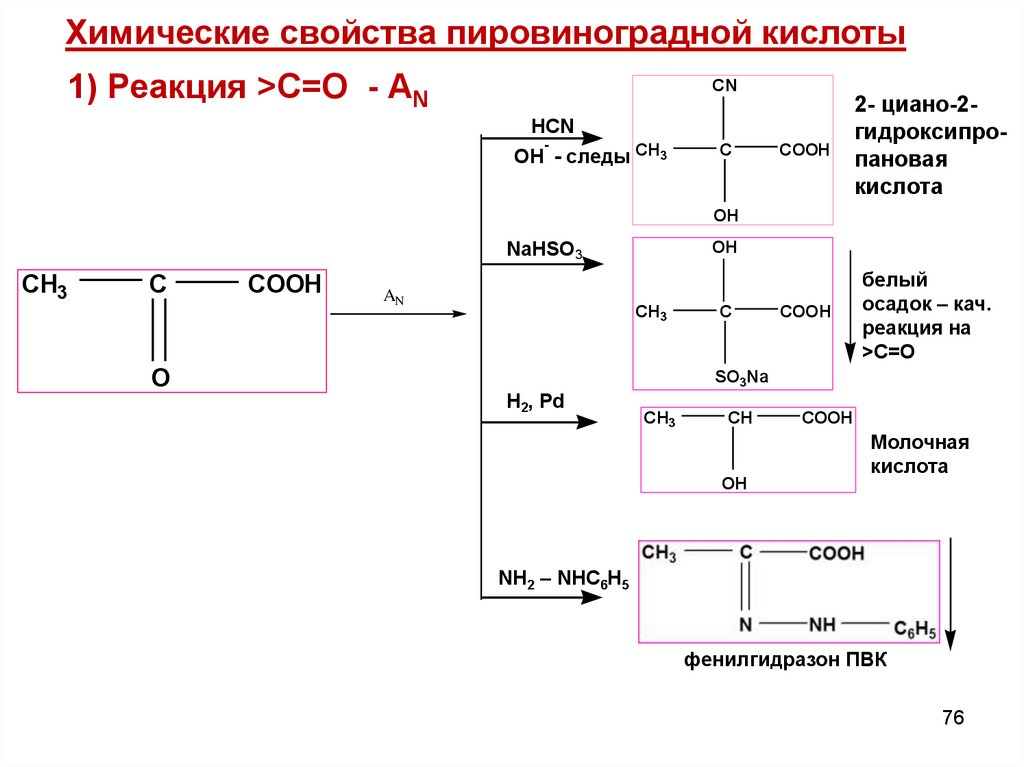
Химические свойства пировиноградной кислоты1) Реакция >С=О - AN
CN
COOH
2- циано-2гидроксипропановая
кислота
COOH
белый
осадок – кач.
реакция на
>C=O
HCN
-
OH - следы CH3
C
OH
OH
NaHSO3
CH3
C
COOH
AN
CH3
O
C
SO3Na
H2, Pd
CH3
CH
OH
COOH
Молочная
кислота
NH2 – NHC6H5
фенилгидразон ПВК
76
77.
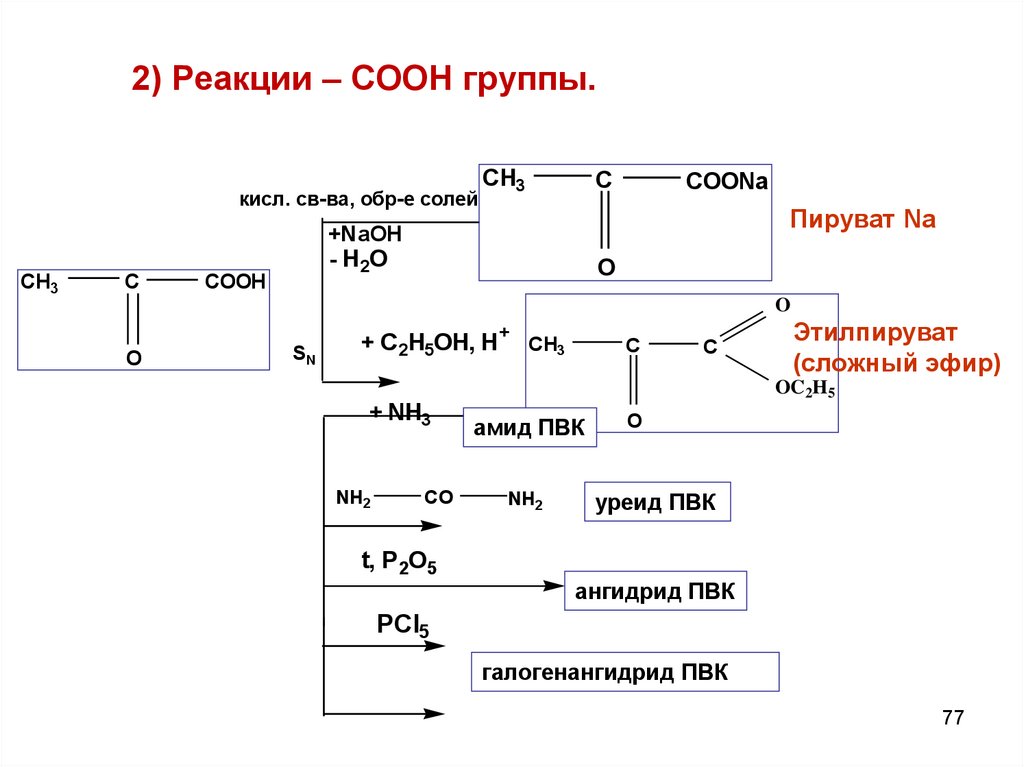
2) Реакции – СООН группы.кисл. св-ва, обр-е солей
CH3
C
COONa
Пируват Na
+NaOH
CH3
C
- H2O
COOH
O
O
O
SN
+ C2H5OH, H+ CH3
+ NH3
NH2
CO
C
C
Этилпируват
(сложный эфир)
OC2H5
амид ПВК
NH2
O
уреид ПВК
t, P 2O5
ангидрид ПВК
PCl5
галогенангидрид ПВК
77
78.
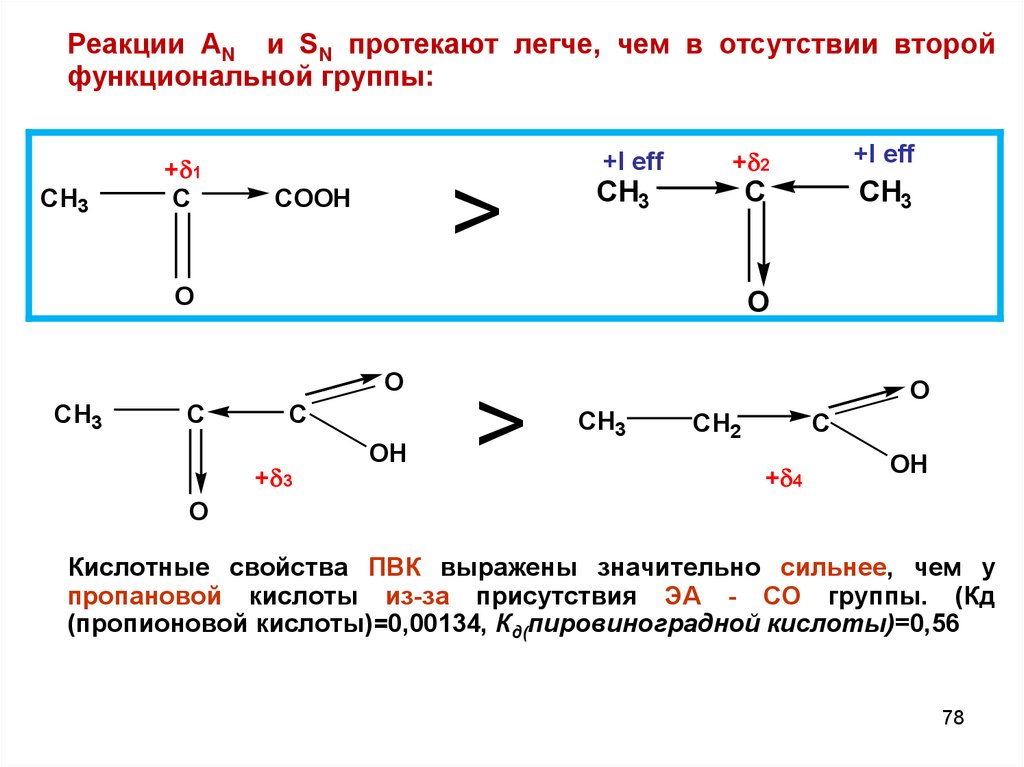
Реакции AN и SN протекают легче, чем в отсутствии второйфункциональной группы:
CH3
+ 1
C
+I eff
>
COOH
CH3
C
O
C
CH3
O
O
CH3
+I eff
+ 2
C
OH
+ 3
>
O
CH3
CH2
C
+ 4
OH
O
Кислотные свойства ПВК выражены значительно сильнее, чем у
пропановой кислоты из-за присутствия ЭА - СО группы. (Кд
(пропионовой кислоты)=0,00134, Кд(пировиноградной кислоты)=0,56
78
79.
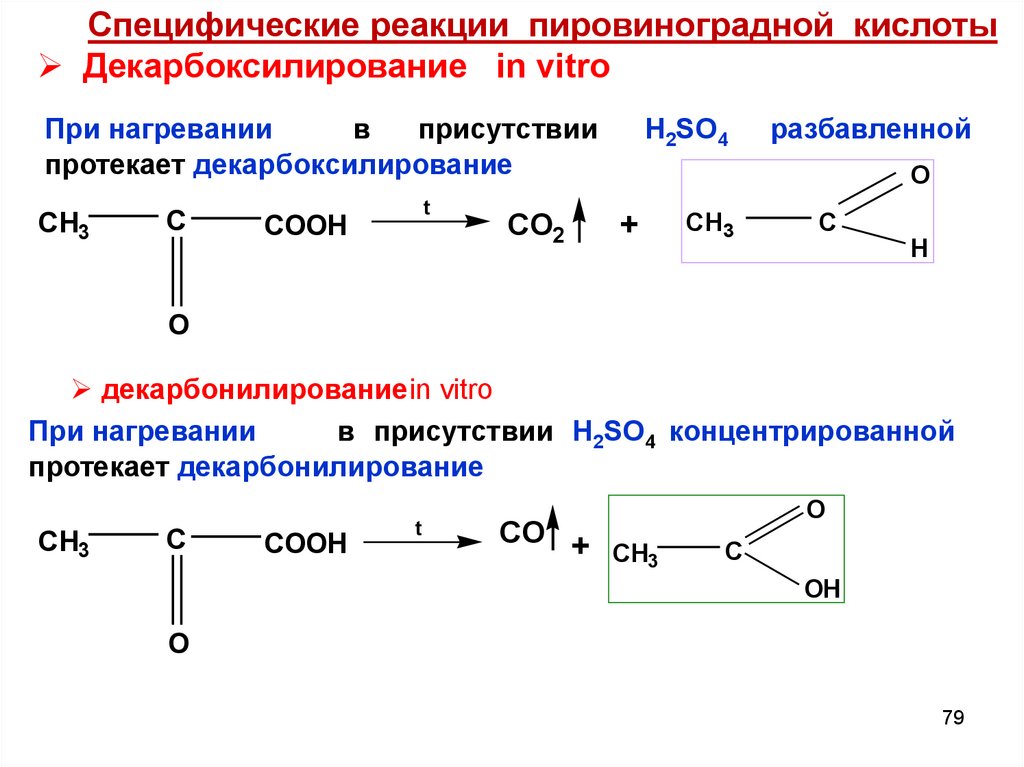
Специфические реакции пировиноградной кислотыДекарбоксилирование in vitro
При нагревании
в
присутствии
протекает декарбоксилирование
CH3
C
t
COOH
CO2
H2SO4
разбавленной
O
+
CH3
C
H
O
декарбонилированиеin vitro
При нагревании
в присутствии H2SO4 концентрированной
протекает декарбонилирование
CH3
C
COOH
t
CO +
CH3
O
C
OH
O
79
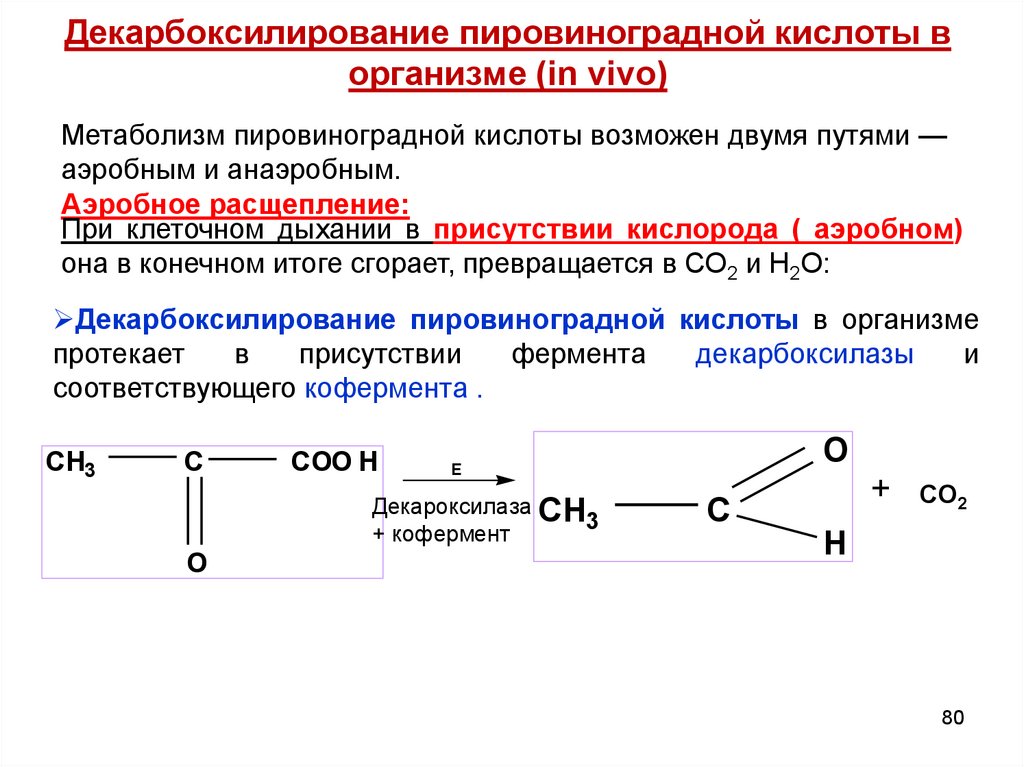
80. Декарбоксилирование пировиноградной кислоты в организме (in vivo)
Метаболизм пировиноградной кислоты возможен двумя путями —аэробным и анаэробным.
Аэробное расщепление:
При клеточном дыхании в присутствии кислорода ( аэробном)
она в конечном итоге сгорает, превращается в СО2 и Н2О:
Декарбоксилирование пировиноградной кислоты в организме
протекает
в
присутствии
фермента
декарбоксилазы
и
соответствующего кофермента .
CH3
C
COO H
Декароксилаза CH
3
+ кофермент
O
O
E
C
+
CO2
H
80
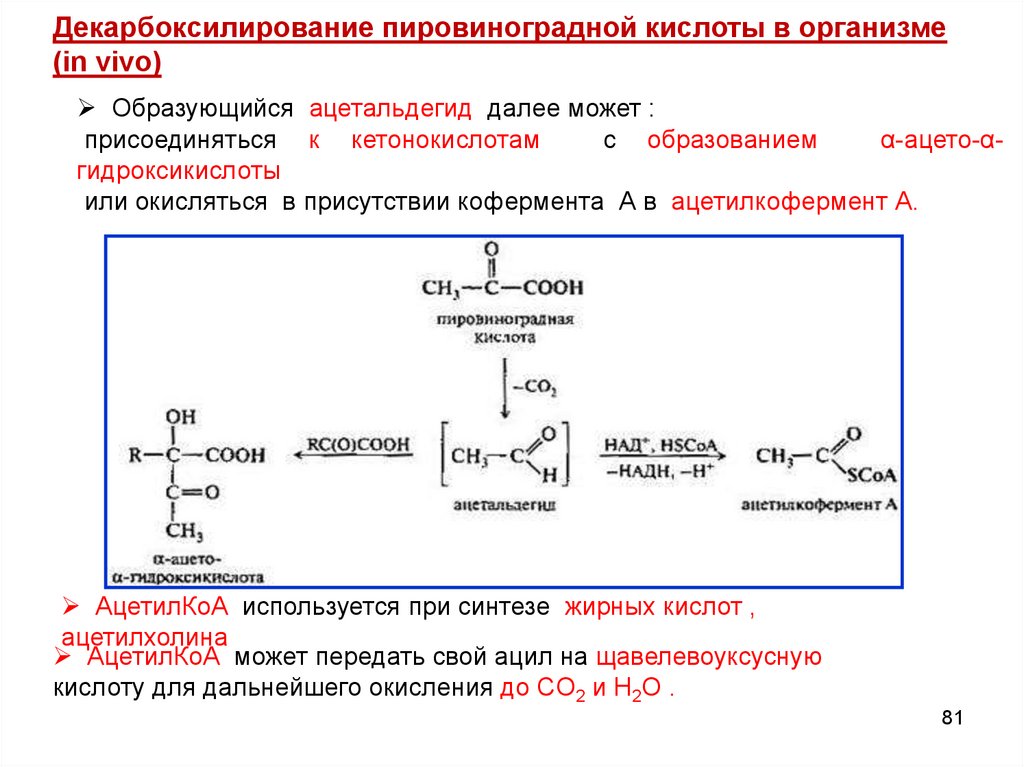
81.
Декарбоксилирование пировиноградной кислоты в организме(in vivo)
Образующийся ацетальдегид далее может :
присоединяться к кетонокислотам
с образованием
α-ацето-αгидроксикислоты
или окисляться в присутствии кофермента А в ацетилкофермент А.
АцетилКоА используется при синтезе жирных кислот ,
ацетилхолина
АцетилКоА может передать свой ацил на щавелевоуксусную
кислоту для дальнейшего окисления до CO2 и H2O .
81
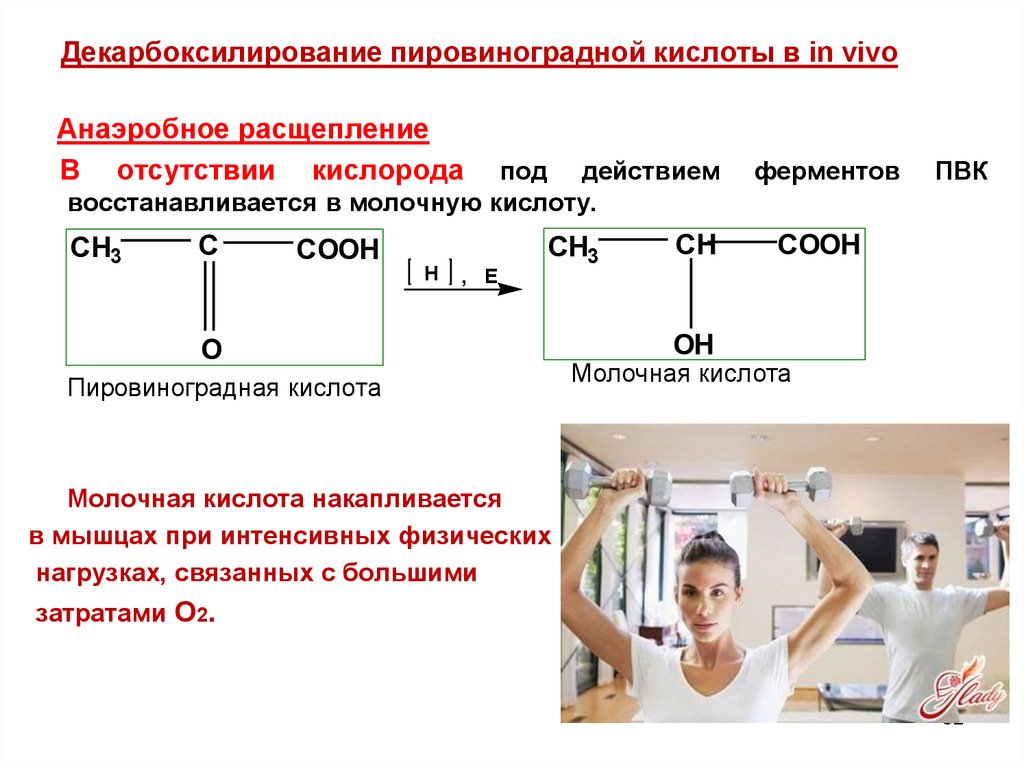
82.
Декарбоксилирование пировиноградной кислоты в in vivoАнаэробное расщепление
В отсутствии кислорода
под действием
восстанавливается в молочную кислоту.
CH3
C
COOH
H
, E
CH3
O
Пировиноградная кислота
CH
ферментов
ПВК
COOH
OH
Молочная кислота
Молочная кислота накапливается
в мышцах при интенсивных физических
нагрузках, связанных с большими
затратами О2.
82
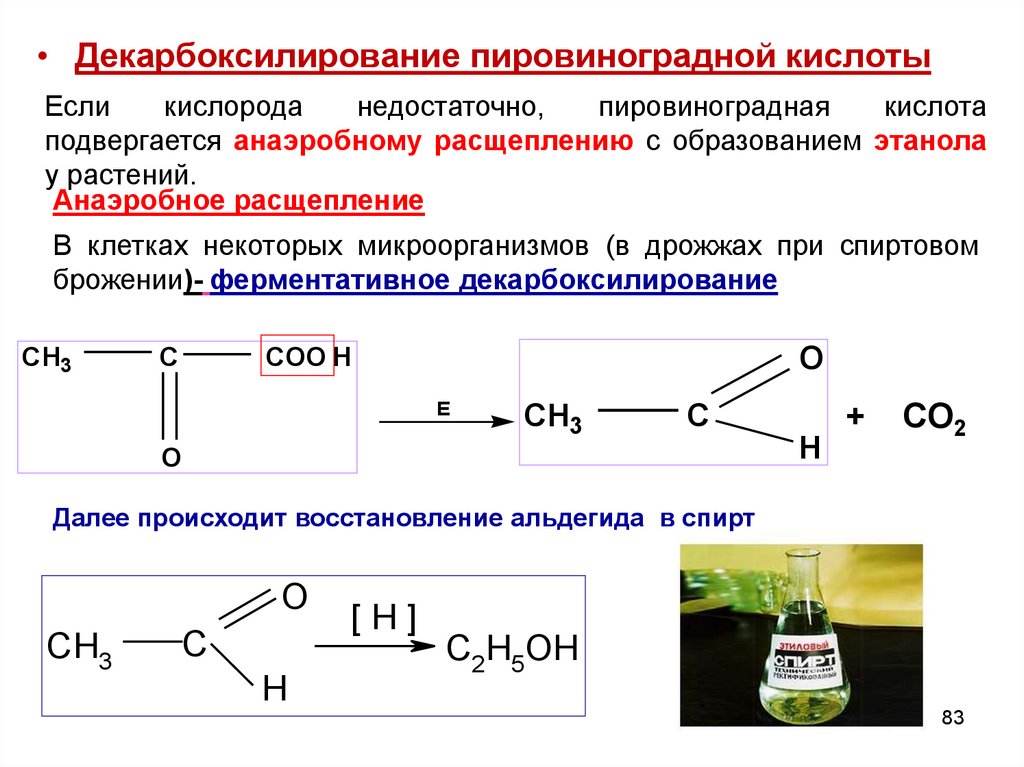
83.
• Декарбоксилирование пировиноградной кислотыЕсли
кислорода
недостаточно,
пировиноградная
кислота
подвергается анаэробному расщеплению с образованием этанола
у растений.
Анаэробное расщепление
В клетках некоторых микроорганизмов (в дрожжах при спиртовом
брожении)- ферментативное декарбоксилирование
CH3
C
O
COO H
E
CH3
C
O
H
+
CO2
Далее происходит восстановление альдегида в спирт
O
CH3
C
H
[H]
C2H5OH
83
84.
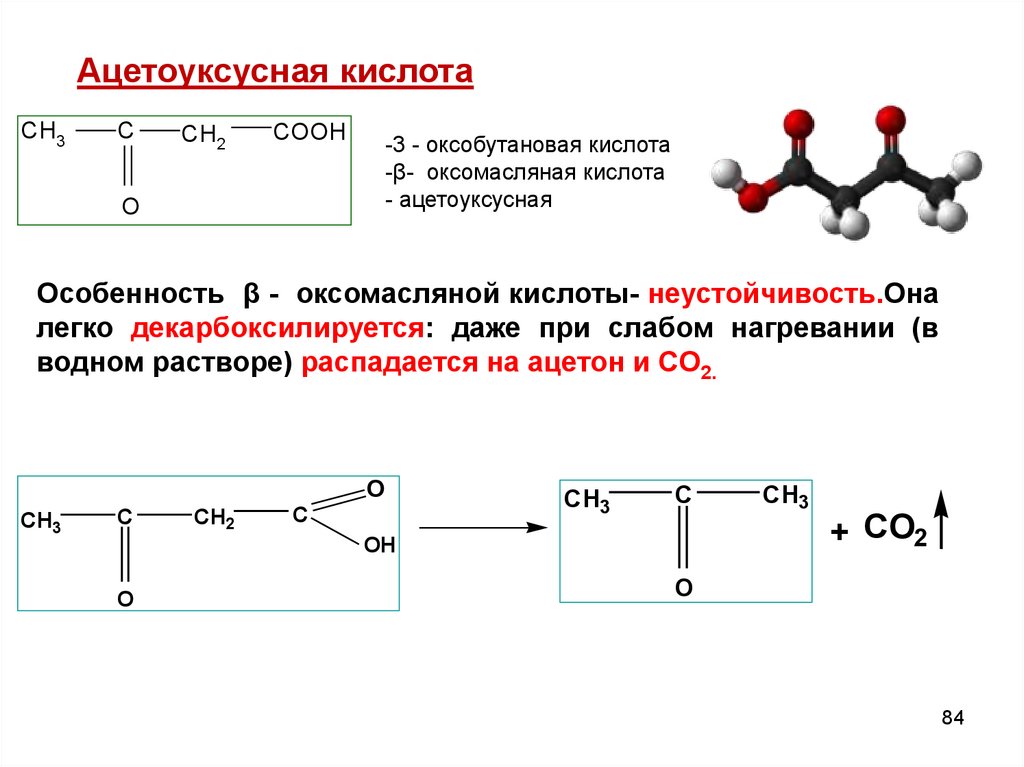
Ацетоуксусная кислотаCH3
C
CH2
COOH
-3 - оксобутановая кислота
-β- оксомасляная кислота
- ацетоуксусная
O
Особенность β - оксомасляной кислоты- неустойчивость.Она
легко декарбоксилируется: даже при слабом нагревании (в
водном растворе) распадается на ацетон и СО2.
O
CH3
C
CH2
C
CH3
C
OH
O
CH3
+ CO2
O
84
85.
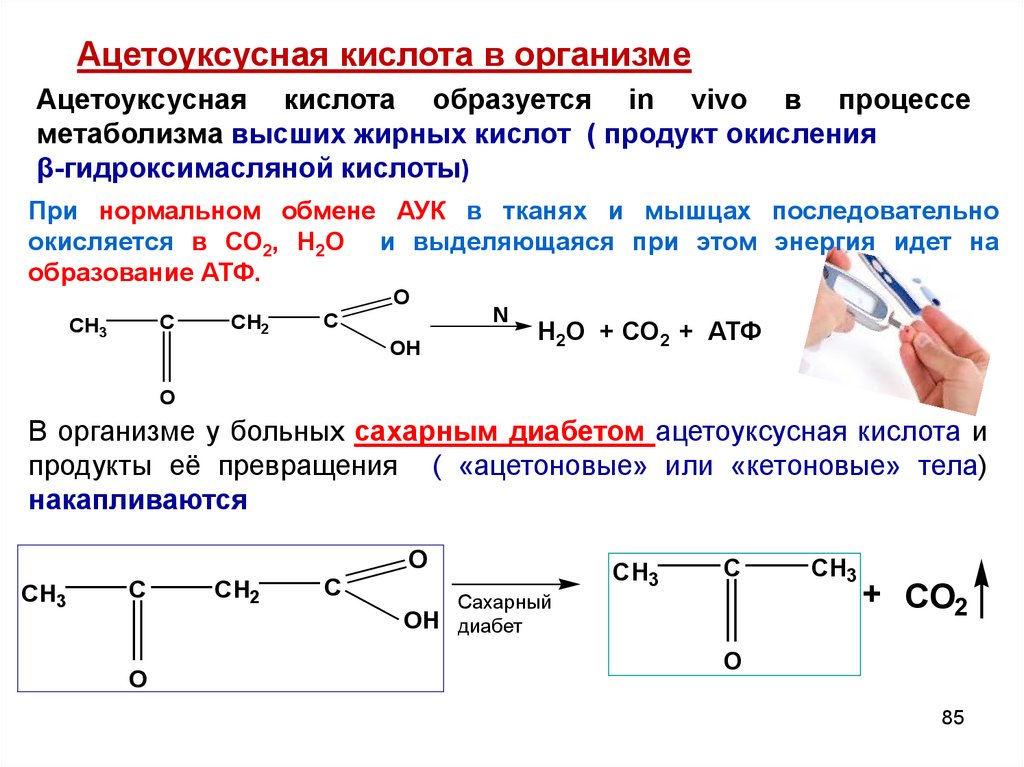
Ацетоуксусная кислота в организмеАцетоуксусная кислота образуется in vivo в процессе
метаболизма высших жирных кислот ( продукт окисления
β-гидроксимасляной кислоты)
При нормальном обмене АУК в тканях и мышцах последовательно
окисляется в СО2, Н2О и выделяющаяся при этом энергия идет на
образование АТФ.
O
C
CH3
CH2
C
OH
N
Н2О + СО2 + АТФ
O
В организме у больных сахарным диабетом ацетоуксусная кислота и
продукты её превращения ( «ацетоновые» или «кетоновые» тела)
накапливаются
O
CH3
C
O
CH2
C
CH3
C
Сахарный
OH диабет
CH3
+ CO2
O
85
86.
Ацетоновые тела: ацетон, ацетоуксусную кислоту, солиацетоуксусной кислоты, которые могут содержаться в
моче при сахарном диабете, в клиническом анализе
определяют галоформной реакцией.
86
87.
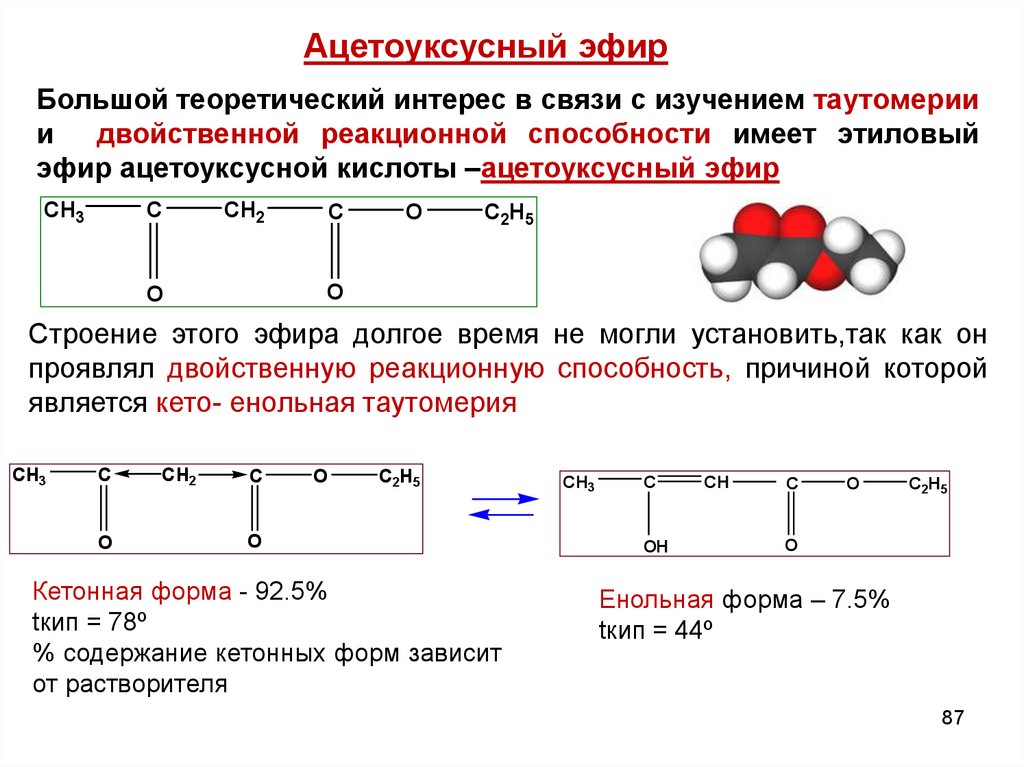
Ацетоуксусный эфирБольшой теоретический интерес в связи с изучением таутомерии
и двойственной реакционной способности имеет этиловый
эфир ацетоуксусной кислоты –ацетоуксусный эфир
CH3
C
CH2
C
O
C2H5
O
O
Строение этого эфира долгое время не могли установить,так как он
проявлял двойственную реакционную способность, причиной которой
является кето- енольная таутомерия
CH3
C
O
CH2
C
O
C2H5
O
Кетонная форма - 92.5%
tкип = 78º
% содержание кетонных форм зависит
от растворителя
CH3
C
OH
CH
C
O
C2H5
O
Енольная форма – 7.5%
tкип = 44º
87
88.
Ацетоуксусный эфирЕнольная форма стабилизируется за счет сопряжения двойной
углерод-углеродной связи с карбонильной группой и образования
внутримолекулярной водородной связи
Как
кетон ацетоуксусный эфир восстанавливается Н2 до
этилгидроксибутирата;
присоединяет
HCN,
NaHSO3
с
образованием
соответственно
циангидрина
и
гидросульфитного производного.
88
89.
Ацетоуксусный эфирКак енол ацетоуксусный эфир
мгновенно обесцвечивает раствор Вг2 (реакция служит
для количественного определения енола)
с FeCl3, образует комплекс – интенсивного
фиолетового окрашивания.
CH3
C
OH
CH
C
O
C2H5
+ FeCl3
- HCl
O
CH3
C
Fe
O
Cl
CH
C
O
C2H5
O
Cl
Эта
реакция
соединений и
кетонов.
характерна
для
енольных
совершенно отсутствует у
89
90.
Таутомерия ацетоуксусного эфираРеакции с бромом в присутствии FeCl3 используются для
изучения скорости установления таутомерного равновесия.
При добавлении избытка FeCl3 появляется фиолетовая окраска
(реакция енола).
При приливании Br2 фиолетовый цвет исчезает, так как комплекс
разрушается, бром присоединяется по двойной связи, но появляется желтая
окраска вследствие отщепления FeCl3
Через некоторое время окраска вновь постепенно появляется в результате
превращения новых порций кетонной формы в енольную.
90
91.
Кето-енольная таутомерияОсновные научные работы Людвига
Кнорра посвящены изучению кетоенольной таутомерии и синтезам на
основе ацетоуксусного эфира. Выделил
(1911) обе формы этого соединения.
Незадолго до смерти синтезировал
Анальгин (метамизол натрия). Изучал (с
1889) строение алкалоидов — кодеина,
морфина, тебаина.
Кнорр, Людвиг (2 декабря 1859 — 4 июня 1921 года) — немецкий химикорганик.
Учился (с 1878 г.) в Мюнхенском, Гейдельбергском, Эрлангенском,
Вюрцбургском университетах. Работал в Эрлангенском (1885 г.),
затем в Вюрцбургском университетах, с 1889 г. — профессор
Йенского университета. Президент Немецкого химического
общества (1915—1916 г.).
91
92.
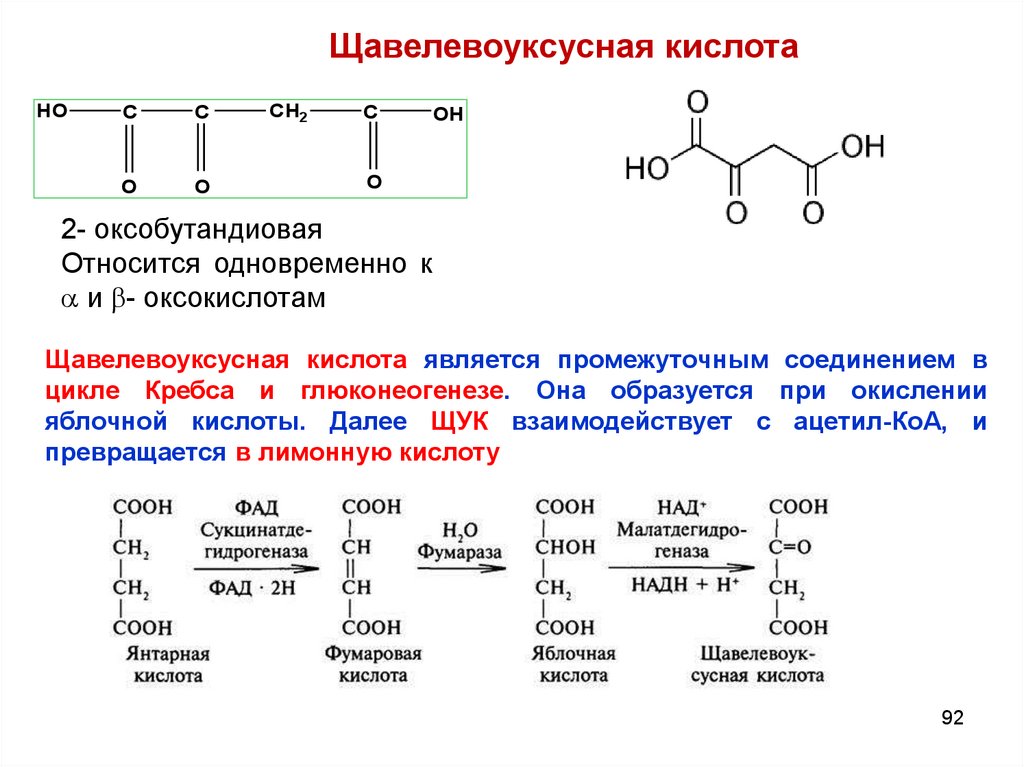
Щавелевоуксусная кислотаHO
C
C
O
O
CH2
C
OH
O
2- оксобутандиовая
Относится одновременно к
и - оксокислотам
Щавелевоуксусная кислота является промежуточным соединением в
цикле Кребса и глюконеогенезе. Она образуется при окислении
яблочной кислоты. Далее ЩУК взаимодействует с ацетил-КоА, и
превращается в лимонную кислоту
92
93.
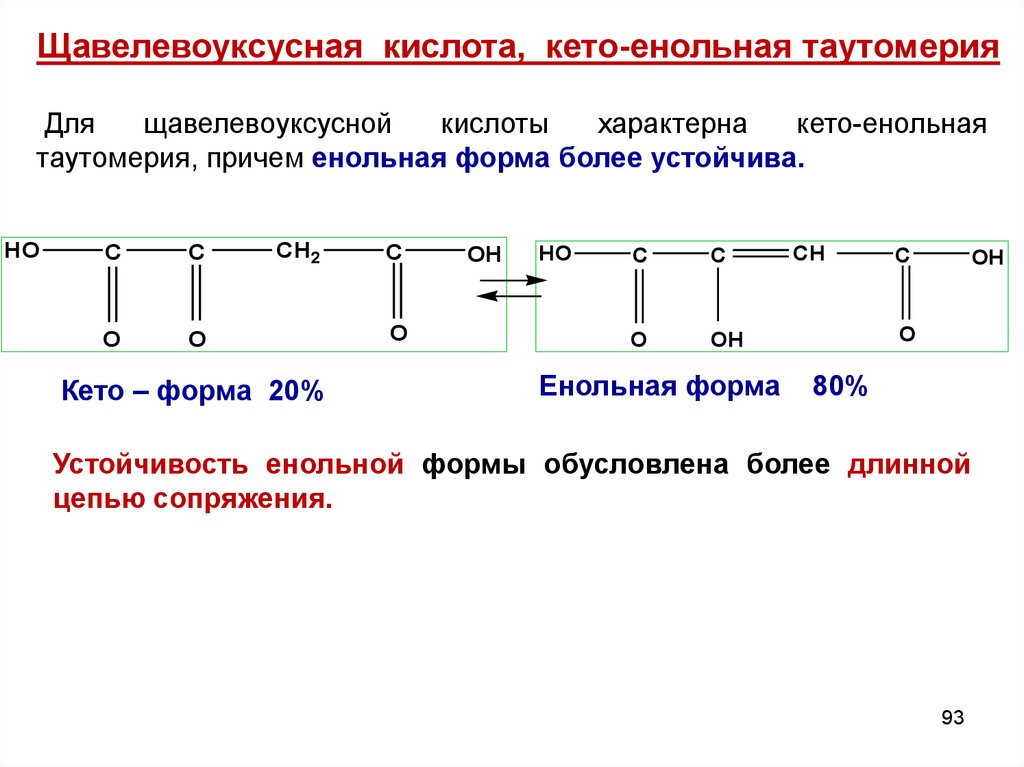
Щавелевоуксусная кислота, кето-енольная таутомерияДля
щавелевоуксусной
кислоты
характерна
кето-енольная
таутомерия, причем енольная форма более устойчива.
HO
C
C
O
O
CH2
Кето – форма 20%
C
O
OH
HO
C
C
O
OH
Енольная форма
CH
C
OH
O
80%
Устойчивость енольной формы обусловлена более длинной
цепью сопряжения.
93
94.
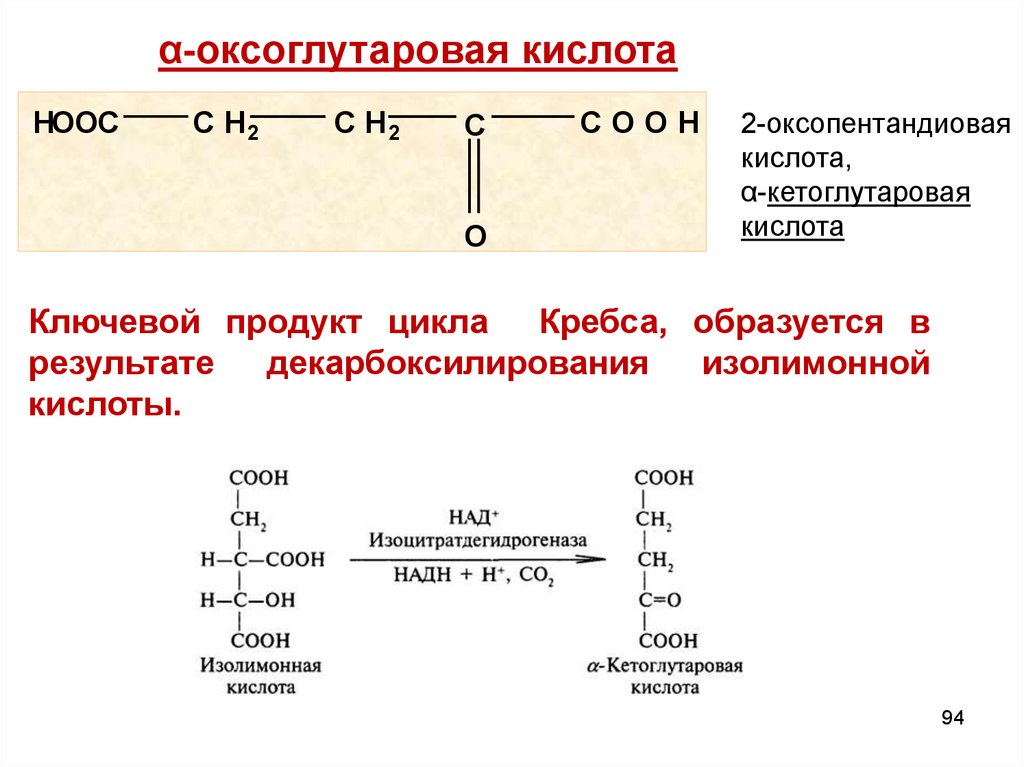
α-оксоглутаровая кислотаHOOC
C H2
C H2
C
O
COOH
2-оксопентандиовая
кислота,
α-кетоглутаровая
кислота
Ключевой продукт цикла Кребса, образуется в
результате
декарбоксилирования
изолимонной
кислоты.
94
95.
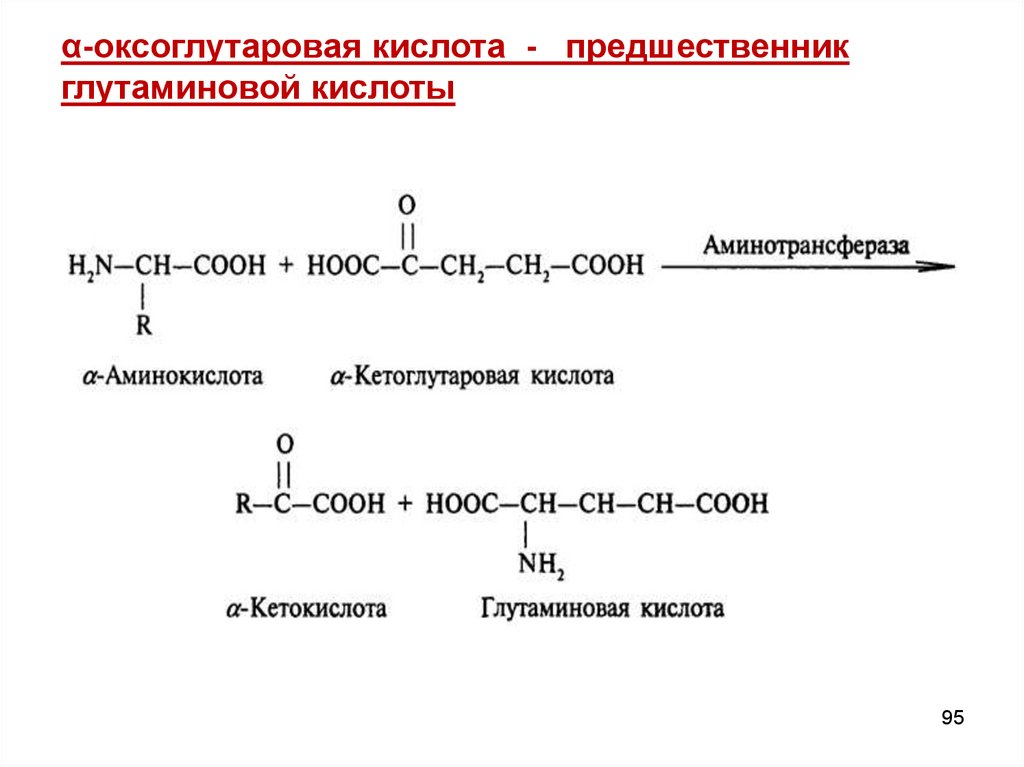
α-оксоглутаровая кислота - предшественникглутаминовой кислоты
95
























 Химия
Химия








