Похожие презентации:
Гидроксикислоты и оксокислоты. Аминокислоты
1.
Гидроксикислоты иоксокислоты.
Аминокислоты
Еремин Алексей Владимирович
к.х.н., доцент, с.н.с.
2.
.Гидроксикислоты ‒
гетерофункциональные соединения, содержащие в молекуле
одновременно карбоксильную и гидроксильную группы
O
гликолевая кислота
C
H
C
2
(гидроксиэтановая,
O
H
гидроксиуксусная)
O
H
O
молочная кислота
C
H
C
H
C
3
(2-гидроксипропановая,
O
H
(α-гидроксипропионовая)
O
H
O
-оксимасляная кислота
C
C
H
C
H
C
H
2
2
2
(ГОМК, 4-гидроксибутановая)
O
H
O
H
2
салициловая кислота
(2-гидроксибензойная
кислота)
Для ароматических кислот
за родоначальную
структуру принята
бензойная кислота.
3.
Стереохимия(от греч. stereos‒пространственный) ‒ раздел химии, изучающий
пространственное строение молекул, его влияние на физические и
химические свойства.
Стереоизомеры – изомеры, имеющие одинаковое строение, но
отличающиеся расположением атомов в пространстве.
Энантиомеры – стереоизомеры, относящиеся друг к другу как
предмет и несовместимое с ним зеркальное изображение.
Хиральность (от греч. сheir – рука) – свойство объекта быть
несовместимым со своим зеркальным изображением любой
комбинацией вращений и перемещений в трехмерном пространстве.
3
4.
Асимметрическим (хиральным)атом углерода C, у которого:
‒ sp3 гибридное состояние;
‒ все четыре заместителя разные.
Энантиомеры (оптические изомеры) имеют одинаковые химические и
физические свойства (одинаковые температуры кипения и плавления,
плотность, растворимость, теплопроводность и т.д. ).
Количество энантиомеров : N=2n, где n – количество хиральных
атомов в молекуле.
Энантиомеры отличаются противоположными знаками
оптической активности и биологической активностью
4
5.
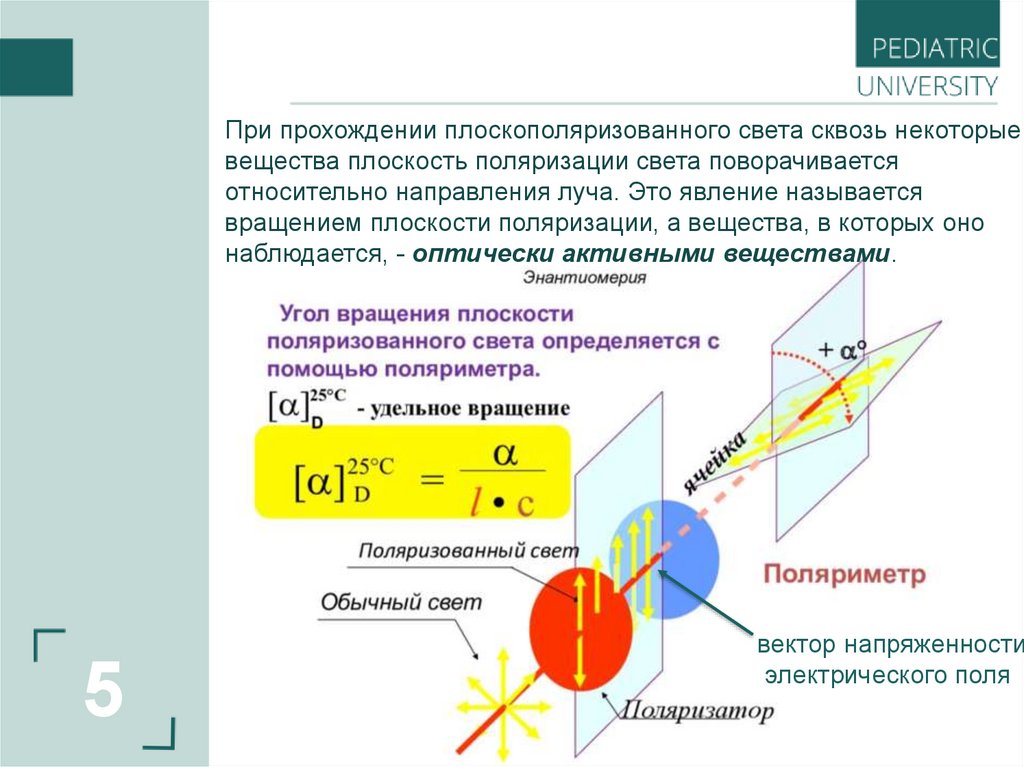
При прохождении плоскополяризованного света сквозь некоторыевещества плоскость поляризации света поворачивается
относительно направления луча. Это явление называется
вращением плоскости поляризации, а вещества, в которых оно
наблюдается, - оптически активными веществами.
5
вектор напряженности
электрического поля
6.
Энантиомер, отклоняющий плоскость поляризации света по часовойстрелке, называется правовращающим (+), а его антипод –
левовращающим (–)
Диастереомеры пространственные изомеры, молекулы которых
различаются конфигурацией заместителей у двух и более
асимметрических атомов углерода.
Относительную конфигурацию определяют путем сравнения с
конфигурационным стандартом. За конфигурационный стандарт
принят глицериновый альдегид (Розанов А.М., 1906 г.).
6
7.
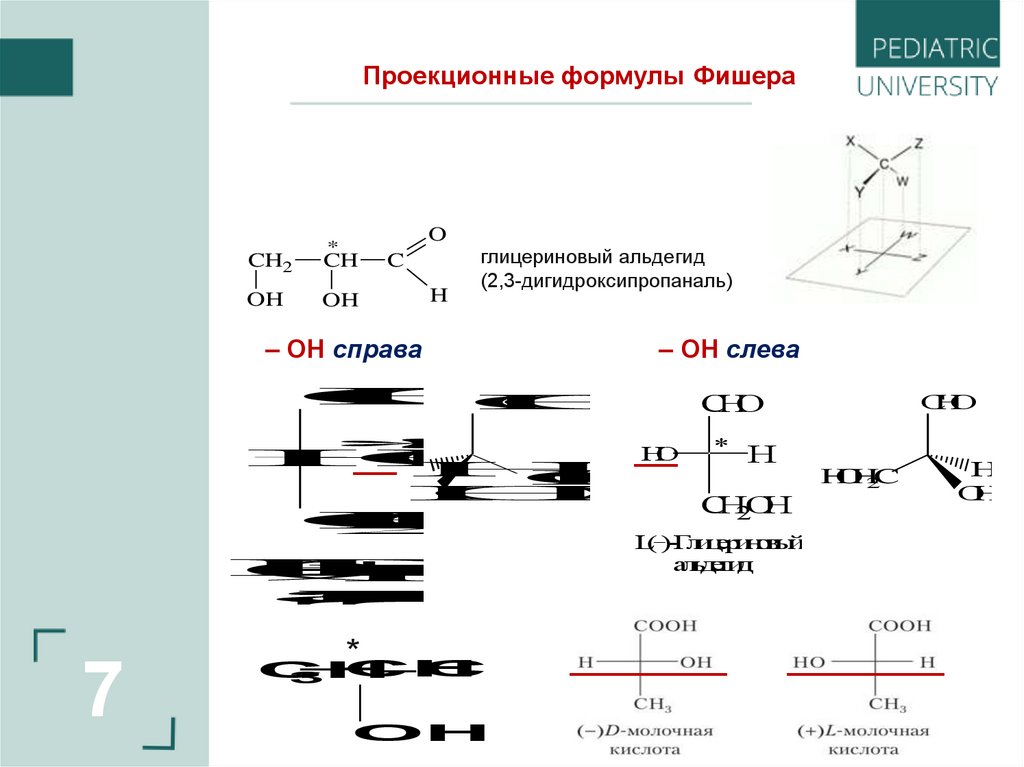
Проекционные формулы ФишераO
*
CH2
CH
OH
OH
C
H
глицериновый альдегид
(2,3-дигидроксипропаналь)
– ОН справа
– ОН слева
C
H
O
C
H
OCHO
*
HO
___
H
O
H
___
H
*
C
H
O
H
C
H
O
H
2
H
O
C
H
O
H_
2
CH2OH
H
O
H
2C
L( )-Глицериновый
D
(
+
)
Г
л
и
ц
е
р
и
н
о
в
ы
й альдегид
а
л
ь
д
е
г
и
д
7
*
___________
COOH
CH
3 CH
OH
___________
H
O
H
8.
Оптическая изомерия и фармакологическаяактивность лекарственных препаратов
У большинства лекарственных препаратов существует тесная
взаимосвязь
между
пространственной
структурой
и
фармакологической активностью, т.е. стереоспецифичность
действия
Распознавание стереоизомеров вводимого в организм
вещества может осуществляться на разных стадиях: при
связывании с ферментами и рецепторами, при транспорте
через мембраны, распределении между тканями.
8
Изменение конфигурации на противоположную, как правило,
ослабляет биологическое действие или приводит даже к
противоположному результату.
9.
Фармакологическая активность рацемических лекарственныхпрепаратов обычно связана с действием лишь одного энантиомера.
L(+)-морфин – сильный анальгетик.
D(-) -морфин фармакологически
неактивен.
1954 Chemie Grünenthal (ФРГ)
молекула состоит из двух компонентов — фталимида и глутаримида
(-) Талидомид – транквилизатор, снотворное
(+) Талидомид – тератоген, нарушение развития конечностей у
плода
9
10.
Талидомид10
11.
Талидомид11
12.
ХИМИЧЕСКИЕ СВОЙСТВАРеакции гидроксильной группы (–ОН)
1. Взаимодействие с галогенводородами (HCl, HBr)
O
O
+
H
O
C
H
C
H
C
+
H
C
l
2
C
H
C
H
C
3
3
H
O
H
C
l O
O
H
2
х
л
о
р
п
р
о
п
а
н
о
в
а
я
к
и
с
л
о
т
а
2. Ацилирование
O O
H
C
O
C
H
C
O
O
H
+
H
C
l
3
2
+
C
H
CC
C
H
C
3
2
C
l
O
H
O
O
H
г
л
и
к
о
л
е
в
а
я
к
и
с
л
о
т
а
О
а
ц
е
т
и
л
г
л
и
к
о
л
е
в
а
я
к
и
с
л
о
т
а
3. Окисление
O
а)
CH2 C
[O]
O
O
C C
OH
OH
H
OH
гликолеваякислота глиоксалеваякислота
12
б)
O
O
[
O
]
C
H
C
C
+
H
O
C
H
C
H
C
3
2
3
O
H
O
H
O
O
H
м
о
л
о
ч
н
а
я
к
и
с
л
о
т
а п
и
р
о
в
и
н
о
г
р
а
д
н
а
я
к
и
с
л
о
т
а
13.
Реакции карбоксильной группы (–СООН)1. Взаимодействие со щелочами
Ka 2.75e-4
pKa 3.56
Ka 1.31e-5
pKa 4.88
2. Взаимодействие с аммиаком
_
O
O
O
H
H
O
C
H
C
H
C+
C
H
C
H
C+
2
N
H
3
3
3 o
t
N
H
O
H
2
O
H
O
H
3. Взаимодействие со спиртами (реакция этерификации)
O
O
H
S
O
2
4
H
O
C
H
C
H
C+
C
H
C
H
C+
2
C
H
O
H
3
3
3
O
C
H
O
H
3
O
H
O
H
4. Декарбоксилирование
13
o
t
C
H
C
H
+
C
O
C
H
C
H
C
O
O
H
3
2
2
3
O
H
(in vivo реакция протекает
O
Hс участием декарбоксилаз)
14.
III. Специфические реакции , , –гидроксикарбоновых кислот
1. - Гидроксикислоты (межмолекулярная этерификация)
O
H
C
O
3
C
H
C
H
C
3
Лактиды способны
o
t
O
H
гидролизоваться
O
H
OO
+
с образованием
2
H
O
2
O
H H
O
исходных кислот.
C
H
C
H
C
H
O
C
3
3
л
а
к
т
и
д
м
о
л
о
ч
н
о
й
к
и
с
л
о
т
ы
O
Лактид – циклический эфир, полученный этерификацией между
двумя (обычно) или более молекулами молочной кислоты или другой
гидроксикарбоновой кислоты.
Полилактид, полимолочная кислота
14
15.
2. -Гидроксикислоты (внутримолекулярная дегидратация)O
CH3
CH
OH
CH2
C
OH
o
t
-H2O
H3C CH CH COOH
кротоновая кислота
3. γ, -Гидроксикислоты (внутримолекулярная этерификация)
o
O
t
CC
H
C
H
C
H
2
2
2
H
O
2
O
O
H
O
H
O
о
к
с
и
м
а
с
л
я
н
а
я
к
и
с
л
о
т
а
Лактоны способны
б
у
т
и
р
о
л
а
к
т
о
нгидролизоваться
с образованием
исходных кислот.
O
o
t
C
C
H
C
H
C
H
C
H
2
2
2
2
H
O
2
O
H
O
O
H
O
о
к
с
и
в
а
л
е
р
и
а
н
о
в
а
я
к
и
с
л
о
т
а
15
в
а
л
е
р
о
л
а
к
т
о
н
Лактоны – внутренние сложные эфиры гидроксикислот, содержащие
сложноэфирную группу ―С(О)О―, включенную в циклическую
структуру.
16.
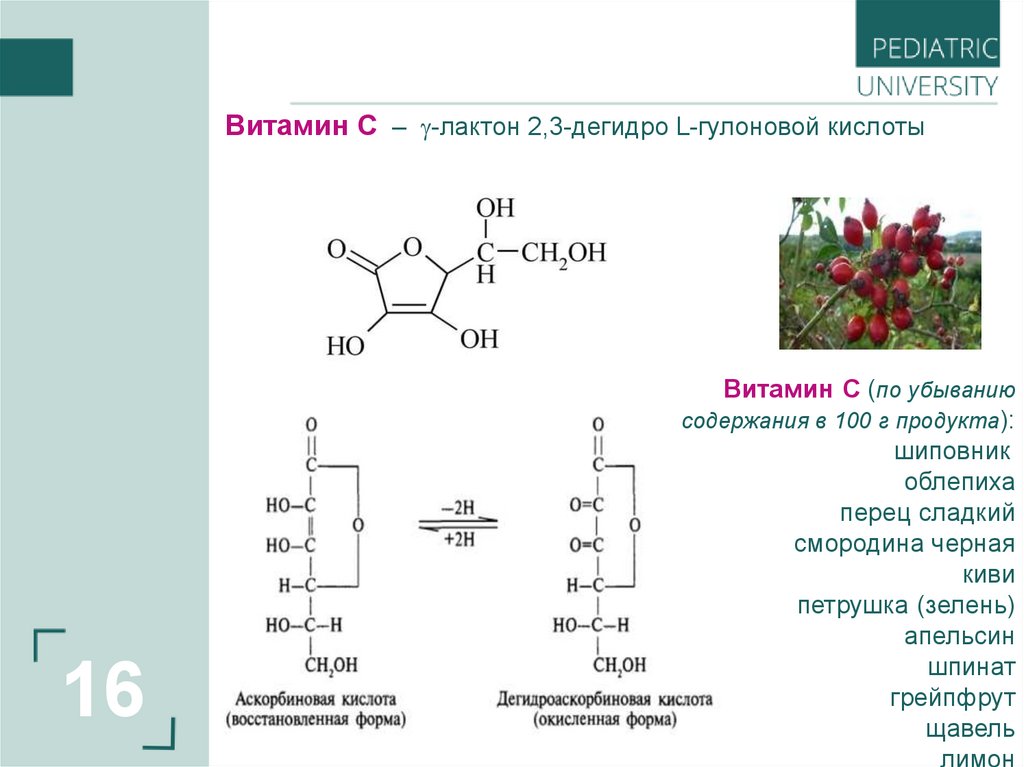
Витамин С – -лактон 2,3-дегидро L-гулоновой кислоты16
Витамин С (по убыванию
содержания в 100 г продукта):
шиповник
облепиха
перец сладкий
смородина черная
киви
петрушка (зелень)
апельсин
шпинат
грейпфрут
щавель
лимон
17.
Дикарбоновые гидроксикислотыЯблочная кислота
HOOC
*
CH
CH2
COOH
OH
2- гидроксибутандиовая,
- гидроксиянтарная, яблочная, соли – малаты
Существует в виде 2-х оптических изомеров и рацемической смеси:
COOH
COOH
H
OH
CH
COOH
2
D (+) яблочная кислота
17
Образуется при восстановлении
D-винной кислоты
H
H
CH
COOH
2
L (–) природная
яблочная кислота
Содержится в кислых плодах:
в незрелых яблоках, рябине, ревене,
в небольшом кол-ве в вине и др.
18.
Винная кислота*
*
НООС – СН – СН -СООН
Ι
Ι
ОН ОН
D(+)
→
(2,3 –дигидроксибутандиовая, виннокаменная,
тартаровая кислота, соли – тартраты)
3 стереоизомера
(оптически
неактивна)
Мезовинная кислота по отношению
к D- или L- винным кислотам
является диастереомером.
18
←
Рацемическая смесь
энантиомерных винных
(D-, L-) кислот –
виноградная кислота
19.
– Получение реактива Фелинга(тартрат калиянатрия)
– Декарбоксилирование
19
Для обнаружения
в альдегидах и углеводах
20.
Лимонная кислота(2-гидроксипропан-1,2,3-трикарбоновая)
муравьиная
кислота
ацетондикарбоновая
кислота
)
20
Соли лимонной кислоты – цитраты.
Цитрат натрия применяется для консервации донорской крови.
Противосвертывающее действие основано на том, что цитрат натрия
связывает участвующие в процессе свертывания ионы Са2+
в нерастворимый цитрат кальция.
21.
ФЕНОЛОКИСЛОТЫФенолкарбоновые кислоты (фенолокислоты) –
производные ароматических углеводородов, в молекулах
которых атомы водорода бензольного ядра замещены на
карбоксильные (–СООН) и гидроксильные (–ОН) группы.
C
O
O
H
C
O
O
H
O
H
O
H
O
H
п
о
к
с
и
б
е
н
з
о
й
н
а
я
к
и
с
л
о
т
а
21
с
а
л
и
ц
и
л
о
в
а
я
к
и
с
л
о
т
а
C
O
O
H
C
O
O
H
O
H
H
O
O
H
O
H
п
р
о
т
о
к
а
т
е
х
о
в
а
я
к
и
с
л
о
т
а
г
а
л
л
о
в
а
я
к
и
с
л
о
т
а
22.
Химические свойства▪ Кислотные свойства
СООNa
I
ОNa
СООН
I
ОН
+ 2NaOH
+ 2H2O
Салициловая кислота обладает более сильными кислотными свойствами
(рКа=2,98), чем ее мета- (рКа=4,00) и пара- (рКа=4,50) изомеры.
O
ΙΙ
С
О:
О Н
←
Внутримолекулярная
водородная связь
▪ Реакции гидроксильной группы (фенольного гидроксила)
22
.
(ацетилсалициловая кислота)
23.
▪ Реакции карбоксильной группы (получениелекарственных препаратов)
COONa
Na2CO3
OH
-NaHCO3
салицилат
натрия
O
C OCH3
COOH
OH
OH
CH3OH, H+
анальгезирующее,
жаропонижающее,
метилсалицилат
противовоспалительное
действие;
-H2O
25%-й NH3
CONH2
OH
NH3, to
салициламид
-H2O
O
C OC6H5
C6H5OH, H+
23
O
сплавление
OH
H2N
OH
антисептик
C NH-C6H5-OH
OH
-C6H5OH
-H2O
фенилсалицилат
(салол)
2-гидрокси-N-(4-гидроксифенил)бензамид
(оксафенамид, оксальмид)
24.
п-аминосалициловая кислота и ее производные обладаютбактериостатической активностью в отношении микобактерий
туберкулеза. Используют как специфическое противотуберкулезное
средство.
Получение пара-аминосалициловой кислоты (ПАСК)
1. Карбоксилирование
м-аминофенол
2. Нейтрализация
24
п-аминосалициловая
кислота
25.
Оксокислоты– соединения, содержащие одновременно карбоксильную
и карбонильную (альдегидную или кетонную) группы.
О
НООС–С Н
Глиоксиловая (глиоксалевая,
оксоэтановая) кислота
,
Пировиноградная ( 2-оксопропановая)
кислота, ПВК
H3C–С–CH2–СOOH
ΙI
О
Ацетоуксусная (3-оксобутановая)
кислота, АУК
HOOC–С–CH2–СOOH
ΙI
О
25
Щавелевоуксусная (2-оксобутандиовая)
кислота, ЩУК
HOOC–C–СH2–CH2–СOOH a-Оксоглутаровая
ΙI
О
(2-оксопентандиовая) кислота
26.
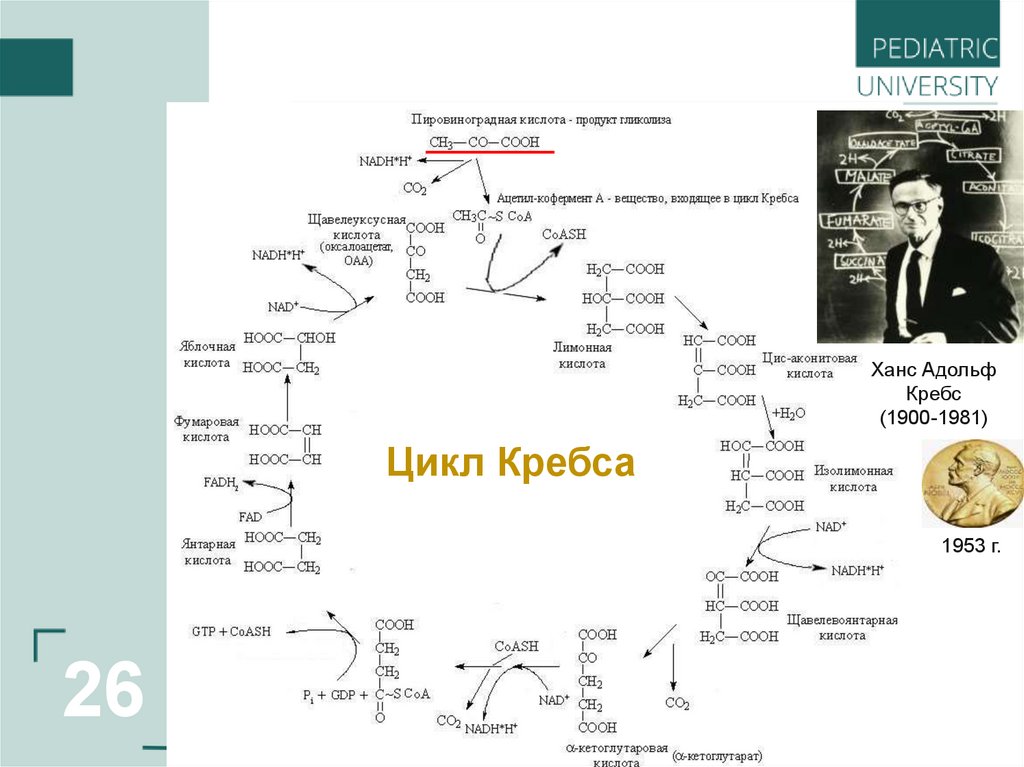
_________Ханс Адольф
Кребс
(1900-1981)
Цикл Кребса
1953 г.
26
27.
Химические свойства оксокарбоновых кислот>С=О – реакции АN, восстановления;
– СООН – реакции SN, образования солей.
Специфические реакции – обусловлены взаимным влиянием
2-х групп.
Реакции >С=О
+ HCN →
CN
Ι
H3C–С–СOOH
Ι
ОН
+ NH2–OH → H3C–С–СOOH
ΙI
-Н2O
N–OH
ПВК
3
ОН
27
оксим ПВК
молочная кислота
→ H C–СН–СOOH
Ι
Pd
+ H2
2-циано-2-гидроксипропановая кислота
28.
Реакции –СООН+ NaOH
-Н2O
+C2H5ОН, Н+
ПВК
-Н2O
H3C–С–СOONa
ΙI
пируват натрия
O
O
H3C–С–С
OC2H5
ΙI
O
этилпируват
+ PCl5; (SOCl2), NH3
…
Специфические реакции
▪ Декарбоксилирование in vitro
1500С,
+H2SO4 (разб).
28
H3C – С
О
Н
+ СО2
↑
29.
II. Аминокислоты.Пептиды
29
30.
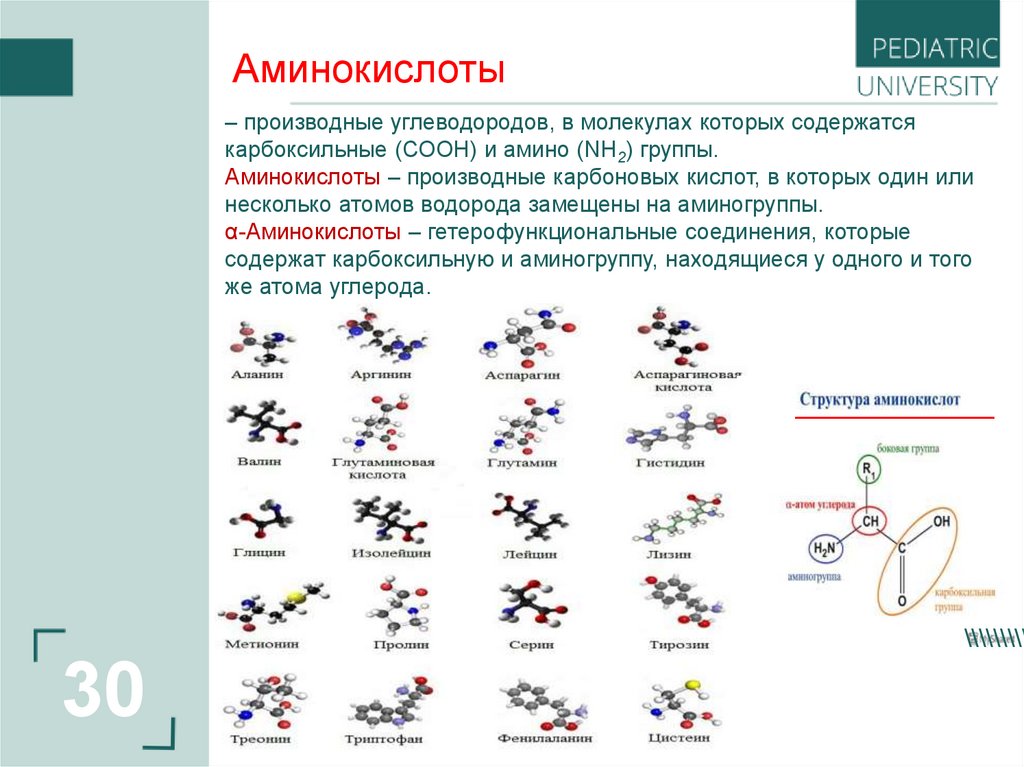
Аминокислоты– производные углеводородов, в молекулах которых содержатся
карбоксильные (СООН) и амино (NH2) группы.
Аминокислоты – производные карбоновых кислот, в которых один или
несколько атомов водорода замещены на аминогруппы.
α-Аминокислоты – гетерофункциональные соединения, которые
содержат карбоксильную и аминогруппу, находящиеся у одного и того
же атома углерода.
______________
\\\\\\\\\
30
31.
НОМЕНКЛАТУРАПо заместительной номенклатуре ИЮПАК аминокислоты
называют исходя от соответствующей карбоновой кислоты с
добавлением префикса амино-, а положение аминогруппы
указывают соответствующей цифрой.
При использовании тривиальных названий положение
аминогруппы по отношению к карбоксильной группе
обозначают буквенным локантом из греческого алфавита:
α, β, γ, , ε.
N
H
HC
O
O
H
2 C
N
H
H
H
O
O
H
2 C
2 C
2 C
C
H
3
2-ам
и
н
оп
роп
ан
оваяки
слота
(
-ам
и
н
оп
роп
и
он
овая,алан
и
н
3-ам
и
н
оп
роп
ан
оваяки
слота
(
-ам
и
н
оп
роп
и
он
овая)
N
H
H
H
H
H
H
O
O
H
2 C
2 C
2 C
2 C
2 C
2 C
31
6-ам
и
н
огексан
оваяки
слота
( -ам
и
н
окап
рон
овая)
32.
КЛАССИФИКАЦИЯ α-АМИНОКИСЛОТ1. По химической природе углеводородного радикала
Формула
аминокислоты
Название
аминокислоты
Сокращенное
название
Алифатические
Глицин
Гли
N
H
C
H
C
O
O
H
2
2
C
H
C
H
C
O
O
H
3
N
H
2
Аланин
Ала
(
C
H
)
C
H
C
H
C
O
O
H
3
2
Валин
Вал
N
H
2
*
H3C
H3C
32
СH – CH2 – СH – COOH
I
Лейцин
Лей
*
NH2
CH3
I
Н3С–CH2–CH –СH–COOH
I
NH2
*
Изолейцин
Иле
33.
Содержащие ОН группуH
O
C
H
C
H
C
O
O
H
2
N
H
2
Серин
C
H
C
H
C
H
C
O
O
H
3
Треонин
O
H
N
H
2
Сер
*
Тре
Содержащие СООН группу
H
O
O
C
C
H
C
H
C
O
O
H
2
Аспарагиновая
N
H
2
Асп
H
O
O
C
C
H
C
H
C
H
C
O
O
H
2
2
Глутаминовая
Глу
N
H
2
Содержащие СОNН2
33
O
C
C
H
C
H
C
O
O
H
2
Аспарагин
H
N
2
N
H
2
O
C
(
C
H
)
C
H
C
O
O
H
Глутамин
2
2
H
N
2
N
H
2
Асн
Глн
34.
Содержащие NH2 группуH
N
C
H
(
C
H
)
C
H
C
O
O
H
2
2
2
3
Лизин
N
H
2
*
Лиз
H
N
C
N
H
(
C
H
)
C
H
C
O
O
H
2
3
Аргинин
H
N
2
N
H
2
Арг
Серасодержащие
H
S
C
H
C
H
C
O
O
H
2
Цистеин
N
H
2
Цис
C
H
S
C
H
C
H
C
H
C
O
O
H
3
2
2
Метионин
*
N
H
2
Мет
Ароматические
C 6H 5
C H 2
C H
N H 2
34
C O O H
Фенилаланин
*
Фен
п
H
O
C
H
C
H
C
H
C
O
O
H
6
4
2
Тирозин
Тир
N
H
2
35.
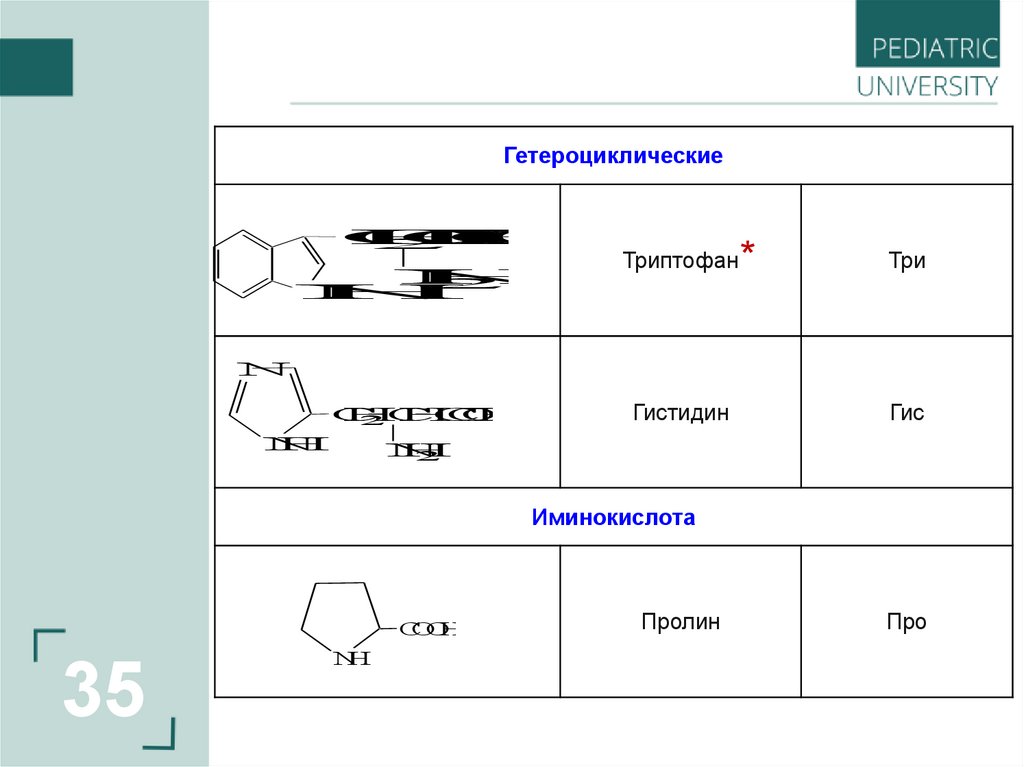
ГетероциклическиеC
H
C
H
C
O
O
H
2
N
H
2
N
H
*
Триптофан
Три
Гистидин
Гис
N
C
H
H
C
O
O
H
2C
N
H
N
H
2
Иминокислота
C
O
O
H
35
N
H
Пролин
Про
36.
2. По количеству амино- и карбоксильных групп* 1 амино- и 1 карбоксильная группа – нейтральные
C
H
C
H
C
O
O
H
3
N
H
2
* 1 амино- и 2 карбоксильные группы – кислые
H
O
O
C
C
H
C
H
C
H
C
O
O
H
H
O
O
C
C
H
C
H
C
O
O
H
2
2
2
N
H
2
N
H
2
* 2 амино- и 1 карбоксильная группа – основные
36
H
N
H
N
C
H
(
C
H
)
C
H
C
O
O
H
C
N
H
(
C
H
)
C
H
C
O
O
H
2
2
2
3
2
3
H
N
2
N
H
N
H
2
2
37.
3. По полярности бокового радикалаАМИНОКИСЛОТЫ
неполярные
(гидрофобные)
полярные
(гидрофильные)
аланин, валин, лейцин,
изолейцин, метионин,
фенилаланин,
незаряженные
триптофан, пролин
(неионогенные)
глицин, серин,
треонин,
цистеин, тирозин,
аспарагин,
глутамин
отрицательно положительно
заряженные
заряженные
(ионогенные)
(ионогенные)
аспарагиновая,
гистидин,
глутаминовая
лизин,
кислоты
аргинин
(дополнительная
карбоксильная группа)
37
38.
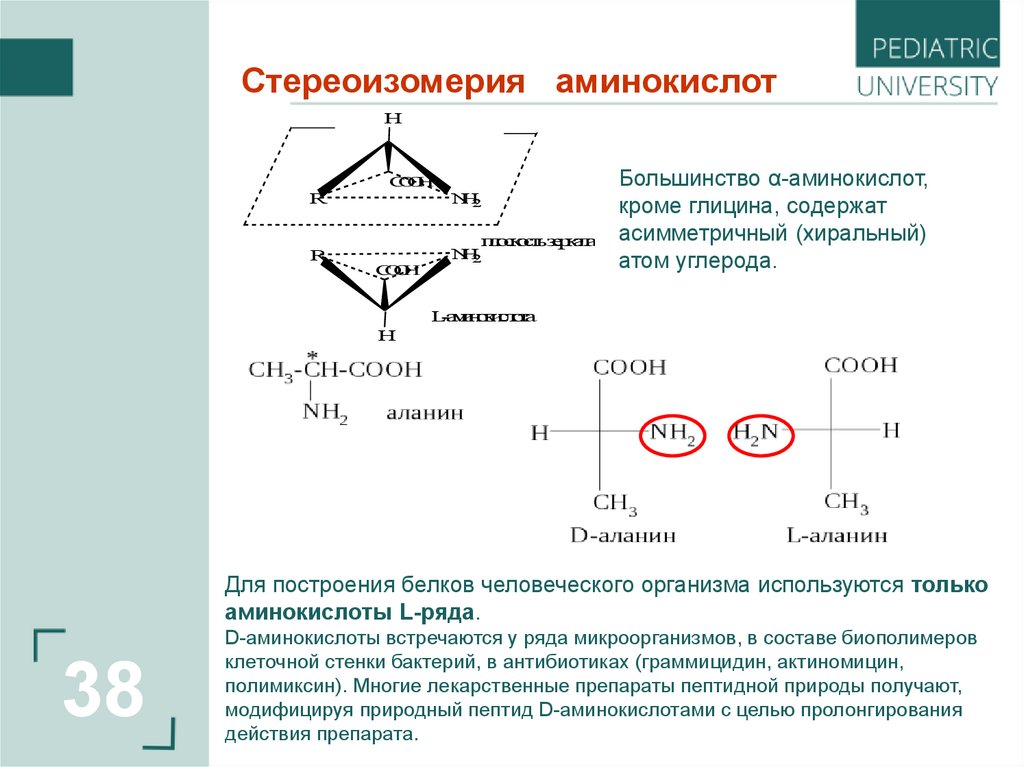
Стереоизомерия аминокислотH
R
C
O
O
H
N
H
2
плоскостьзеркала
N
H
2
R
C
O
O
H
Большинство α-аминокислот,
кроме глицина, содержат
асимметричный (хиральный)
атом углерода.
L-аминокислота
H
Для построения белков человеческого организма используются только
аминокислоты L-ряда.
38
D-аминокислоты встречаются у ряда микроорганизмов, в составе биополимеров
клеточной стенки бактерий, в антибиотиках (граммицидин, актиномицин,
полимиксин). Многие лекарственные препараты пептидной природы получают,
модифицируя природный пептид D-аминокислотами с целью пролонгирования
действия препарата.
39.
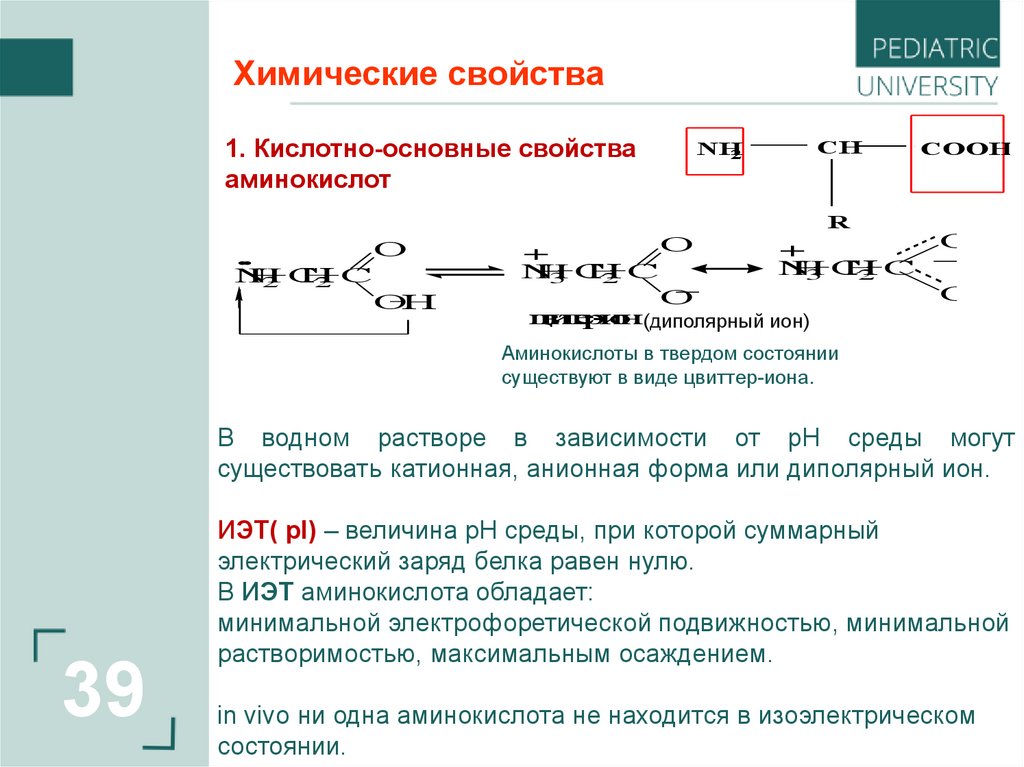
Химические свойства1. Кислотно-основные свойства
аминокислот
NH
2
CH
COOH
R
O
..
N
H
H
2 C
2 C
OH
O
O
+
_
+
N
H
H
N
H
H
3 C
2 C
3 C
2 C _
O
O
ц
в
и
т
т
е
р
-и
о
н(диполярный ион)
Аминокислоты в твердом состоянии
существуют в виде цвиттер-иона.
В водном растворе в зависимости от рН среды могут
существовать катионная, анионная форма или диполярный ион.
39
ИЭТ( pI) – величина pH среды, при которой суммарный
электрический заряд белка равен нулю.
В ИЭТ аминокислота обладает:
минимальной электрофоретической подвижностью, минимальной
растворимостью, максимальным осаждением.
in vivo ни одна аминокислота не находится в изоэлектрическом
состоянии.
40.
Равновесие аминокислот в водном раствореНейтральные АК: 1 амино- и 1 карбоксильная группа
+
CH
NH 3
+H
COOH
CHCO
NH
3
OH-
R
R
катионная форма
pH
<
цвиттер-ион
0 заряд
pI
pI
+ OH-
N H 2
+
+H
40
C O O -
C H
R
анионная форма
pI
<
pH
+
H
O
2
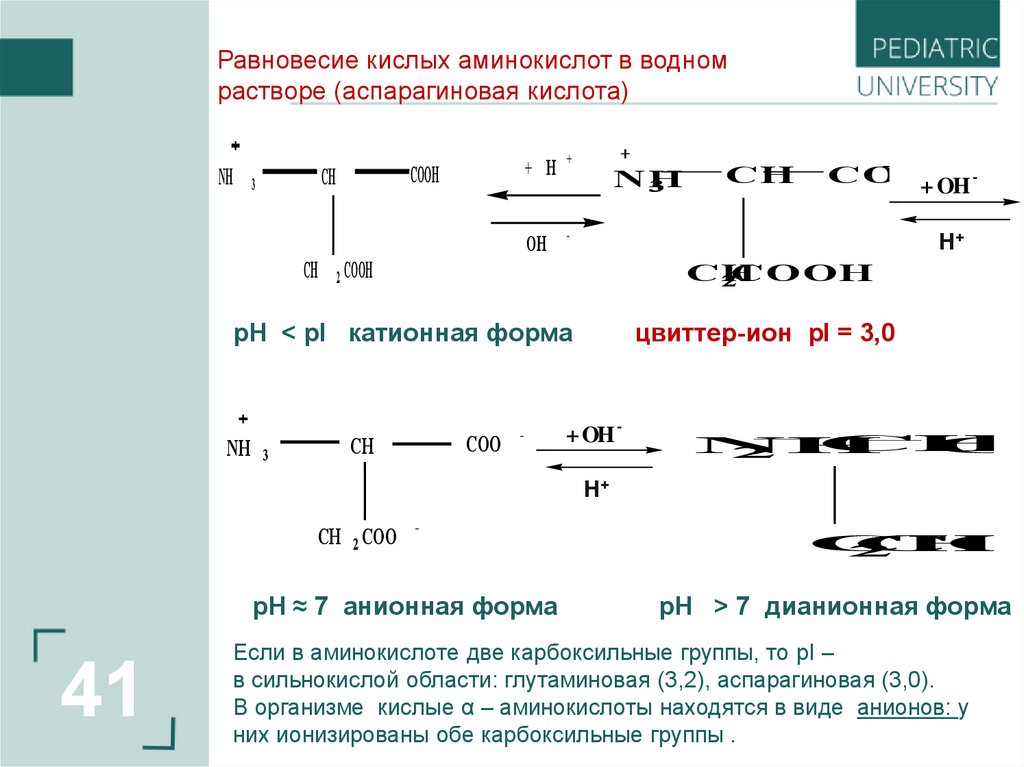
41.
Равновесие кислых аминокислот в водномрастворе (аспарагиновая кислота)
NH
3
+ H +
COOH
CH
OH
CH
NH
3
COO
+ OH -
-
H+
2 COOH
CH
2COOH
pH < pI катионная форма
NH 3
CH
COO
CH
-
цвиттер-ион pI = 3,0
+ OH -
CH
NH
CO
2
H+
CH 2 COO
-
pH ≈ 7 анионная форма
41
CH
CO
2
pH > 7 дианионная форма
Если в аминокислоте две карбоксильные группы, то pI –
в сильнокислой области: глутаминовая (3,2), аспарагиновая (3,0).
В организме кислые α – аминокислоты находятся в виде анионов: у
них ионизированы обе карбоксильные группы .
42.
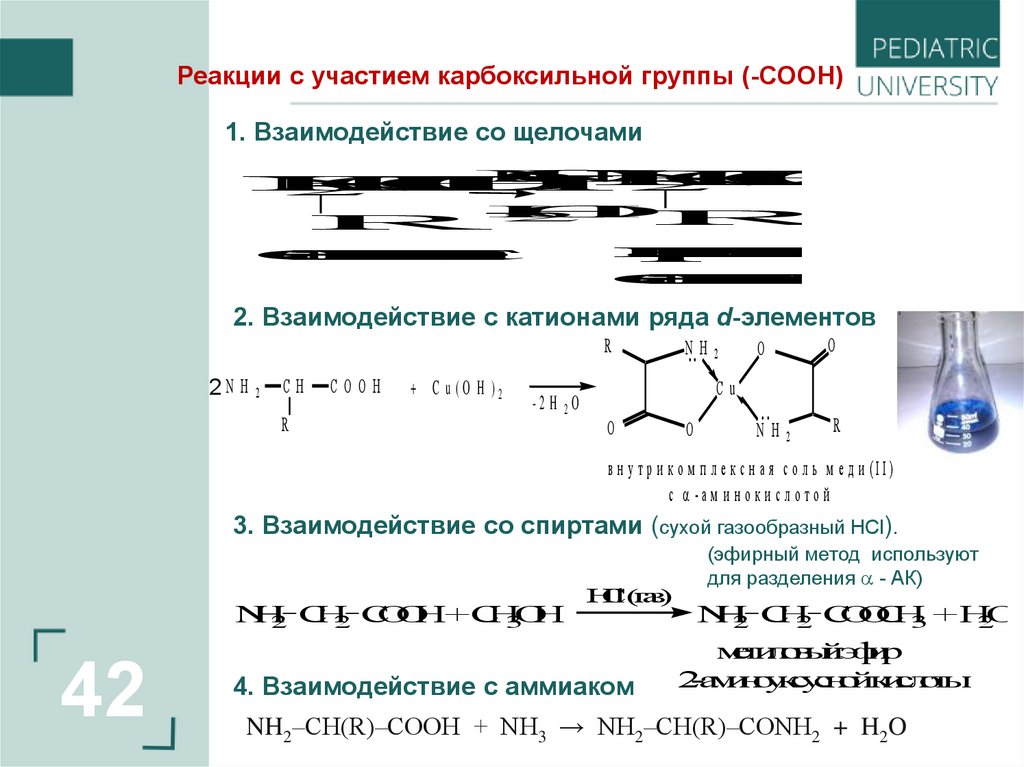
Реакции с участием карбоксильной группы (-СООН)1. Взаимодействие со щелочами
N
a
O
H
N
H
C
H
C
O
O
N
a
2
N
H
C
H
C
O
O
H
2
H
O
R
R 2
а
м
и
н
о
к
и
с
л
о
т
а
н
а
т
р
и
е
в
а
я
с
о
л
ь
а
м
и
н
о
к
и
с
л
о
т
ы
2. Взаимодействие с катионами ряда d-элементов
R
2N H 2
CH
R
COOH
+ C u (O H )2
-2 H 2O
N. . H 2
O
O
..
NH2
R
Cu
O
O
в н у тр и к о м п л е к с н а я с о л ь м е д и (II)
с -а м и н о к и с л о то й
3. Взаимодействие со спиртами (сухой газообразный HСl).
N
H
H
O
O
H+ C
H
H
2 C
2 C
3O
42
H
C
l(газ)
4. Взаимодействие с аммиаком
(эфирный метод используют
для разделения - АК)
N
H
H
O
O
C
H
2 C
2 C
3 +H
2O
м
етиловы
йэф
ир
2-ам
иноуксуснойкислоты
NH2‒CH(R)‒COOH + NH3 → NH2‒CH(R)‒CONH2 + H2O
43.
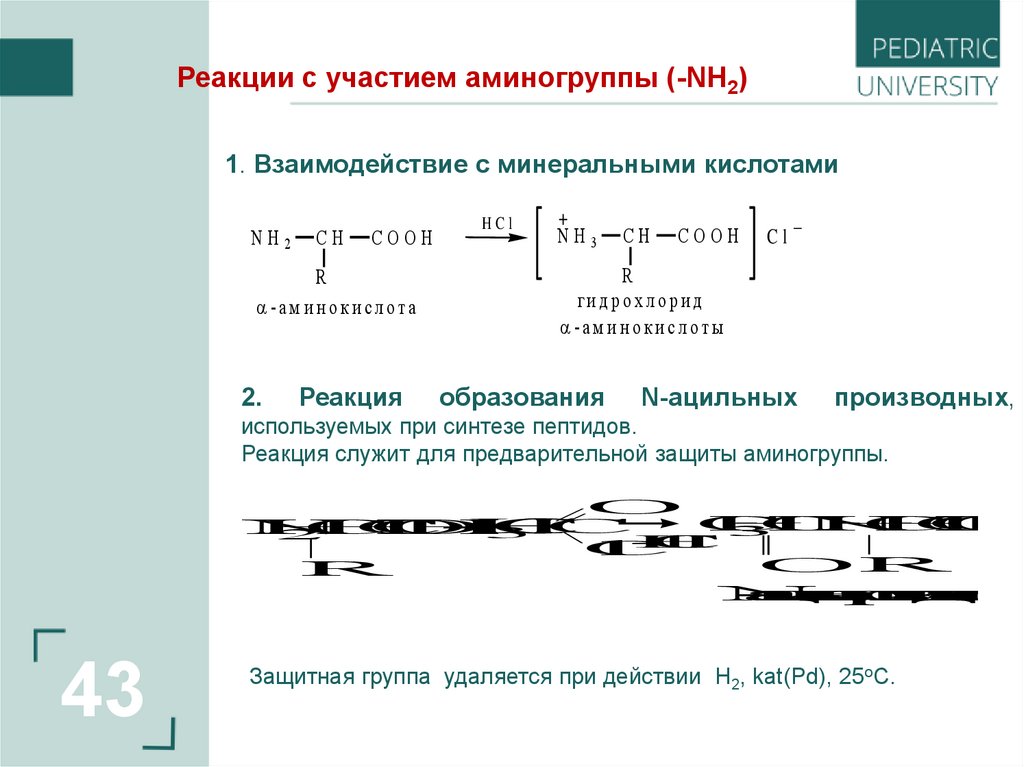
Реакции с участием аминогруппы (-NН2)1. Взаимодействие c минеральными кислотами
NH2
CH
COOH
R
-а м и н о к и с л о та
2.
Реакция
HCl
+
NH3
CH
COOH
Cl
_
R
ги д р о х л о р и д
-а м и н о к и с л о ты
образования
N-ацильных
производных,
используемых при синтезе пептидов.
Реакция служит для предварительной защиты аминогруппы.
O
C
H
C
N
H
C
H
C
O
O
H
+
H
C
C
N
H
C
H
C
O
O
H
3
3
2
H
C
l
C
l
OR
R
N
а
ц
и
л
ь
н
о
е
п
р
о
и
з
в
о
д
н
о
е
43
Защитная группа удаляется при действии H2, kat(Pd), 25oC.
44.
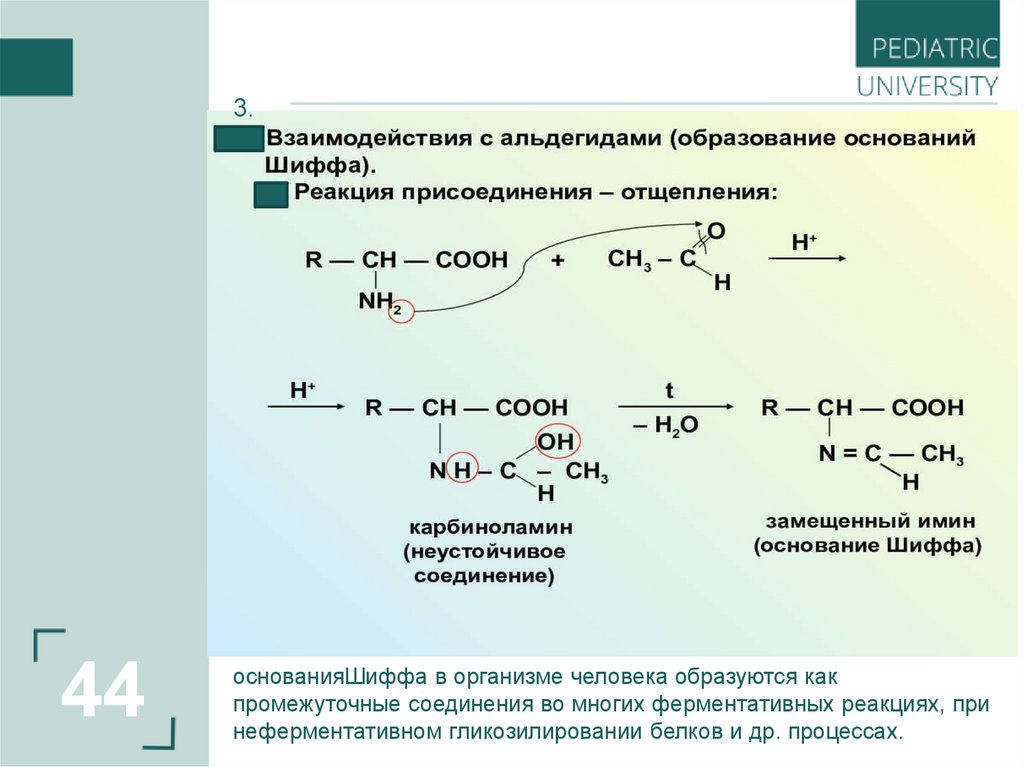
3.44
основанияШиффа в организме человека образуются как
промежуточные соединения во многих ферментативных реакциях, при
неферментативном гликозилировании белков и др. процессах.
45.
Биологически важные химические реакцииДекарбоксилирование – образование биогенных аминов из
α – аминокислот (лиз, цис, три, сер, асп) – метаболическое
превращение аминокислот. Реакции декарбоксилирования
аминокислот являются необратимыми, катализируются –
декарбоксилазами аминокислот.
▪
N
▪
N
CH 2
N
H
45
CH
NH 2
COOH
CH 2
- CO2
CH 2 NH 2
N
H
гистидин
гистамин
46.
Окислительное дезаминированиеДезаминирование – удаление аминогруппы из молекулы.
Дезаминирование АК – реакция отщепления α-аминогруппы от АК, в
результате чего образуется соответствующая α-кетокислота и выделяется
молекула аммиака. Ферменты, катализирующие дезаминирование,
называют дезаминазами.
H3C–СН–СOOH
I
NH2
оксидаза
НАД
→
-H
2
аланин
+ H2О
→
-NH
3
46
H3C–С–СOOH
II
NH
иминокислота
H3C–С–СOOH
II
О
пировиноградная
кислота
+ H2О
→
-NH3
47.
Трансаминирование –используется для биосинтеза заменимых α-аминокислот из
α -оксокислот.
Трансаминирование – передача NH2- группы от аминокислоты на
α-оксокислоту под действием ферментов трансаминаз и кофермента
пиридоксальфосфата.
____
47
___
Пиридоксальфосфат
Процесс трансаминирования является
связующим звеном между метаболизмом
белков (аминокислоты) и углеводов
(оксокислоты).
___
____
Пиридоксальфосфат –
временная камера
хранения NH2–группы.
48.
Пептиды –соединения, построенные из двух и более остатков
аминокислот, соединенных в цепь пептидными(амидными)
связями ‒C(O)NH‒.
HC
O
O
H+ H
HC
O
O
H
H
HC
O
O
H+ H
2N C
2N C
2N C
R
'
R
O
R
''
O
H
H C N
HC
H C N
H C
HC
O
O
H +2H
2O
2N C
R
N
-конец
R
'
R
''
C
-конец
трипептид
◄ H N CH COOH + H N CH COOH + H N CH COOH
2
2
2
CH3
CH2OH
аланин
серин
48
CH C
CH3
фенилаланин
O
O
H2N
CH2
HN
CH
C
CH2OH
аланилсерилфенилаланин
_
_
HN
CH COOH + H2O
CH2
49.
КАЧЕСТВЕННЫЕ РЕАКЦИИ1. Реакция с нингидрином
дактилоскопия
ТСХ
Спектрофотометрическое
определение
на аминокислотных
анализаторах в области
550-570 нм.
49
50.
2. Биуретовая реакция – качественная реакция напептидные связи.
Образуется комплекс с Сu(OH)2 – фиолетового цвета.
C
2 N H 2
NH
O
NH 2
N
NH
2 +
C u ( O H )2
O
C
O
O
C
O
C
Cu
C
NH 2
50
C
O
NH 2
N
NH 2
Биуретовая реакция – качественная реакция на белки, продукты их
неполного гидролиза, которые содержат не менее двух пептидных
связей.
Биуретовую реакцию дают также некоторые небелковые вещества,
н.р, биурет (NH2-CO-NH-CO-NH2),
оксамид (NH2-CO-CO-NH2).
51.
3. Реакция ФоляПри нагревании раствора белка с ацетатом свинца в
щелочной среде образуется осадок черного цвета PbS, что
указывает на присутствие в белках цистеина.
O
C
H
C
H
C
O
O
H
+
N
a
S
+
H
O
H
S
C
H
C
H
C
O
O
H
+
2
N
a
O
HH
2
2
2
2
N
H
2
ц
и
с
т
е
и
н
N
H
2
с
е
р
и
н
Pb(CH3COO)2 + 2NaOH = Pb(OH)2↓ + 2CH3COONa
Pb(OH)2 +2NaOH = Na2[Pb(OH)4] + 2H2O
Na2S + Na2[Pb(OH)4] + 2H2O = PbS↓ + 4NaOH
51
PbS
52.
4. Ксантопротеиновая реакция для ароматических игетероциклических аминокислот (фен, тир, гис, три) –
окрашивание в желтый цвет.
52
53.
СПАСИБОЗА ВНИМАНИЕ!
Фотографии и рисунки, используемые в лекции, взяты
из свободного доступа сети интернет.









































 Химия
Химия








