Похожие презентации:
Углеводы. Моно- и дисахариды. Хроматографические методы исследования
1.
Кафедра общей и медицинской химииЛекция 7-I
Углеводы. Моно- и дисахариды
Хроматографические методы
исследования.
1
2.
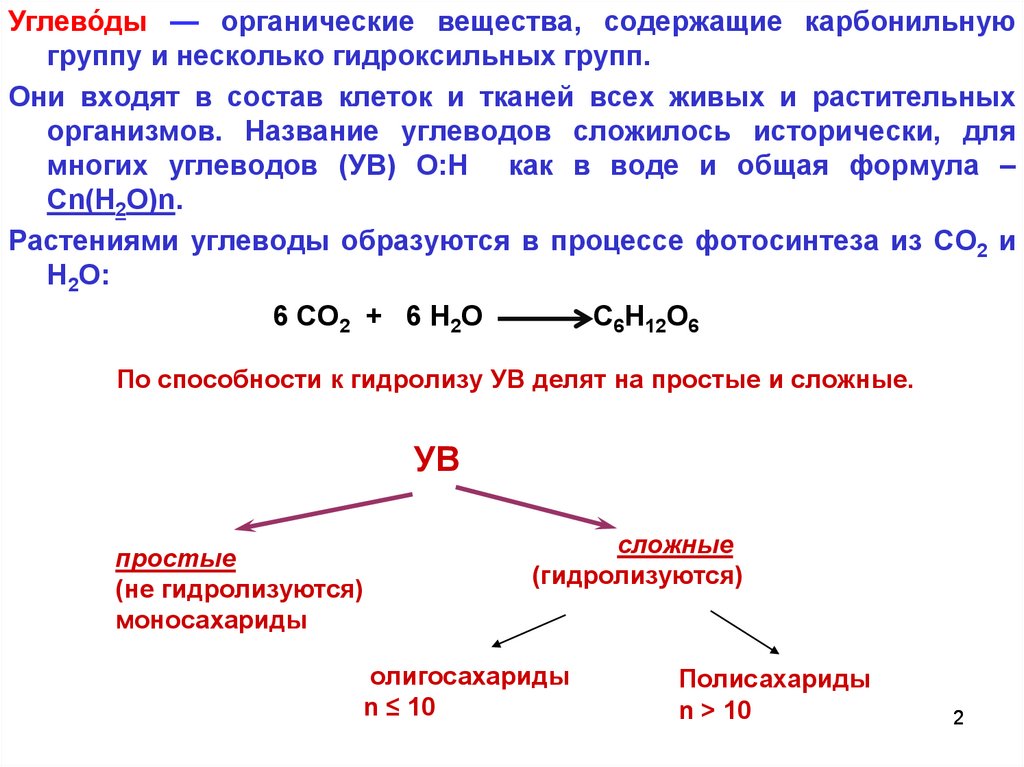
Углево́ды — органические вещества, содержащие карбонильнуюгруппу и несколько гидроксильных групп.
Они входят в состав клеток и тканей всех живых и растительных
организмов. Название углеводов сложилось исторически, для
многих углеводов (УВ) О:H как в воде и общая формула –
Сn(H2O)n.
Растениями углеводы образуются в процессе фотосинтеза из CO2 и
Н2О:
6 CO2 + 6 Н2О
C6H12O6
По способности к гидролизу УВ делят на простые и сложные.
УВ
простые
(не гидролизуются)
моносахариды
сложные
(гидролизуются)
олигосахариды
n ≤ 10
Полисахариды
n > 10
2
3.
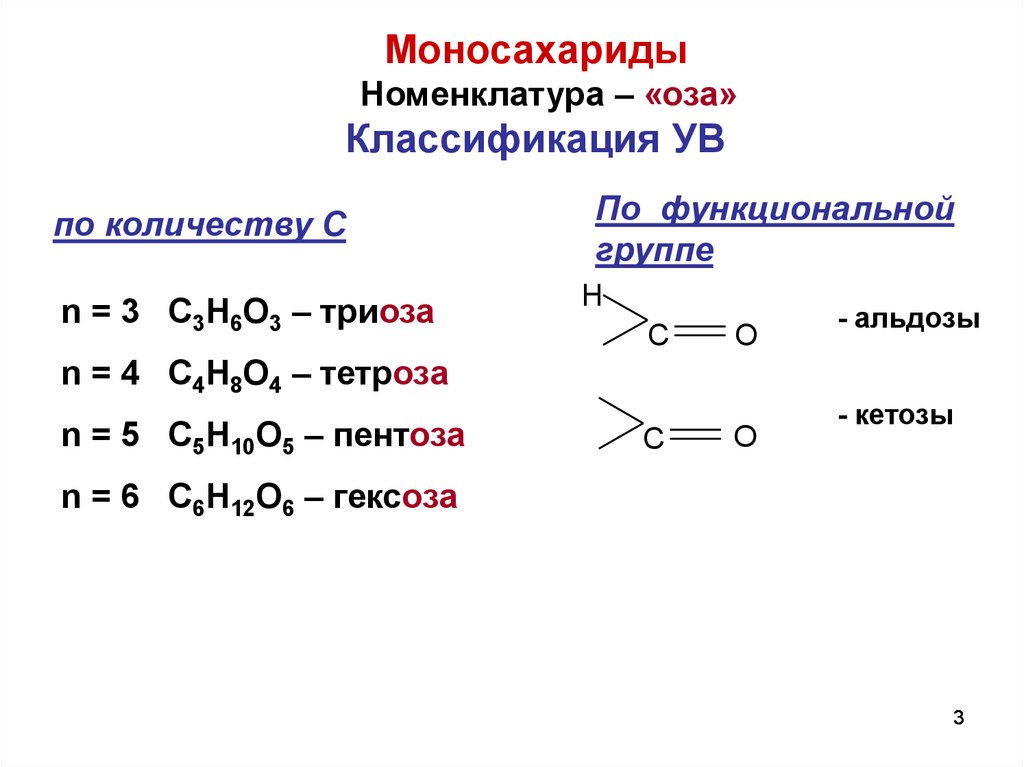
МоносахаридыНоменклатура – «оза»
Классификация УВ
по количеству С
n = 3 C3H6O3 – триоза
По функциональной
группе
H
C
O
- альдозы
n = 4 C4H8O4 – тетроза
n = 5 C5H10O5 – пентоза
C
O
- кетозы
n = 6 C6H12O6 – гексоза
3
4.
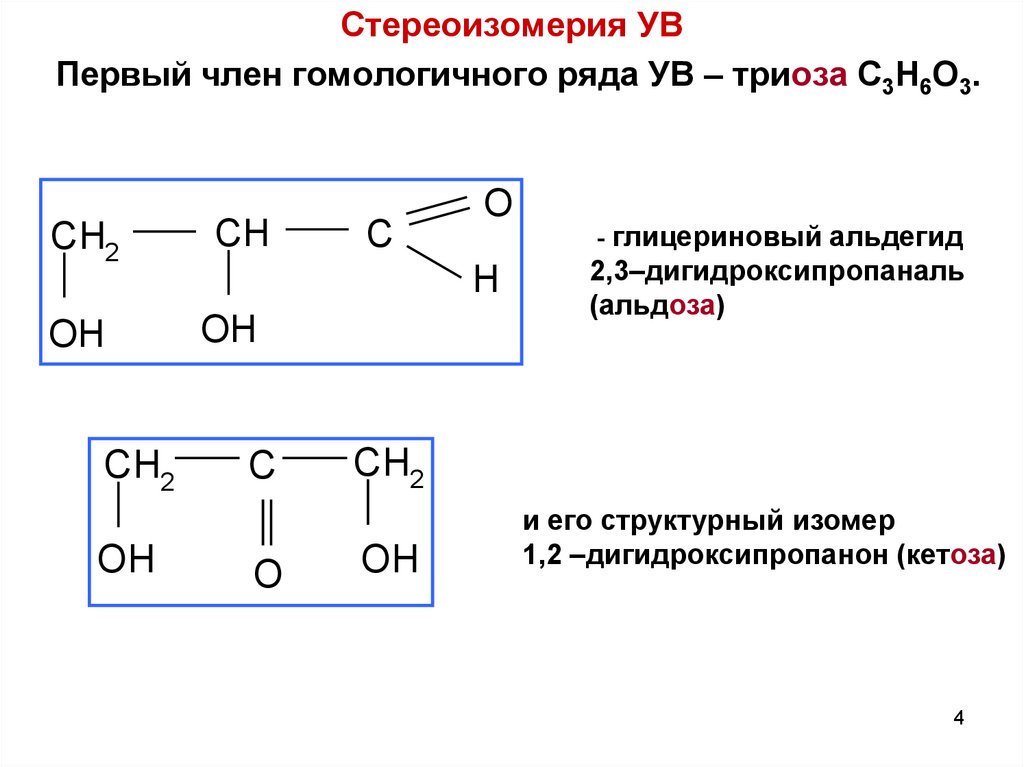
Стереоизомерия УВПервый член гомологичного ряда УВ – триоза C3H6O3.
CH2
CH
OH
OH
CH2
OH
C
O
H
C
O
- глицериновый альдегид
2,3–дигидроксипропаналь
(альдоза)
CH2
OH
и его структурный изомер
1,2 –дигидроксипропанон (кетоза)
4
5.
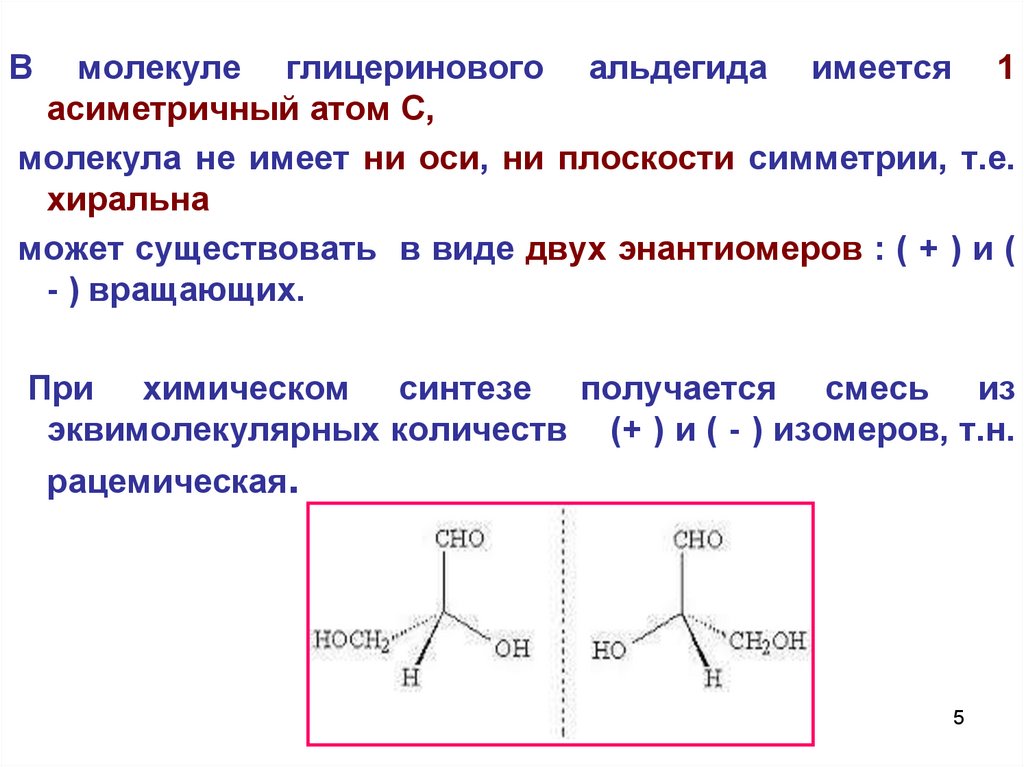
Вмолекуле глицеринового альдегида имеется 1
асиметричный атом С,
молекула не имеет ни оси, ни плоскости симметрии, т.е.
хиральна
может существовать в виде двух энантиомеров : ( + ) и (
- ) вращающих.
При химическом синтезе получается смесь из
эквимолекулярных количеств (+ ) и ( - ) изомеров, т.н.
рацемическая.
5
6.
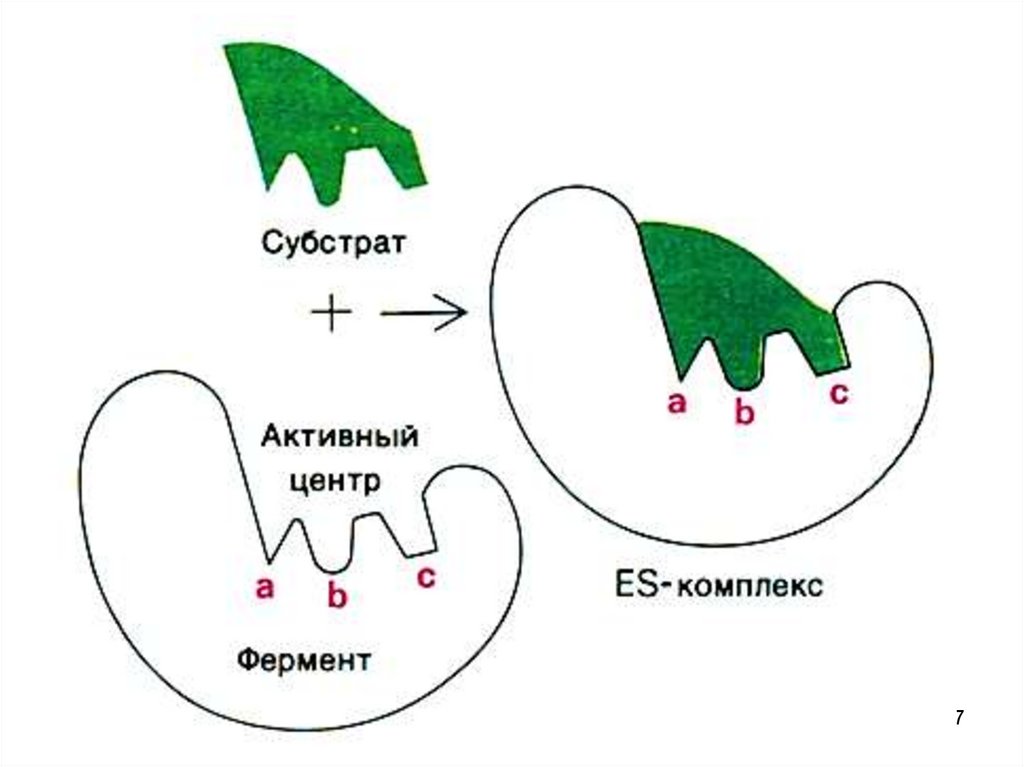
• Реакции, протекающие в живом организмеприводят
к
одному
энантиомеру,
т.е.
стереоселективны.
• Необходимо знать конфигурацию атомов в этих
энантиомерах, ведь биохимические реакции –
ферментативны, а конфигурация фермента
должна совпадать с конфигурацией Sb, т.е. они
должны подходить друг к другу, как ключ к замку
6
7.
78.
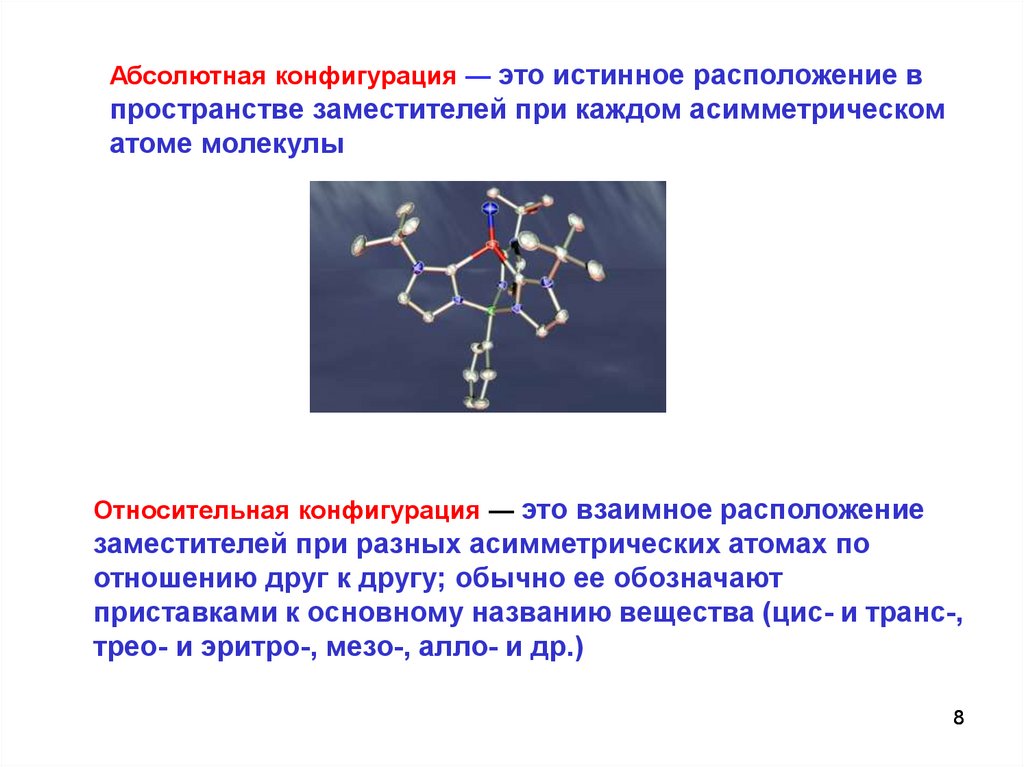
Абсолютная конфигурация — это истинное расположение впространстве заместителей при каждом асимметрическом
атоме молекулы
Относительная конфигурация — это взаимное расположение
заместителей при разных асимметрических атомах по
отношению друг к другу; обычно ее обозначают
приставками к основному названию вещества (цис- и транс-,
трео- и эритро-, мезо-, алло- и др.)
8
9.
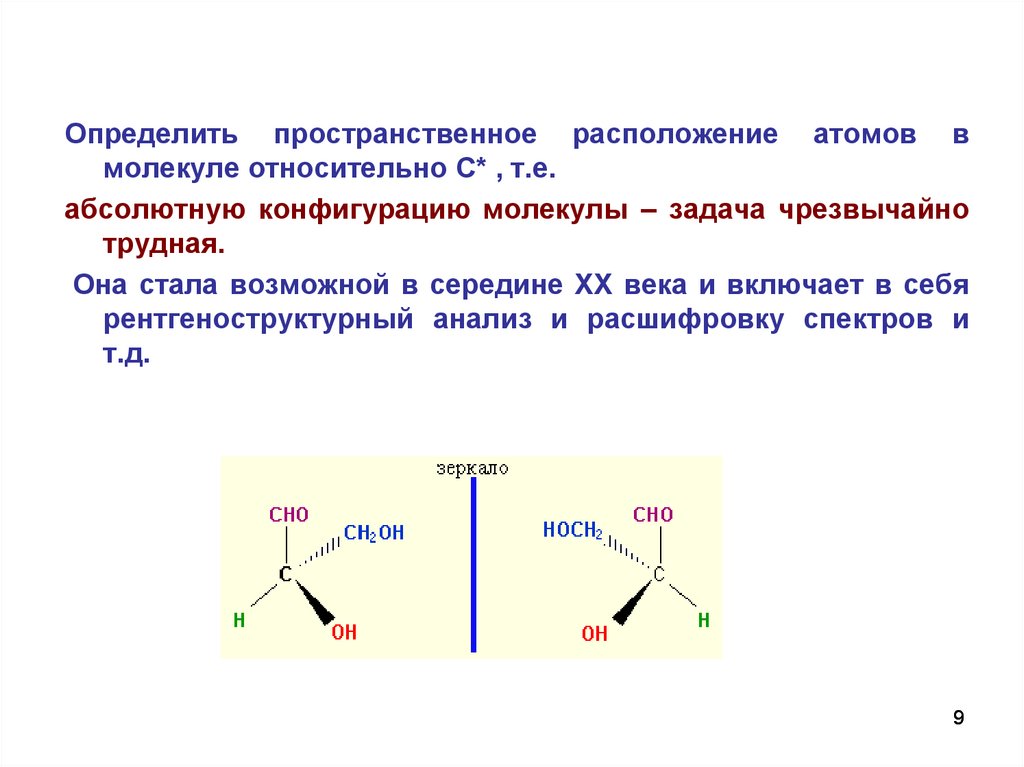
Определить пространственное расположение атомов вмолекуле относительно С* , т.е.
абсолютную конфигурацию молекулы – задача чрезвычайно
трудная.
Она стала возможной в середине ХХ века и включает в себя
рентгеноструктурный анализ и расшифровку спектров и
т.д.
9
10.
Если абсолютную конфигурацию молекулы узнатьтрудно, то можно определить относительную.
Химики в начале ХХ века ввели стереохимические ряды,
условно обозначаемые как D и L,
1)выбрали конфигурационный стандарт
2)
стали определять относительную конфигурацию
изучаемого
стереоизомера,
сравнивая
его
со
стандартом,
3) относить соединения к D и L стереохимическим рядам.
За
конфигурационный
эталон
в
1906
Розанов А. принял глицериновый альдегид.
году
10
11.
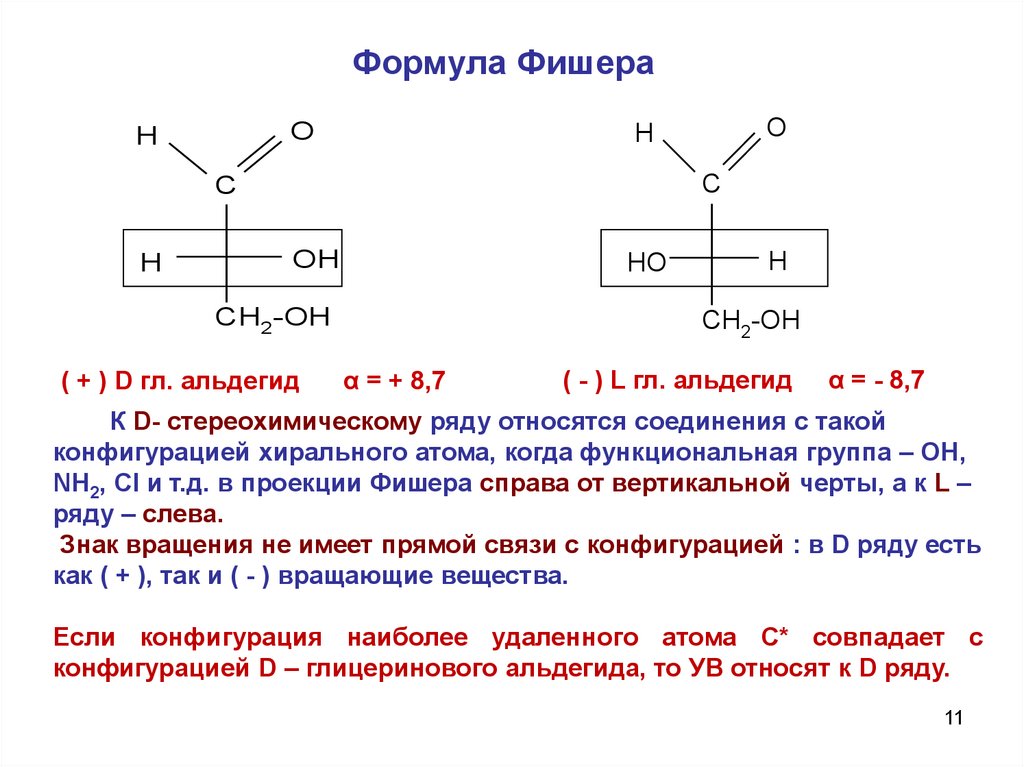
Формула ФишераO
H
C
C
H
O
H
OH
HO
CH2-OH
( + ) D гл. альдегид
H
CH2-OH
α = + 8,7
( - ) L гл. альдегид
α = - 8,7
К D- стереохимическому ряду относятся соединения с такой
конфигурацией хирального атома, когда функциональная группа – OH,
NH2, Cl и т.д. в проекции Фишера справа от вертикальной черты, а к L –
ряду – слева.
Знак вращения не имеет прямой связи с конфигурацией : в D ряду есть
как ( + ), так и ( - ) вращающие вещества.
Если конфигурация наиболее удаленного атома С* совпадает с
конфигурацией D – глицеринового альдегида, то УВ относят к D ряду.
11
12.
Дляизображения
строения
проекционные формулы Фишера.
мнсх.
используют
Фишер Эмиль Герман (18521919), немецкий химик-органик,
создатель научной школы,
основоположник химии природных
соединений.
1. Исследовал строение и синтезировал
ряд производных пурина: кофеин,
гуанин, аденин и др.
2. Ввел номенклатуру, создал
рациональную классификацию и
осуществил синтез многих углеводов.
3. Открыл специфичность действия
ферментов. Основополагающие
исследования по химии белков.
Нобелевская премия (1902).
12
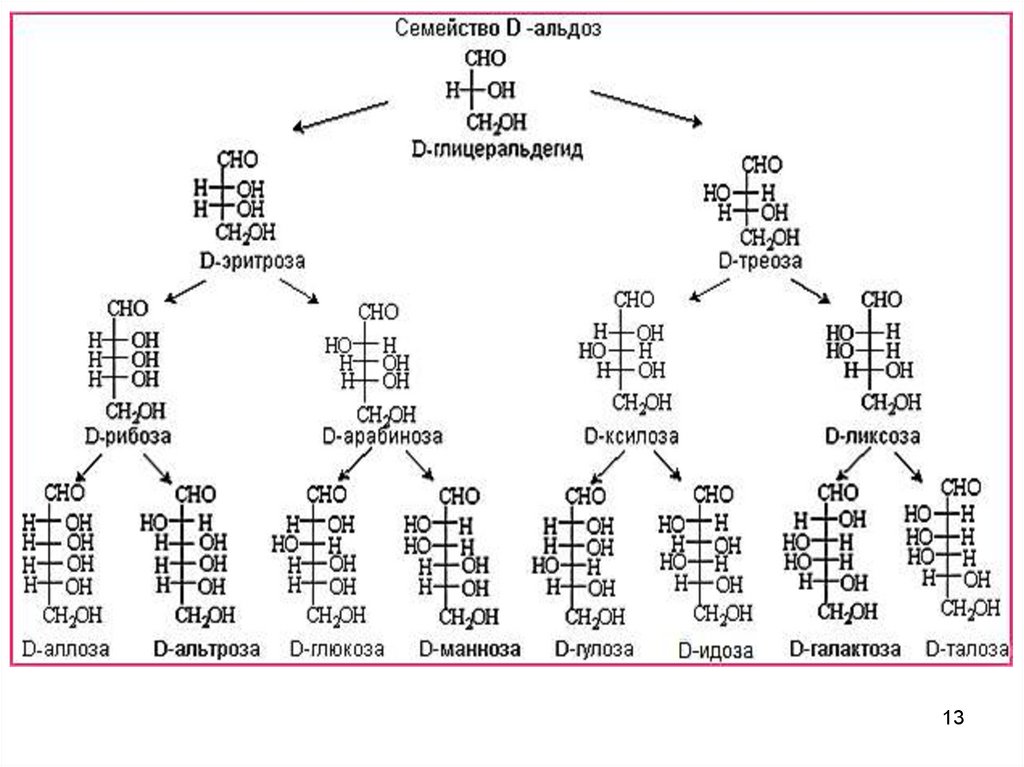
13.
1314.
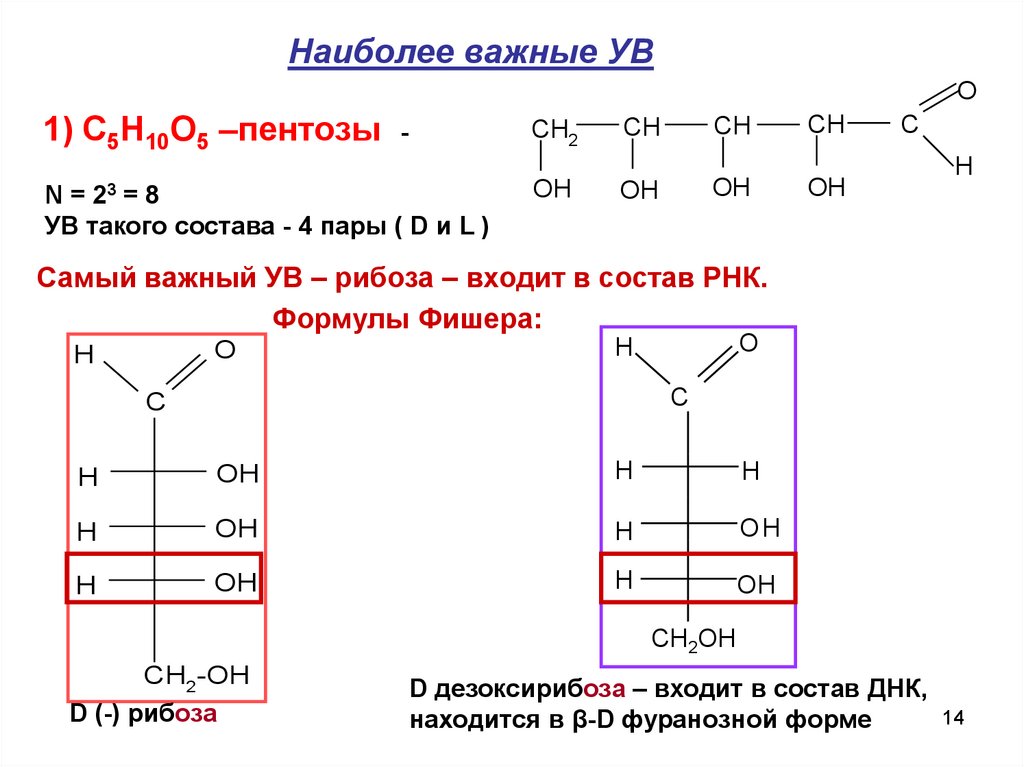
Наиболее важные УВO
1) C5H10O5 –пентозы -
CH2
N = 23 = 8
OH
CH
CH
CH
OH
OH
OH
C
H
УВ такого состава - 4 пары ( D и L )
Самый важный УВ – рибоза – входит в состав РНК.
Формулы Фишера:
O
H
O
H
C
C
H
OH
H
H
H
OH
H
OH
H
OH
H
ОH
СН2ОН
CH2-OH
D (-) рибоза
D дезоксирибоза – входит в состав ДНК,
14
находится в β-D фуранозной форме
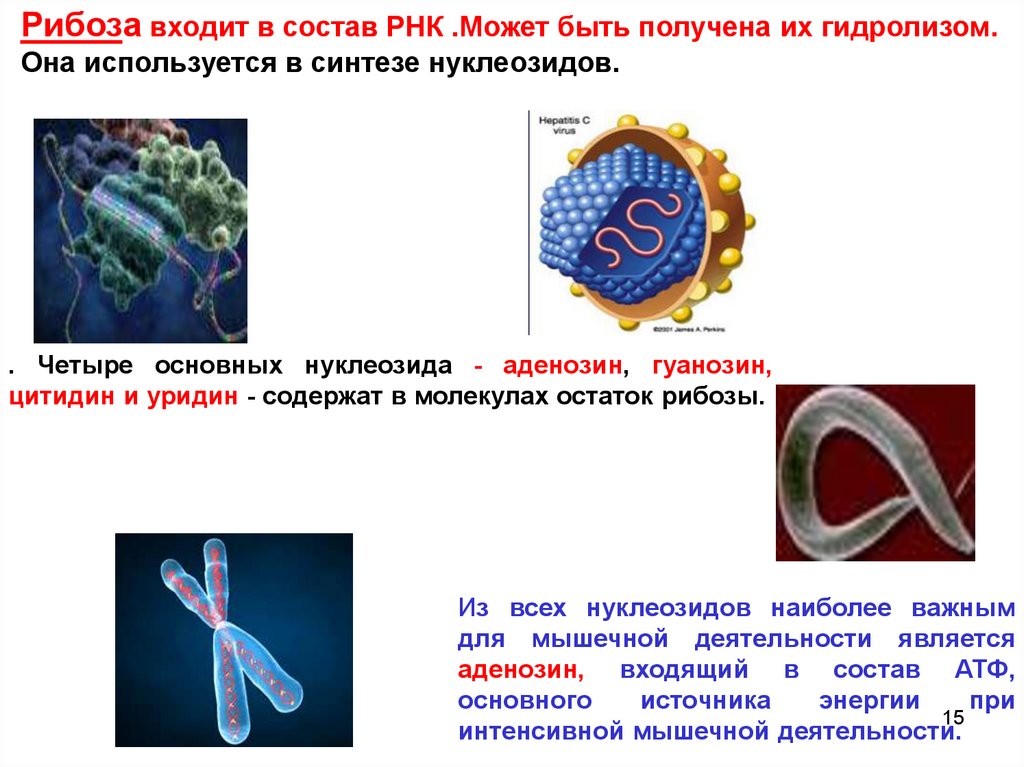
15.
Рибоза входит в состав РНК .Может быть получена их гидролизом.Она используется в синтезе нуклеозидов.
. Четыре основных нуклеозида - аденозин, гуанозин,
цитидин и уридин - содержат в молекулах остаток рибозы.
Из всех нуклеозидов наиболее важным
для мышечной деятельности является
аденозин, входящий в состав АТФ,
основного
источника
энергии
при
15
интенсивной мышечной деятельности.
16.
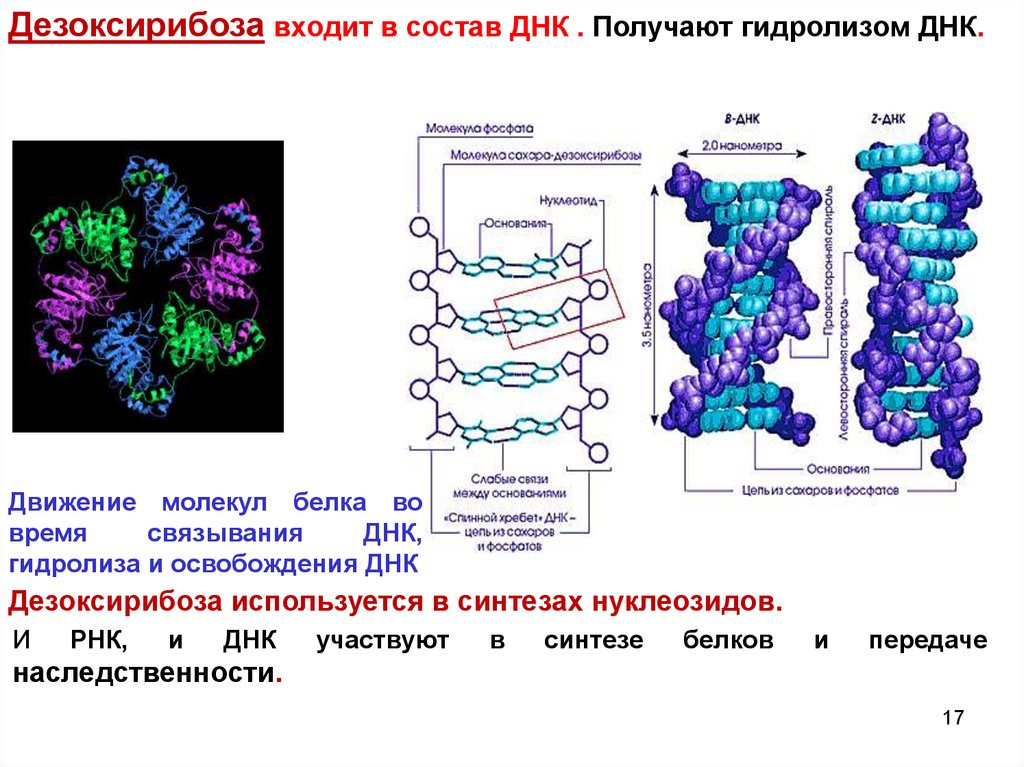
1617.
Дезоксирибоза входит в состав ДНК . Получают гидролизом ДНК.Движение молекул белка во
время
связывания
ДНК,
гидролиза и освобождения ДНК
Дезоксирибоза используется в синтезах нуклеозидов.
И
РНК,
и
ДНК
участвуют
в
синтезе
белков
и
передаче
наследственности.
17
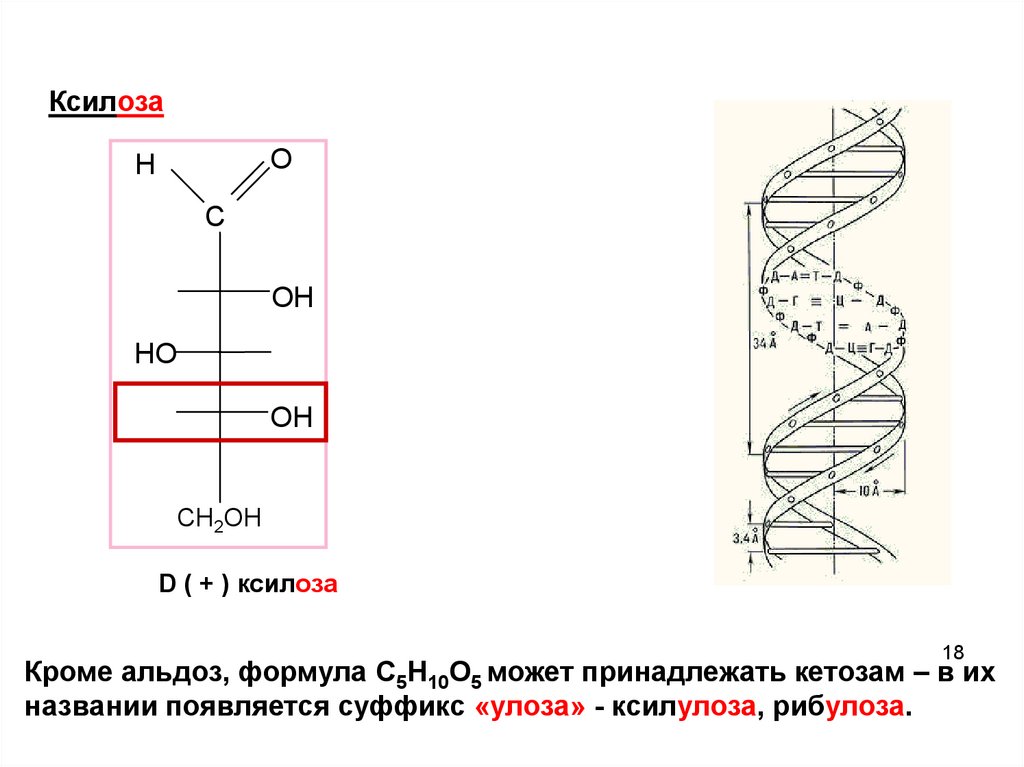
18.
КсилозаO
H
C
ОH
НO
OН
СН2ОН
D ( + ) ксилоза
18
Кроме альдоз, формула C5H10O5 может принадлежать кетозам – в их
названии появляется суффикс «улоза» - ксилулоза, рибулоза. 18
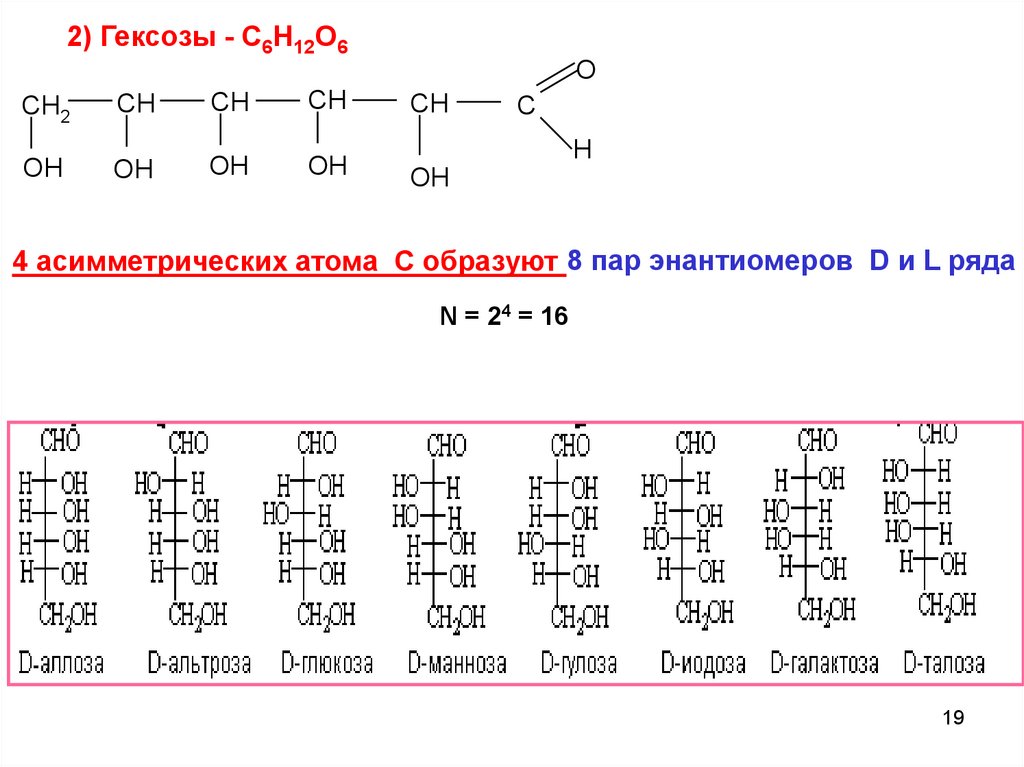
19.
2) Гексозы - C6H12O6O
CH2
CH
CH
CH
OH
OH
OH
OH
CH
C
H
OH
4 асимметрических атома С образуют 8 пар энантиомеров D и L ряда
N = 24 = 16
19
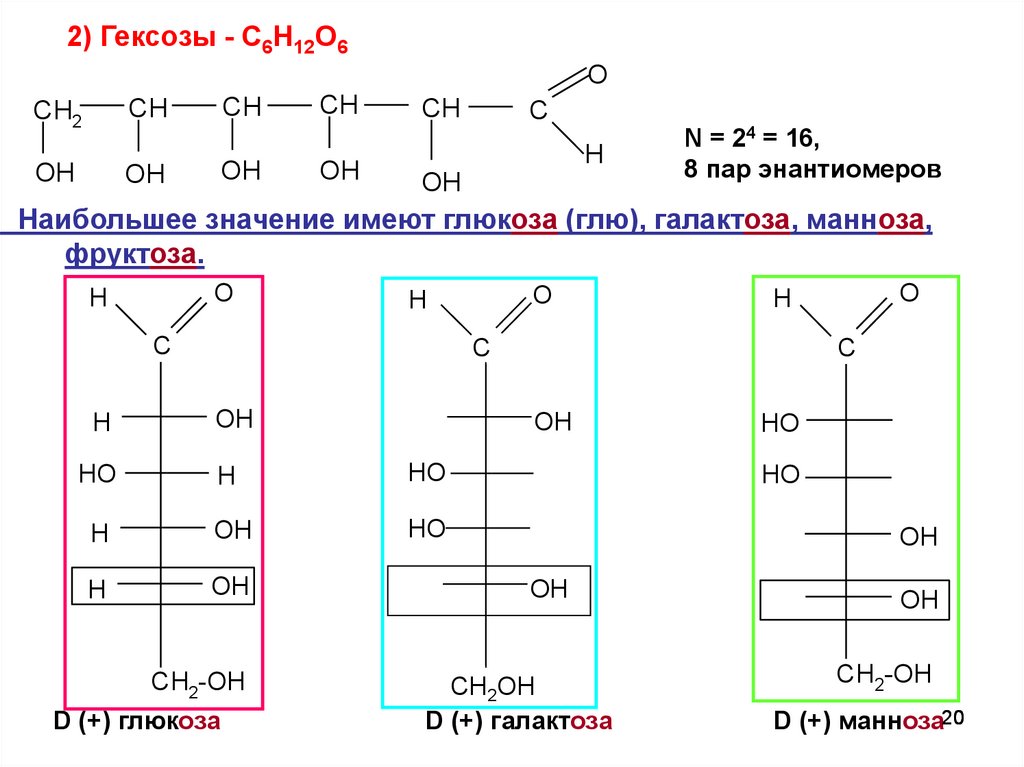
20.
2) Гексозы - C6H12O6O
CH
CH
CH2
OH
OH
OH
CH
OH
CH
C
H
OH
N = 24 = 16,
8 пар энантиомеров
Наибольшее значение имеют глюкоза (глю), галактоза, манноза,
фруктоза.
O
H
O
H
C
C
C
OН
H
OH
HO
H
HО
H
OH
НO
H
OH
CH2-OH
D (+) глюкоза
O
H
HO
HO
OH
OН
СН2ОН
D (+) галактоза
OH
CH2-OH
D (+) манноза20
21.
ГлюкозаГлюкоза - самый распространенный моносахарид
В свободном виде содержится
во фруктовых соках,
в качестве составной части входит в
молекулы дисахаридов (сахарозы,
мальтозы, лактозы, целлобиозы
и полисахаридов (крахмал,
гликогена, целлюлозы, декстринов
21
22.
ГлюкозаИспользуют глюкозу
в пищевой промышленности,
медицине , для синтеза глюконовой
и аскорбиновой кислот,
в качестве
восстановителя в
текстильной промышленности,
для получения этилового спирта.
22
23.
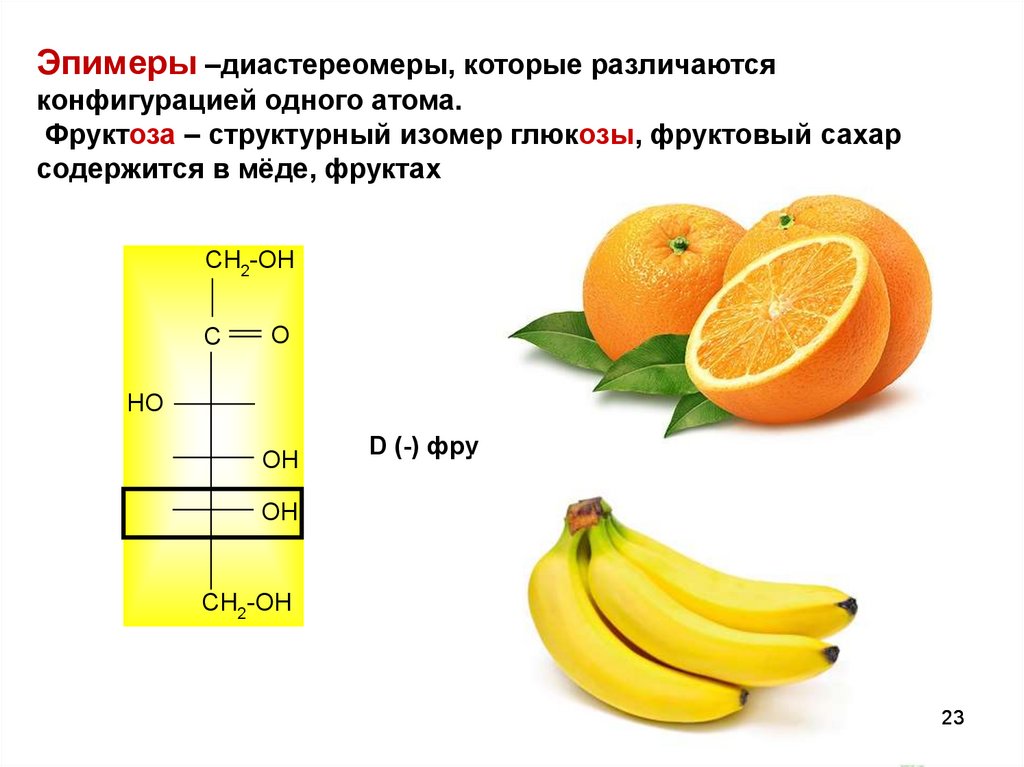
Эпимеры –диастереомеры, которые различаютсяконфигурацией одного атома.
Фруктоза – структурный изомер глюкозы, фруктовый сахар
содержится в мёде, фруктах
CH2-OH
C
O
HO
OH
D (-) фру
OH
CH2-OH
23
24.
ФруктозаФруктоза
фруктовый или плодовый, сахар, левулёза, β-Dфруктофураноза, бесцветные кристаллы сладкого вкуса (слаще
сахарозы в 1,5 раза и глюкозы в 3 раза), растворимы в воде.
Встречается в свободном виде во многих фруктах и плодах: в
яблоках, помидорах, пчелином мёде (около 50% ), входит в состав
олиго- и полисахаридов.
24
25.
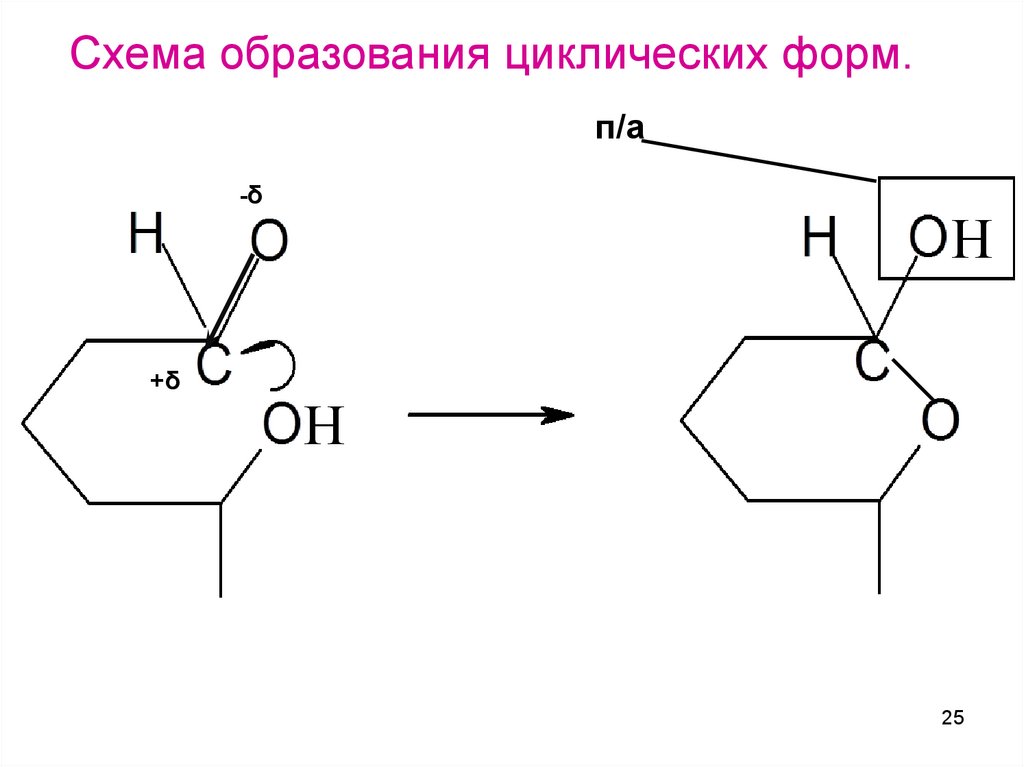
Схема образования циклических форм.п/а
-δ
+δ
Н
Н
25
26.
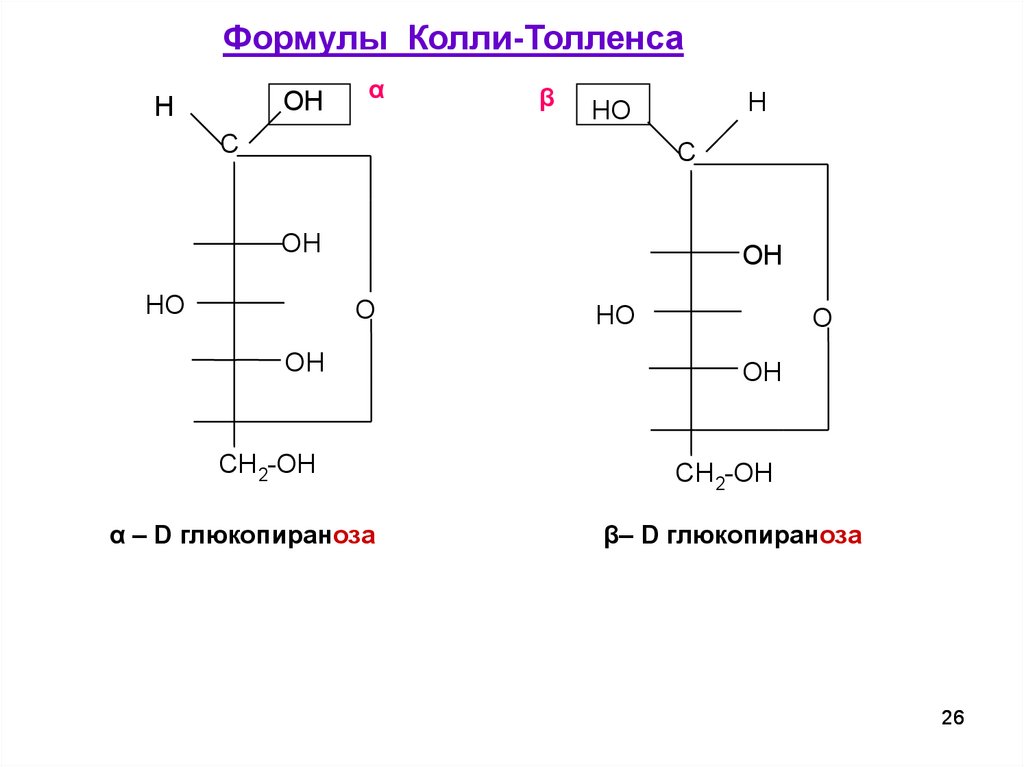
Формулы Колли-ТолленсаOH
H
α
β
H
HO
C
C
OH
HO
OH
O
HO
O
OH
OH
CH 2-OH
CH 2-OH
α – D глюкопираноза
β– D глюкопираноза
26
27.
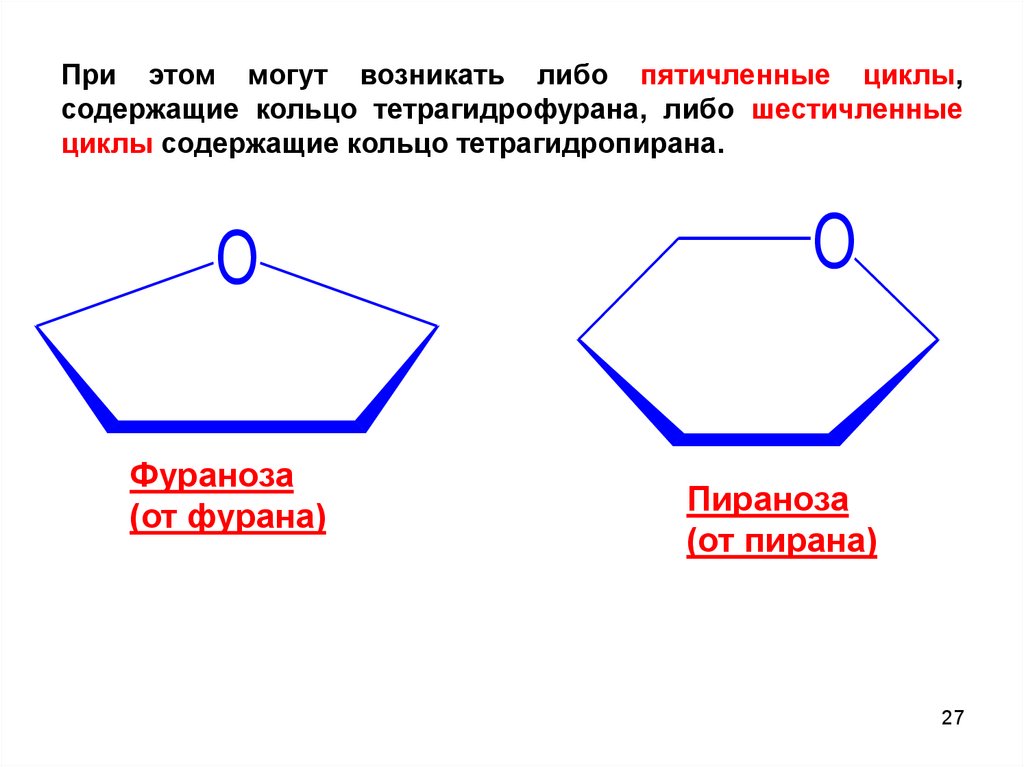
При этом могут возникать либо пятичленные циклы,содержащие кольцо тетрагидрофурана, либо шестичленные
циклы содержащие кольцо тетрагидропирана.
O
Фураноза
(от фурана)
O
Пираноза
(от пирана)
27
28.
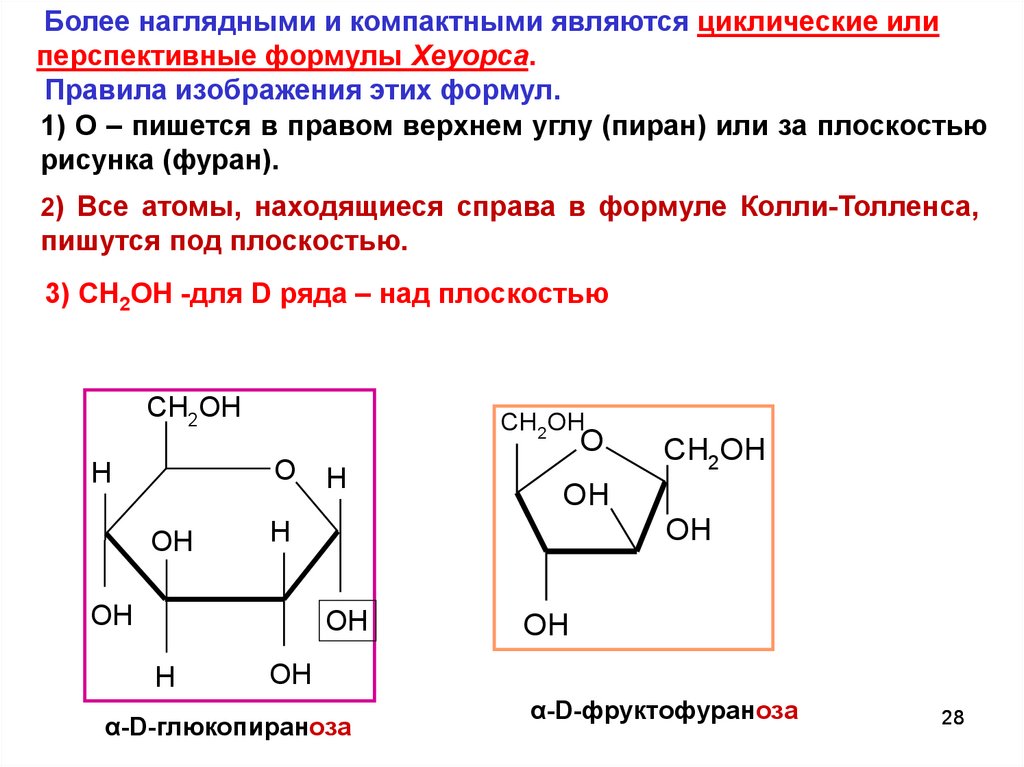
Более наглядными и компактными являются циклические илиперспективные формулы Хеуорса.
Правила изображения этих формул.
1) О – пишется в правом верхнем углу (пиран) или за плоскостью
рисунка (фуран).
2) Все атомы, находящиеся справа в формуле Колли-Толленса,
пишутся под плоскостью.
3) CH2OH -для D ряда – над плоскостью
CH2OH
CH2OH
O
O
H
OH
H
OH
OH
H
OH
H
OH
CH2OH
OH
OH
α-D-глюкопираноза
α-D-фруктофураноза
28
29.
Таутомерия. МутаротацияДоказательством существования циклической формы может
быть явление мутаротации.
В твердом состоянии моносахариды имеют циклическое
строение.
При
растворении
моносахаридов
первоначальное
значение [α] меняется, со временем достигнув определенного
значения, которое остается постоянным.
Мутаротация – изменение удельного вращения растворов УВ
во времени.
Сахариметр-поляриметр
СУ-5
предназначен
для
измерения
концентрации сахарозы в растворах
по
углу
вращения
плоскости
поляризации
29
30.
Таутомерия. МутаротацияПри растворении моносахарид из одной циклической формы
может перейти в другую, но только через открытую.
β-D- глюкопираноза
D – глю
α = + 19°
равнов. α = 52.5°
α-D- глюкопираноза
α = + 112°
Автоматический цифровой поляриметр
Сосуществование в динамическом равновесии двух и более
изомерных форм называется таутомерией.
Таутомерия УВ - окси-оксо, цикло-оксо, или кольчатоцепная.
30
31.
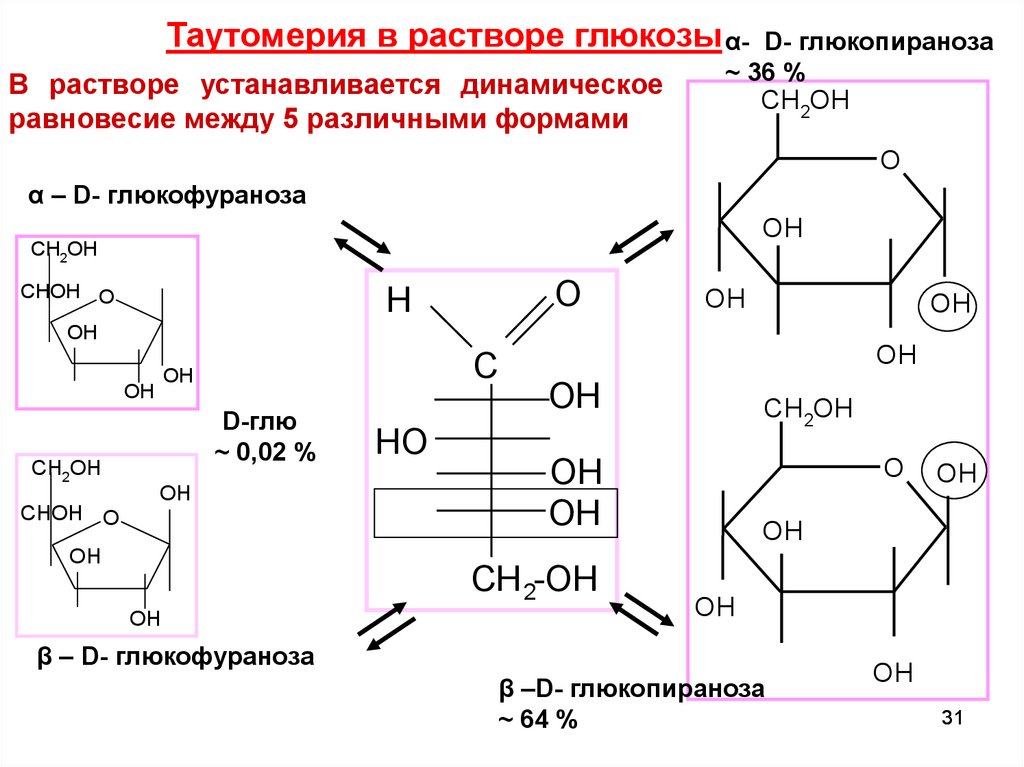
Таутомерия в растворе глюкозы α- D- глюкопиранозаВ растворе устанавливается динамическое
равновесие между 5 различными формами
~ 36 %
CH 2OH
O
α – D- глюкофураноза
OH
CH2OH
CHOH O
O
H
OH
OH
OH
C
OH
OH
D-глю
~ 0,02 %
CH2OH
OH
CHOH O
OH
HO
OH
OH
O
OH
OH
CH 2-OH
OH
CH 2OH
OH
OH
OH
β – D- глюкофураноза
β –D- глюкопираноза
~ 64 %
OH
31
32.
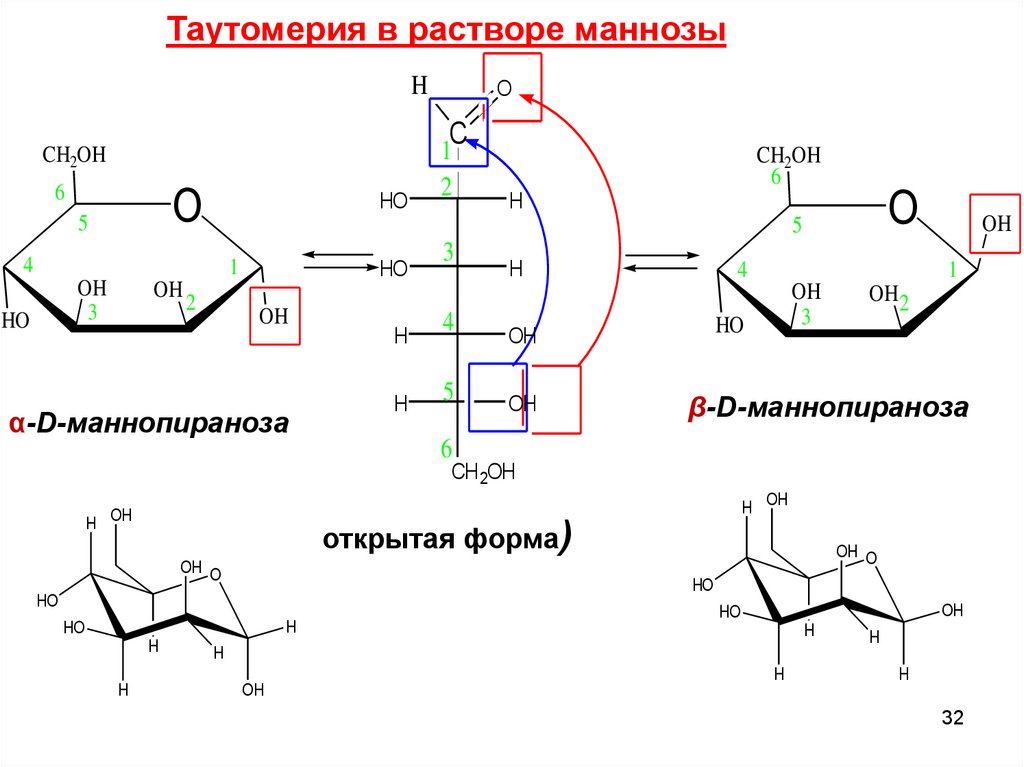
Таутомерия в растворе маннозыH
C
CH2OH
6
O
5
HO
1
OH
3
OH
1
2
CH2OH
6
O
H
5
4
HO
O
2
HO
OH
α-D-маннопираноза
H
H
3
4
5
H
4
OH
1
OH
3
HO
OH
OH
OH 2
β-D-маннопираноза
6
CH 2OH
H OH
H OH
открытая форма)
OH O
HO
HO
H
HO
H
OH O
OH
HO
H
H
H
H
H
H
OH
32
33.
МаннозаМанноза – компонент
многих
полисахаридов
и
смешанных
биополимеров
растительного,
животного
и
бактериального происхождения,
имеет сладкий вкус.
В природе встречается только Dформа. Существует в виде двух
аномеров: α- и β- формы.
В свободном виде обнаружена в
плодах
многих
цитрусовых,
анакардиевых и коринокарповых
33
34.
МаннозаПревращения маннозы в организме происходят с помощью
активированной
формы
маннозы
–
гаунозиндифосфатманнозы
(ГДФМ),
которая
служит
донором остатка маннозы при биосинтезе маннанов и
других биополимеров.
34
35.
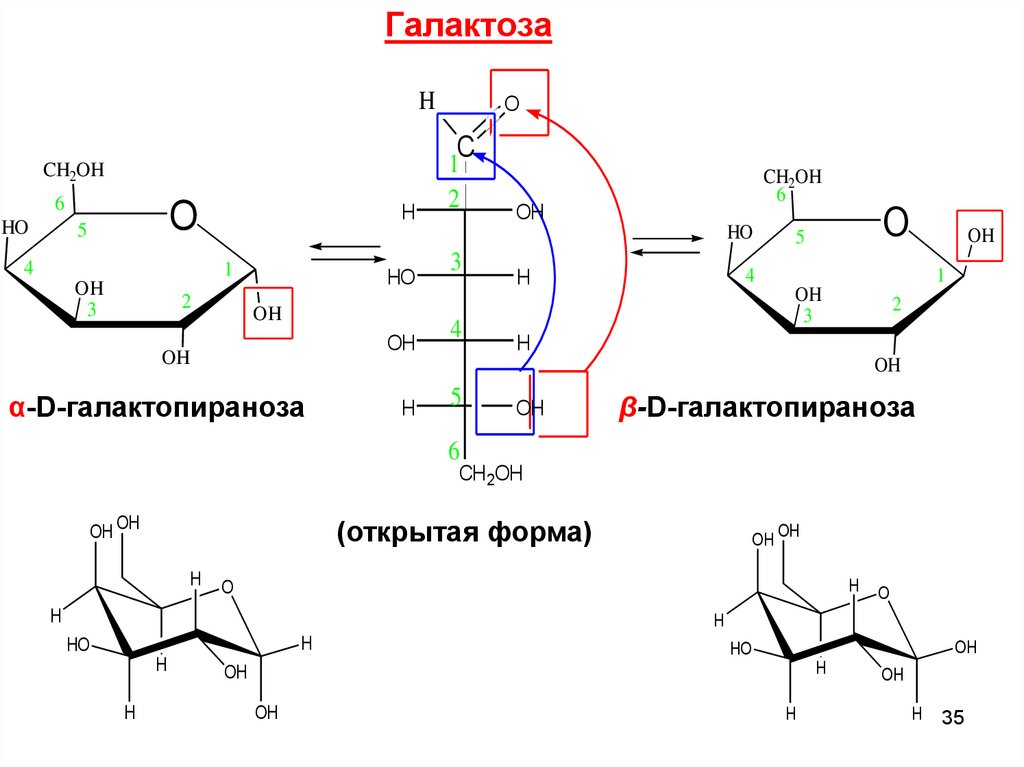
ГалактозаH
C
CH2OH
6
HO
O
O
5
4
H
CH2OH
6
OH
HO
1
OH
3
1
2
2
HO
OH
OH
OH
3
4
O
5
OH
4
H
1
OH
3
2
H
OH
α-D-галактопираноза
H
5
OH
β-D-галактопираноза
6
CH 2OH
(открытая форма)
OH OH
H
OH OH
H
O
H
O
H
H
HO
H
H
OH
HO
H
OH
OH
H
OH
H
35
36.
ГалактозаВстречается в природе в свободном
виде,
в
виде
гликозидов,
дисахаридов
(лактозы),
полисахаридов
(агар-агара,).
Галактоза
входит
в
состав
стероидных
алкалоидов,
выделенных из растений семейства
пасленовых, например саланина
содержащегося в картофеле.
Агар-агар
36
37.
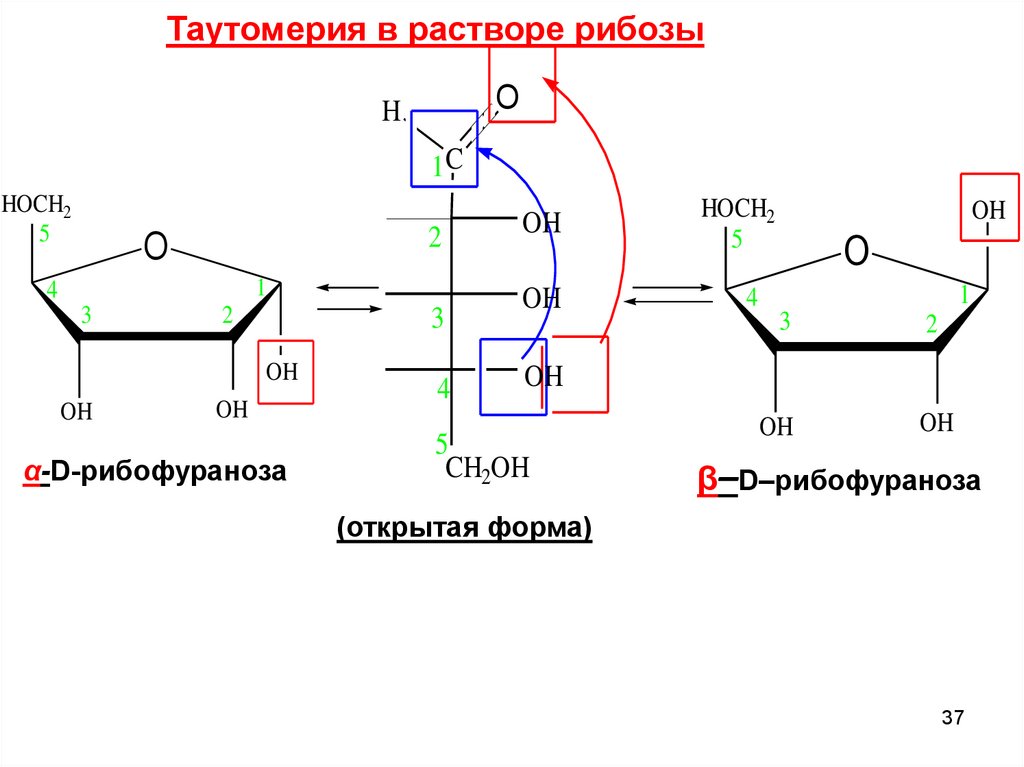
Таутомерия в растворе рибозыO
H
1C
HOCH2
5
2
O
1
4
3
2
3
OH
OH
OH
α-D-рибофураноза
4
OH
HOCH2
5
OH
4
OH
O
1
3
2
OH
OH
OH
5
CH2OH
β–D–рибофураноза
(открытая форма)
37
38.
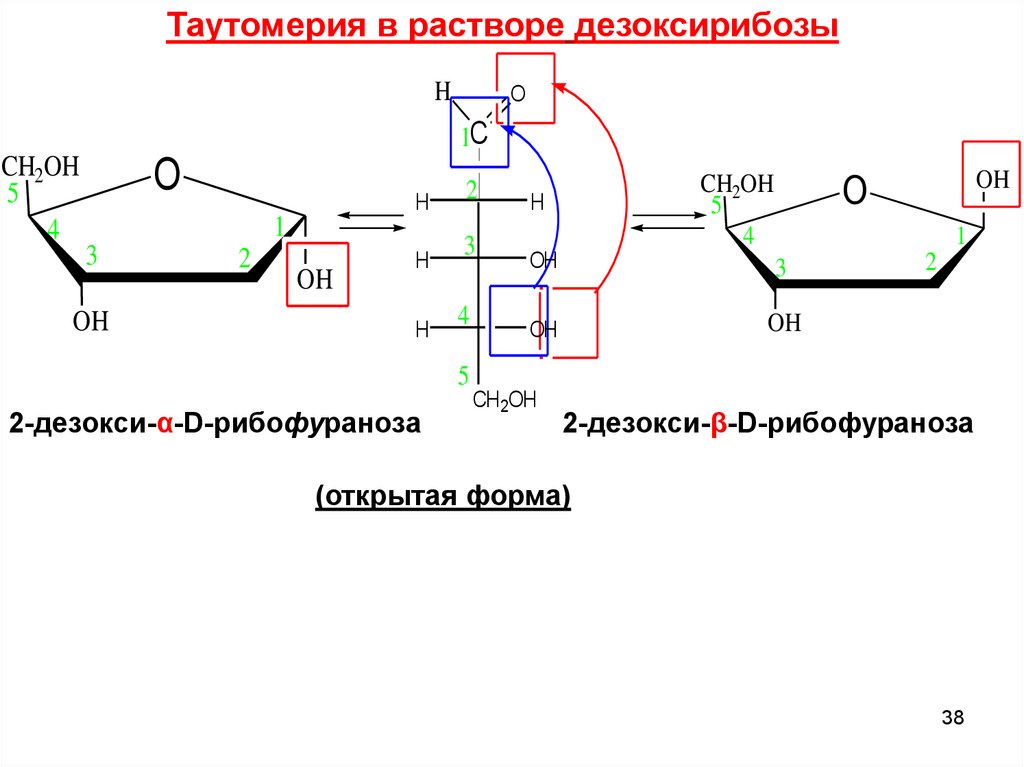
Таутомерия в растворе дезоксирибозыH
O
1C
CH2OH
5
4
O
H
1
3
OH
2
OH
H
H
2
3
4
5
2-дезокси-α-D-рибофураноза
CH2OH
5
4
H
1
OH
3
OH
OH
CH 2OH
OH
O
2
2-дезокси-β-D-рибофураноза
(открытая форма)
38
39.
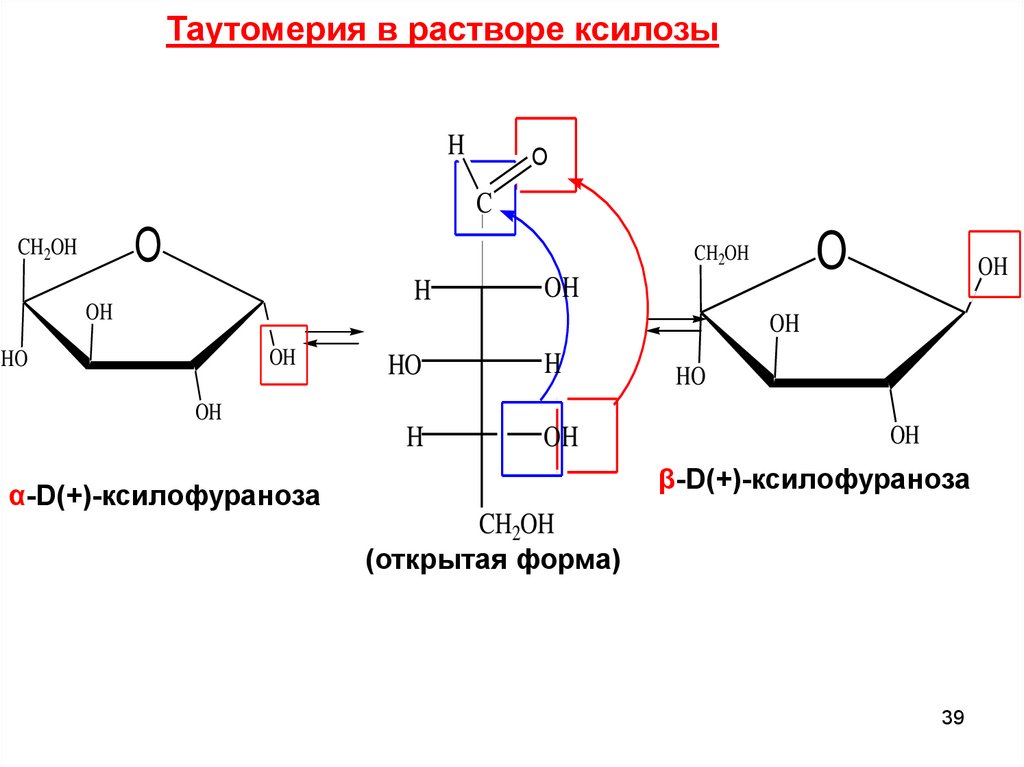
Таутомерия в растворе ксилозыH
O
C
O
CH2OH
O
CH2OH
H
OH
OH
OH
OH
OH
HO
HO
H
H
OH
HO
OH
OH
β-D(+)-ксилофураноза
α-D(+)-ксилофураноза
CH2OH
(открытая форма)
39
40.
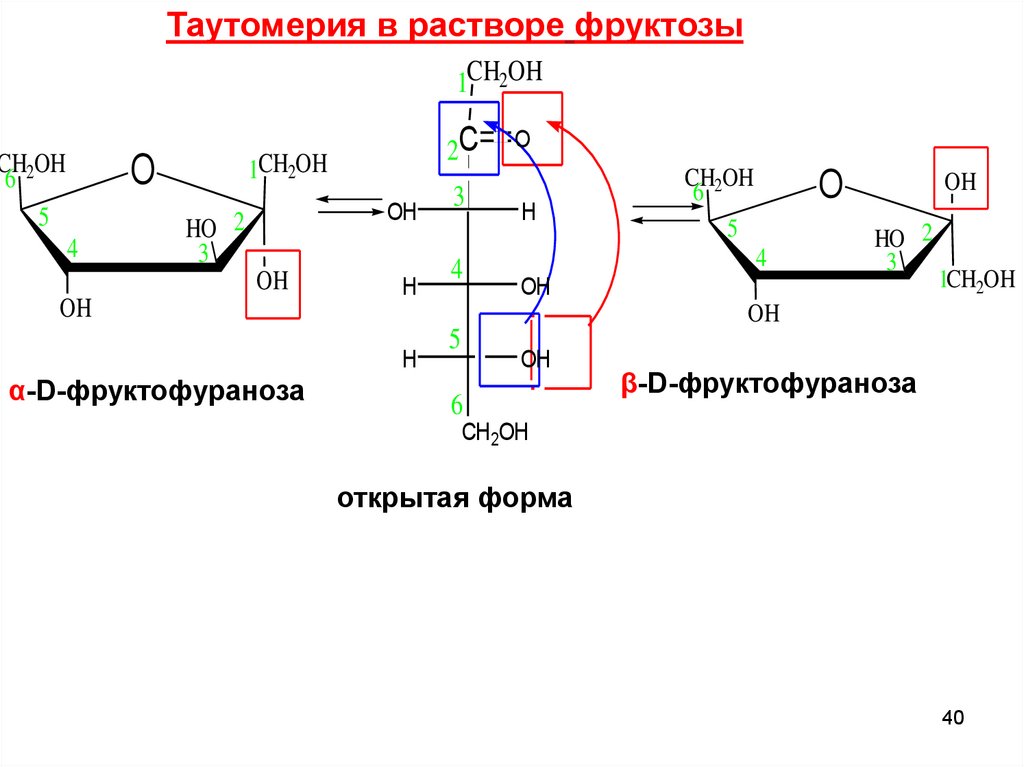
Таутомерия в растворе фруктозы1CH2OH
CH2OH
6
5
1CH2OH
O
4
2C
OH
HO 2
3
OH
OH
H
4
H
CH2OH
6
5
O
4
OH
HO 2
3
OH
1CH2OH
OH
H
α-D-фруктофураноза
3
O
5
OH
6
β-D-фруктофураноза
CH2OH
открытая форма
40
41.
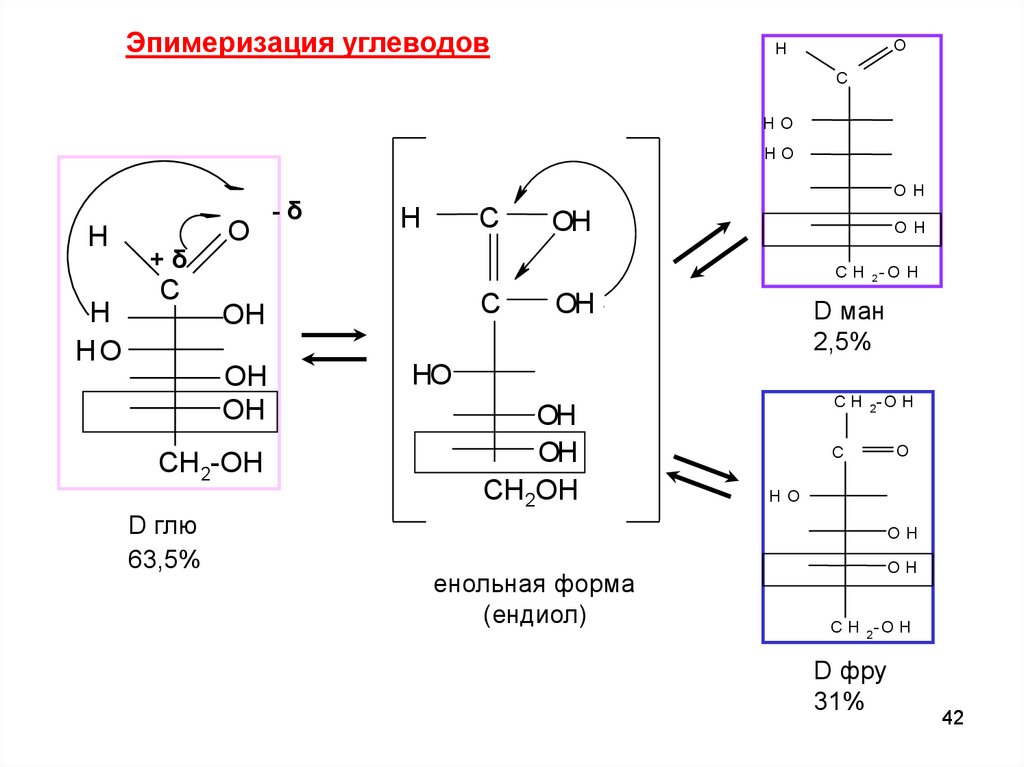
Эпимеризация углеводовЭПИМЕРИЗАЦИЯ - изменение конфигурации одного
хиральных центров молекулы на противоположную
из
Эпимеры –диастереомеры,отличающиеся конфигурацией только
одного асимметрического атома С.
В организме эпимеризация происходит ферментативно, in vitro- в
щелочной среде.
В слабощелочном растворе D-глюкоза находится в равновесии с
кетогексозой, D-фруктозой, и альдогексозой, D-маннозой.
Глюкоза и манноза различаются конфигурацией при С-2
Связана с открытой формой УВ .
Причина – в кислотном характере Н при α.С атоме.
Dфру
Dглю
Dман
41
42.
Эпимеризация углеводовO
H
C
H O
HO
H
H
HO
+δ
C
O
H
C
OH
O H
C H 2-O H
C
OH
OH
OH
CH 2-OH
D глю
63,5%
-δ
O H
OH
D ман
2,5%
HO
OH
OH
CH2OH
C H 2- O H
C
O
H O
OH
енольная форма
(ендиол)
OH
C H 2- O H
D фру
31%
42
43.
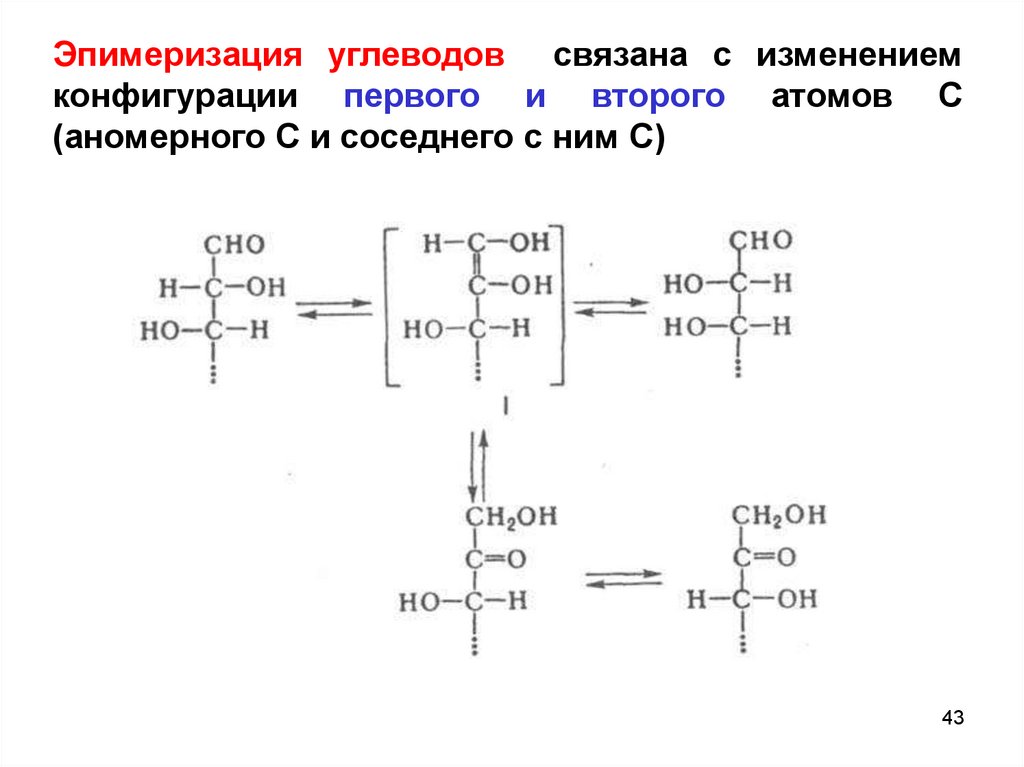
Эпимеризация углеводов связана с изменениемконфигурации первого и второго атомов С
(аномерного С и соседнего с ним С)
43
44.
Химические свойства УВОбщие реакции для всех углеводордов
на ОН- спирт
на п/а ОН
на > C = O
ОВР
Специфические реакции (различают пентозы и гексозы)
брожение
действ. кт. конц.
реакция Селиванова
44
45.
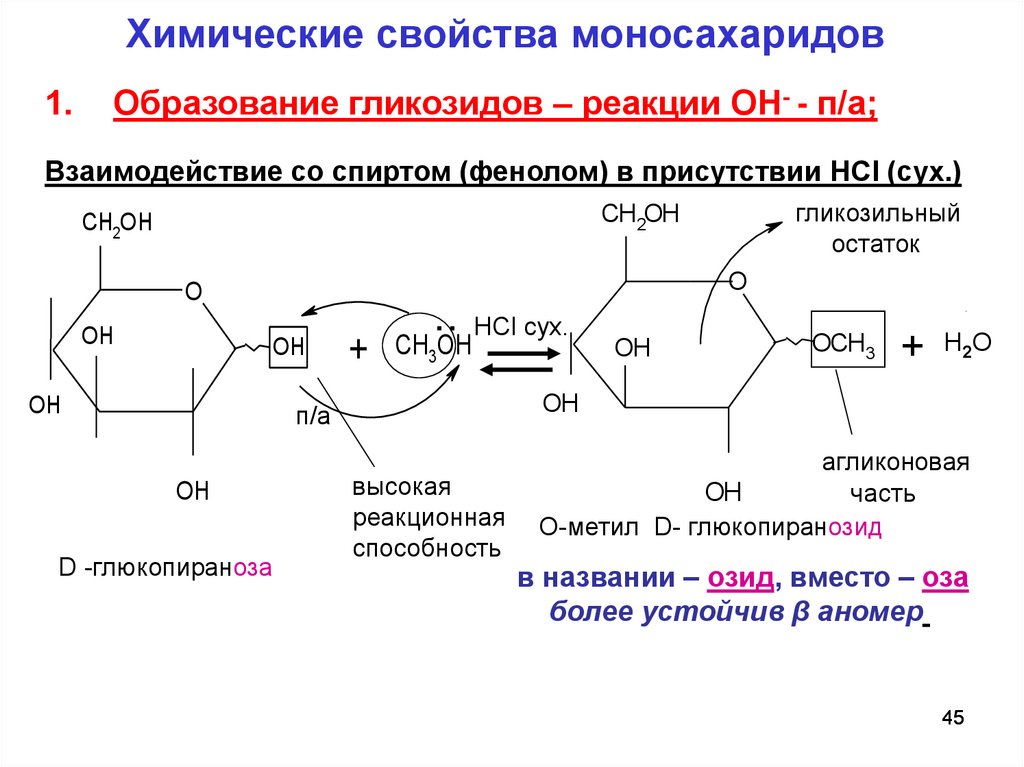
Химические свойства моносахаридов1.
Образование гликозидов – реакции ОН- - п/а;
Взаимодействие со спиртом (фенолом) в присутствии HCl (сух.)
гликозильный
остаток
CH2OH
CH2OH
O
O
OH
OH
OH
.. HCl сух.
+ CH3OH
D -глюкопираноза
OCH3
+ Н2О
OH
п/а
OH
OH
высокая
реакционная
способность
агликоновая
OH
часть
О-метил D- глюкопиранозид
в названии – озид, вместо – оза
более устойчив β аномер
45
46.
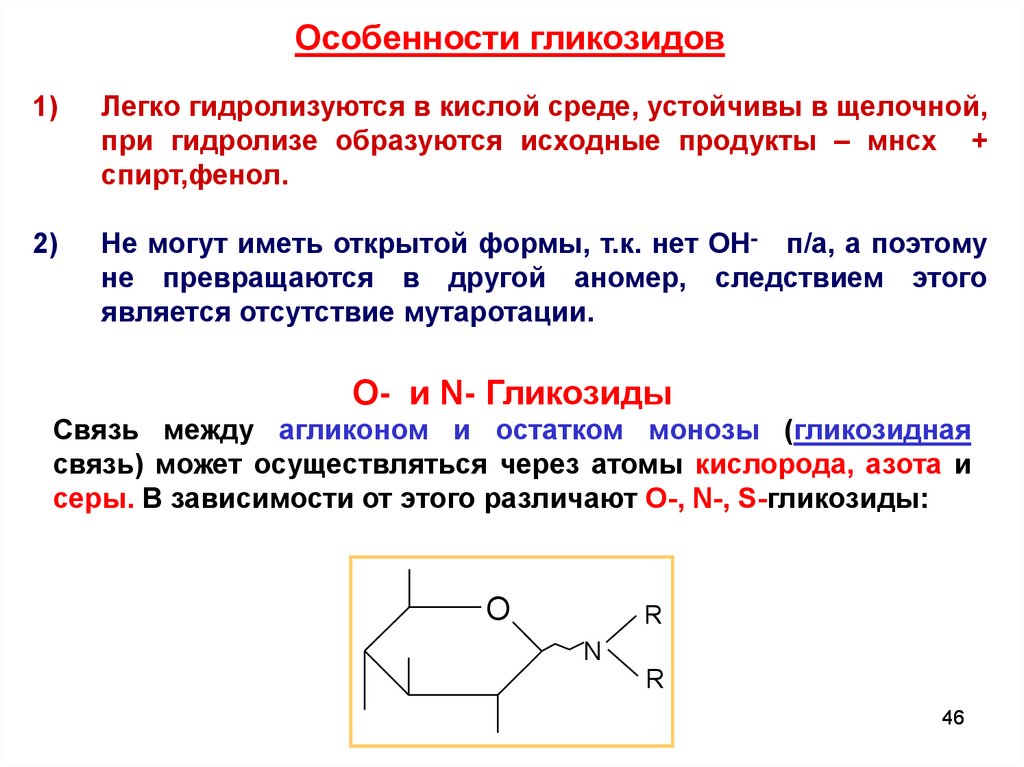
Особенности гликозидов1)
Легко гидролизуются в кислой среде, устойчивы в щелочной,
при гидролизе образуются исходные продукты – мнсх +
спирт,фенол.
2)
Не могут иметь открытой формы, т.к. нет ОН- п/а, а поэтому
не превращаются в другой аномер, следствием этого
является отсутствие мутаротации.
O- и N- Гликозиды
Связь между агликоном и остатком монозы (гликозидная
связь) может осуществляться через атомы кислорода, азота и
серы. В зависимости от этого различают O-, N-, S-гликозиды:
O
R
N
R
46
47.
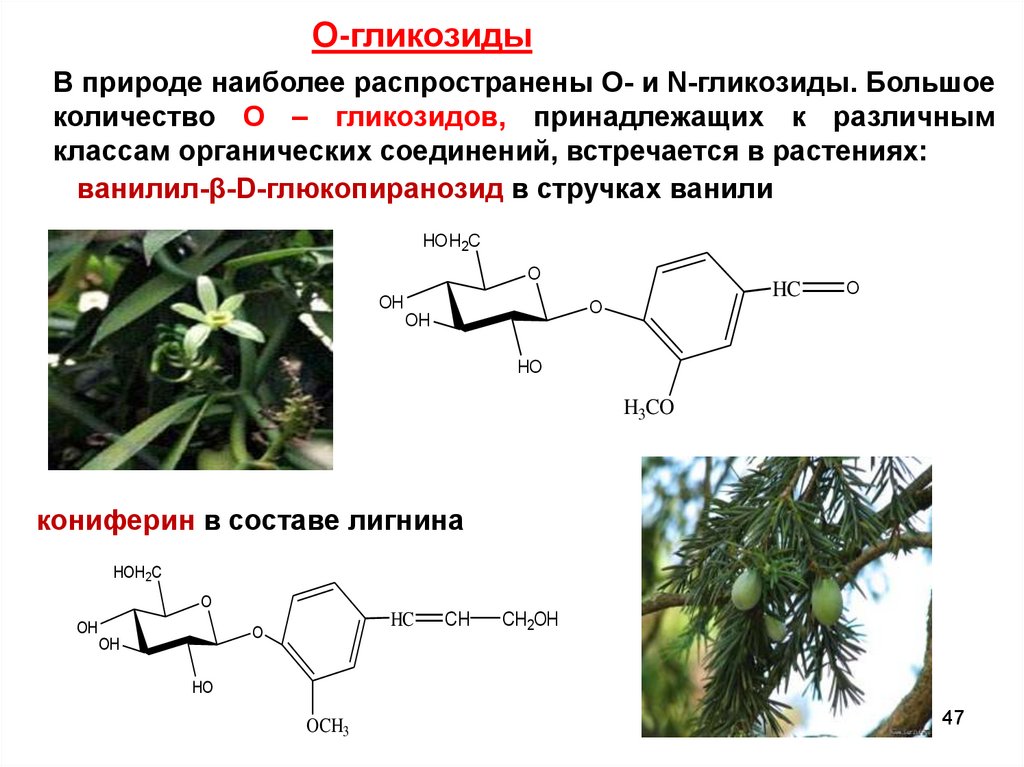
О-гликозидыВ природе наиболее распространены O- и N-гликозиды. Большое
количество О – гликозидов, принадлежащих к различным
классам органических соединений, встречается в растениях:
ванилил-β-D-глюкопиранозид в стручках ванили
HOH2C
O
OH
HC
O
OH
O
HO
H3CO
кониферин в составе лигнина
HOH2C
O
OH
HC
O
OH
CH
CH2OH
HO
OCH3
47
48.
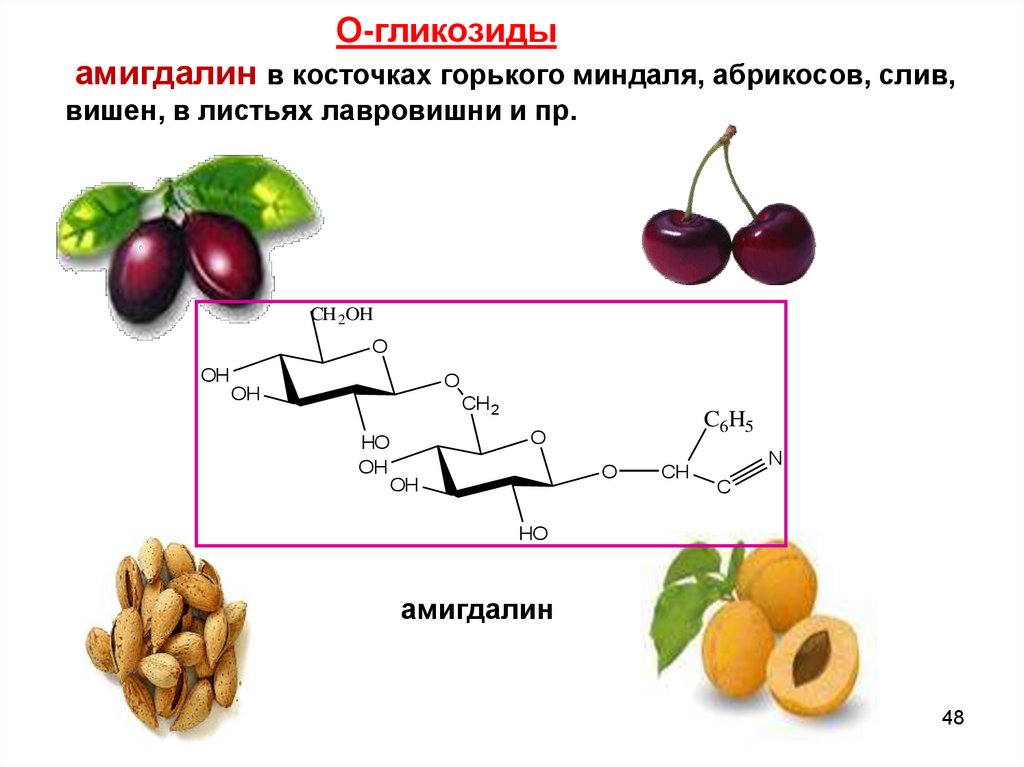
О-гликозидыамигдалин в косточках горького миндаля, абрикосов, слив,
вишен, в листьях лавровишни и пр.
CH 2OH
O
OH
O
OH
CH 2
C6H5
O
HO
OH
O
OH
CH
N
C
HO
амигдалин
48
49.
О-гликозидыВитамины К, Р – это О -
гликозиды, некоторые
лекарственные препараты (стрептомицин), антибиотики,
сердечные гликозиды, извлекаемые из ландыша наперстянки.
49
50.
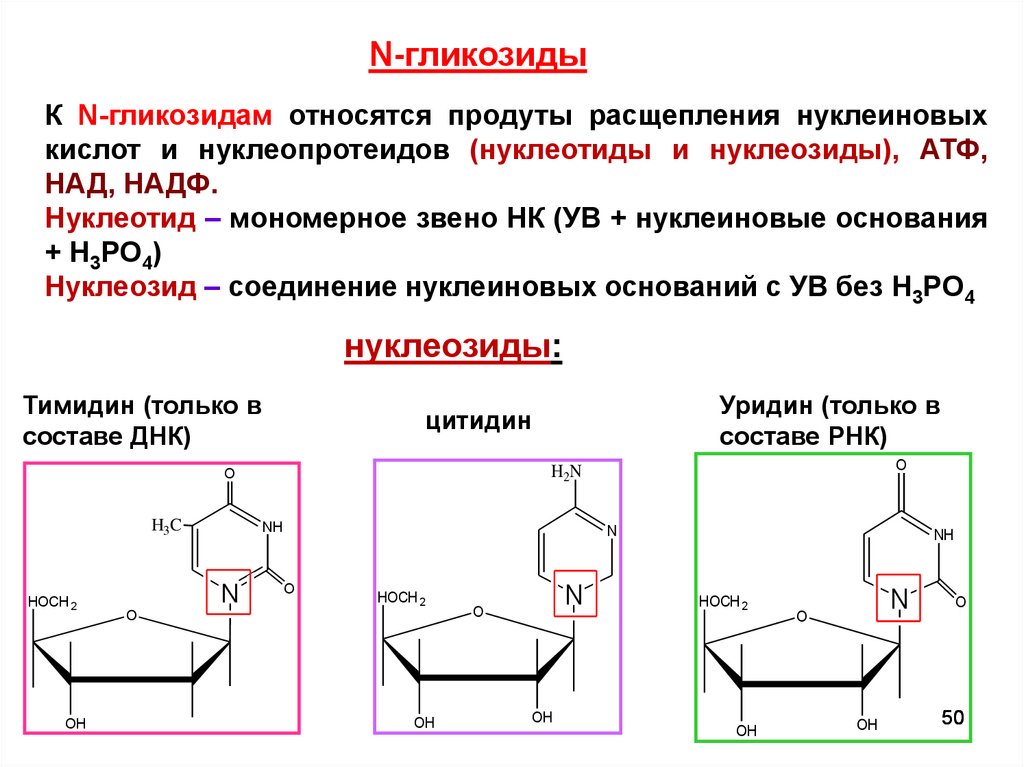
N-гликозидыК N-гликозидам относятся продуты расщепления нуклеиновых
кислот и нуклеопротеидов (нуклеотиды и нуклеозиды), АТФ,
НАД, НАДФ.
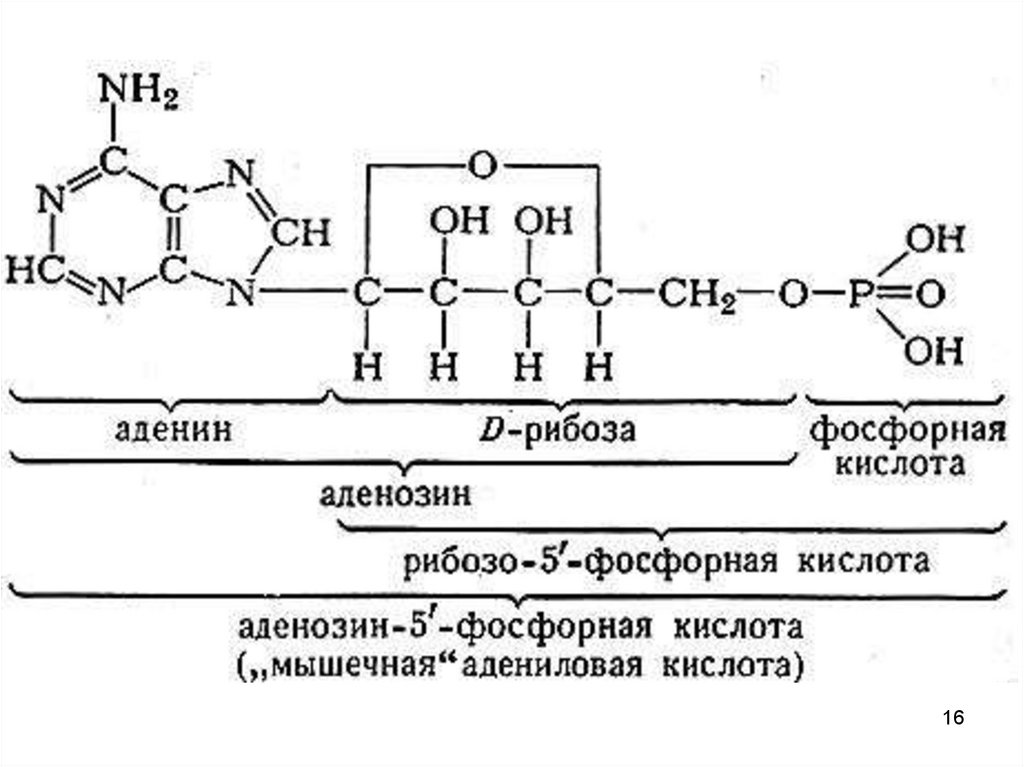
Нуклеотид – мономерное звено НК (УВ + нуклеиновые основания
+ H3PO4)
Нуклеозид – соединение нуклеиновых оснований с УВ без H3PO4
нуклеозиды:
Тимидин (только в
составе ДНК)
HOCH 2
OH
NH
N
O
H2N
O
H3C
Уридин (только в
составе РНК)
цитидин
N
O
HOCH 2
O
OH
N
O
OH
NH
HOCH 2
OH
N
O
OH
O
50
51.
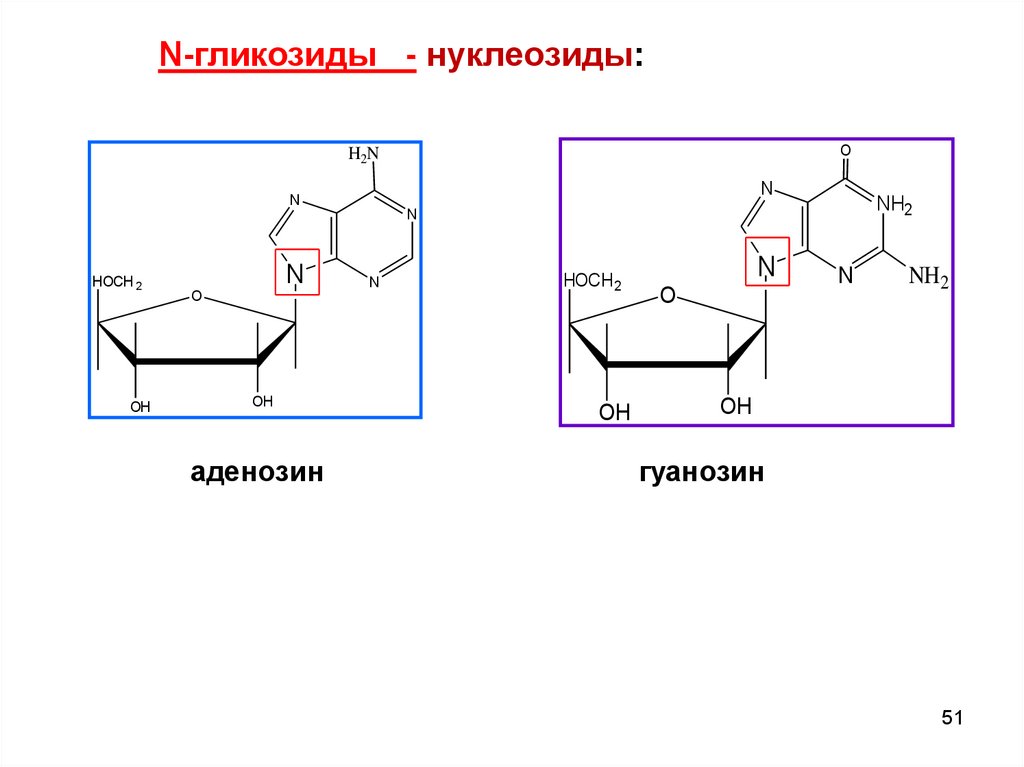
N-гликозиды - нуклеозиды:O
H2N
N
N
NH2
N
HOCH 2
OH
N
O
OH
аденозин
N
HOCH2
OH
N
O
N
NH2
OH
гуанозин
51
52.
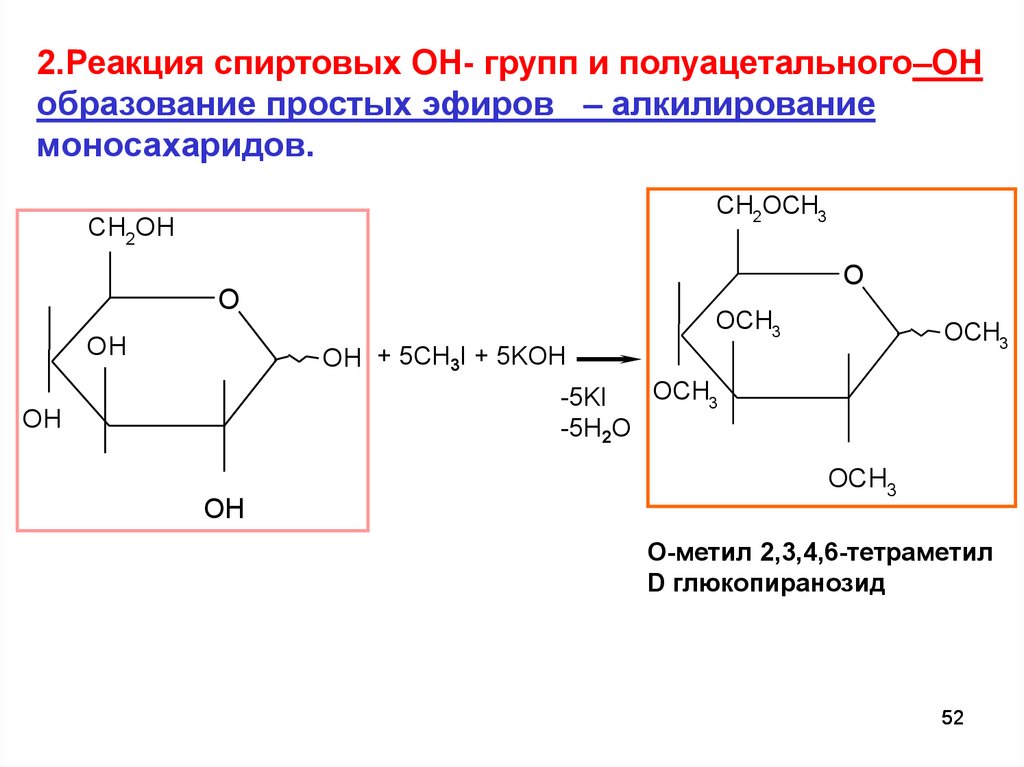
2.Реакция спиртовых ОН- групп и полуацетального–ОНобразование простых эфиров – алкилирование
моносахаридов.
CH2OCH3
CH2OH
O
OH
O
OCH3
OCH3
OH + 5CH3I + 5KOH
OCH3
-5KI
-5H2O
OH
OH
OCH3
O-метил 2,3,4,6-тетраметил
D глюкопиранозид
52
53.
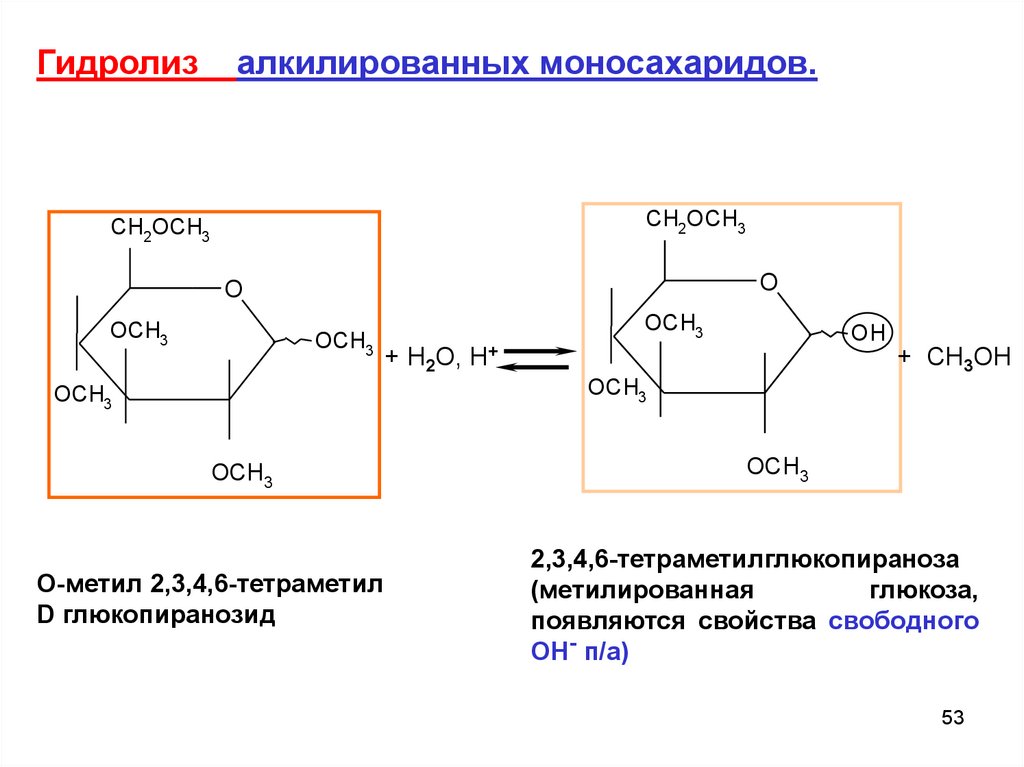
Гидролизалкилированных моносахаридов.
CH2OCH3
CH2OCH3
O
O
OCH3
OCH3
OCH3
OH
+ H2O, H+
+ CH3OH
OCH3
OCH3
OCH3
O-метил 2,3,4,6-тетраметил
D глюкопиранозид
OCH3
2,3,4,6-тетраметилглюкопираноза
(метилированная
глюкоза,
появляются свойства свободного
ОН- п/а)
53
54.
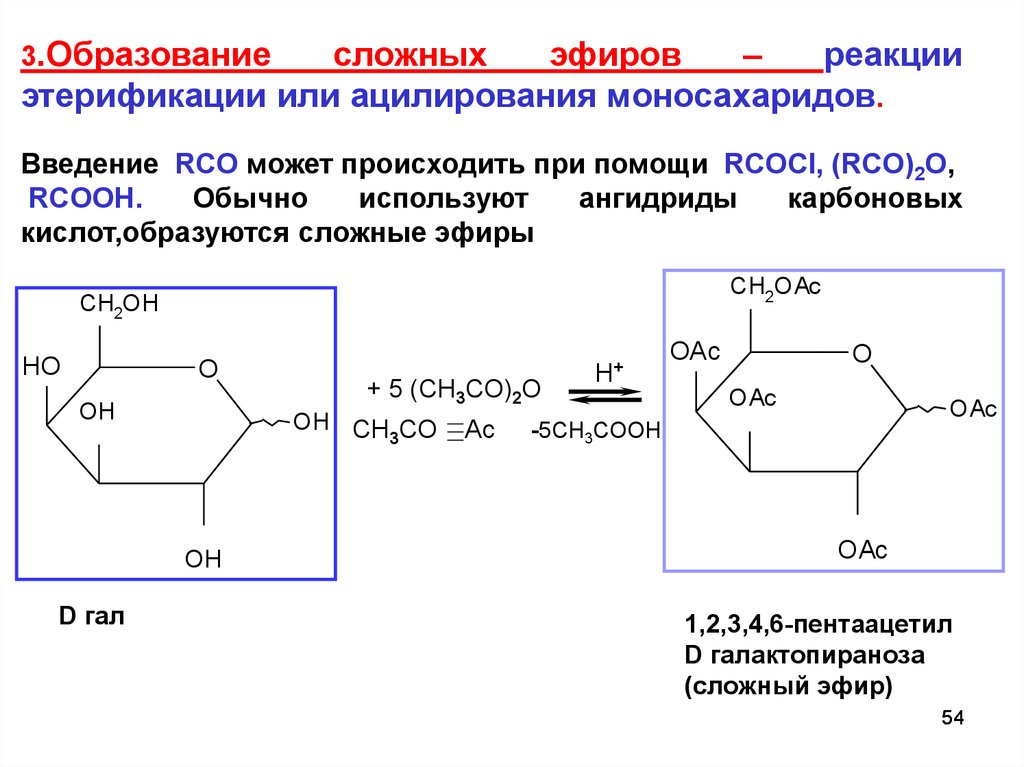
сложныхэфиров
–
реакции
этерификации или ацилирования моносахаридов.
3.Образование
Введение RCO может происходить при помощи RCOCI, (RCO)2О,
RCOOH.
Обычно
используют
ангидриды
карбоновых
кислот,образуются сложные эфиры
CH2OAc
CH2OH
HO
O
OH
OH CH CO
3
OH
D гал
+ 5 (CH3CO)2O
Ac
H+
OAc
O
OAc
OAc
-5CH3COOH
OAc
1,2,3,4,6-пентаацетил
D галактопираноза
(сложный эфир)
54
55.
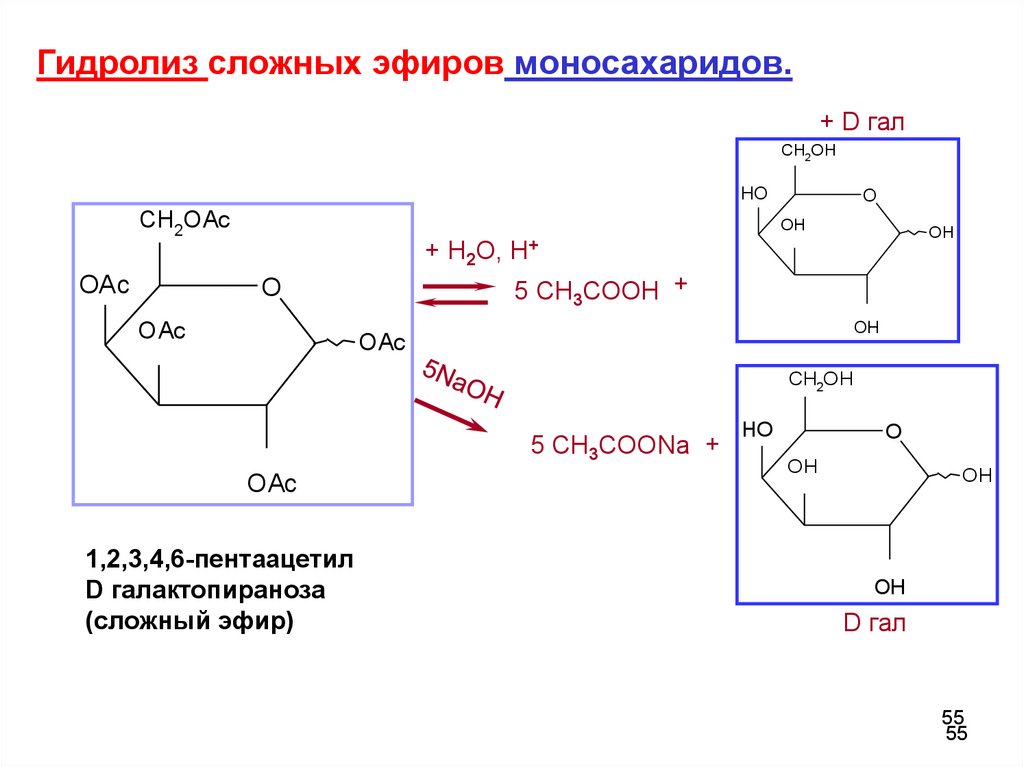
Гидролиз сложных эфиров моносахаридов.+ D гал
CH2OH
HO
CH2OAc
O
OH
OH
+ H2O, H+
OAc
5 CH3COOH +
O
OAc
OH
OAc
CH2OH
5 CH3COONa +
OAc
1,2,3,4,6-пентаацетил
D галактопираноза
(сложный эфир)
HO
O
OH
OH
OH
D гал
55
55
56.
3.Образование сложных эфиров- фосфатовБольшое значение имеют эфиры H3PO4 – фосфаты. Это наиболее метаболически активные формы моносахаридов,
содержатся во всех растительных и животных организмах.
Фосфаты D глюкозы и D фруктозы).
Фосфаты содержатся во всех растительных
организмах
и животных
56
57.
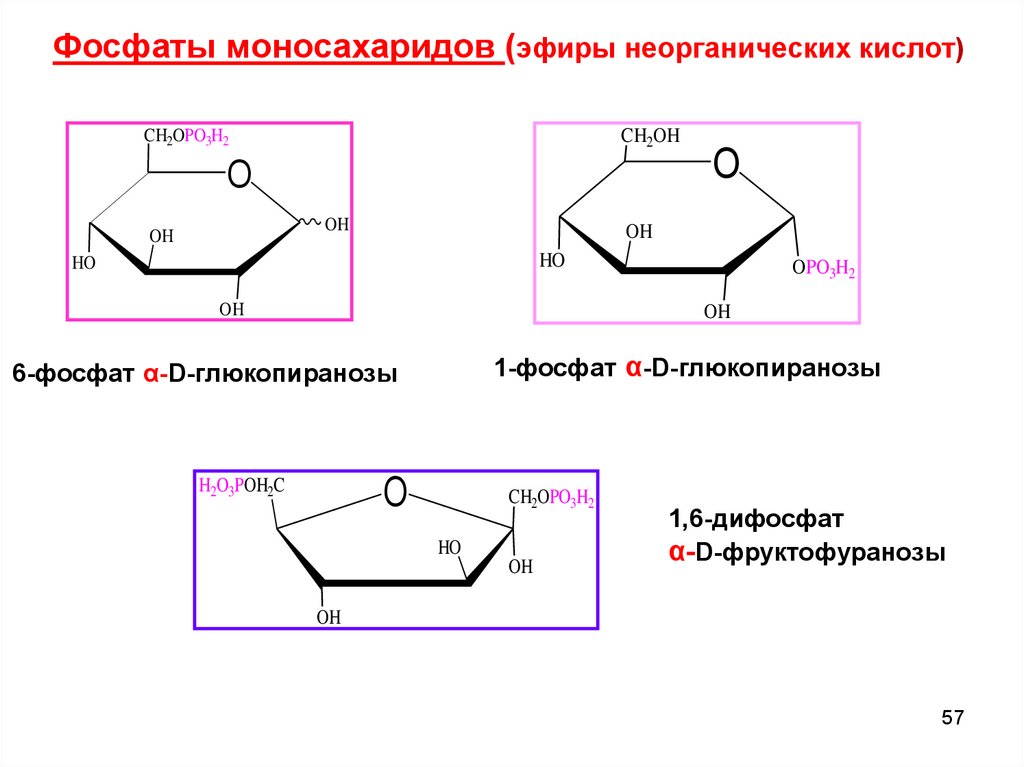
Фосфаты моносахаридов (эфиры неорганических кислот)CH2OH
CH2OPO3H2
O
OH
OH
O
OH
HO
HO
OH
OPO3H2
OH
1-фосфат α-D-глюкопиранозы
6-фосфат α-D-глюкопиранозы
O
H2O3POH2C
CH2OPO3H2
HO
OH
1,6-дифосфат
α-D-фруктофуранозы
OH
57
58.
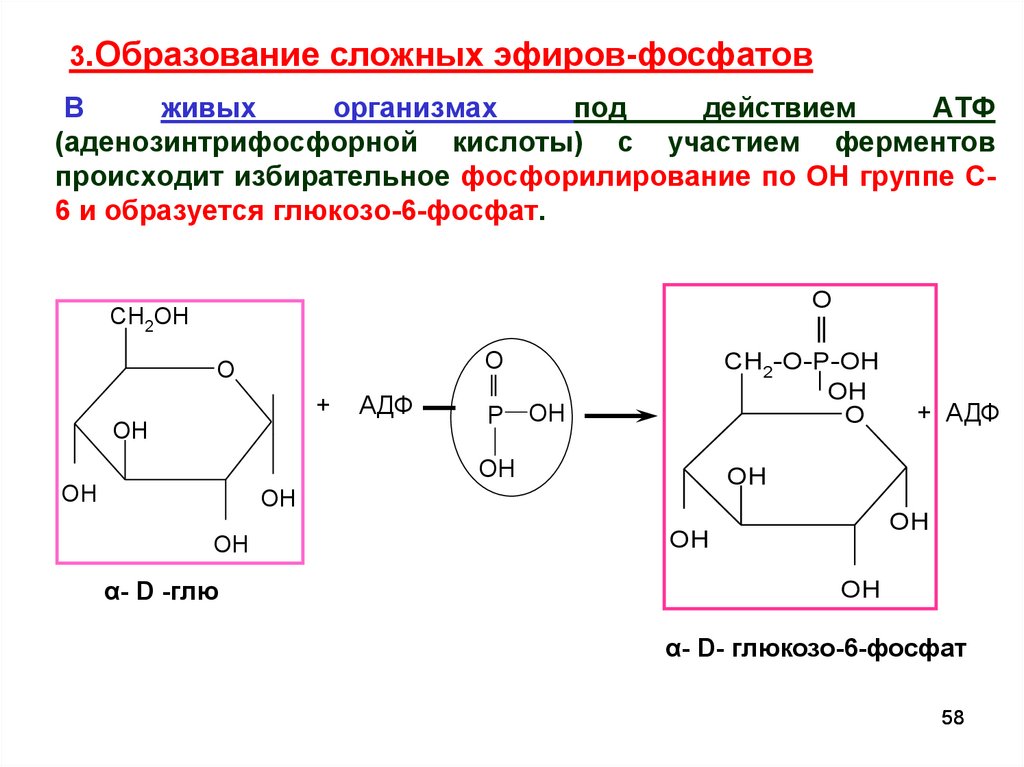
3.Образование сложных эфиров-фосфатовВ
живых
организмах
под
действием
АТФ
(аденозинтрифосфорной кислоты) с участием ферментов
происходит избирательное фосфорилирование по ОН группе С6 и образуется глюкозо-6-фосфат.
O
CH2OH
O
O
+
OH
АДФ
P
CH2-O-P-OH
OH
O
OH
OH
OH
+ АДФ
OH
OH
OH
α- D -глю
OH
OH
OH
α- D- глюкозо-6-фосфат
58
59.
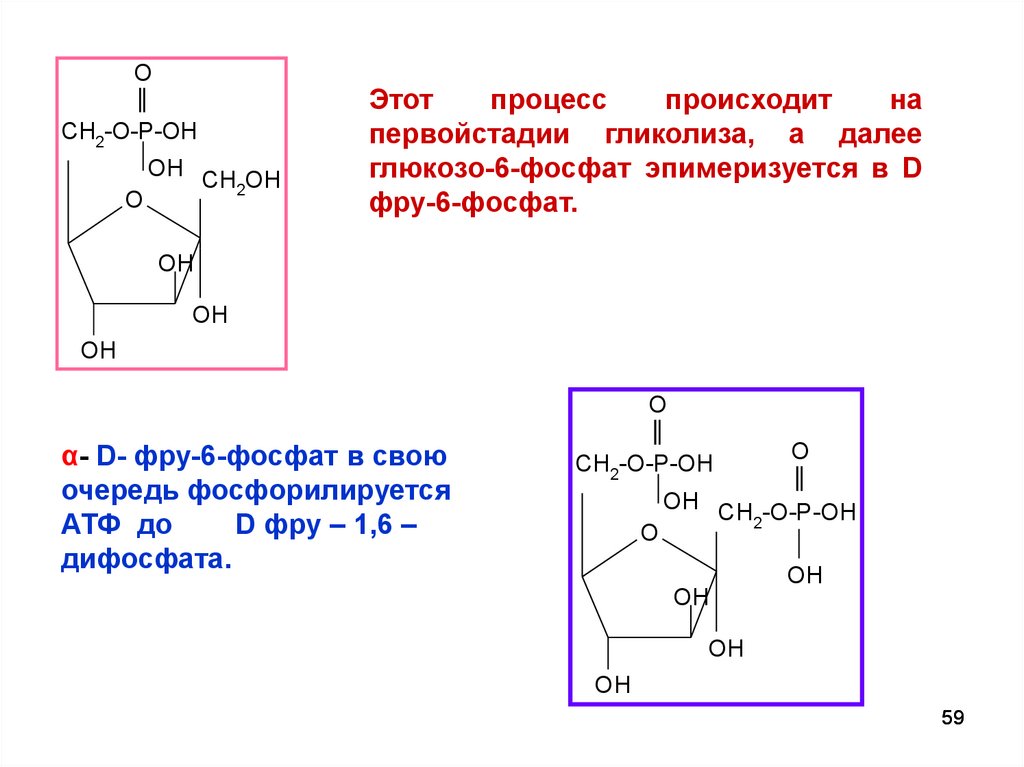
OCH2-O-P-OH
O
OH CH OH
2
Этот
процесс
происходит
на
первойстадии гликолиза, а далее
глюкозо-6-фосфат эпимеризуется в D
фру-6-фосфат.
OH
OH
OH
O
α- D- фру-6-фосфат в свою
очередь фосфорилируется
АТФ до
D фру – 1,6 –
дифосфата.
CH2-O-P-OH
O
O
OH CH -O-P-OH
2
OH
OH
OH
OH
59
60.
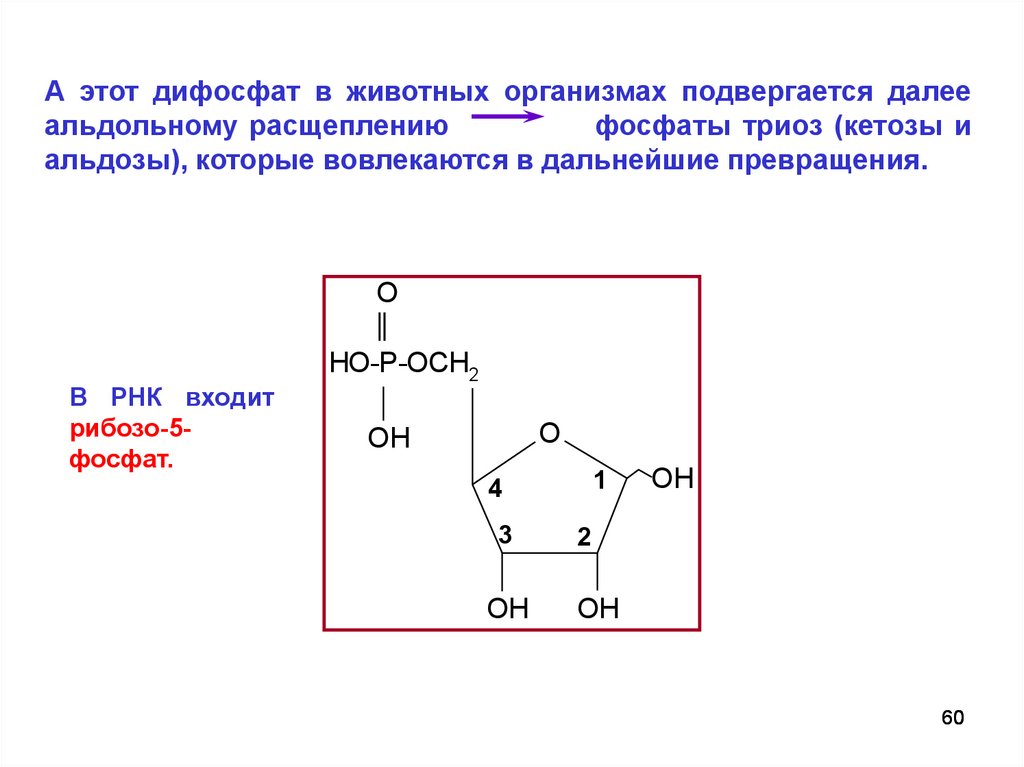
А этот дифосфат в животных организмах подвергается далееальдольному расщеплению
фосфаты триоз (кетозы и
альдозы), которые вовлекаются в дальнейшие превращения.
O
В РНК входит
рибозо-5фосфат.
HO-P-OCH2
O
OH
1
4
3
2
OH
OH
OH
60
61.
Кроме того,Фруктоза-1,6-дифосфат, фруктозо-6-фосфат
промежуточные соединения в темновой фазе фотосинтеза (цикл
Кельвина),
участники спиртового брожения и
биосинтеза углеводов.
61
62.
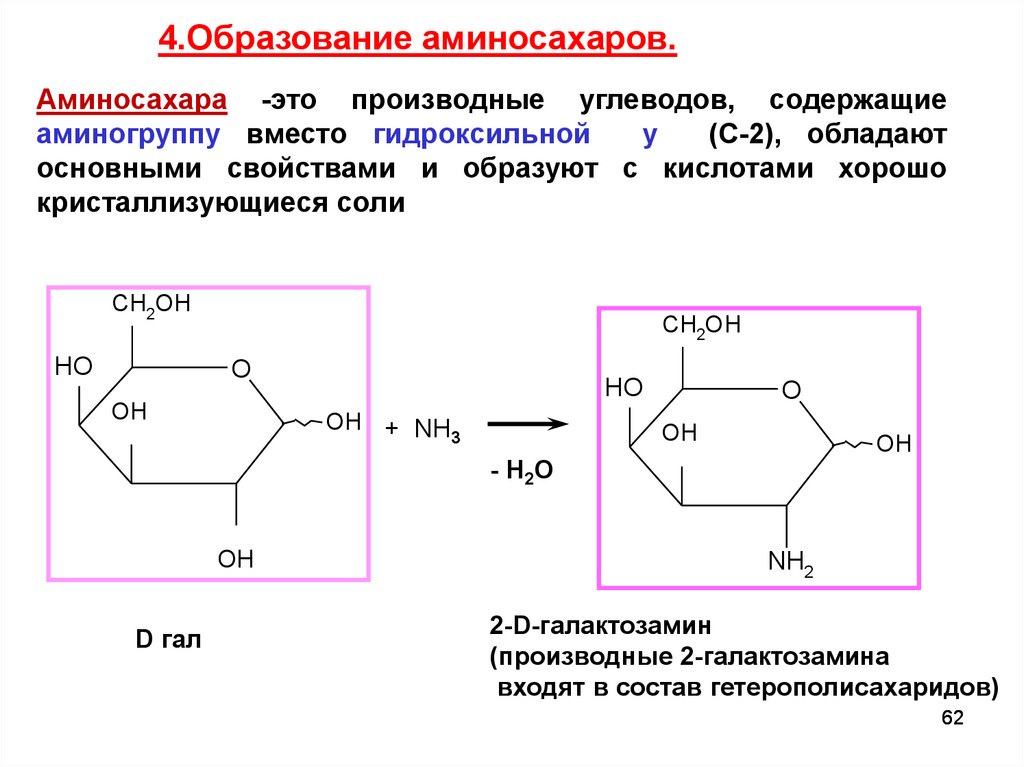
4.Образование аминосахаров.Аминосахара -это производные углеводов, содержащие
аминогруппу вместо гидроксильной
у
(С-2), обладают
основными свойствами и образуют с кислотами хорошо
кристаллизующиеся соли
CH2OH
HO
CH2OH
O
OH
HO
OH + NH
3
O
OH
OH
- Н2О
OH
D гал
NH2
2-D-галактозамин
(производные 2-галактозамина
входят в состав гетерополисахаридов)
62
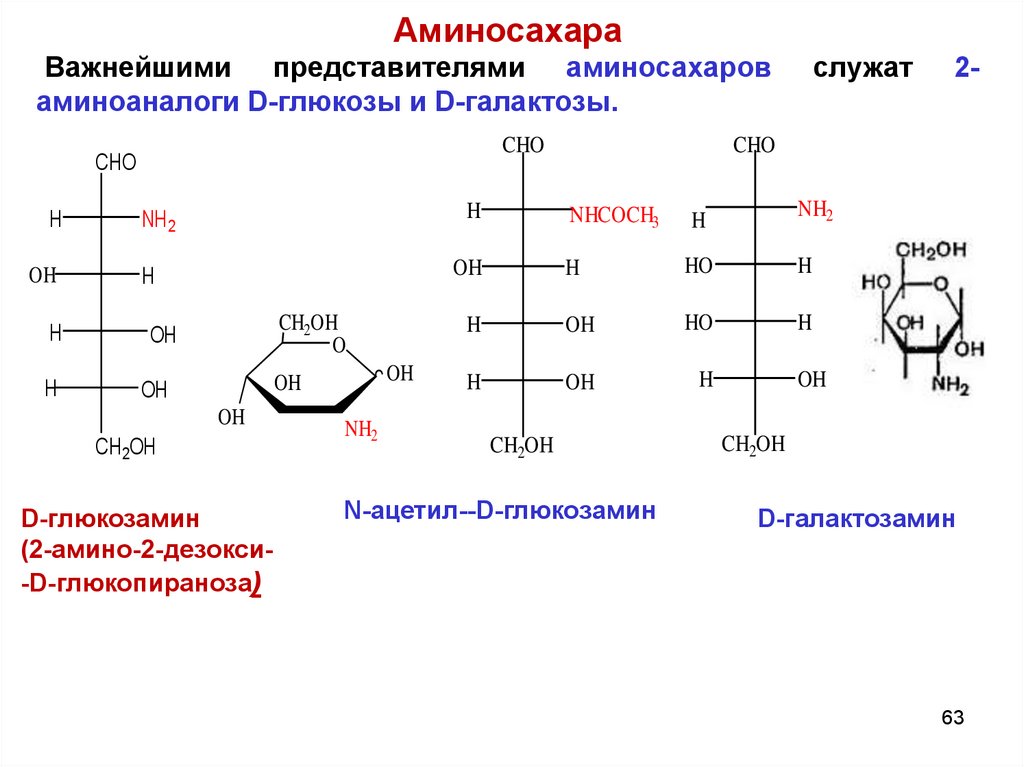
63.
АминосахараВажнейшими представителями аминосахаров
аминоаналоги D-глюкозы и D-галактозы.
CHO
CHO
служат
CHO
H
NH2
H
NHCOCH3
H
NH2
OH
H
OH
H
HO
H
H
OH
CH2OH
O
H
OH
HO
H
H
OH
OH
H
OH
H
OH
OH
CH2OH
D-глюкозамин
(2-амино-2-дезокси-D-глюкопираноза)
OH
NH2
2-
CH2OH
N-ацетил--D-глюкозамин
CH2OH
D-галактозамин
63
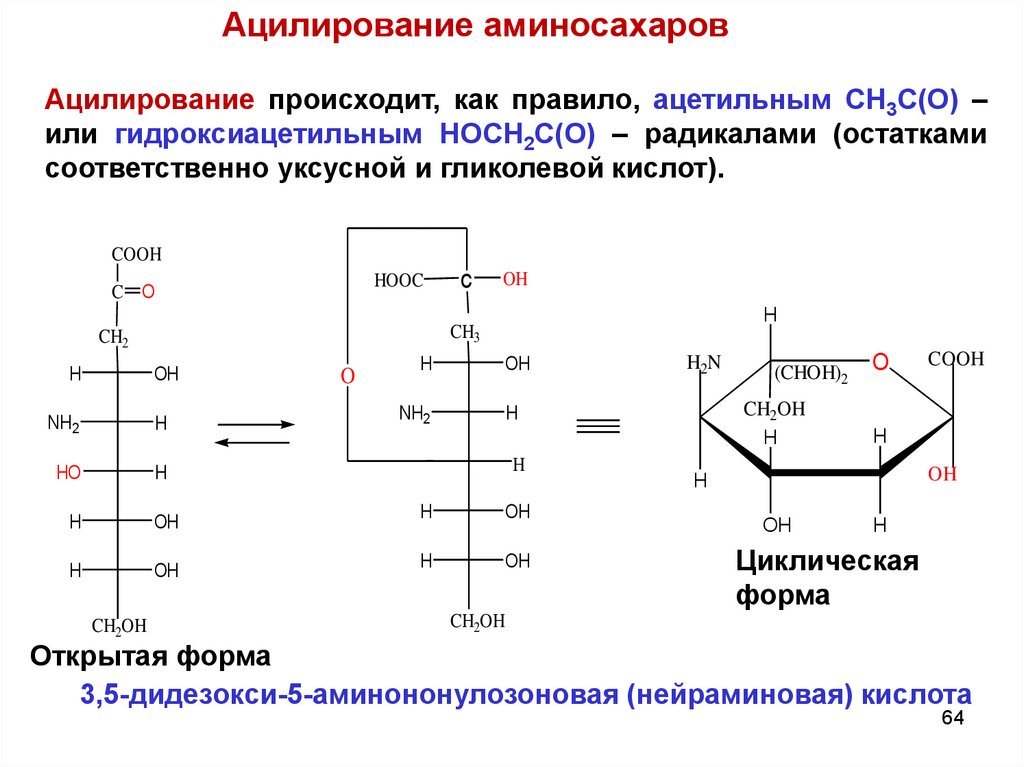
64.
Ацилирование аминосахаровАцилирование происходит, как правило, ацетильным CH3C(O) –
или гидроксиацетильным HOCH2C(O) – радикалами (остатками
соответственно уксусной и гликолевой кислот).
COOH
HOOC
C O
c
OH
H
CH3
CH2
H
OH
NH2
H
H
OH
NH2
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
O
H
H2N
(CHOH)2
CH2OH
H
O
COOH
H
OH
H
OH
H
Циклическая
форма
CH2OH
Открытая форма
3,5-дидезокси-5-аминононулозоновая (нейраминовая) кислота
64
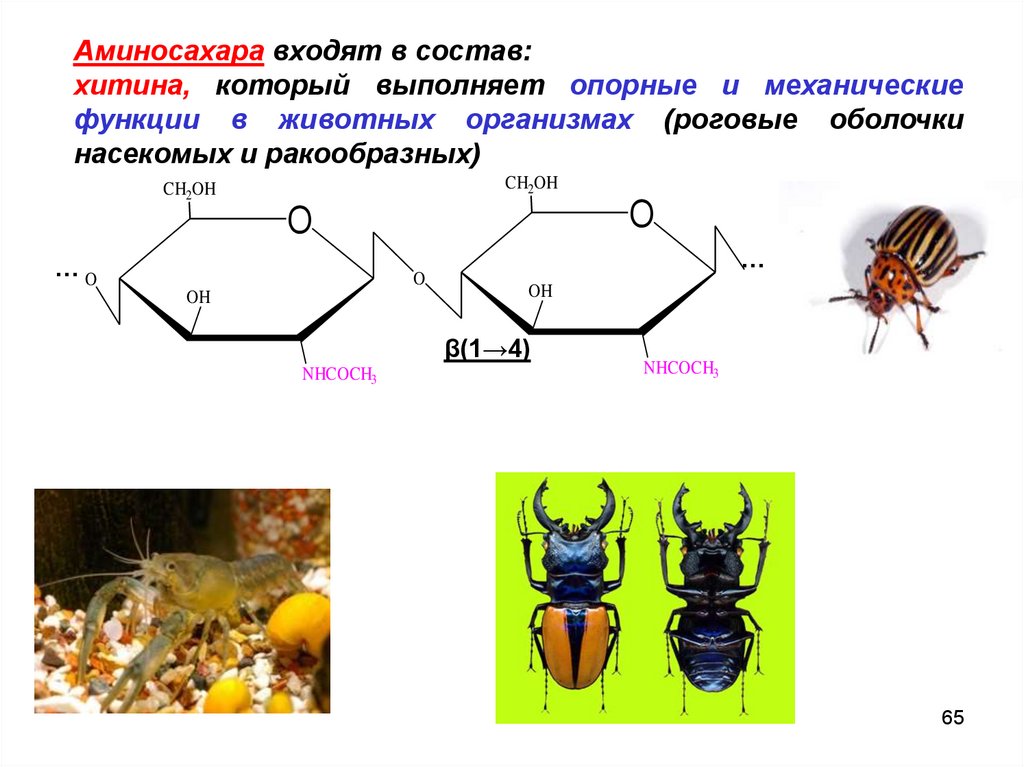
65.
Аминосахара входят в состав:хитина, который выполняет опорные и механические
функции в животных организмах (роговые оболочки
насекомых и ракообразных)
CH2OH
CH2OH
O
O
…O
O
OH
…
OH
β(1→4)
NHCOCH3
NHCOCH3
65
66.
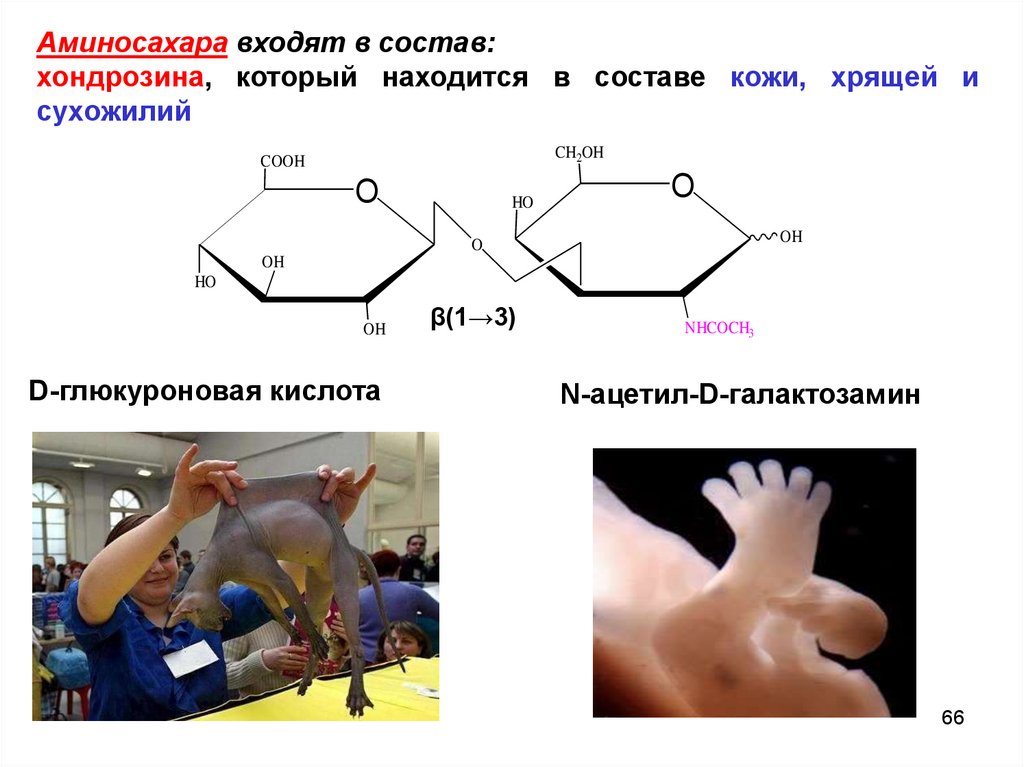
Аминосахара входят в состав:хондрозина, который находится в составе кожи, хрящей и
сухожилий
CH2OH
COOH
O
HO
O
OH
O
OH
HO
OH
D-глюкуроновая кислота
β(1→3)
NHCOCH3
N-ацетил-D-галактозамин
66
67.
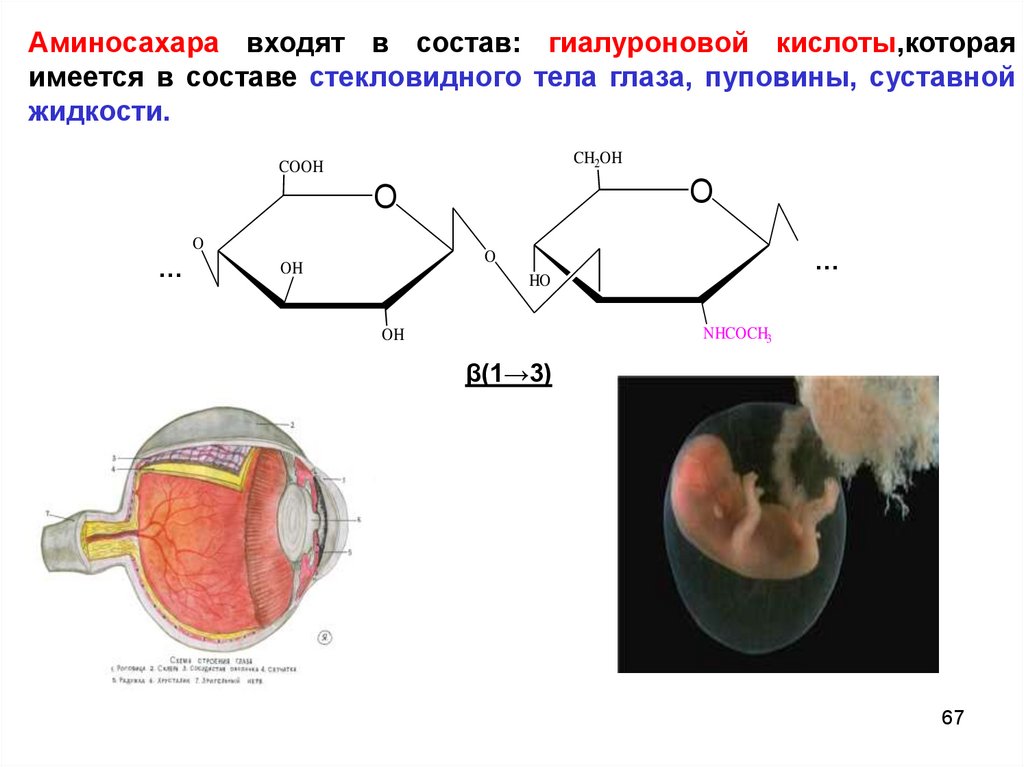
Аминосахара входят в состав: гиалуроновой кислоты,котораяимеется в составе стекловидного тела глаза, пуповины, суставной
жидкости.
CH2OH
COOH
O
O
O
…
…
O
OH
HO
NHCOCH3
OH
β(1→3)
67
68.
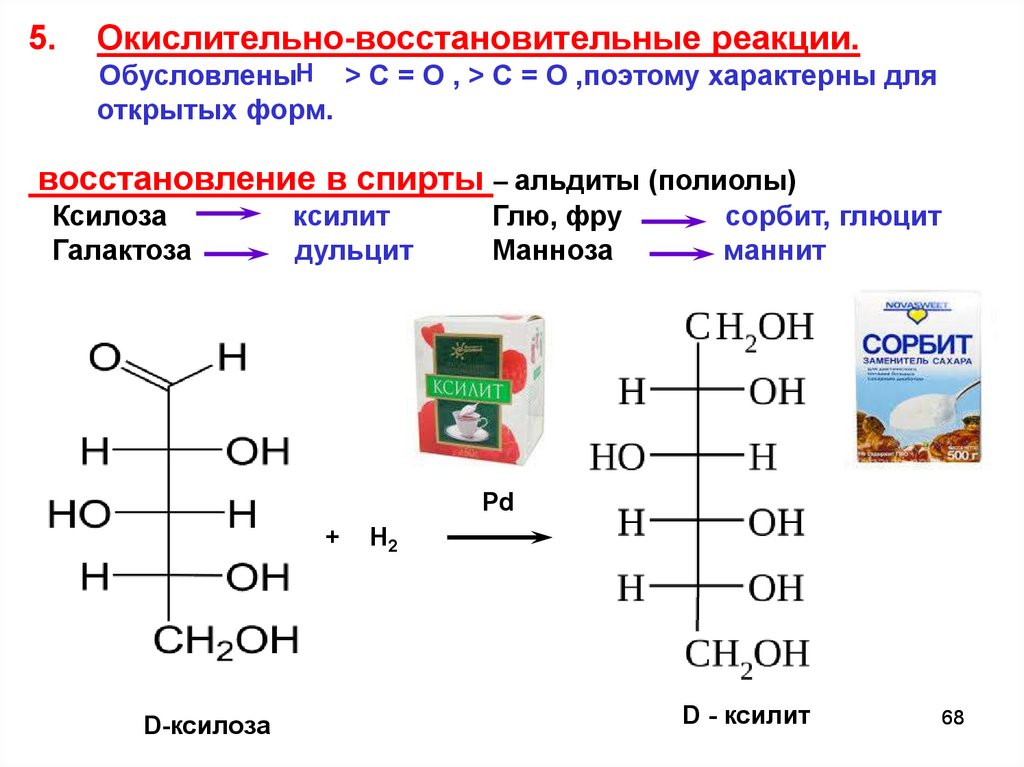
5.Окислительно-восстановительные реакции.
ОбусловленыН > C = O , > C = O ,поэтому характерны для
открытых форм.
восстановление в спирты – альдиты (полиолы)
Ксилоза
Галактоза
ксилит
дульцит
Глю, фру
Манноза
сорбит, глюцит
маннит
Pd
+
D-ксилоза
Н2
D - ксилит
68
69.
Окисление моносахаридовРеакции окисления используют в структурных исследованиях
и биохимических анализах для обнаружения моносахаридов,
в частности глюкозы, в биологических жидкостях (моча ,
кровь).
В зависимости от условий окисления образуются различные
продукты.
69
70.
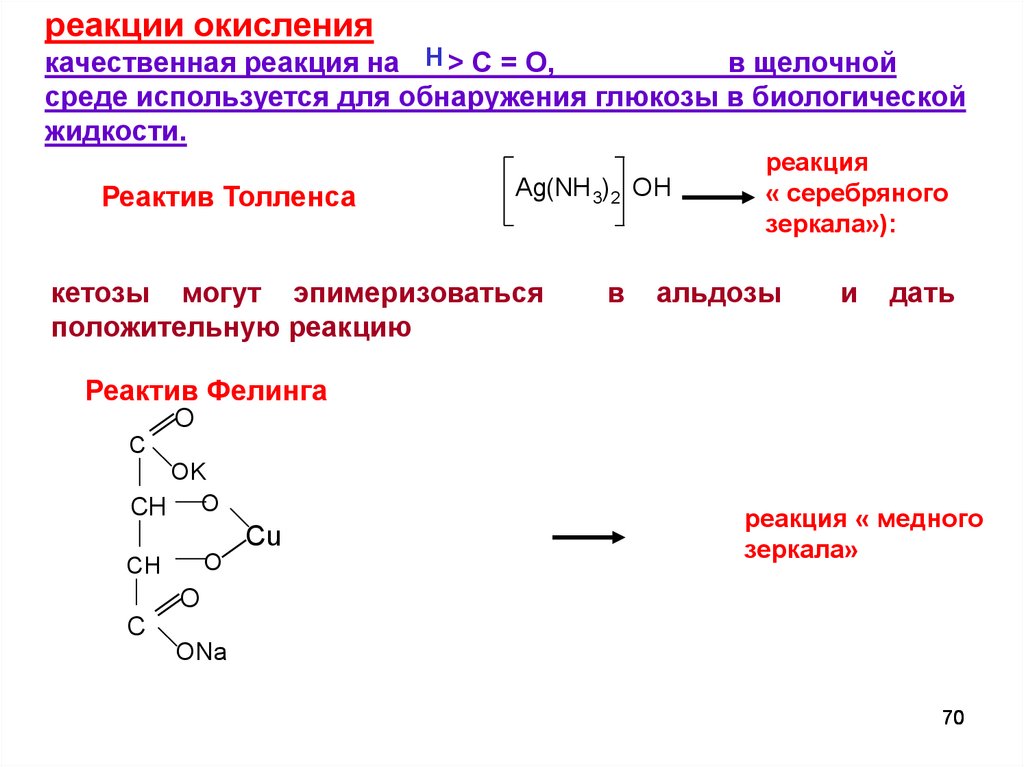
реакции окислениякачественная реакция на Н > C = O,
в щелочной
среде используется для обнаружения глюкозы в биологической
жидкости.
Реактив Толленса
Ag(NH 3) 2 OH
кетозы могут эпимеризоваться
положительную реакцию
в
реакция
« серебряного
зеркала»):
альдозы
и
дать
Реактив Фелинга
O
C
OK
CH O
Cu
O
CH
реакция « медного
зеркала»
O
C
ONa
70
71.
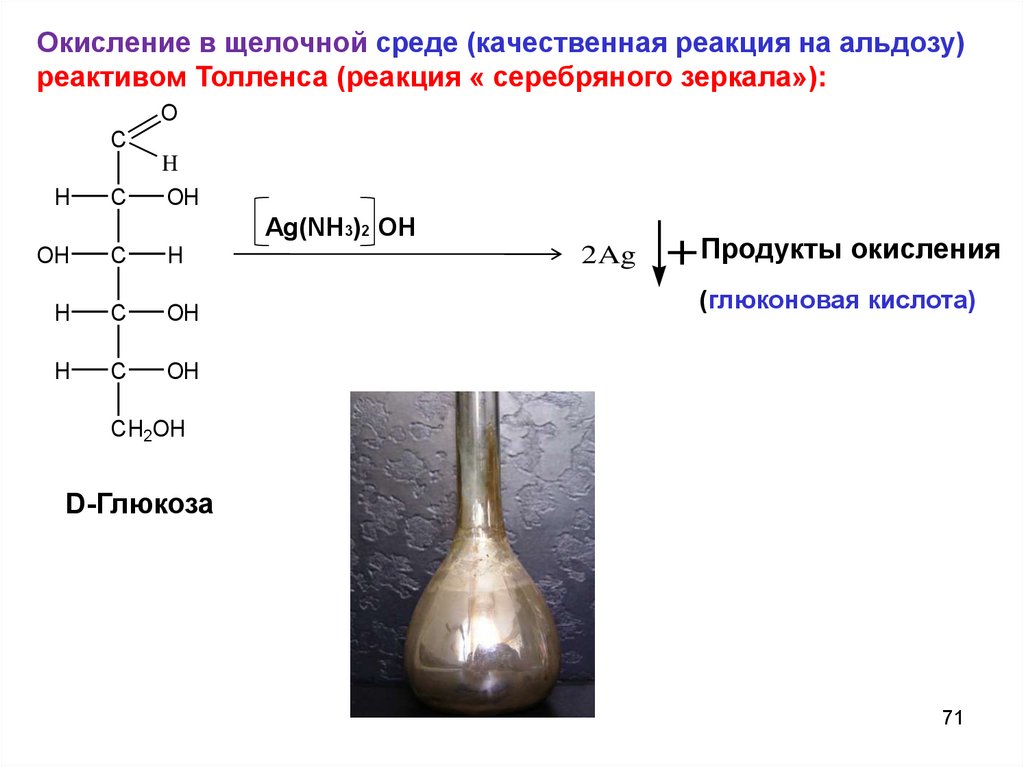
Окисление в щелочной среде (качественная реакция на альдозу)реактивом Толленса (реакция « серебряного зеркала»):
O
C
H
C
H
OH
Ag(NH3)2 OH
OH
C
H
H
C
OH
H
C
OH
2Ag
+ Продукты окисления
(глюконовая кислота)
CH2OH
D-Глюкоза
71
72.
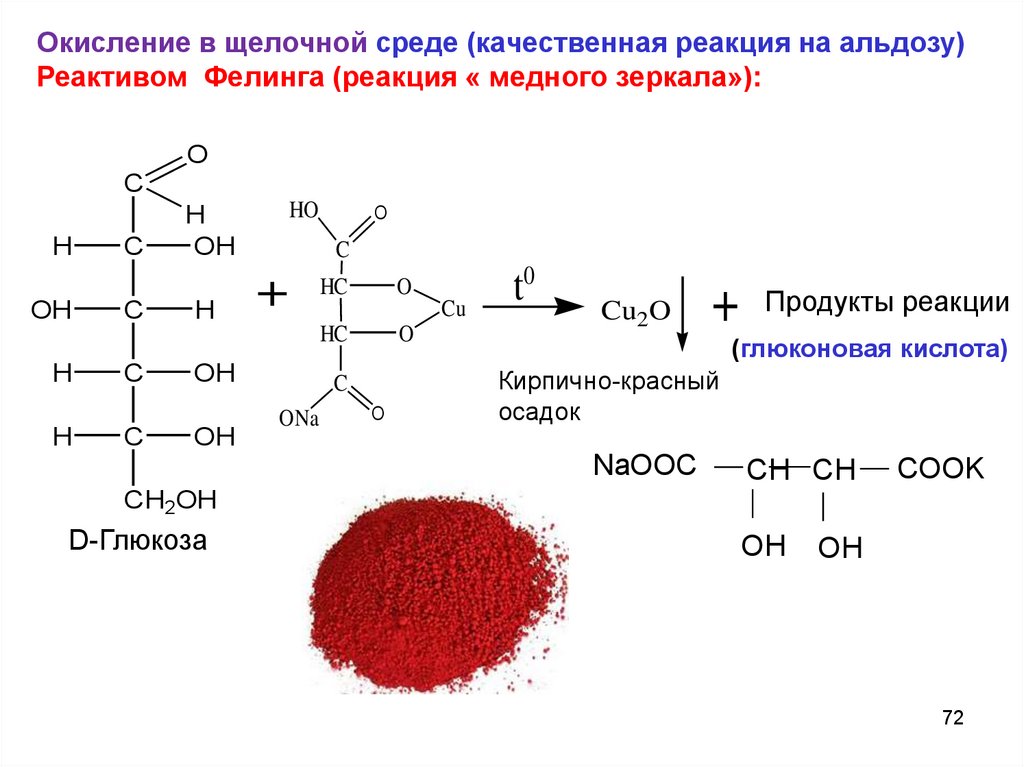
Окисление в щелочной среде (качественная реакция на альдозу)Реактивом Фелинга (реакция « медного зеркала»):
O
C
H
OH
H
H
C
C
C
C
H
OH
H
HO
C
+ HC
O
HC
O
OH
OH
O
Cu
C
ONa
O
t0
Cu2O
+ Продукты реакции
(глюконовая кислота)
Кирпично-красный
осадок
NaOOC
CH CH
COOK
CH2OH
D-Глюкоза
OH
OH
72
73.
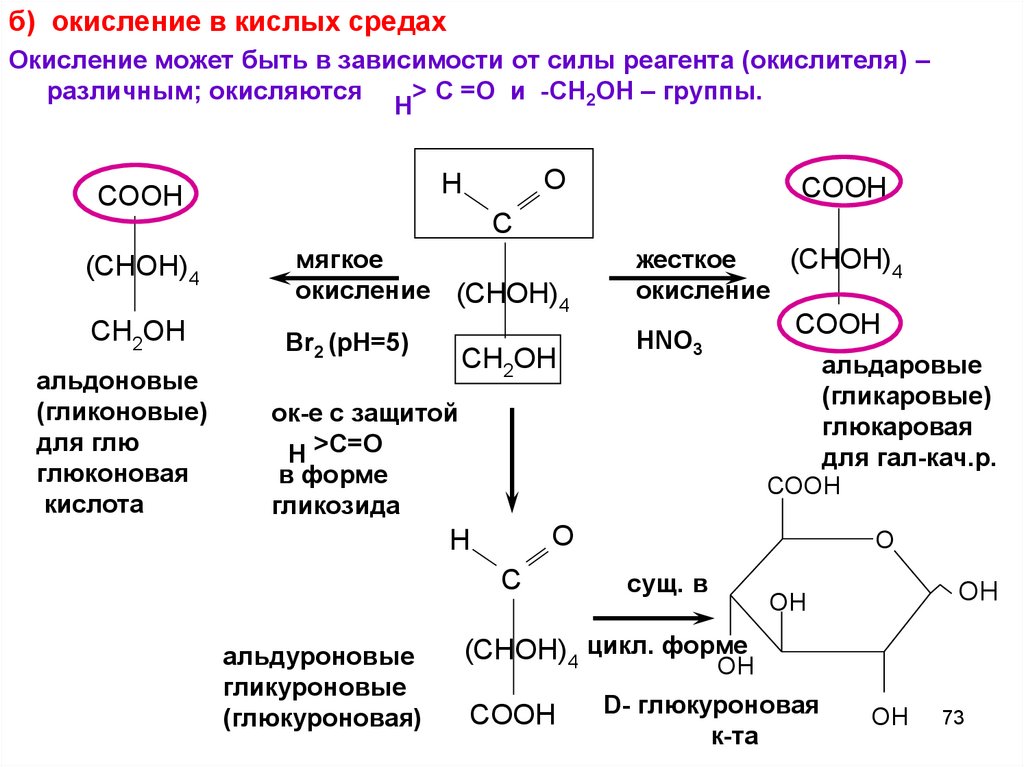
б) окисление в кислых средахОкисление может быть в зависимости от силы реагента (окислителя) –
различным; окисляются
> C =O и -СН2ОН – группы.
Н
O
COOH
(CHOH)4
мягкое
окисление (CHOH)
4
жесткое
(CHOH)4
окисление
CH2OH
Br2 (pH=5)
HNO3
H
COOH
C
альдоновые
(гликоновые)
для глю
глюконовая
кислота
CH2OH
COOH
альдаровые
(гликаровые)
глюкаровая
для гал-кач.р.
ок-е с защитой
Н >C=O
в форме
гликозида
COOH
O
H
C
альдуроновые
гликуроновые
(глюкуроновая)
O
сущ. в
OH
OH
(CHOH)4 цикл. форме
OH
COOH
D- глюкуроновая
к-та
OH
73
74.
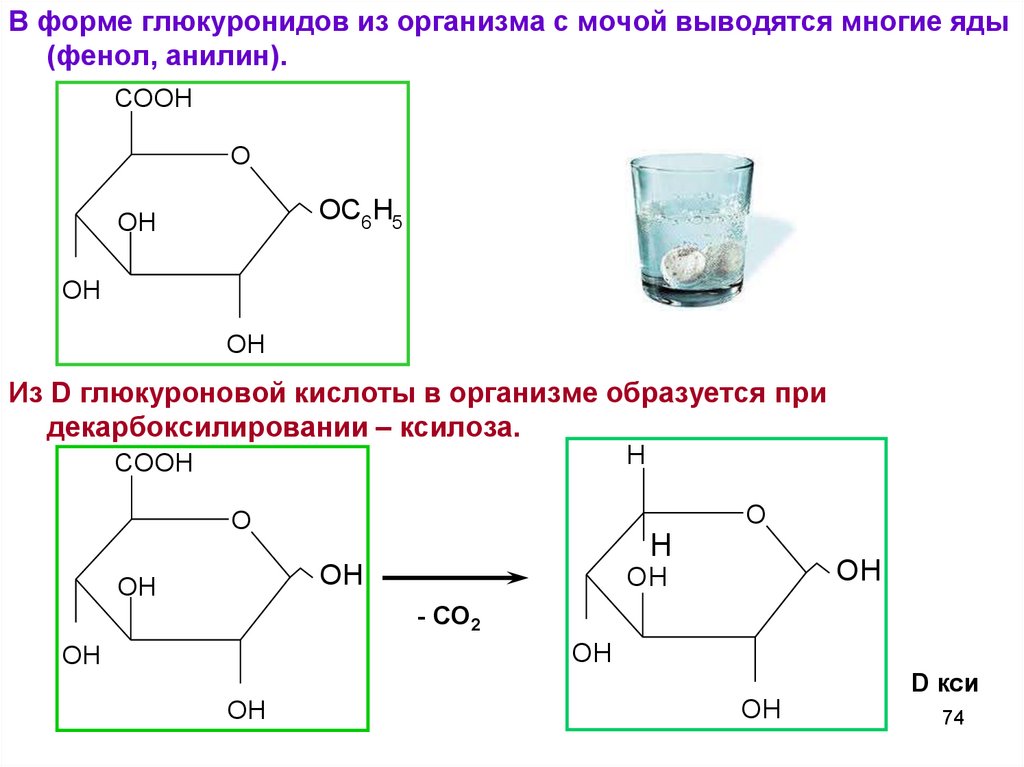
В форме глюкуронидов из организма с мочой выводятся многие яды(фенол, анилин).
COOH
O
OC6 H5
OH
OH
OH
Из D глюкуроновой кислоты в организме образуется при
декарбоксилировании – ксилоза.
H
COOH
O
O
H
OH
OH
OH
OH
- СО2
OH
OH
D кси
OH
OH
74
75.
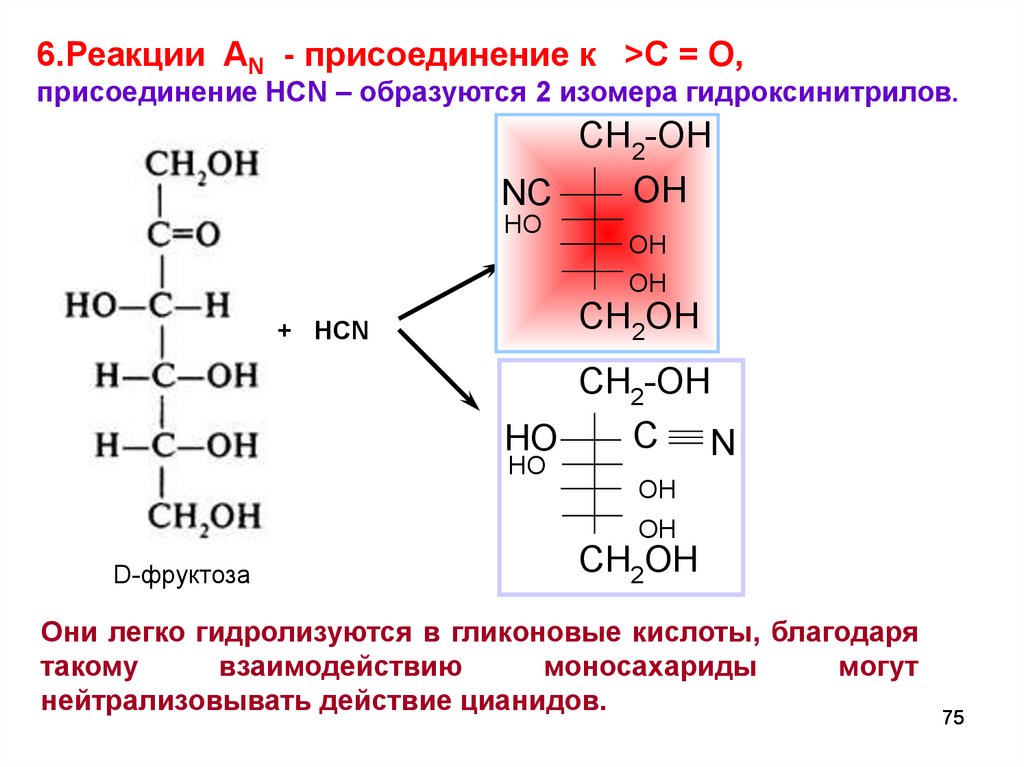
6.Реакции AN - присоединение к >C = O,присоединение HCN – образуются 2 изомера гидроксинитрилов.
CH2-OH
OH
NC
HO
OH
OH
CH2OH
+ HCN
CH2-OH
HO
C
HO
N
OH
OH
D-фруктоза
CH2OH
Они легко гидролизуются в гликоновые кислоты, благодаря
такому
взаимодействию
моносахариды
могут
нейтрализовывать действие цианидов.
75
76.
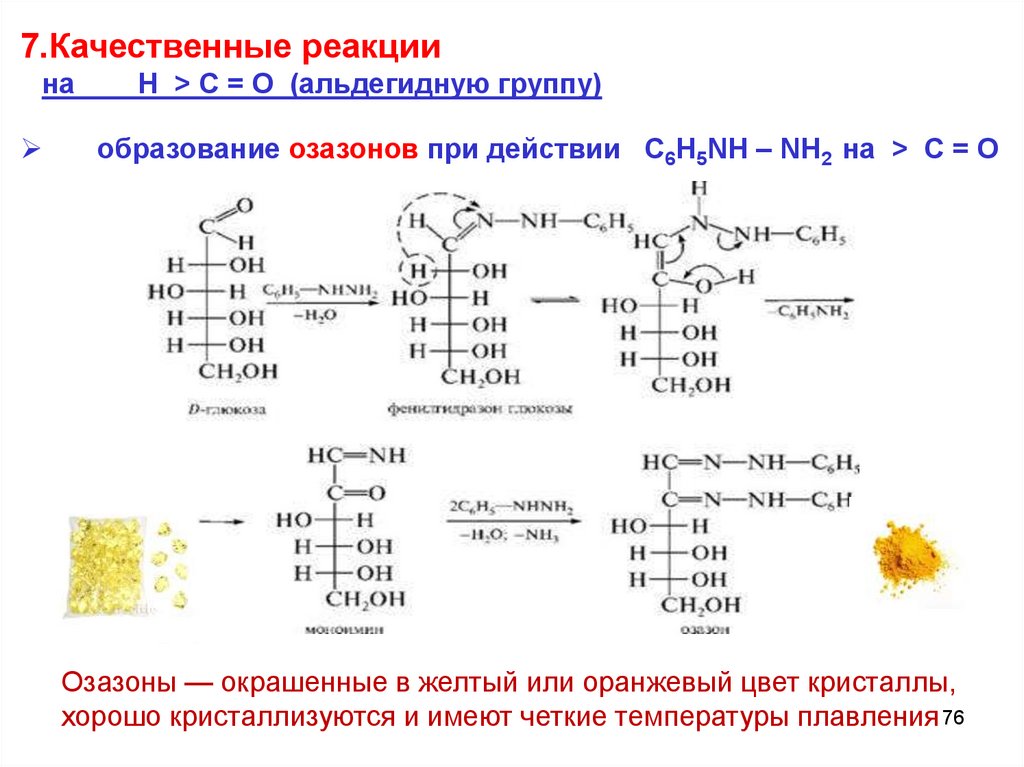
7.Качественные реакциина
Н > C = O (альдегидную группу)
образование озазонов при действии С6H5NH – NH2 на > C = O
Озазоны — окрашенные в желтый или оранжевый цвет кристаллы,
хорошо кристаллизуются и имеют четкие температуры плавления 76
77.
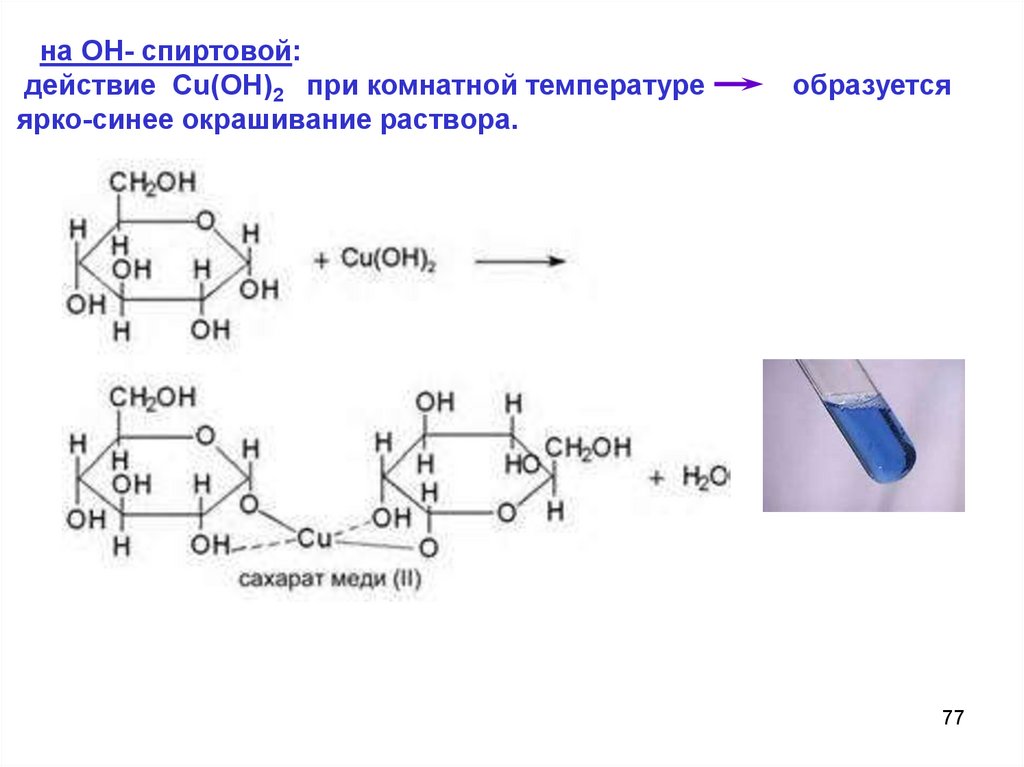
на ОН- спиртовой:действие Cu(OH)2 при комнатной температуре
ярко-синее окрашивание раствора.
образуется
77
78.
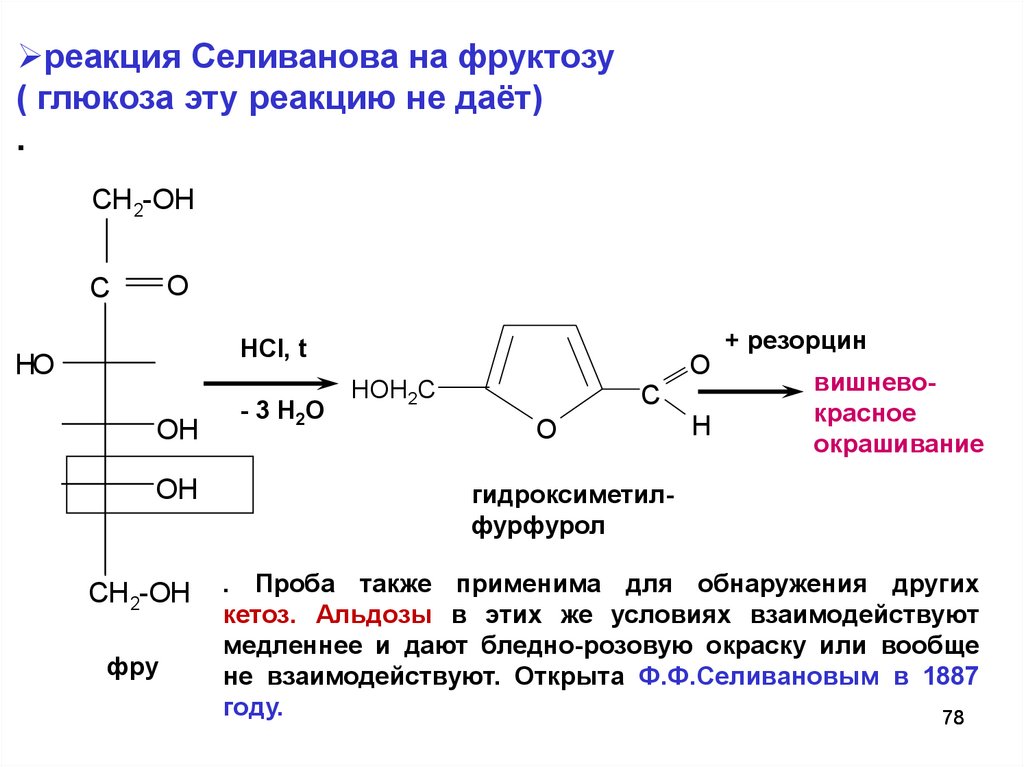
реакция Селиванова на фруктозу( глюкоза эту реакцию не даёт)
.
CH 2-OН
O
C
+ резорцин
HCl, t
HO
OH
OH
CH 2-OH
фру
- 3 H2O
O
HOH2C
C
O
H
вишневокрасное
окрашивание
гидроксиметилфурфурол
. Проба также применима для обнаружения других
кетоз. Альдозы в этих же условиях взаимодействуют
медленнее и дают бледно-розовую окраску или вообще
не взаимодействуют. Открыта Ф.Ф.Селивановым в 1887
году.
78
79.
Дисахариды79
80.
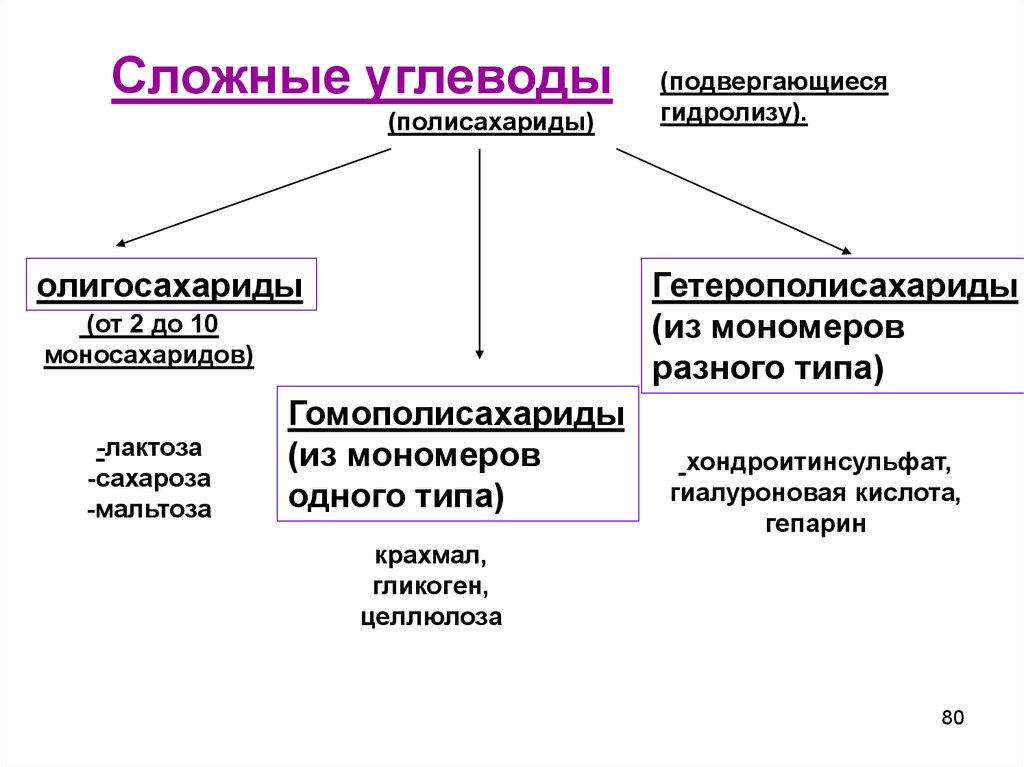
Сложные углеводы(полисахариды)
олигосахариды
Гетерополисахариды
(из мономеров
разного типа)
(от 2 до 10
моносахаридов)
-лактоза
-сахароза
-мальтоза
(подвергающиеся
гидролизу).
Гомополисахариды
(из мономеров
одного типа)
хондроитинсульфат,
гиалуроновая кислота,
гепарин
крахмал,
гликоген,
целлюлоза
80
81.
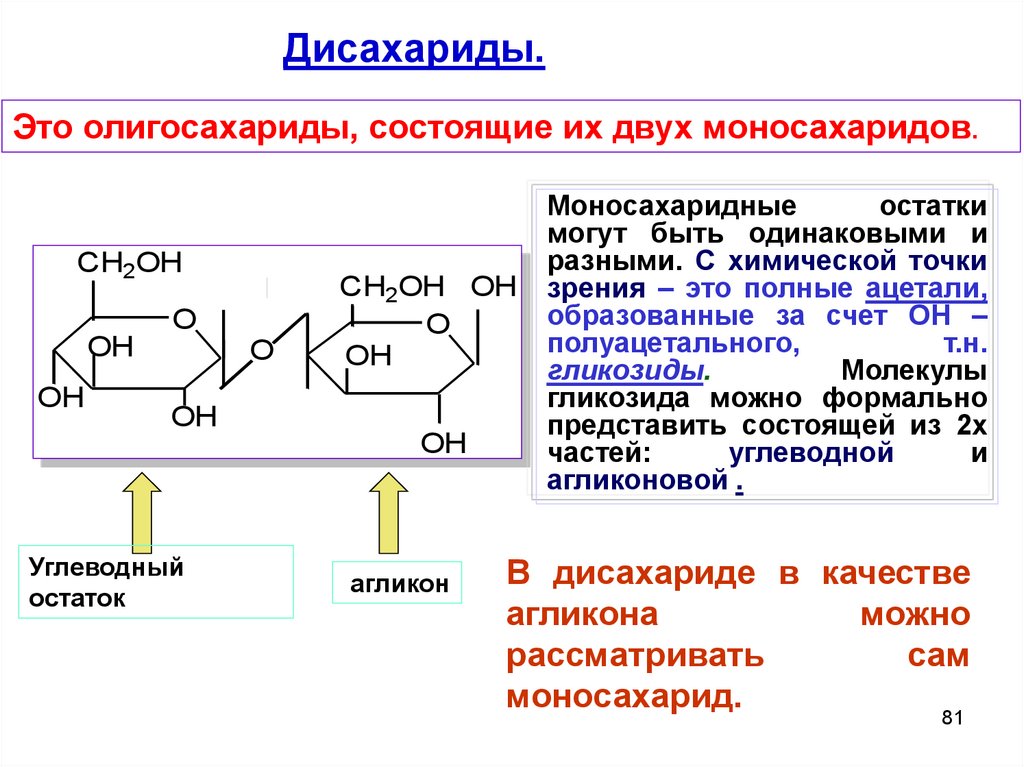
Дисахариды.Это олигосахариды, состоящие их двух моносахаридов.
CH2OH
OH
OH
O
OH
Углеводный
остаток
OH
O
CH2OH OH
O
OH
OH
агликон
Моносахаридные
остатки
могут быть одинаковыми и
разными. С химической точки
зрения – это полные ацетали,
образованные за счет ОН –
полуацетального,
т.н.
гликозиды.
Молекулы
гликозида можно формально
представить состоящей из 2х
частей:
углеводной
и
агликоновой .
В дисахариде в качестве
агликона
можно
рассматривать
сам
моносахарид.
81
82.
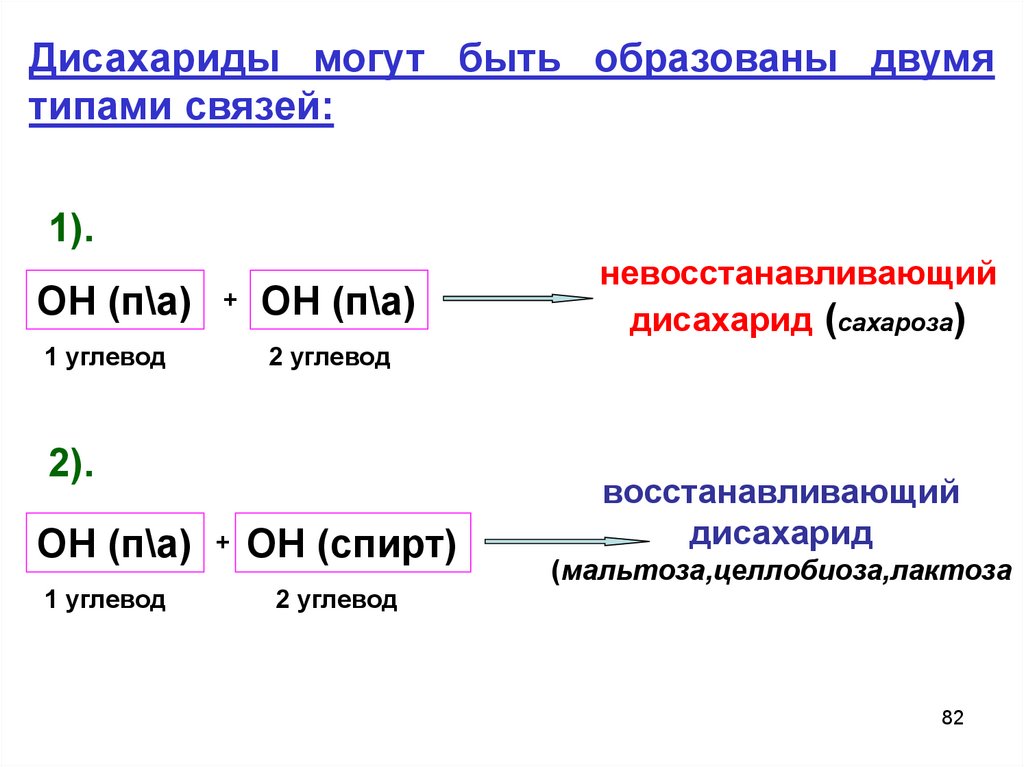
Дисахариды могут быть образованы двумятипами связей:
1).
ОН (п\а)
1 углевод
+
ОН (п\а)
2 углевод
2).
ОН (п\а) + ОН (спирт)
1 углевод
невосстанавливающий
дисахарид (сахароза)
2 углевод
восстанавливающий
дисахарид
(мальтоза,целлобиоза,лактоза
82
83.
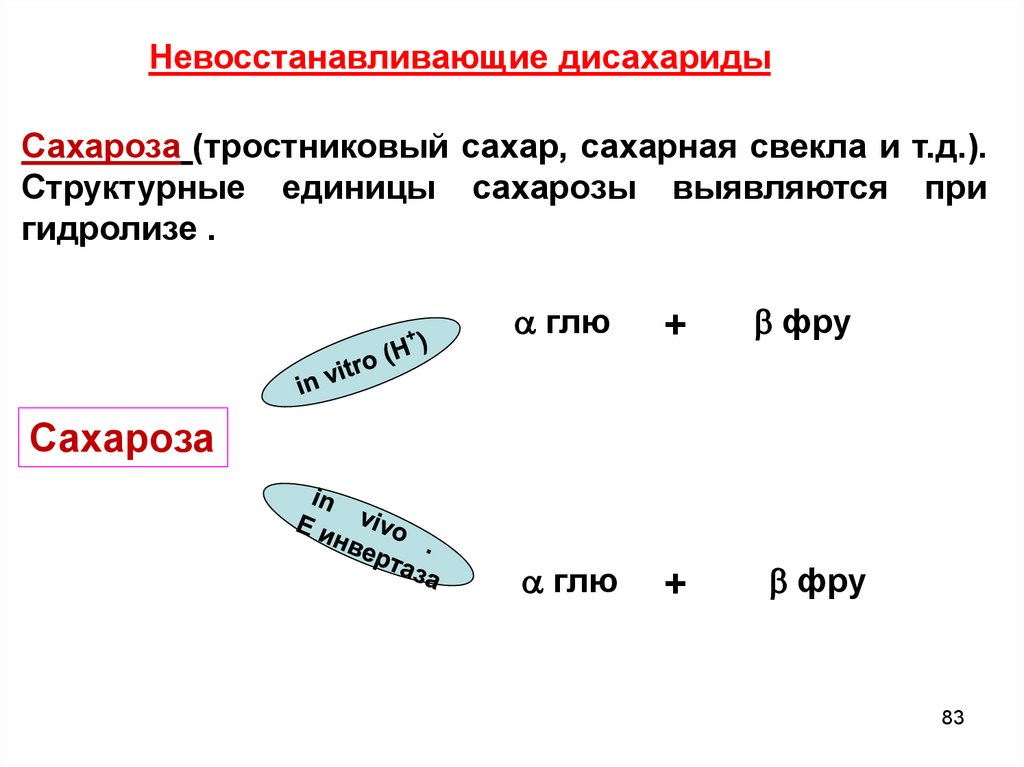
Невосстанавливающие дисахаридыСахароза (тростниковый сахар, сахарная свекла и т.д.).
Структурные единицы сахарозы выявляются при
гидролизе .
глю
+
фру
глю
+
фру
Сахароза
83
84.
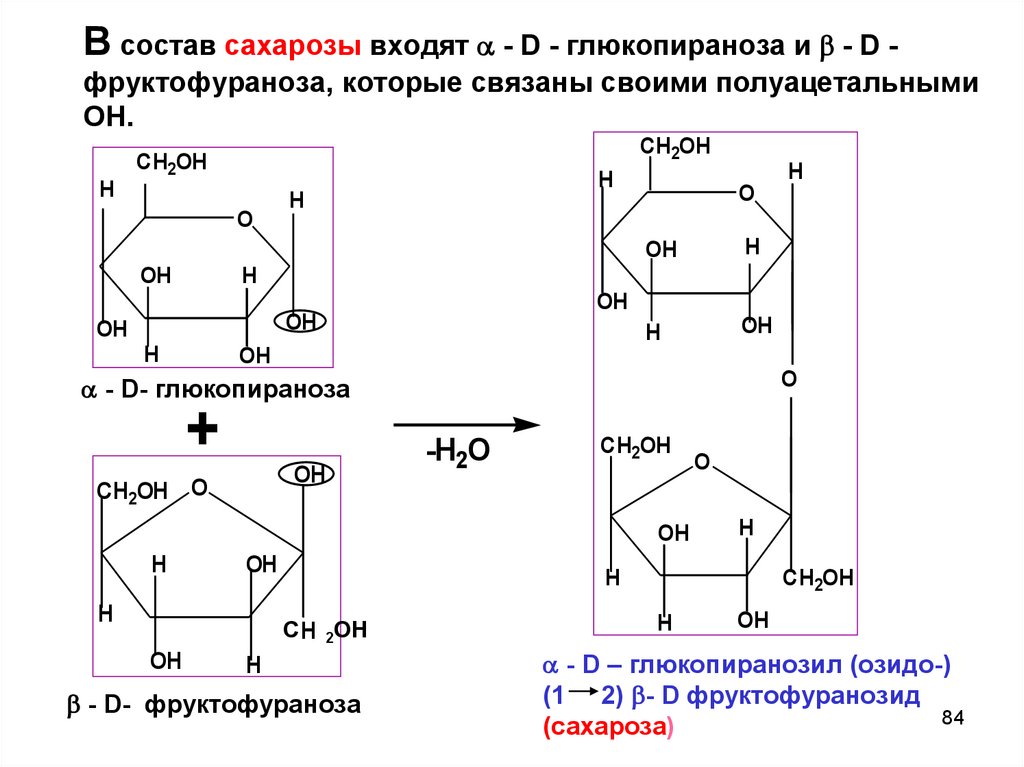
В состав сахарозы входят - D - глюкопираноза и - D фруктофураноза, которые связаны своими полуацетальнымиОН.
CH2OH
CH2OH
H
O
OH
H
H
H
H
OH
H
H
OH
OH
OH
OH
O
OH
O
- D- глюкопираноза
+
OH
CH2OH O
-H2O
CH2OH
OH
H
OH
H
OH
O
H
H
С H 2ОН
H
- D- фруктофураноза
H
CH2OH
H
OH
- D – глюкопиранозил (озидо-)
(1 2) - D фруктофуранозид
84
(сахароза)
85.
В названии невосстанавливающих дисахаридовотражено отсутствие полуацетальных ОН, суффикс
оза заменен на озил (или озидо) для I углевода и
озид для II. Сахароза – это озидо – озид.
Правомерны оба названия:
- D - фруктофуранозил - (2
- глюкопиранозид.
1) - - D
- D - глюкопиранозил - (1
фруктофуранозид.
2) - - D –
85
86.
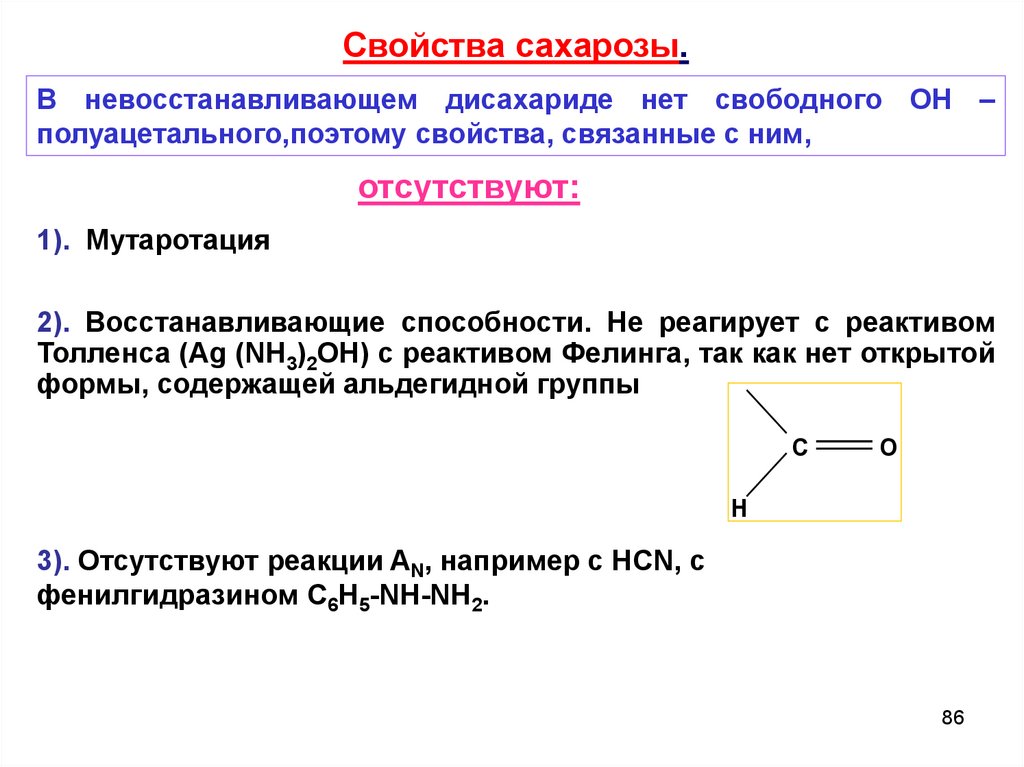
Свойства сахарозы.В невосстанавливающем дисахариде нет свободного ОН –
полуацетального,поэтому свойства, связанные с ним,
отсутствуют:
1). Мутаротация
2). Восстанавливающие способности. Не реагирует с реактивом
Толленса (Ag (NH3)2OH) с реактивом Фелинга, так как нет открытой
формы, содержащей альдегидной группы
C
O
H
3). Отсутствуют реакции AN, например с HCN, с
фенилгидразином C6Н5-NH-NH2.
86
87.
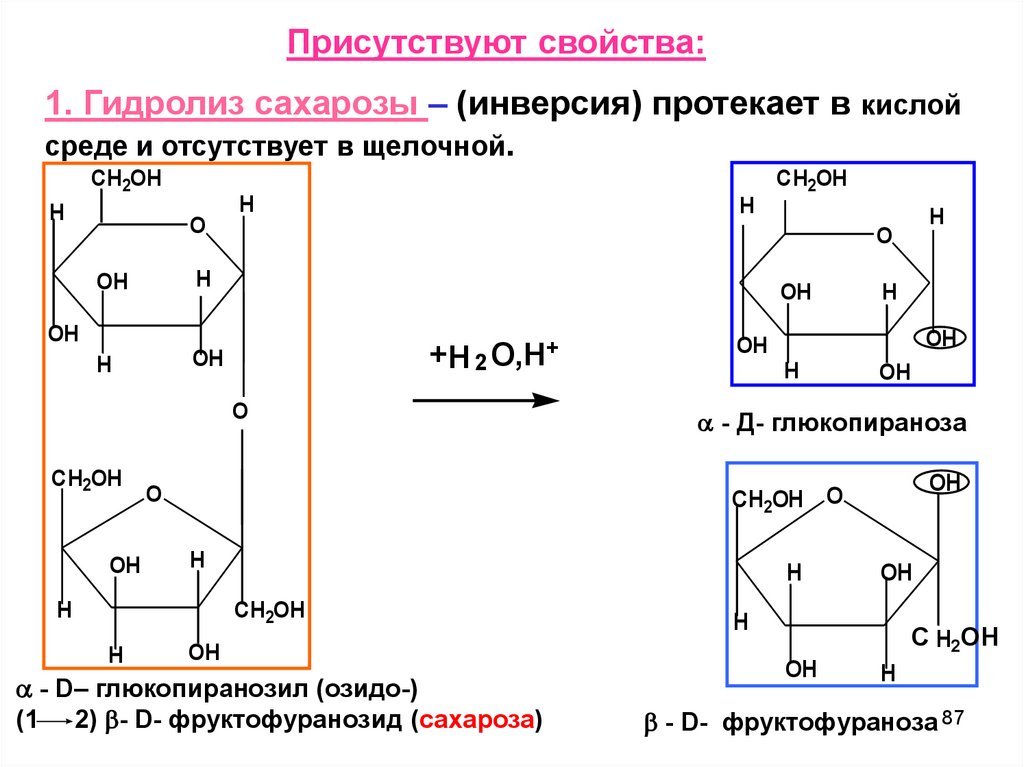
Присутствуют свойства:1. Гидролиз сахарозы – (инверсия) протекает в кислой
среде и отсутствует в щелочной.
CH2OH
H
O
CH2OH
H
H
O
H
OH
OH
OH
+H 2
OH
H
O,H+
O
CH2OH
OH
O
H
OH
OH
H
OH
- Д- глюкопираноза
OH
CH2OH O
H
H
H
CH2OH
H
H
OH
- D– глюкопиранозил (озидо-)
(1 2) - D- фруктофуранозид (сахароза)
OH
H
С H2ОН
OH
H
- D- фруктофураноза 87
88.
При гидролизе сахарозы в кислойобразуются исходные моносахариды.
среде
Гидролиз сахарозы идет очень легко, даже в присутствии слабых
кислот. Ход гидролиза можно проследить с помощью
поляриметра, измеряя 20 (удельное вращение).
Автоматический поляриметр
Раствор сахарозы правовращающий (+), а при гидролизе
образуется -D- глю (+) и -D- фру (-) – левовращающая. В
результате будет преобладать левое вращение.
88
89.
Поэтому процесс гидролиза иногда называетсяинверсией, а смесь образующихся глю и фру –
инвертным сахаром.
89
90.
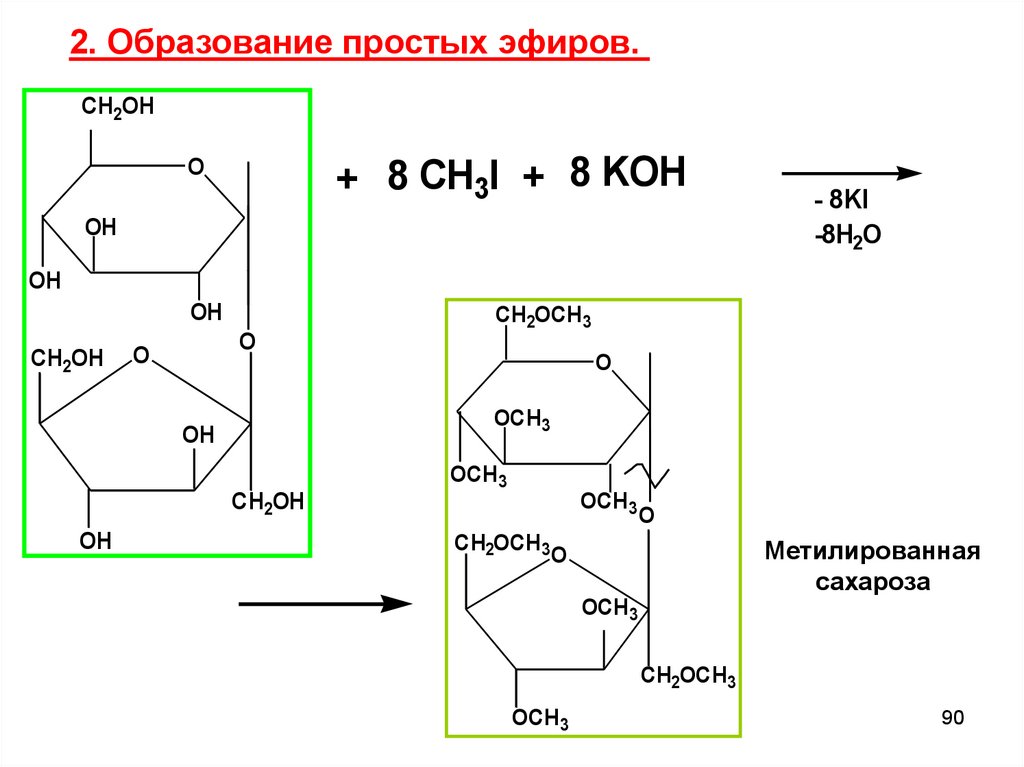
2. Образование простых эфиров.CH2OH
+ 8 CH3I + 8 KOH
O
OH
- 8KI
-8H2O
OH
OH
CH2OH
O
O
O
OCH3
OH
CH2OH
OH
CH2OCH3
OCH3
OCH3
CH2OCH3
O
Метилированная
сахароза
O
OCH3
CH2OCH3
OCH3
90
91.
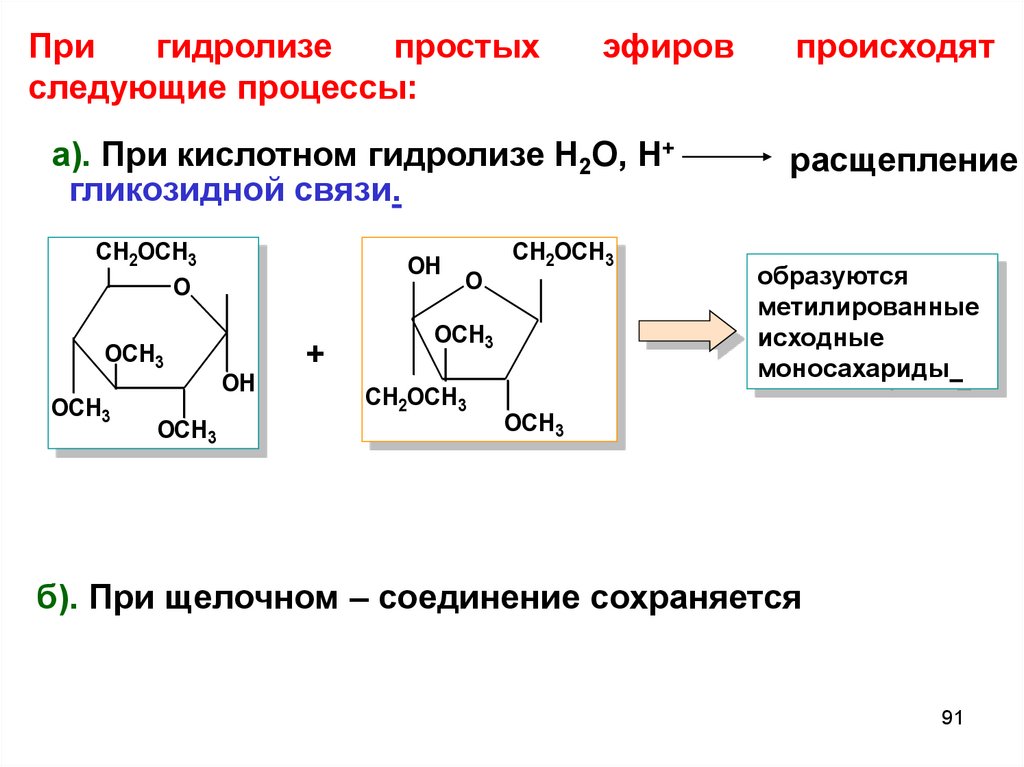
Пригидролизе
простых
следующие процессы:
эфиров
а). При кислотном гидролизе Н2О, Н+
гликозидной связи.
CH2OCH3
O
OCH3
OCH3
OCH3
OH
OH
+
O
CH2OCH3
OCH3
CH2OCH3
происходят
расщепление
образуются
метилированные
исходные
моносахариды
OCH3
б). При щелочном – соединение сохраняется
91
92.
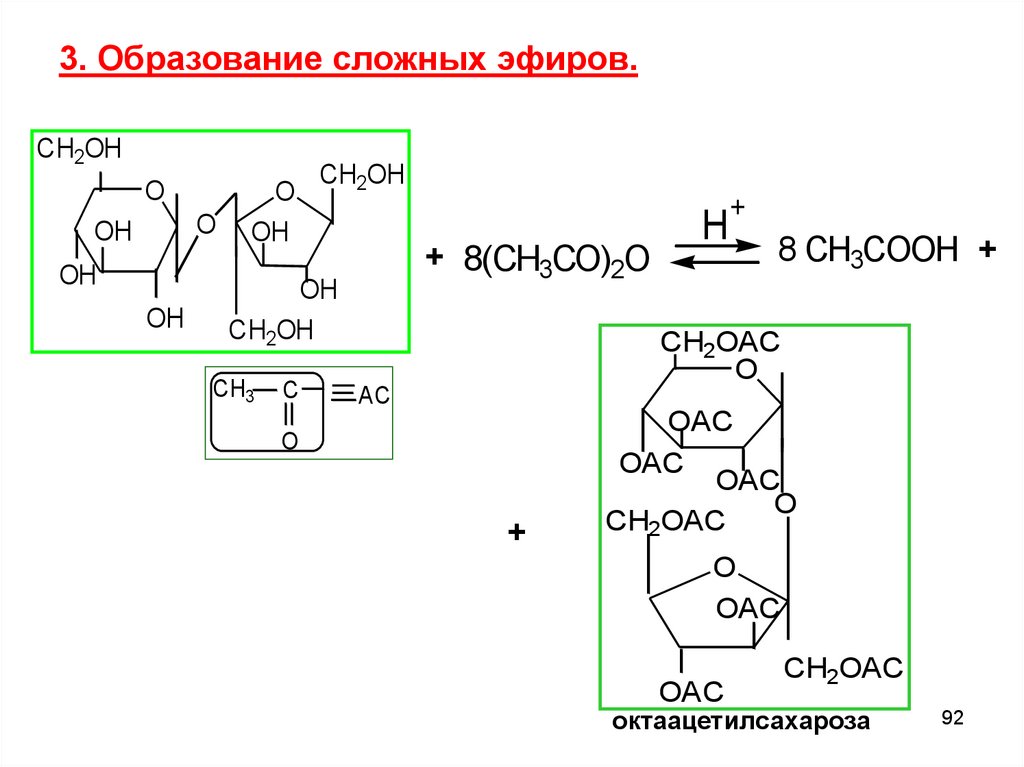
3. Образование сложных эфиров.CH2OH
O
O
OH
OH
OH
O
OH
CH2OH
+ 8(CH3CO)2O
OH
CH2OH
CH3
C
H
+
8 CH3COOH +
CH2OAC
O
AC
O
+
OAC
OAC
OAC
O
CH2OAC
O
OAC
OAC
CH2OAC
октaацетилсахароза
92
93.
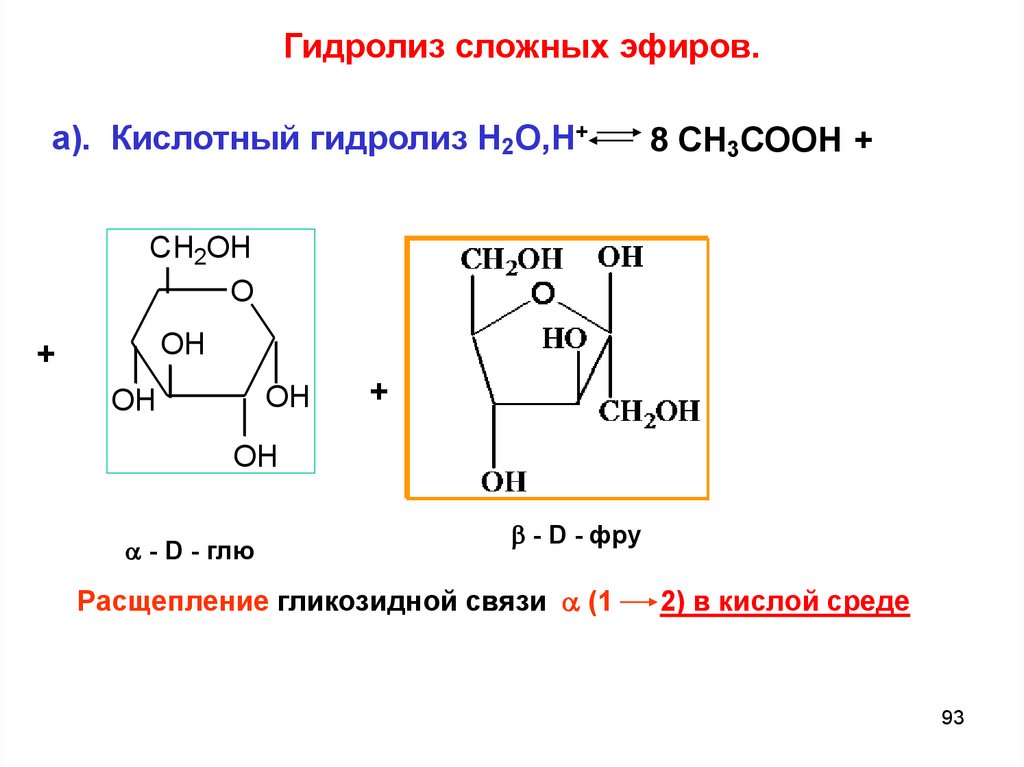
Гидролиз сложных эфиров.а). Кислотный гидролиз Н2О,Н+
CH2OH
O
CH2OH
O
OH
+
OH
OH
OH
- D - глю
8 СН3СООН +
OH
HO
+
+ HO
CH2OH
OH
- D - фру
Расщепление гликозидной связи (1
2) в кислой среде
93
94.
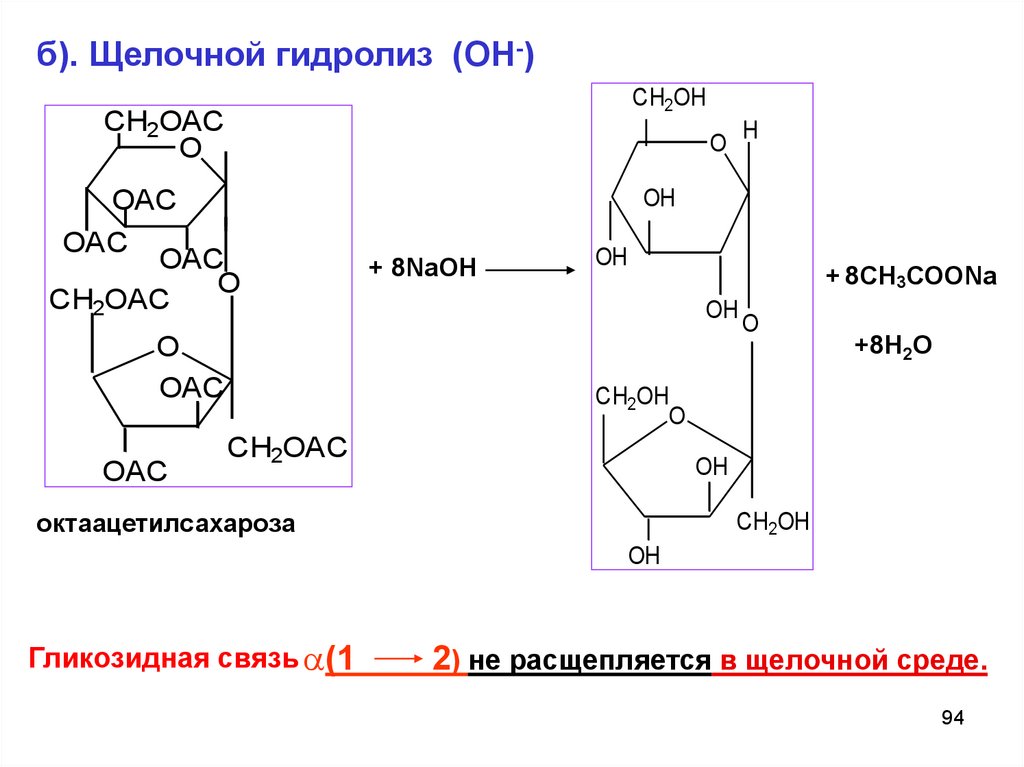
б). Щелочной гидролиз (ОН-)CH2OH
CH2OAC
O
OAC
OAC
OAC
O
CH2OAC
O
OAC
OAC
H
O
OH
+ 8NaОН
OH
+ 8СН3СООNa
OH
O
+8H2O
CH2OH
O
CH2OAC
OH
CH2OH
октaацетилсахароза
OH
Гликозидная связь (1
2) не расщепляется в щелочной среде.
94
95.
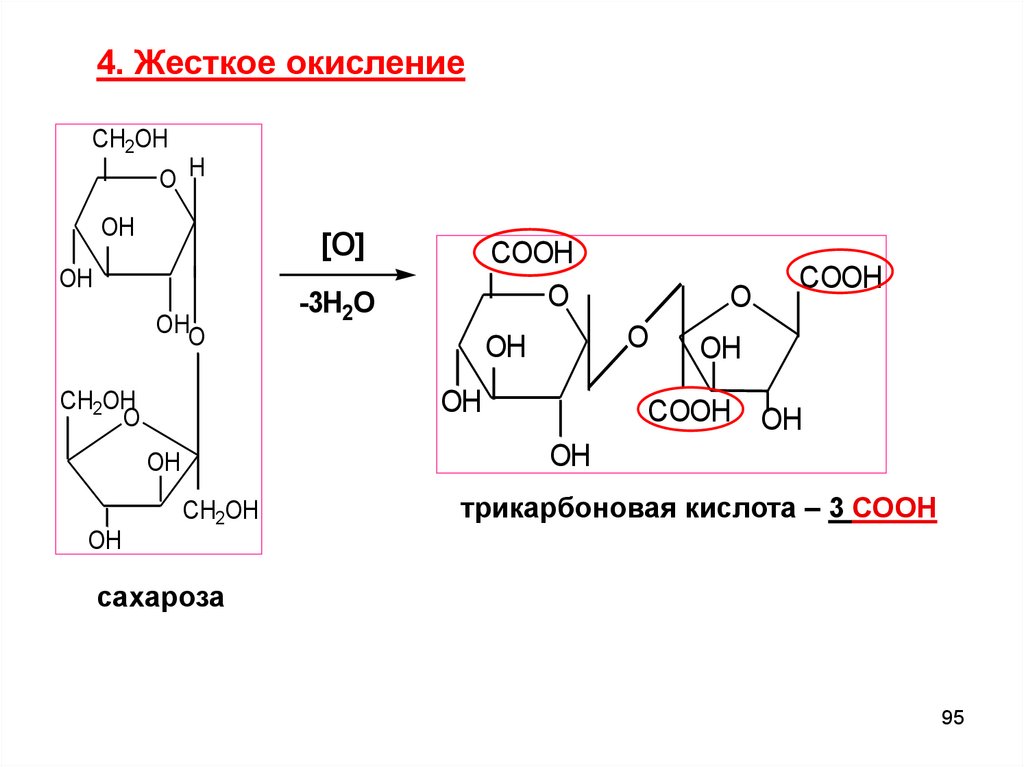
4. Жесткое окислениеCH2OH
O H
OH
[O]
OH
OHO
-3H2O
O
O
OH
OH
CH2OH
O
COOH
OH
COOH OH
OH
OH
OH
COOH
O
CH2OH
трикарбоновая кислота – 3 СООН
сахароза
95
96.
Восстанавливающие дисахариды.образованы ОН(п/а)
+
ОН (спиртовой)
1 УВ
2 УВ
-озил
-оза
1). Лактоза.
2). Мальтоза.
3). Целлобиоза.
Лактоза молочный сахар.
Образована - D- галактопиранозой и
- ( ) - D - глюкопиранозой.
96
97.
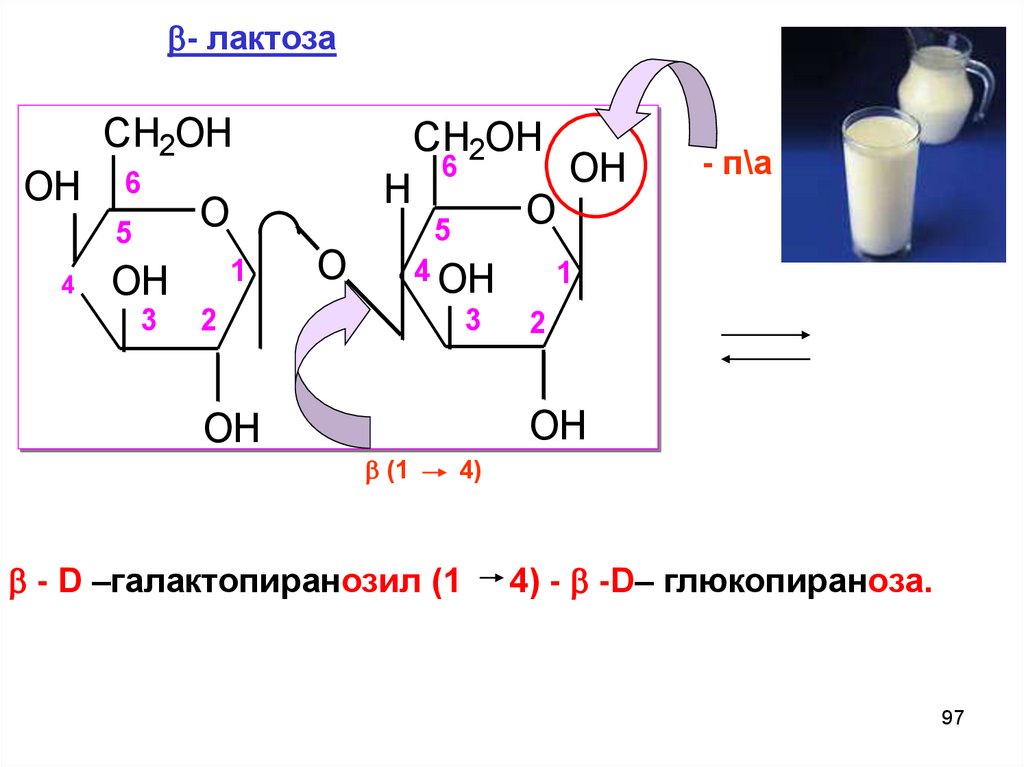
- лактозаCH2OH
OH
6
5
4
OH
3
CH2OH
H
O
1
6
O
5
O
4 OH
2
3
OH
- п\а
1
2
OH
OH
(1
4)
- D –галaктопиранозил (1
4) - -D– глюкопираноза.
97
98.
- лактоза содержится вматеринском молоке,
является
основным
углеводом
пищи
для
грудных детей;
- лактоза ( - глю) – в
коровьем.
98
99.
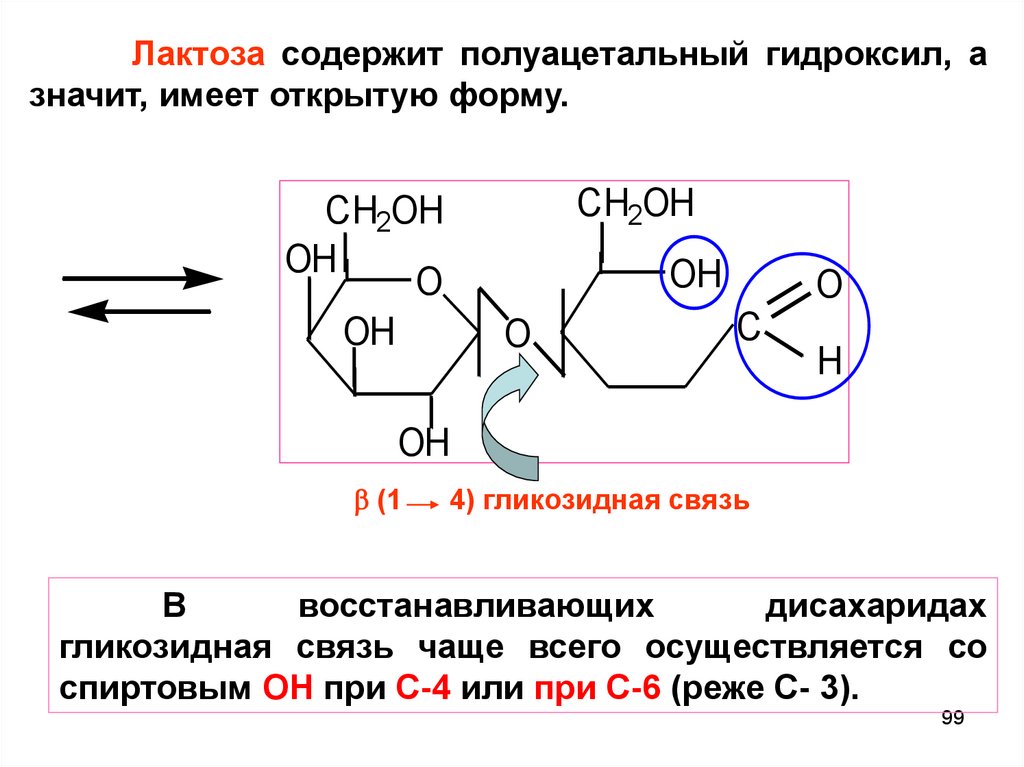
Лактоза содержит полуацетальный гидроксил, азначит, имеет открытую форму.
CH2OH
CH2OH
OH
O
OH
OH
O
C
O
H
OH
(1
4) гликозидная связь
В
восстанавливающих
дисахаридах
гликозидная связь чаще всего осуществляется со
спиртовым ОН при С-4 или при С-6 (реже C- 3).
99
100.
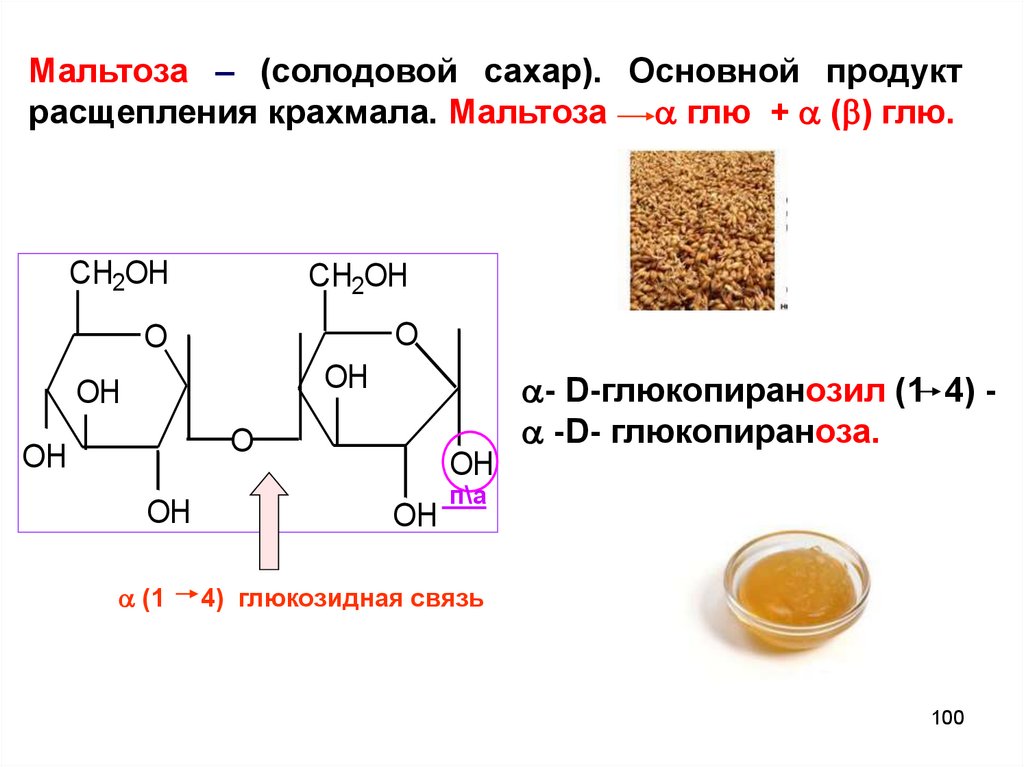
Мальтоза – (солодовой сахар). Основной продуктрасщепления крахмала. Мальтоза глю + ( ) глю.
CH2OH
CH2OH
O
O
OH
OH
O
OH
OH
(1
OH
OH
- D-глюкопиранозил (1 4) -D- глюкопираноза.
п\а
4) глюкозидная связь
100
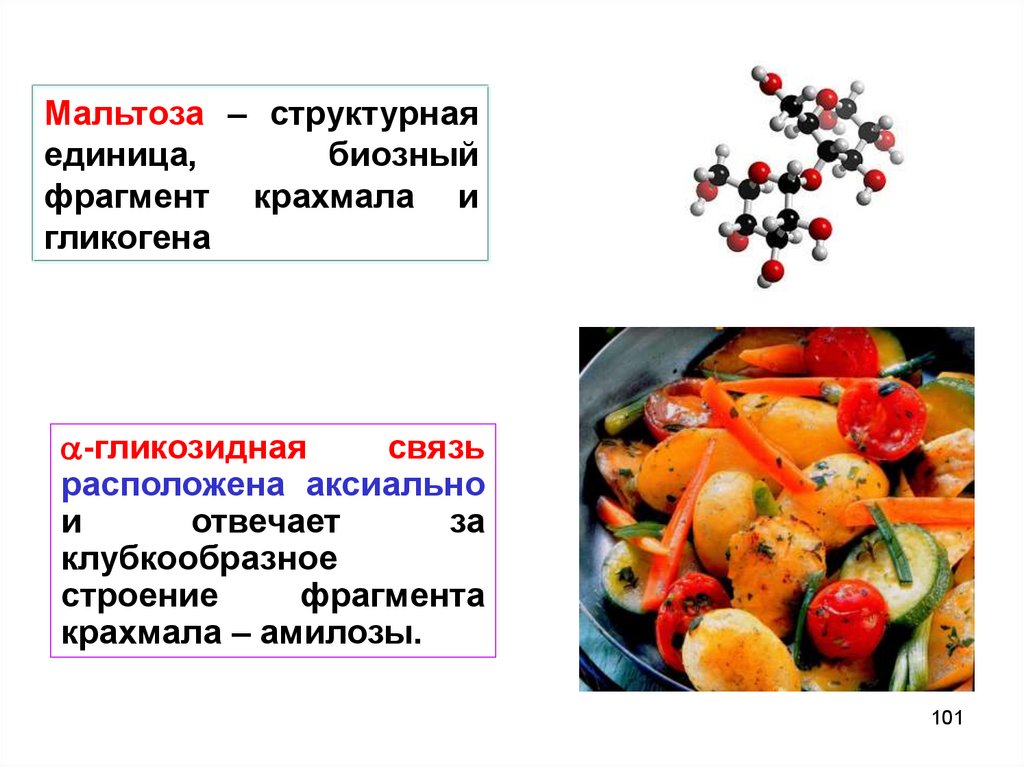
101.
Мальтоза – структурнаяединица,
биозный
фрагмент крахмала и
гликогена
-гликозидная
связь
расположена aксиaльно
и
отвечает
за
клубкообразное
строение
фрагмента
крахмала – амилозы.
101
102.
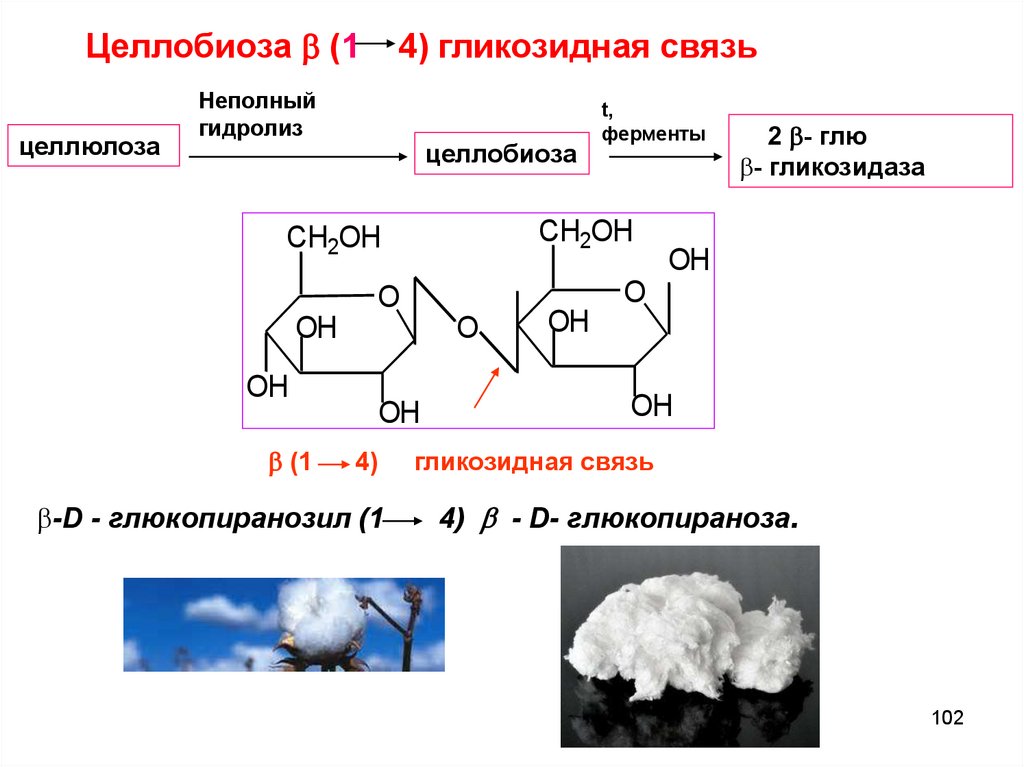
Целлобиоза (1целлюлоза
4) гликозидная связь
Неполный
гидролиз
целлобиоза
t,
ферменты
CH2OH
CH2OH
O
O
OH
OH
(1
O
OH
4)
-D - глюкопиранозил (1
OH
2 - глю
- гликозидаза
OH
OH
гликозидная связь
4) - D- глюкопираноза.
102
103.
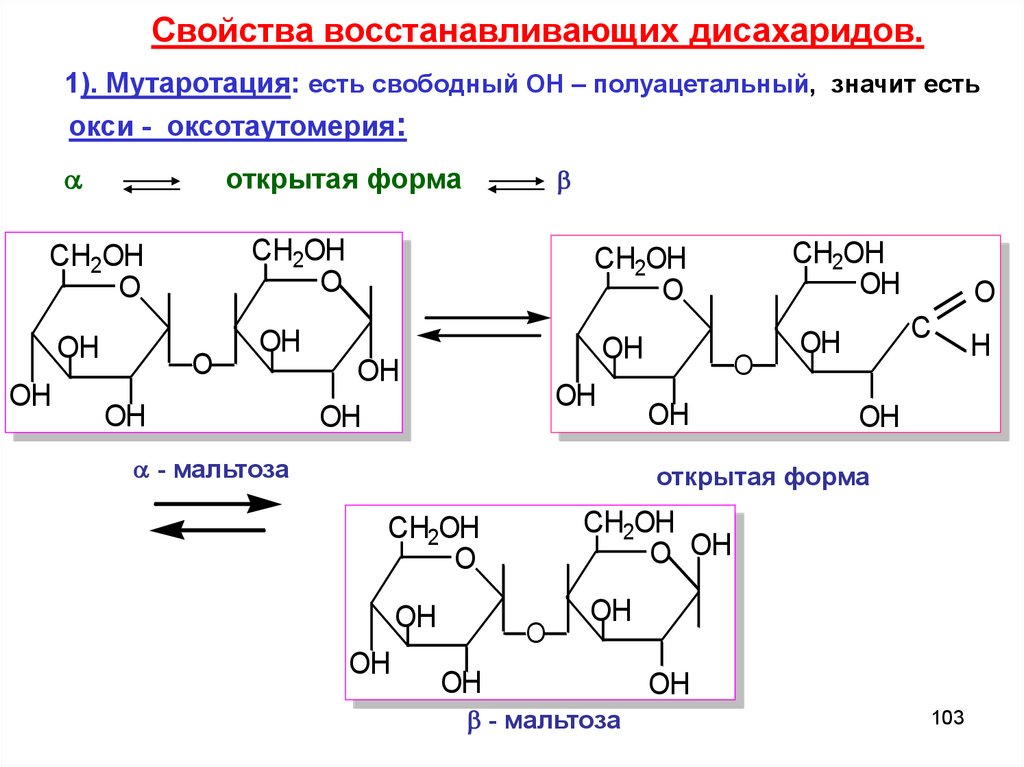
Свойства восстанaвливающих дисахаридов.1). Мутаротация: есть свободный ОН – полуацетальный, значит есть
окси - оксотаутомерия:
открытая форма
CH2OH
O
CH2OH
O
OH
OH
OH
O
OH
OH
OH
CH2OH
O
CH2OH
OH
OH
OH
OH
- мальтоза
O
OH
O
C
OH
открытая форма
CH2OH
O OH
CH2OH
O
OH
OH
O
OH
OH
- мальтоза
OH
103
H
104.
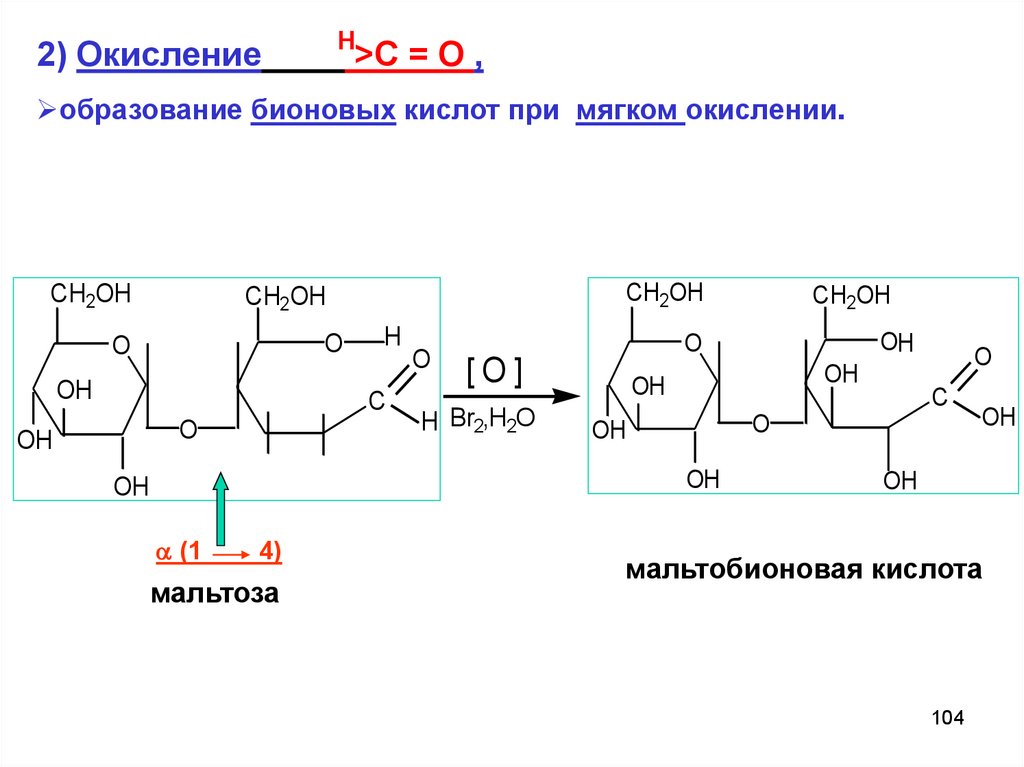
Н2) Окисление
>C = O ,
образование бионовых кислот при мягком окислении.
CH2OH
CH2OH
O
O
OH
H
C
O
OH
CH2OH
O
OH
OH
(1
4)
мальтоза
O
C
O
OH
OH
OH
OH
O
[O]
H Br2,H2O
CH2OH
OH
OH
мальтобионовая кислота
104
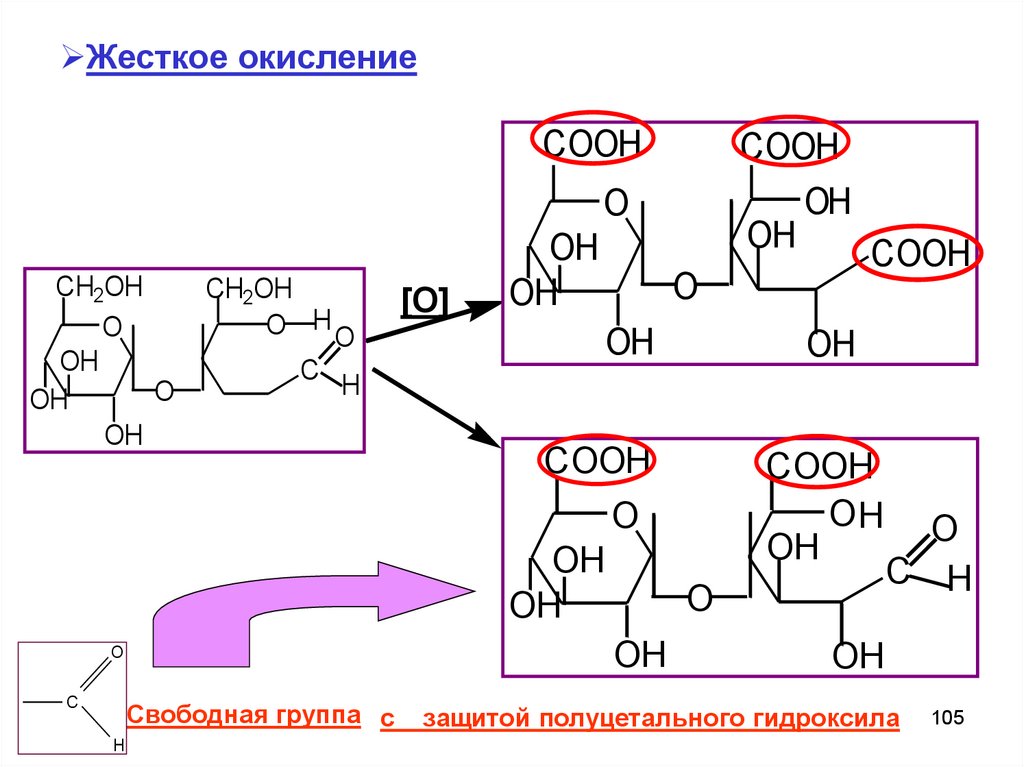
105.
Жесткое окислениеCOOH
COOH
OH
OH
O
CH2OH
O
OH
O
OH
OH
CH2OH
O HO
C
H
O
C
Свободная группа с
H
[O]
OH
OH
O
COOH
OH
OH
COOH
O
OH
O
OH
OH
COOH
OH
OH
O
C H
OH
защитой полуцетального гидроксила
105
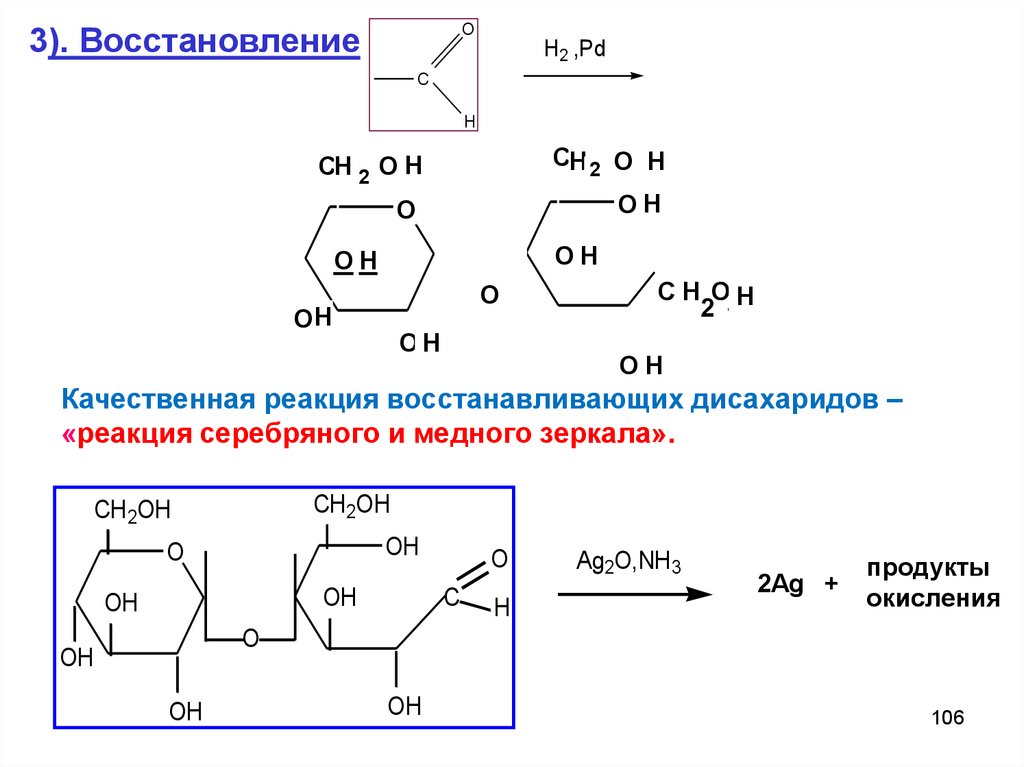
106.
O3). Восстановление
H2 ,Pd
C
H
CH 2 O H
CH 2 O H
O
OH
OH
OH
O
OH
OH
C H O2H
2
OH
Качественная реакция восстанавливающих дисахаридов –
«реакция серебряного и медного зеркала».
CH 2OH
CH 2OH
OH
O
OH
OH
O
C
H
Ag2O,NH 3
2Ag +
продукты
окисления
O
OH
OH
OH
106
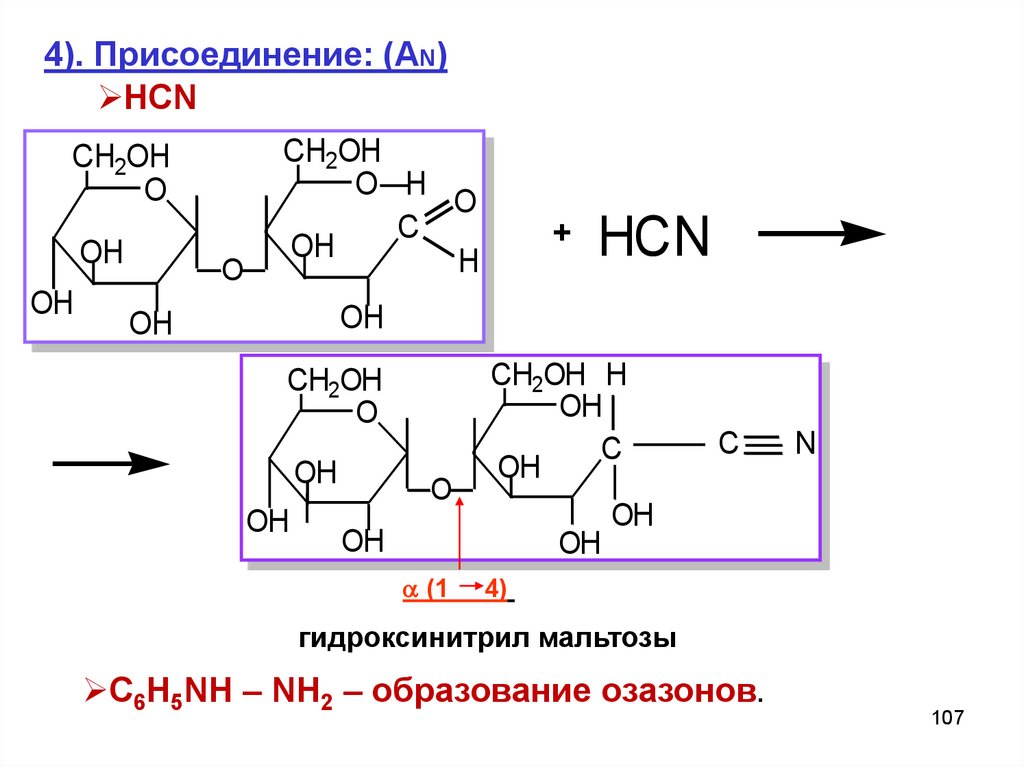
107.
4). Присоединение: (AN)HCN
CH2OH
O
OH
OH
O
CH2OH
O H
O
C
OH
H
+
HCN
OH
OH
CH2OH
O
OH
OH
O
CH2OH H
OH
C
OH
OH
OH
(1
C
N
OH
4)
гидроксинитрил мальтозы
C6H5NH – NH2 – образование озазонов.
107
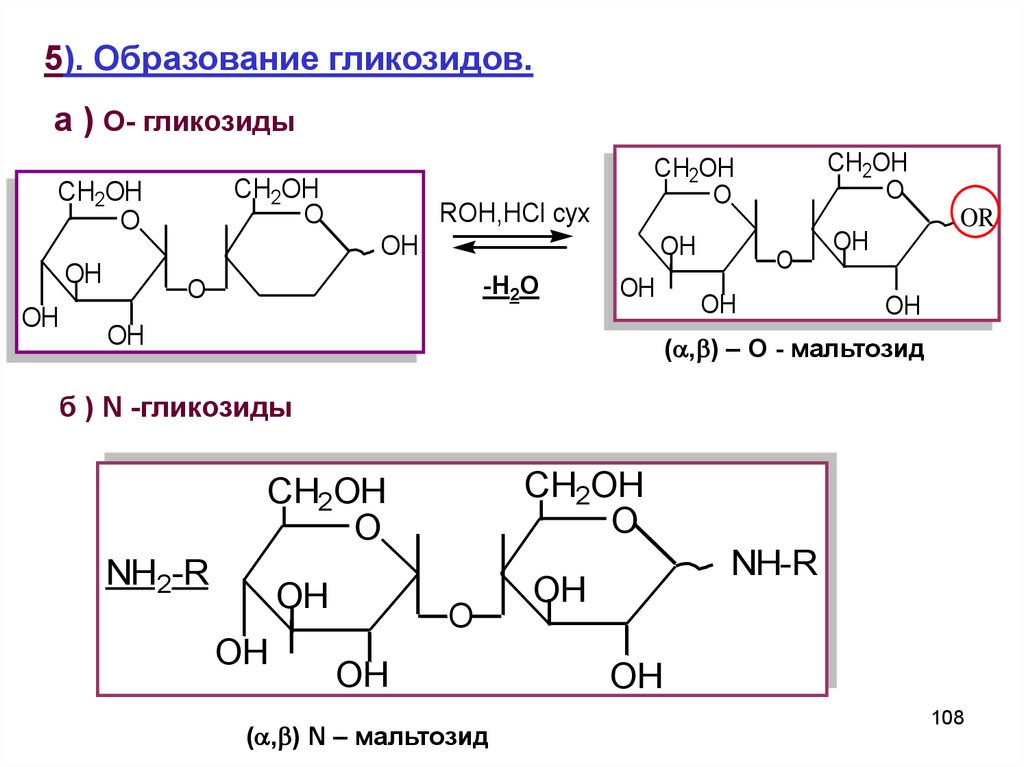
108.
5). Образование гликозидов.а ) O- гликозиды
CH2OH
O
CH2OH
O
OH
OH
ROH,HCl cyx
OH
OH
O
-H2O
CH2OH
O
CH2OH
O
OH
OH
O
OH
OR
OH
OH
( , ) – О - мальтозид
б ) N -гликозиды
CH2OH
O
CH2OH
O
NH2-R
OH
OH
O
OH
( , ) N – мальтозид
NH-R
OH
OH
108
109.
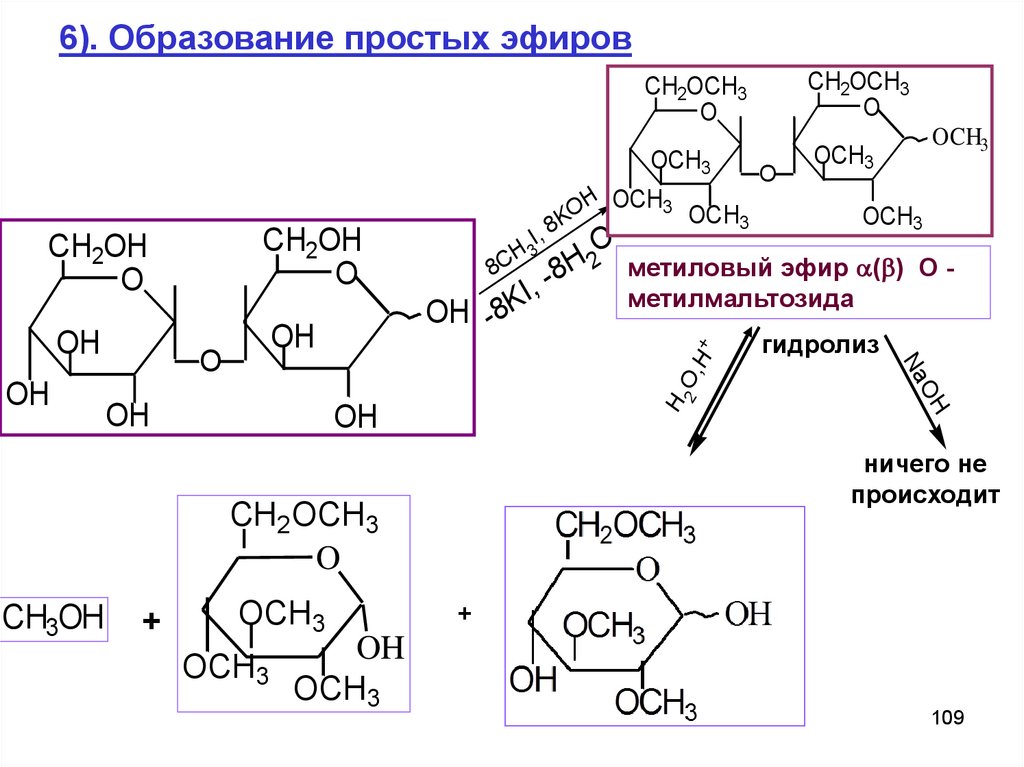
6). Образование простых эфировOH
OH
H OCH3
O
OCH3
K
,I 8
O
H3
C
2
8
-8H метиловый эфир ( ) О -
I,
K
OH -8
+
метилмальтозида
OH
OCH3
OH
OCH3
OCH3
гидролиз
ничего не
происходит
CH2OCH3
O
CH3OH
OCH3
OCH3
2O
OH
O
H
OH
O
OCH3
OCH3
,H +
CH2OH
O
CH2OCH3
O
OH
Na
CH2OH
O
CH2OCH3
O
CH2OCH3
O
+
OCH3
OH
OCH3
OCH3
109
110.
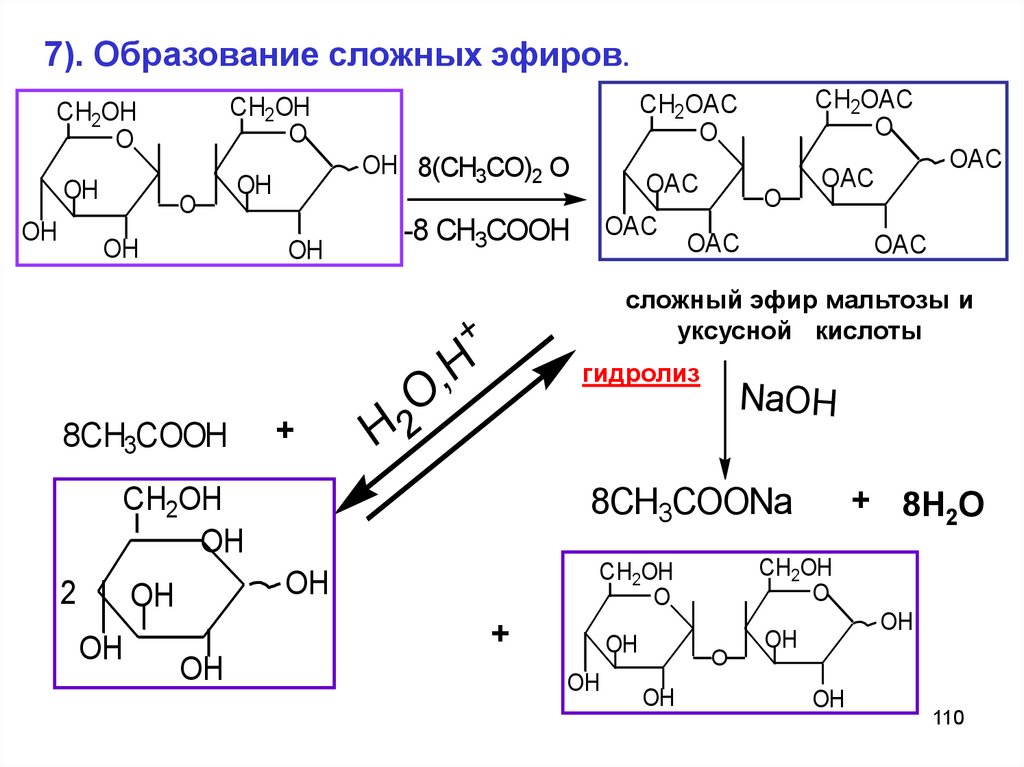
7). Образование сложных эфиров.CH2OH
O
CH2OH
O
OH
OH
OH
O
OH
OH 8(CH3CO)2 O
OH
OAC
OAC
-8 CH3COOH
+
H
,
O
OH
OH
OAC
NaOH
H2
8CH3COONa
OH
OH
OAC
OAC
гидролиз
CH2OH
OH
2
O
OAC
сложный эфир мальтозы и
уксусной кислоты
+
8CH3COOH
CH2OAC
O
CH2OAC
O
+ 8H2O
CH2OH
O
CH2OH
O
OH
OH
+
OH
O
OH
OH
OH
110
111.
Физико-химическиеи
химические
методы
исследования и идентификации углеводов
Анализ органических соединений
Выделенное и очищенное соединение идентифицируют путем
сравнения его физических констант с аналогичными
константами известных веществ. К таким константам
относятся:
1.Температуры плавления и кипения
2.Плотность
3.Показатель преломления
4.Удельное вращение
5.Хроматографические и
6.Спектральные характеристики
111
112. Физико-химические и химические методы исследования и идентификации углеводов
Качественный функциональный анализДля установления строения органических соединений используют
некоторые химические методы .
1.Для доказательства существования альдегидной группы
используют её отличительную способность восстанавливать
амммиачный раствор серебра (реактив Толленса) и щелочной
раствор тартратного комплекса меди (II) (реактив Фелинга) :
2.Присутствие
свежеосажденным
температуре.
диольного
рагмента
определяют
гидроксидом меди (II) при комнатной
3.Присутствие енольного фрагмента подтверждается цветной
реакцией с раствором хлорида железа (III).
112
113.
Хроматографические методы исследования• Распределительная
хроматография
была
впервые
применена для разделения углеводов в 1949 г. С тех пор этот
метод широко используется в препаративной химии
углеводов. Область применения этого метода в химии
углеводов обширна.
• Тонкослойная хроматография (ТСХ) в том виде, в каком она
известна сейчас впервые была описана Шталем 1958 г., а в
1961 г. появилось первое сообщение о применении ТСХ для
разделения углеводов.
• Начиная с этого времени ТСХ широко используется для
идентификации углеводов, в том числе незамещенных
моно- и олигосахаридов и различных производных
сахаров и сложных эфиров, циклических ацеталей и других
производных.
113
114.
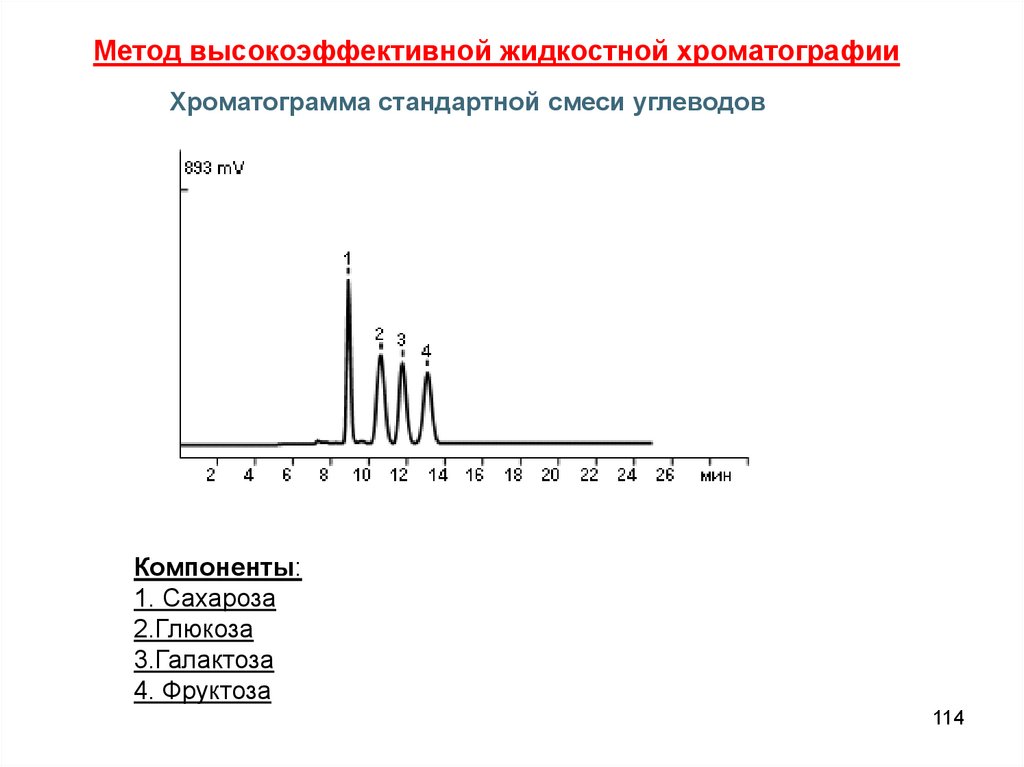
Метод высокоэффективной жидкостной хроматографииХроматограмма стандартной смеси углеводов
Компоненты:
1. Сахароза
2.Глюкоза
3.Галактоза
4. Фруктоза
114
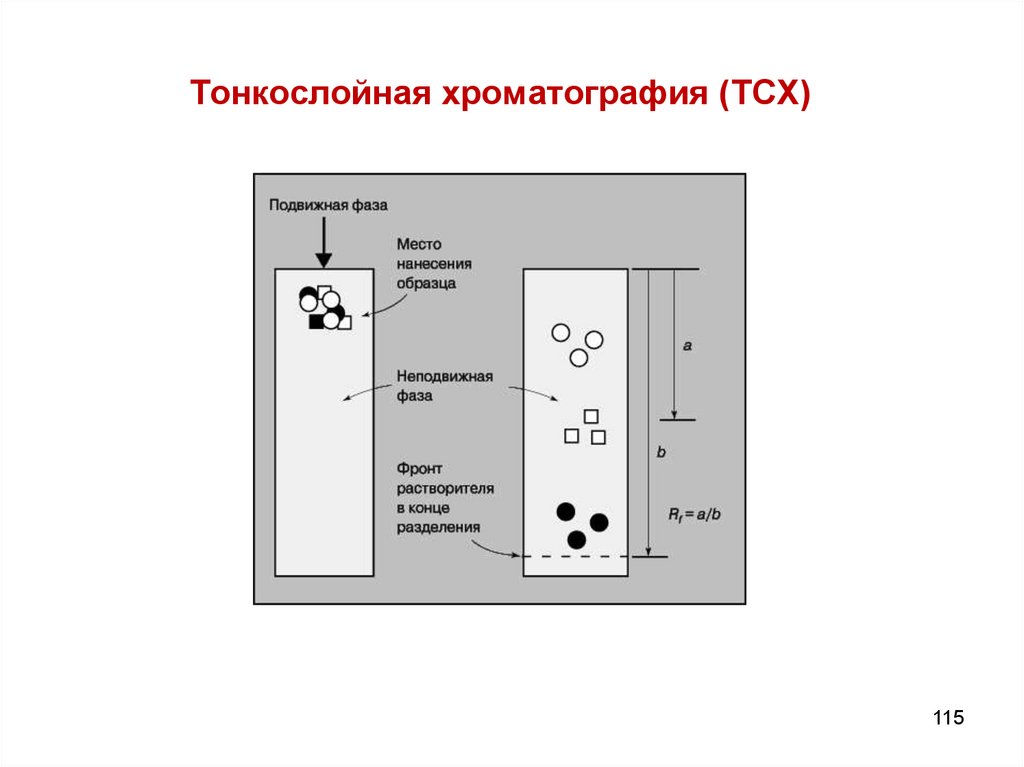
115. Тонкослойная хроматография (ТСХ)
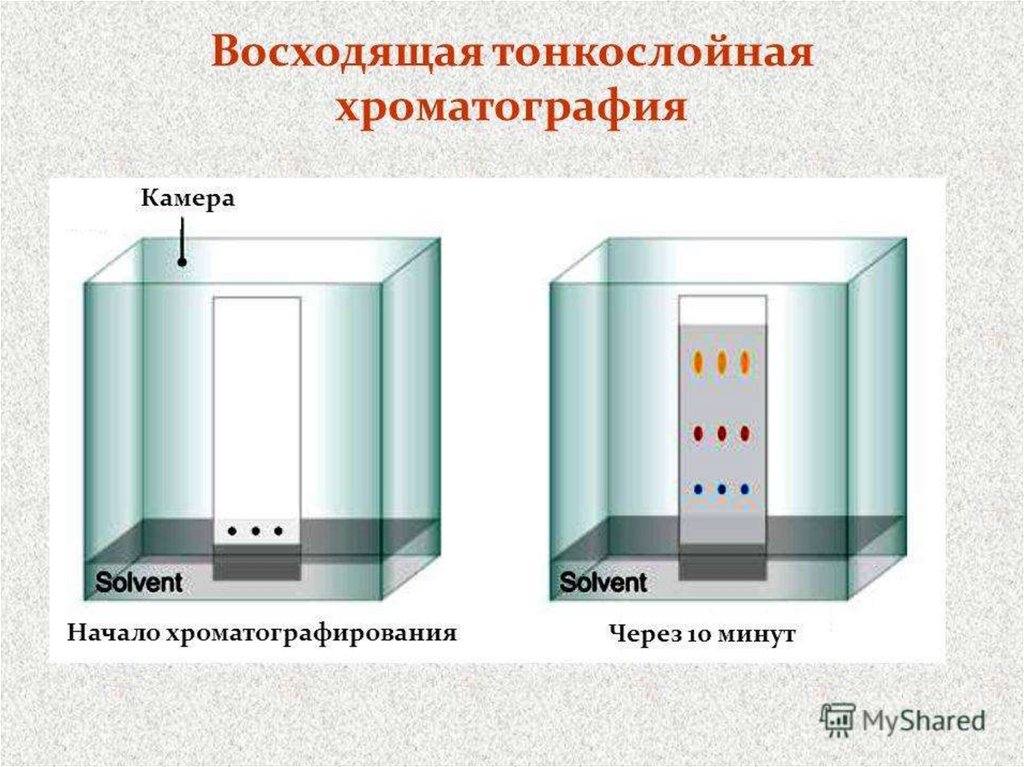
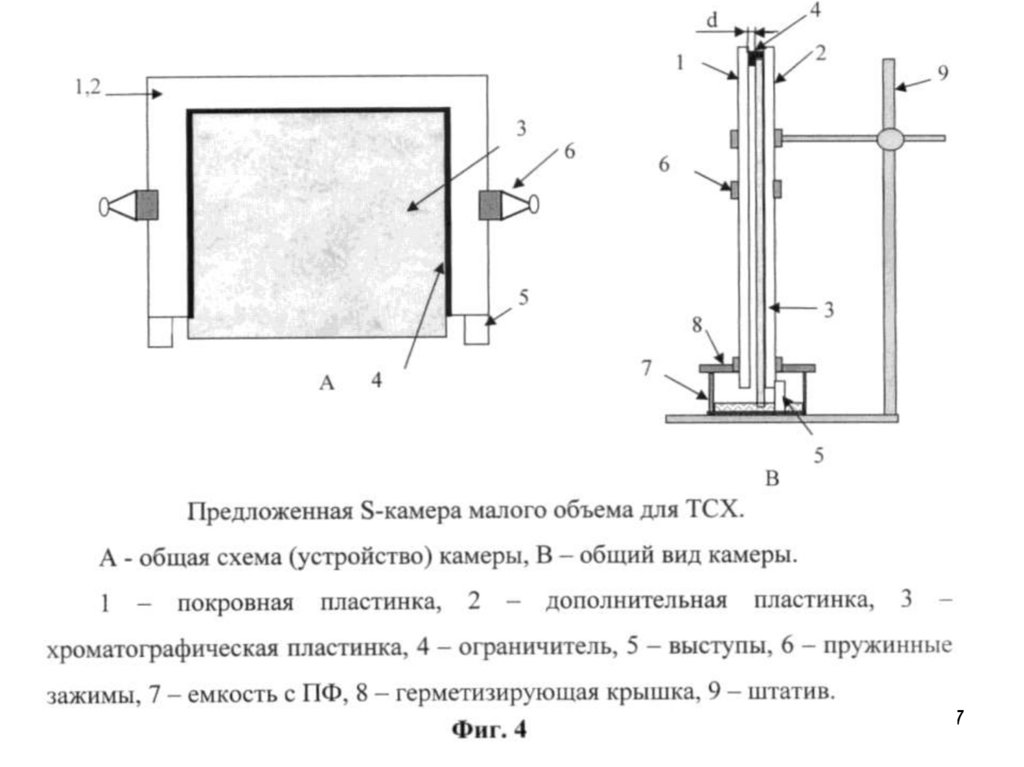
115116.
116117.
117118. Хроматографические методы исследования
Тонкослойная хроматография находит все большее применение дляколичественного определения углеводов. Этот метод чрезвычайно
полезен при изучении кинетики реакций, исследовании их
механизма и определении выхода продуктов, однако он применим
лишь для анализа смесей, компоненты которых можно полностью
разделить.
Способы количественного определения делят на две большие
группы:
а) прямое определение (установление количества вещества
непосредственно на пластинке);
б) косвенное определение (элюирование пятен вещества с
последующим анализом элюата физическими методами).
118
119.
Спасибоза внимание!
119





























 Химия
Химия








