Похожие презентации:
Многоатомные спирты
1. Многоатомные спирты
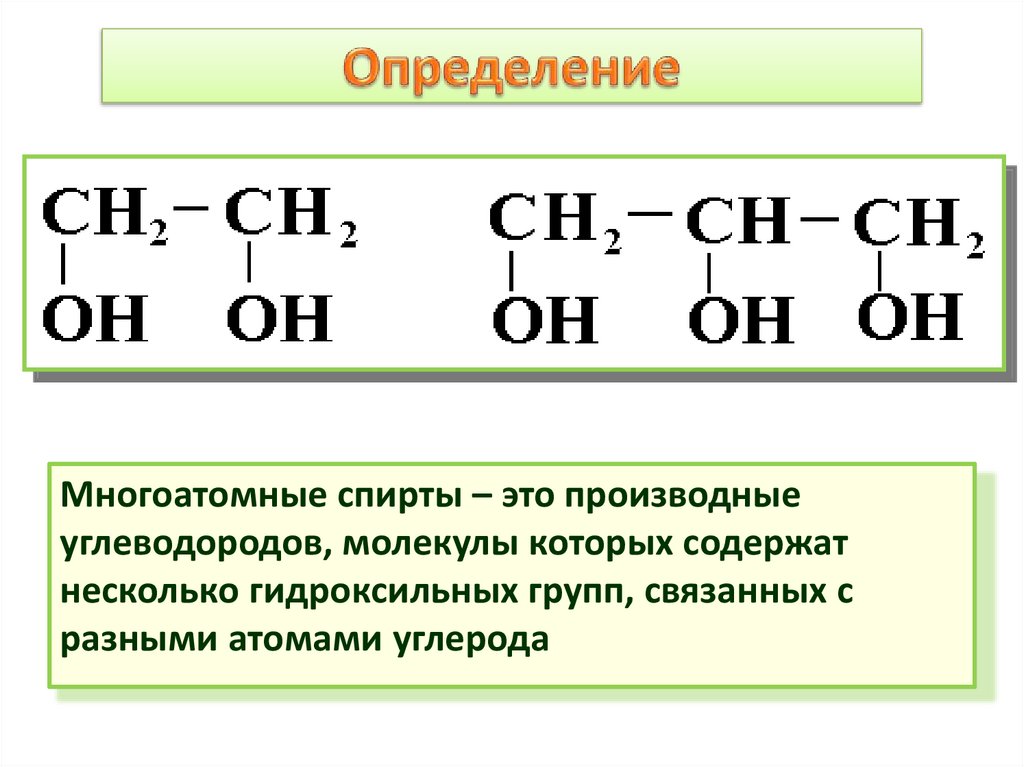
2. Определение
Многоатомные спирты – это производныеуглеводородов, молекулы которых содержат
несколько гидроксильных групп, связанных с
разными атомами углерода
3. Номенклатура
По систематической номенклатуре названиемногоатомных спиртов дается следующим
образом:
4. Физические свойства.
ЭтиленгликольГлицерин
б/ц, б/з вязкая
сладковатая жидкость
б/ц, б/з вязкая
сладковатая жидкость
Неограниченно
растворим в воде
Неограниченно
растворим в воде
t0кип= -120С
t0кип= - 170С
t0пл = 1970С
t0пл = 2900С
ρ = 1,43г/см3
ρ = 1,26г/см3
Ядовит!!!
5. Многоатомный спирт -этиленгликоль
Многоатомный спирт этиленгликоль• Этиленгликоль — представитель
предельных двухатомных спиртов —
гликолей.
• Название гликоли получили вследствие
сладкого вкуса многих представителей
ряда (греч. «гликос» — сладкий).
• Этиленгликоль - сиропообразная
жидкость сладкого вкуса, без запаха,
ядовит. Хорошо смешивается с водой и
спиртом, гигроскопичен.
6. Применение этиленгликоля
• Важным свойствомэтиленгликоля является
способность понижать
температуру замерзания воды,
от чего вещество нашло
широкое применения как
компонент автомобильных
антифризов и незамерзающих
жидкостей.
• Он применяется для
получения лавсана (ценного
синтетического волокна).
7. Этиленгликоль – яд !
Дозы вызывающие смертельное отравление
этиленгликолем варьируются в широких пределах - от
100 до 600 мл. Смертельной дозой для человека
является 50-150 мл. Смертность при поражении
этиленгликолем очень высока и составляет более 60%
всех случаев отравления.
• Механизм токсического действия этиленгликоля до
настоящего времени изучен недостаточно.
Этиленгликоль быстро всасывается (в том числе через
поры кожи) и в течение нескольких часов циркулирует
в крови в неизмененном виде, достигая максимальной
концентрации через 2-5 часов. Затем его содержание в
крови постепенно снижается, и он фиксируется в
тканях.
8.
Химические свойствамногоатомных спиртов
Химические
свойства
КИСЛОТНЫЕ
СВОЙСТВА
РЕАКЦИИ
ЗАМЕЩЕНИЯ
РЕАКЦИИ
ОКИСЛЕНИЯ
КАЧЕСТВЕННАЯ
РЕАКЦИЯ
РЕАКЦИИ с :
щелочными
металлами,
нерастворимыми
основаниями
РЕАКЦИИ с :
галогеноводородами;
этерификация
РЕАКЦИИ:
горения,
окисления
РЕАКЦИЯ с
Cu(OH)2
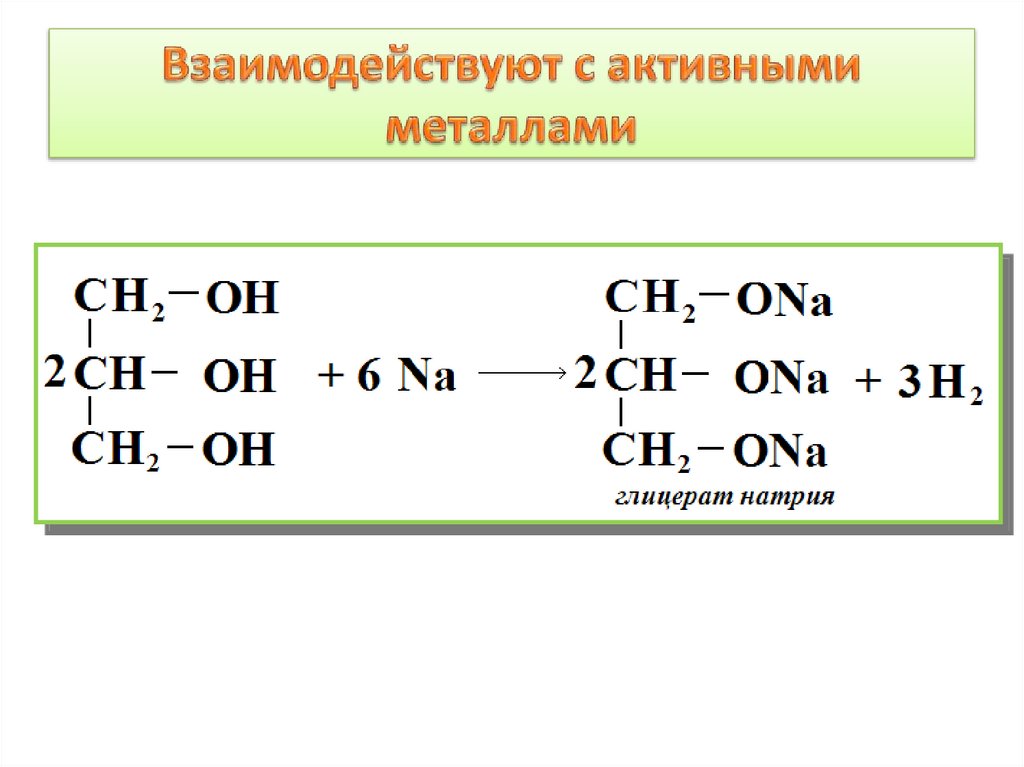
9. Взаимодействуют с активными металлами
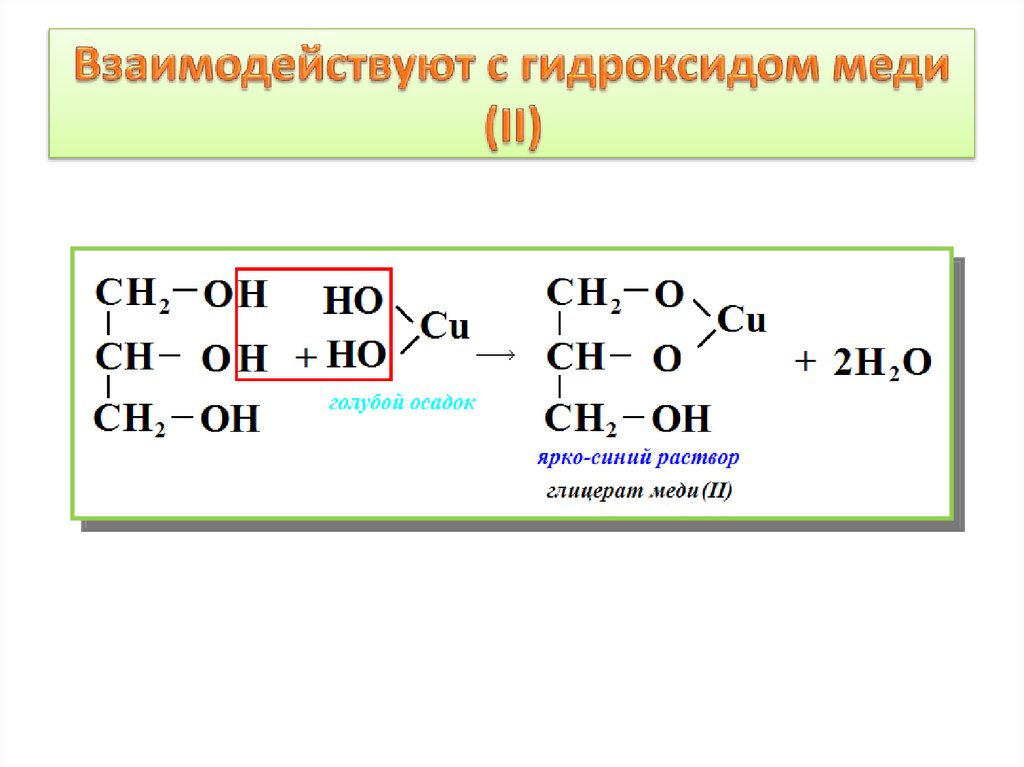
10. Взаимодействуют с гидроксидом меди (II)
11. Взаимодействуют с галогенводородами
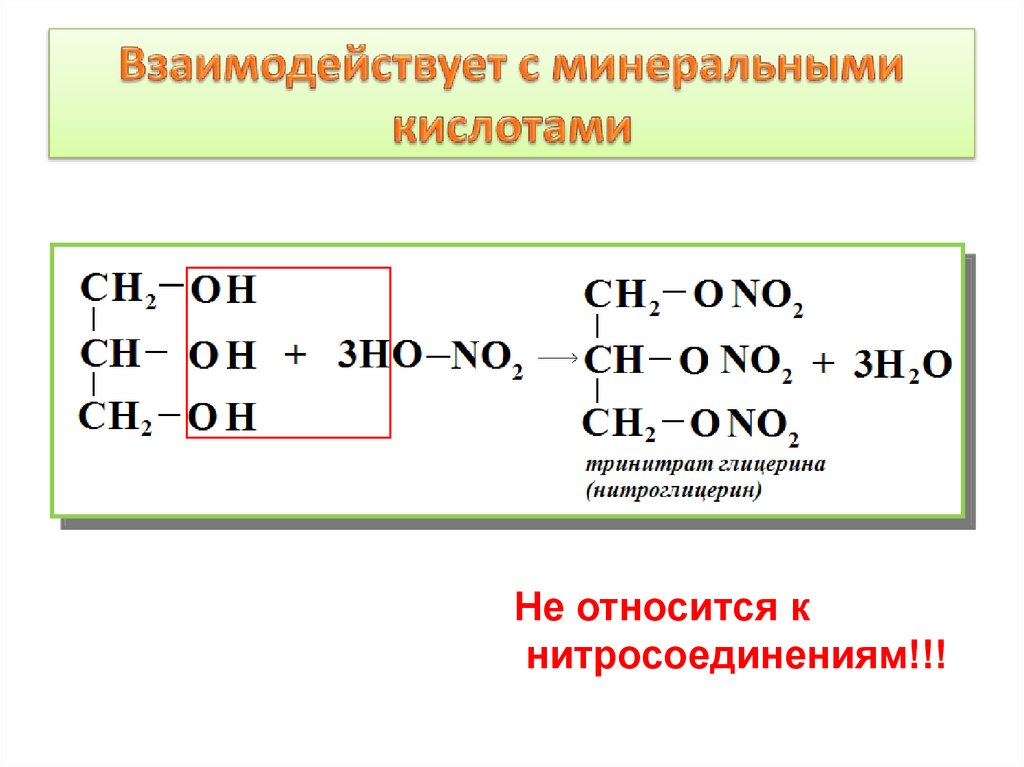
12. Взаимодействует с минеральными кислотами
Не относится книтросоединениям!!!
13. О нитроглицерине
Его производство разработал русский ученыйН.Н.Зинин в 1853г., но предложения о строительстве
промышленных предприятий по изготовлению
снарядов и мин не заинтересовали царское
правительство. Только в 1863-1867 гг. нитроглицерин
начали успешно применять для подземных и
подводных взрывов. Ученик Н.Н.Зинина Альфред
Нобель продолжил работы своего учителя и
запатентовал способ производства динамита в 1867г.
14. О нитроглицерине
• Оказывает антиангинальное и спазмолитическоедействие, расслабляет гладкую
мускулатуру сосудистых
стенок, бронхов, желудочно-кишечного
тракта, желчевыводящих путей, мочеточников.
При внутривенном введении вызывает
уменьшает приток крови к правому предсердию,
способствует снижению давления в «малом»
круге кровообращения
• 5.30
https://www.youtube.com/watch?v=5V2zbeGUtwo#t=169.627987012987
15. Взаимодействуют с органическими кислотами
16.
CH2 -OHH2O,
+
H
CH -OH + 3 C17H35-COOH
CH2 -O- CO-C17 H35
to
CH2 -O- CO-C17 H35
CH2 -OH
стеариновая кислота
глицерин
CH -O- CO-C17 H35
тристеарин
17. Получение
18. Получение этиленгликоля
Гидролиз дигалогенэтанаОкисление этилена
Гидратация оксида этилена
19.
20. Гидролиз жиров
В зависимости от условий бывает:А) водный (без катализатора, при высоких
температуре и давлении)
Б) кислотный (в присутствии кислоты в
качестве катализатора)
В) ферментативный (происходит в живых
клетках)
Г) щелочной (под действием щелочей).
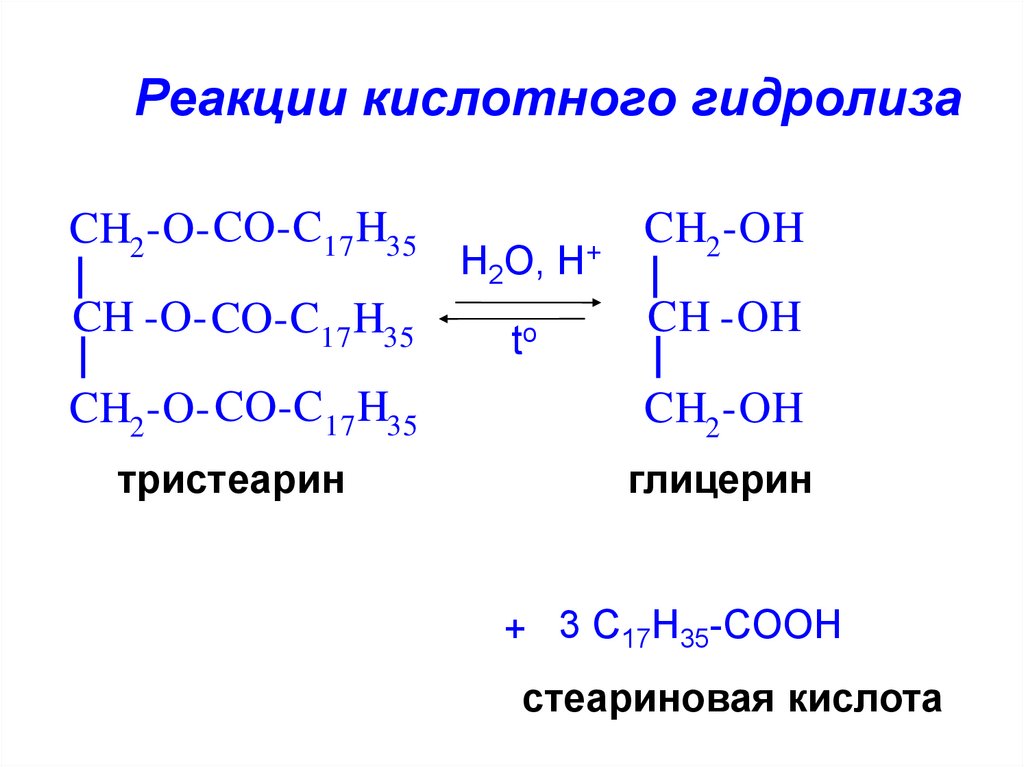
21.
Реакции кислотного гидролизаCH2 -O- CO-C17 H35
CH -O- CO-C17 H35
H2O, H+
to
CH2 -OH
CH -OH
CH2 -O- CO-C17 H35
CH2 -OH
тристеарин
глицерин
+ 3 C17H35-COOH
стеариновая кислота
22. Применение глицерина
• В производстве взрывчатых веществ, вчастности тринитрата глицерина.
• При обработке кожи, для предотвращения от
высыхания.
• В текстильной промышленности для придания
тканям мягкости и шелковистости.
• Как компонент некоторых клеeв.
• При производстве пластмасс в качестве
пластификатора – компонента, придающего
материалу гибкость и эластичность.
• В производстве кондитерских изделий и
напитков (как пищевая добавка E422).
• Широко используется в парфюмерной
промышленности: входит в состав кремов,
помад, зубных паст, предотвращая их от
высыхания и способствуя увлажнению и
смягчению кожи.
• Несмотря на взрывоопасность этого вещества,
в очень малых дозах его применяют в
медицине в качестве сосудорасширяющего
средства при сердечно-сосудистых
23. Глицерин. Видео по теме
• https://www.youtube.com/watch?v=ir_S46_qyaE
24. Вулкан Шееле: глицерин и перманганаткалия
• Реакцию можно выразить уравнением:14КМnО4 + 3С3Н5(ОН)3 = 7K2CO3 + 14MnO2 + 12H2O +
2CO2
• Взаимодействие сопровождается выделением
большого количества теплоты и газов
(углекислый газ СО2 и пары воды Н2О), которые
увлекают за собой горячие твердые частицы
диоксида марганца МnО2 и карбоната калия
К2CO3.
https://www.youtube.com/watch?v=lTrFoLSUDgs



















 Химия
Химия








