Похожие презентации:
Многоатомные спирты
1.
900igr.net2. Вопросы для повторения
Какими способами может бытьполучен этиловый спирт?
Назовите условия промышленного
процесса гидратации этилена и
дайте им объяснение.
3. Задания
Напишите структурные формулыпропанола-2, 2,2-диметилпропанола-1;
На примере пропилового спирта
охарактеризуйте химические свойства
одноатомных спиртов. Напишите
уравнения соответствующих реакций.
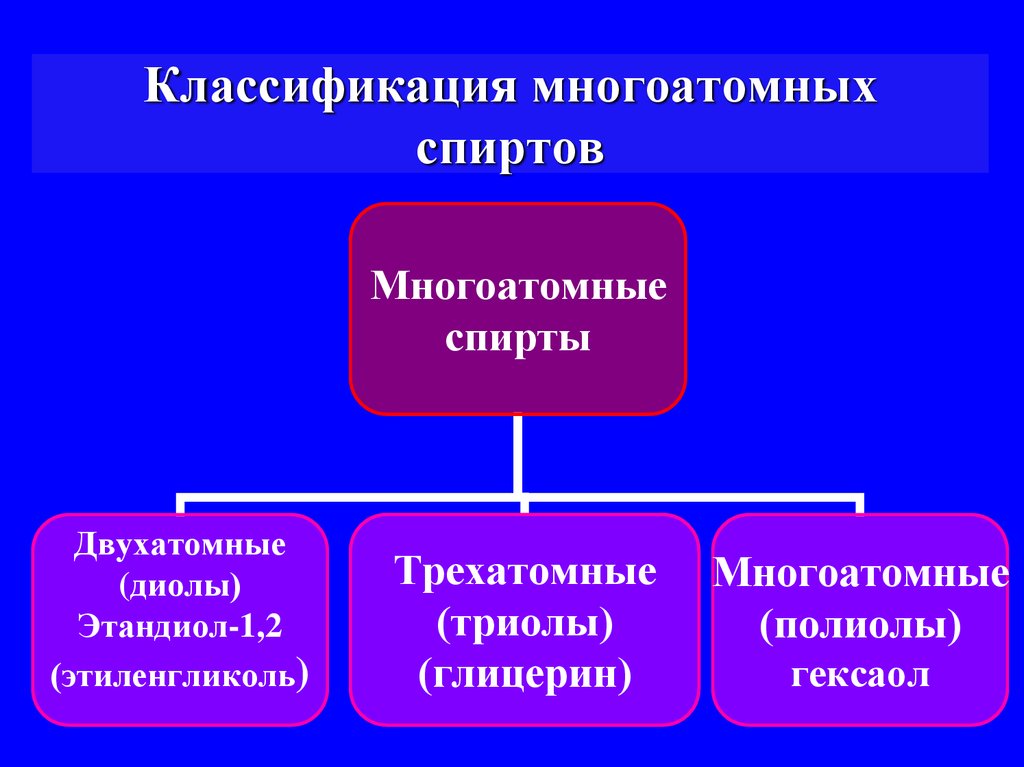
4. Классификация многоатомных спиртов
Многоатомныеспирты
Двухатомные
(диолы)
Этандиол-1,2
(этиленгликоль)
Трехатомные
(триолы)
(глицерин)
Многоатомные
(полиолы)
гексаол
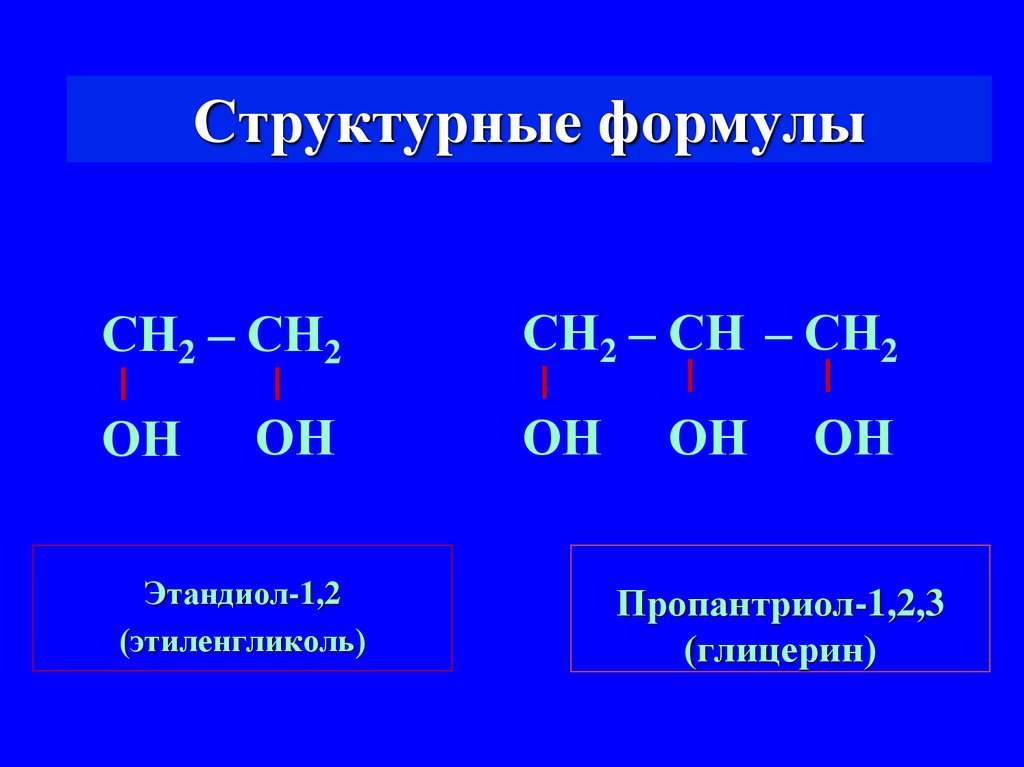
5. Структурные формулы
СН2 – СН2ОН
ОН
Этандиол-1,2
(этиленгликоль)
СН2 – СН – СН2
ОН
ОН
ОН
Пропантриол-1,2,3
(глицерин)
6.
Этандиол-1,2(этиленгликоль)
Пропантриол-1,2,3
(глицерин)
7. Физические свойства глицерина
Бесцветная, прозрачная, вязкая,сиропообразная жидкость,
сладкая на вкус.
не ядовит
t кип= 2900 С
Неограниченно растворим в воде,
очень гигроскопичен
8. Физические свойства этиленгликоля
бесцветная вязкая жидкость сосвоеобразным запахом, сладкого вкуса
ядовит
t кип= 1980 С
С водой смешивается в любых
соотношениях, причем эти растворы
имеют очень низкую температуру
замерзания.
9. Сравнение физических свойств одноатомных и многоатомных спиртов
СпиртыМr
Tкип, 0С
Плотность,
г/ см3
Этанол
Пропанол-1
Глицерин
46
60
92
78
97
290
0,79
0,80
1,26
10.
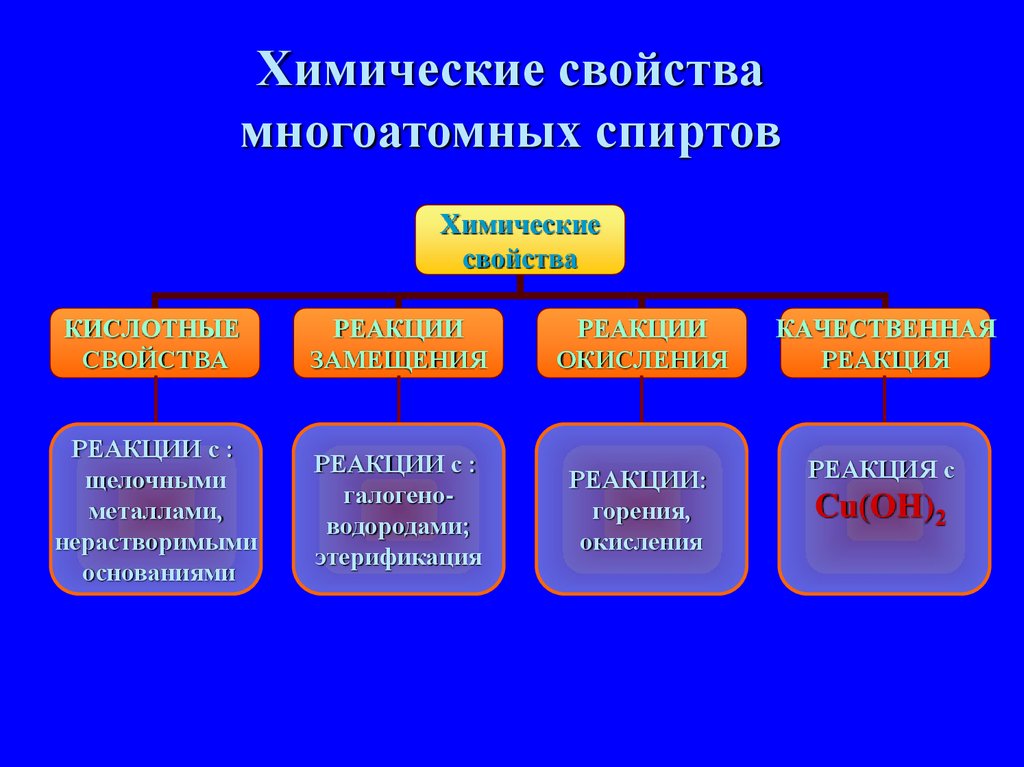
Химические свойствамногоатомных спиртов
Химические
свойства
КИСЛОТНЫЕ
СВОЙСТВА
РЕАКЦИИ
ЗАМЕЩЕНИЯ
РЕАКЦИИ
ОКИСЛЕНИЯ
КАЧЕСТВЕННАЯ
РЕАКЦИЯ
РЕАКЦИИ с :
щелочными
металлами,
нерастворимыми
основаниями
РЕАКЦИИ с :
галогеноводородами;
этерификация
РЕАКЦИИ:
горения,
окисления
РЕАКЦИЯ с
Cu(OH)2
11.
Взаимодействие глицерина сазотной кислотой
СН2 – ОН HO-NO2 СН2 – О -NO2
СН – ОН
HO-NO2 СН – О -NO2
СН2 – ОН HO-NO2 СН2 – О -NO2
+ 3 H 2O
12.
Взаимодействиемногоатомных спиртов
с гидроксидом меди (II)
Задание
Получите гидроксид меди (II),
путем сливания растворов
гидроксида натрия и сульфата
меди (II). Прилейте
полученный осадок к
глицерину.
Постарайтесь составить
уравнение химической
реакции.
Осадок гидроксида меди растворяется и образуется темно-синий раствор
глицерата меди (II).
13.
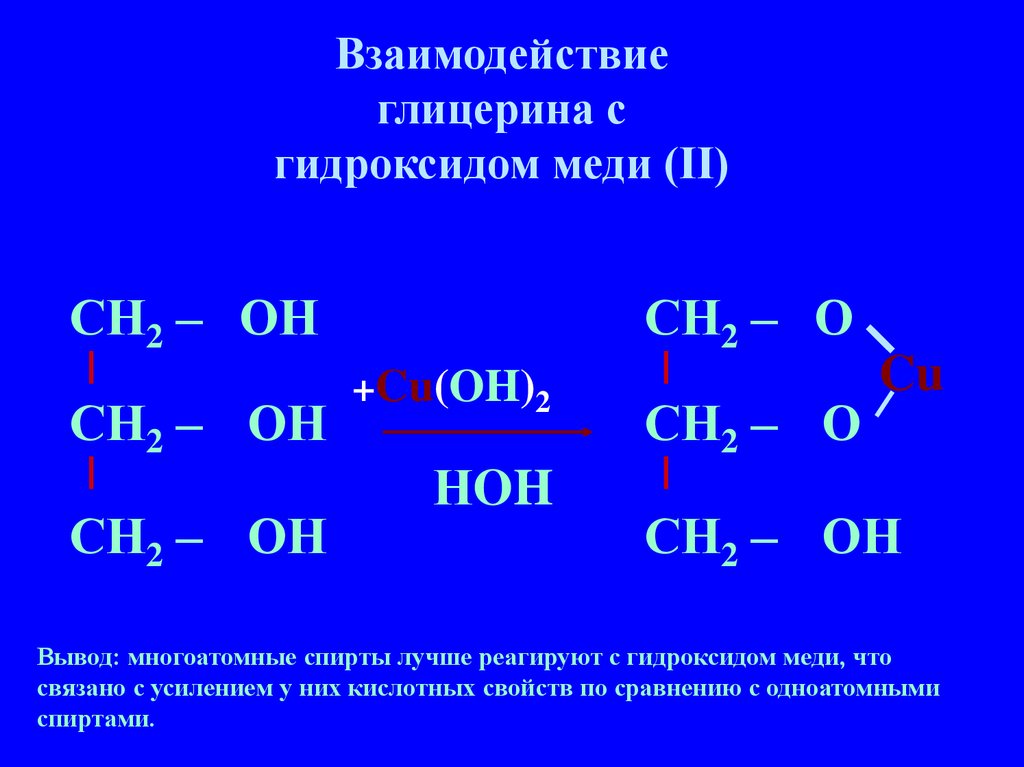
Взаимодействиеглицерина с
гидроксидом меди (II)
СН2 – ОН
СН2 – ОН
СН2 – ОН
СН2 – О
+Cu(OH)2
НOH
СН2 – О
Cu
СН2 – ОН
Вывод: многоатомные спирты лучше реагируют с гидроксидом меди, что
связано с усилением у них кислотных свойств по сравнению с одноатомными
спиртами.
14. Получение
Этиленгликоль (этандиол-1,2) синтезируютиз этилена различными способами
3CH2=CH2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
Глицерин (пропантриол -1,2,3) получают гидролизом
жиров или из пропилена
15. Применение этиленгликоля
Антифризы – незамерзающие жидкостиСинтетическое волокно лавсан
Пластиковые бутылки
16. Применение глицерина
ПомадыМыло
Крема
Зубные пасты
Нитроглицерин
Изделия из кожи
Пластмассовые изделия
Кондитерские изделия
17. Применение многоатомных спиртов
Области применениямногоатомных спиртов
1.
2.
3.
4.
5.
Антифризы для двигателей
внутреннего сгорания.
Добавление в
косметические средства.
Использование в качестве
пластификатора.
Применение в кожевенном
производстве.
В фармацевтической
промышленности.
Свойство спирта, на котором
основано применение
18. Применение многоатомных спиртов
Области применениямногоатомных спиртов
1.
2.
3.
4.
5.
Антифризы для двигателей
внутреннего сгорания.
Добавление в косметические
средства.
Использование в качестве
пластификатора.
Применение в кожевенном
производстве.
В фармацевтической
промышленности.
Свойство спирта, на котором
основано применение
1.
2.
3.
4.
5.
Низкая температура замерзания
этиленгликоля.
Глицерин - смягчающее
средство.
Глицерин – смазка между
полимерными молекулами.
Гигроскопичность глицерина
предохраняет от высыхания.
Глицерин –
сосудорасширяющее средство
при сердечно-сосудистых
заболеваниях.
19. Выводы
Во всех многоатомных спиртах гидроксильныегруппы находятся при разных атомах углерода;
число гидроксогрупп влияет на физические
свойства спирта (за счет водородных связей);
свойства, общие с одноатомными спиртами,
объясняются наличием функциональной
группы ОН;
число гидроксильных групп в молекуле
обусловило, в результате их взаимного влияния,
появление у многоатомных спиртов новых
свойств по сравнению с одноатомными
спиртами (к примеру – взаимодействие с
нерастворимыми основаниями).














 Химия
Химия








