Похожие презентации:
УИР. Теоретические основы реакции нитрования (лекция 5)
1.
Тема:Теоретические основы
реакции нитрования
1
2.
Реакция нитрованияБольшинство индивидуальных ЭМ представляют собой соединения,
содержащие нитрогруппу –NO2. Нитрогруппы могут быть введены в состав
молекулы различными способами. Основным является обработка
нитруемых веществ азотной кислотой или ее растворами.
В результате реакции нитрования выделяется вода, что осложняет
реакцию, так как в результате разбавления азотной кислоты теряется её
нитрующая активность и усиливаются окисляющее действие.
По этой причине нельзя применять теоретически рассчитанное по
стехиометрическому уравнению количество азотной кислоты. Всегда
требуется ее избыток.
Расход азотной кислоты можно сильно уменьшить, если ввести в
реакционную смесь вещества, связывающие воду.
2
3.
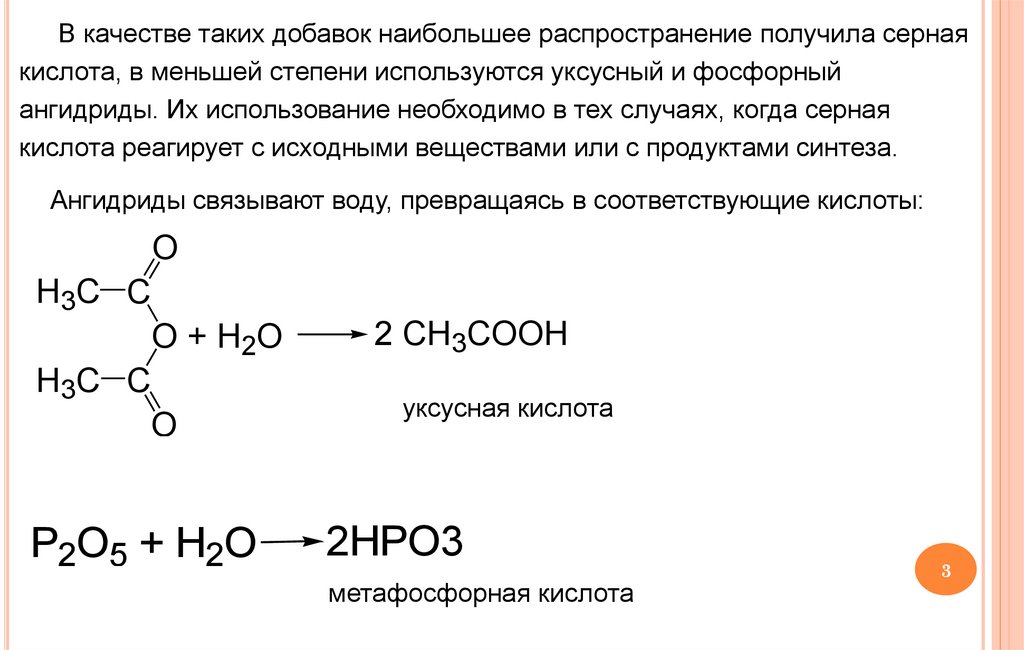
В качестве таких добавок наибольшее распространение получила сернаякислота, в меньшей степени используются уксусный и фосфорный
ангидриды. Их использование необходимо в тех случаях, когда серная
кислота реагирует с исходными веществами или с продуктами синтеза.
Ангидриды связывают воду, превращаясь в соответствующие кислоты:
O
H3C C
O + H2O
H3C C
O
P2O5 + H2O
2 CH3COOH
уксусная кислота
2HPO3
метафосфорная кислота
3
4.
Использование для нитрования не чистой азотной кислоты, а её смесей,дает возможность не только уменьшить расход азотной кислоты, но и
ускорить реакцию нитрования.
Применение серно-азотных кислотных смесей, кроме того, имеет
преимущество, поскольку они могут храниться в железной и чугунной
аппаратуре не вызывая коррозии, что важно в заводской практике.
В качестве нитрующего агента, кроме азотной кислоты, могут
применяться оксиды азота, азотный ангидрид , нитраты калия и натрия и
другие вещества.
Азотная кислота и серно-азотные кислотные смеси
Процесс нитрования является многостадийным, то есть состоит из ряда
последовательно и параллельно протекающих химических реакций.
Известно, что растворение веществ не является чисто физическим
процессом.
4
5.
Происходит взаимодействие растворенных веществ с растворителемподобно обычным химическим процессам, то есть происходит частичный
или полный разрыв связей в исходных веществах и образование новых
связей.
В настоящее время установлено, что ион водорода (протон) практически
не существует в растворах в свободном виде, то есть он связывается с
молекулами растворителя.
Для воды этот процесс:
+
H + H2O
H3O+
Таким образом, диссоциация азотной кислоты в воде
HNO3 + H2O
H3O+ + NO3катион гидроксония
Это уравнение справедливо и для других сильных кислот (серной,
хлорной и т.д.).
5
6.
Появление ионов в растворе может быть легко проконтролированоизмерением их электропроводности.
Чистая вода плохо проводит ток, а добавление к ней кислоты резко
увеличивает проводимость.
Экспериментально установлено, что 100 %-ная азотная кислота
довольно хорошо проводит электрический ток, следовательно, в ней есть
заряженные частицы.
Различными физико-химическими методами было показано, что азотная
кислота диссоциирует по схеме:
2HNO3
NO2+ + NO3- + H2O
катион нитрония
Количество диссоциирующей азотной кислоты относительно не велико
(около 4% для безводной кислоты).
6
7.
Степень диссоциации уменьшается с добавлением воды. И в 94-95%азотной кислоте катион нитрония не обнаруживается.
Введение серной кислоты наоборот сильно увеличивает процесс
диссоциации, например 10-15% раствор азотной кислоты в безводной
серной кислоте представляет собой по существу раствор катионов нитрония.
Схема диссоциации:
H2SO4 + HNO3
NO2+ + HSO4- + H2O
Серная кислота по своей силе превосходит азотную, поэтому вода в
серной азотных кислотных смесях связывается серной кислотой:
H3O+ + HSO4-
H2O + H2SO4
Соответственно суммарный процесс:
2H2SO4 + HNO3
H3O+ + NO2+ + 2HSO47
Именно катион нитрония замещает в молекулах нитруемых соединений
атомы водорода превращаясь в нитрогруппы.
8.
Механизм реакции нитрования.Первой стадией нитрования является ионизация азотной кислоты.
Далее катион нитрония атакует молекулу углеводорода и присоединяется
к ней с образованием комплекса:
+ NO2+
H +
NO2
В присутствии отрицательно заряженных частиц
отщепляет протон, превращаясь в нейтральную молекулу:
H +
+
HSO
4
NO
2
этот
комплекс
NO2
+ H2SO4
8
9.
Таким образом, серная кислота выполняет несколько функций:• помогает образованию катиона нитрония из азотной кислоты;
• связывает воду, которая выделяется при реакции;
• является источником бисульфат аниона, служащего для отщепления
протона от комплекса.
Водосвязывающее действие серной кислоты состоит в том, что при ее
реакции с водой образуется катион гидроксония, который имеет
положительный заряд, который не реагирует с катионом нитрония.
9
10.
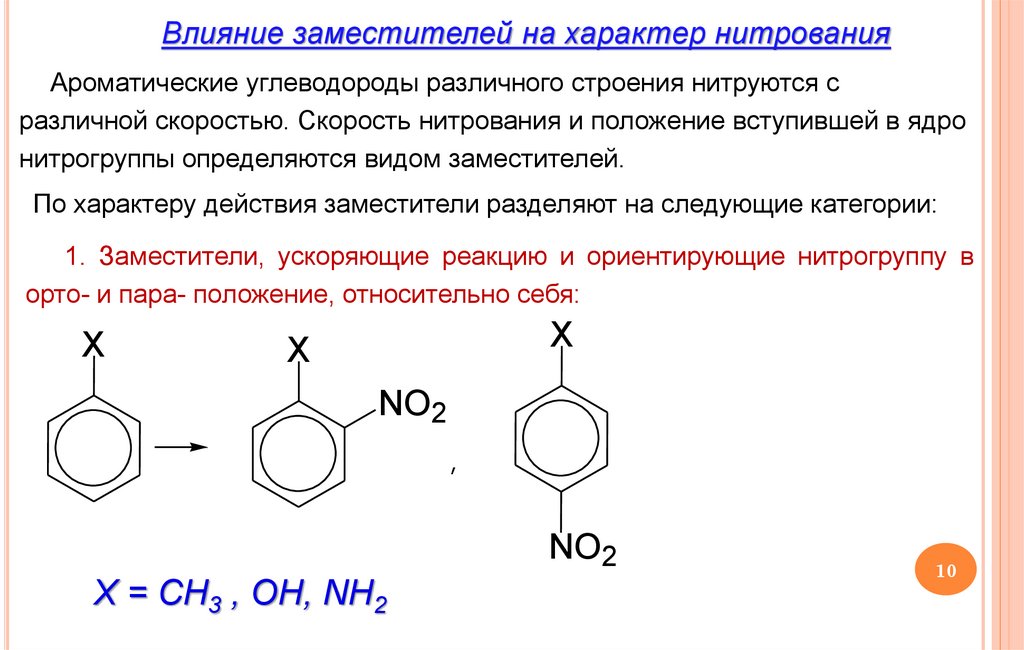
Влияние заместителей на характер нитрованияАроматические углеводороды различного строения нитруются с
различной скоростью. Скорость нитрования и положение вступившей в ядро
нитрогруппы определяются видом заместителей.
По характеру действия заместители разделяют на следующие категории:
1. Заместители, ускоряющие реакцию и ориентирующие нитрогруппу в
орто- и пара- положение, относительно себя:
X
X
X
NO2
,
NO2
X = CH3 , OH, NH2
10
11.
2. Заместители, замедляющие реакцию и ориентирующие нитрогруппу вмета- положение:
X
X
X = NO2 , CN, CH2Cl
NO2
3. Заместители, ориентирующие нитрогруппу в орто- и пара- положение,
но несколько уменьшают скорость реакции нитрования (например, Cl, Br).
Введение хотя бы одной нитро группы в состав молекулы
ароматического углеводорода очень сильно дезактивируют ее.
Для компенсации падения скорости нитрования при получении
полинитропроизводных необходимо увеличивать крепость кислотных
смесей и температуру реакции.
11
12.
Кислоты, применяемые при нитрованииВ настоящее время в производстве применяются следующие виды кислот:
1. Концентрированная азотная кислота 1 и 2 сорта, содержащая,
соответственно, не менее 98% и 96% HNO3.
2. Слабая азотная кислота, концентрация которой в пределах 45-50%
HNO3.
3. Серная кислота с концентрацией не менее 93% (купоросное масло).
4. Олеум – безводная серная кислота, содержащая 18-20% свободного
серного ангидрида (SO3).
5. Меланж: 88±1% азотной кислоты, 8±1% серной кислоты, 4±1% H2O.
12










 Химия
Химия








