Похожие презентации:
Азотсодержащие органические соединения . Нитросоединения
1.
Азотсодержащиеорганические соединения
1. Нитросоединения
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
2.
Нитросоединения - это производные углеводородов, содержащие в своем составеодну или несколько нитрогрупп NO2. Характерная особенность
нитросоединений – связь с углеводородным радикалом через атом азота: C-N.
Электронное и пространственное строение нитрогруппы
Атом азота находится в нитрогруппе в состоянии sр2гибридизации, т.е. нитрогруппа имеет плоское строение. Один из
атомов кислорода соединен с атомом азота двумя ковалентными
связями, а другой — семиполярной связью.
O
N
+
N
O
O
-
O
Две формы записи нитрогруппы
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
3.
Классификацияи номенклатура нитросоединений
В зависимости от природы углеводородного радикала, с которым связана
нитрогруппа, различают алифатические и ароматические
нитросоединения.
В зависимости от того, у какого (первичного, вторичного, третичного)
атома углерода находится нитрогруппа, нитросоединения бывают
первичные, вторичные или третичные.
Названия нитросоединений образуют путем добавления префикса
нитро- к названию соответствующего углеводорода с указанием
положения нитрогруппы. Напишите структурные формулы следующих
нитросоединений : нитроэтан; 2-нитробутен-2; 3-нитрогексин-1.
Нитроарены, содержащие нитрогруппу в боковой цепи, рассматривают
как производные предельных углеводородов, содержащих в качестве
заместителей ароматический радикал и нитро-группу. Напишите
структурные формулы следующих нитросоединений : Нитробензол;
фенилнитрометан; 2-нитро-1-фенилпропан.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
4.
1.2. Способы получения нитросоединений1.2.1. Нитрование
1.2.1.1. Нитрование по Коновалову
Нитросоединения алифатического ряда получают нитрованием алканов (реакция Коновалова).
Направление реакции для алканов – всегда
углерода.
по наиболее разветвлённому атому
o
120 C
CH3CH2CH2CH3 + HNO3
бутан
CH3CHCH2CH3 + H2O,
15% раствор
CH3
NO2 2-нитробутан
CH3
o
CH3CHCH2CH3 + HNO3
120 C
CH3CCH2CH3 + H2O.
15% раствор
2-метилбутан
NO2
2-метил-2-нитробутан
CH3
CH3
o
CH3CHCH2CH3 + HNO3
2-метилбутан
120 C
CH3CCH2CH3 + H2O.
15% раствор
NO2
2-метил-2-нитробутан
Реакция Коновалова используется и для введения нитрогруппы в боковую цепь ароматических
углеводородов. Реакция всегда протекает по α-углеродному атому :
H2C CH2 CH3
+ HNO3 (разб)
пропилбензол
O2N HC CH2 CH3
t, p
+ H2O
фенилнитропропан
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
5.
1.2.1.2. Парофазное нитрование алкановПарофазное нитрование алканов протекает в жёстких условиях, сопровождается
разрывом всех видов связей и присоединением нитрогруппы по местам разрыва.
Например, число различных продуктов парофазного нитрования бутана достигает 6:
H H H H
H C C C C H
HNO3, 350oC
NO2
O2N CH2 CH2 CH2 CH3 + CH3 CH CH2 CH3 +
H H H H
+ H3C NO2 + O2N CH2CH2CH3 + H3CCH2 NO2 + O2N CH2CH3
1.2.1.3. Нитрование в ароматическое ядро
Нитрование в ароматическое ядро протекают только в присутствии серной кислоты. Реакция
протекает по механизму электрофильного замещения водорода. Именно в нитрующей
смеси (смесь азотной и концентрированной серной кислот) генерируется электрофил – катион
нитрония, NO2+:
HNO3
бензол
NO2
H2SO4
нитрующая
смесь
нитробензол
+ H2O
Нитрогруппа – сильный электроноакцептор. Она
дезактивирует бензольное
ядро, поэтому для введения второй и третьей нитрогрупп требуются более жесткие
условия.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
6.
1.2.2. Действие солей азотистой кислоты на галогенопроизводныеНитросоединения получают по реакции галогенопроизводных: с нитритами металлов I
или II групп (реакция нуклеофильного замещения галогена, нуклеофил – анион NO2-).
Анион азотистой кислоты существует в двух изомерных формах поэтому всегда
образуется два продукта:
H-O-N=O
-
O-N=O
H+ + -O-N=O,
O
изомеризация N
O
нуклеофильный
центр на кислороде
CH3 J + Ag NO2
иодистый
метил
CH3CH2CH2Br + NaNO2
1-бромпропан
CH2 Cl
нуклеофильный центр
на азоте
CH3 NO2 + CH3.-O-N=O + AgJ
нитрометан
CH3CH2CH2 NO2 + CH3CH2CH2-O-N=O + NaBr
пропилнитрит
1-нитропропан
CH2 NO2
+ KNO2
бензилхлорид
метилнитрит
CH2 O-NO2
+
фенилнитрометан
+ KCl
бензилнитрит
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
7.
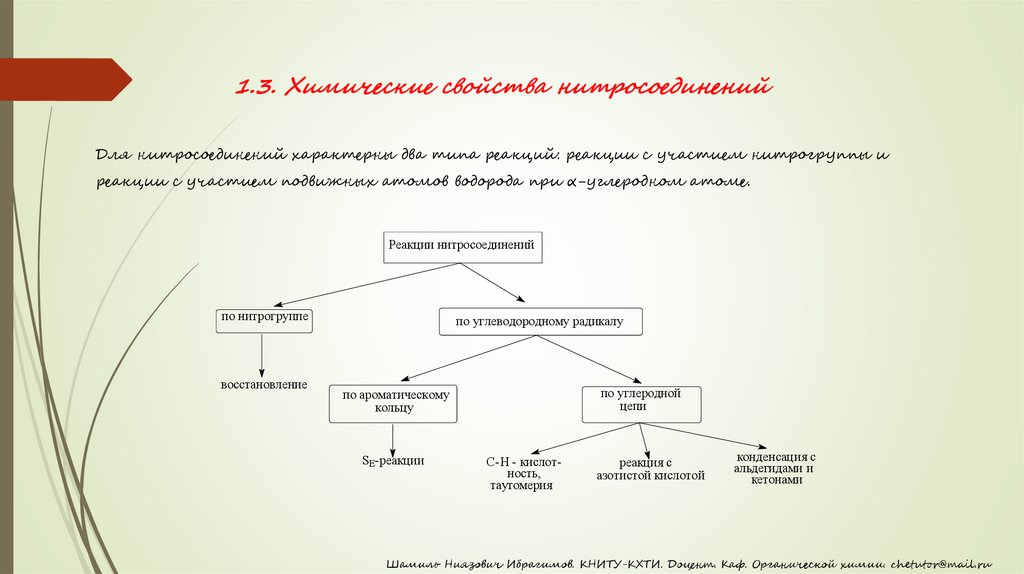
1.3. Химические свойства нитросоединенийДля нитросоединений характерны два типа реакций: реакции с участием нитрогруппы и
реакции с участием подвижных атомов водорода при α-углеродном атоме.
Реакции нитросоединений
по нитрогруппе
восстановление
по углеводородному радикалу
по углеродной
цепи
по ароматическому
кольцу
SE-реакции
С-Н - кислотность,
таутомерия
реакция с
азотистой кислотой
конденсация с
альдегидами и
кетонами
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
8.
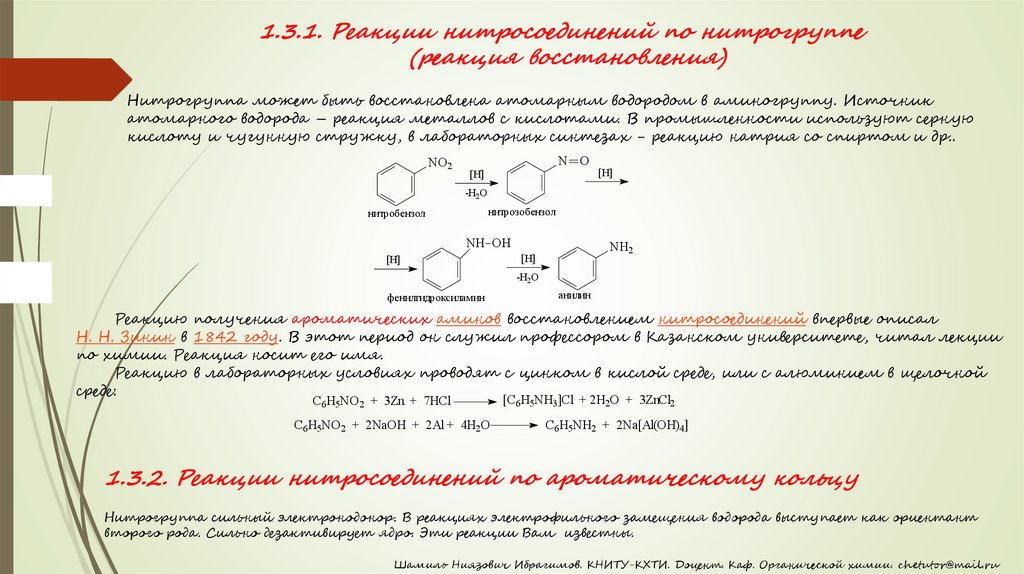
1.3.1. Реакции нитросоединений по нитрогруппе(реакция восстановления)
Нитрогруппа может быть восстановлена атомарным водородом в аминогруппу. Источник
атомарного водорода – реакция металлов с кислотами. В промышленности используют серную
кислоту и чугунную стружку, в лабораторных синтезах - реакцию натрия со спиртом и др..
NO2
N O
[H]
[H]
-H2O
нитрозобензол
нитробензол
NH OH
[H]
NH2
[H]
-H2O
фенилгидроксиламин
анилин
Реакцию получения ароматических аминов восстановлением нитросоединений впервые описал
Н. Н. Зинин в 1842 году. В этот период он служил профессором в Казанском университете, читал лекции
по химии. Реакция носит его имя.
Реакцию в лабораторных условиях проводят с цинком в кислой среде, или с алюминием в щелочной
среде:
C6H5NO2 + 3Zn + 7HCl
C6H5NO2 + 2NaOH + 2Al + 4H2O
[C6H5NH3]Cl + 2H2O + 3ZnCl2
C6H5NH2 + 2Na[Al(OH)4]
1.3.2. Реакции нитросоединений по ароматическому кольцу
Нитрогруппа сильный электронодонор. В реакциях электрофильного замещения водорода выступает как ориентант
второго рода. Сильно дезактивирует ядро. Эти реакции Вам известны.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
9.
1.3.3. Реакции нитросоединений, обусловленные высокойподвижностью атомов водорода при α-углеродном атоме
1.3.3.1. Нитро-ацинитро-таутомерия нитросоединений
и образование солей
Водород на α-углероде нитросоединений подвижен. Поэтому первичные и вторичные нитросоединения существуют
в двух изомерных формах и вступают в реакции одновременно тоже в двух изомерных формах – нитроформе и
аци-нитроформе (нитроновые кислоты). Между этими формами устанавливается динамическое равновесие и
разделить их невозможно. Такой вид таутомерии называют нитро-ацинитро-таутомерия.
OH
O
N
O
молекула азотной
кислоты
O
H
OH
R CH N
R CH N
нитроформа
аци-нитроформа
(нитроновая
кислота)
O
H3C
O
CH
N
HCl
H3C
2-нитропропан
NaOH H3C
O
O
ONa
C N
H3C
натриевая соль O
диметилнитроновой кислоты
Первичные и вторичные нитроалканы реагируют с водным раствором
щелочи, образуя соли нитроновых кислот. Реакция протекает через ацинитроформу. В отличие от малорастворимых в воде нитроформ, соли
нитроновых кислот хорошо растворимы в воде. При действии минеральных
кислот они переходят обратно в нитроновые кислоты, которые вновь
изомеризуются в свою нитроформу и выделяются в виде несмешивающегося
с водой слоя.
Третичные нитросоединения, ввиду отсутствия атомов водорода при
α-углеродном атоме, не способны к таутомерии и, поэтому, не
взаимодействуют со щелочами.
Обратите внимание на сходство нитро-ацинитро-таутомерии с
кето-енольной таутомерией альдегидов и кетонов, в молекулах которых
также присутствует подвижный водород на α-углероде. Также, отметьте
сходство в строении молекул аци-нитроформы нитросоединений и
азотной кислоты.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. chetutor@mail.ru
10.
1.3.3.2. Реакции нитросоединений с азотистой кислотойНитросоединения реагируют с азотистой кислотой.
Первичные нитропроизводные образуют алкилнитроловые кислоты :
H3C C
NO2 +
O N OH
H H
-H2O
CH3 C NO2
N OH
метилнитроловая
кислота
Нитроловые кислоты растворяются в щелочах, образуя соли, окрашивающие раствор в красный цвет.
Вторичные нитросоединения с азотистой кислотой образуют псевдонитролы (нитрозонитросоединения):
NO2
NO2
H3C
C
H + HO N O
CH3
-H2O
H3C
C N O
CH3
псевдонитрол,
2-нитрозо-2-нитропропан
Псевдонитролы в растворе дают синее окрашивание.
Третичные нитросоединения не реагируют с азотистой кислотой.
Реакцию с азотистой кислотой используют
третичных нитросоединений друг от друга.
для
отличия
первичных,
вторичных
и
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru
11.
1.3.3.3. Реакция конденсации с альдегидами и кетонамиЗа счет подвижных атомов водорода в α-положении нитросоединения способны в слабощелочной среде
вступать в реакции конденсации с альдегидами с образованием нитроспиртов (нитроалканолов),
а также непредельных нитросоединений. Реакция может протекать последовательно по каждому
подвижному атому водорода:
H
H
H
C=O
H
O2N-CH2-H + C=O
O2N-CH2- C - OH
H
H
H
метилолнитрометан
нитрометан
H
O2N-CH - C - OH
C=O
H
H
2
диметилолнитрометан
H
O2N-C
- C - OH
H
3
триметилолнитрометан
O
CH3
+ H2C NO2
C
этаналь
электрофил
H
H3C CH CH NO2
OH H
NaOH
H
нуклеофил
t
- H2O
H3C CH CH NO2
1-нитропропен-1
Обратите внимание на сходство этих реакций с реакциями альдольной и кротоновой конденсации
альдегидов и кетонов, в молекулах которых также присутствует подвижный водород на α-углероде.
Шамиль Ниязович Ибрагимов. КНИТУ-КХТИ. Доцент. Каф. Органической химии. chetutor@mail.ru









 Химия
Химия








