Похожие презентации:
Реакции электрофильного замещения в ароматическом и гетероциклическом рядах SE. (Лекция 5)
1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ В АРОМАТИЧЕСКОМ и ГЕТЕРОЦИКЛИЧЕСКОМ РЯДАХ SE
ЛЕКЦИЯ5
РЕАКЦИИ
ЭЛЕКТРОФИЛЬНОГО
ЗАМЕЩЕНИЯ В
АРОМАТИЧЕСКОМ и
ГЕТЕРОЦИКЛИЧЕСКОМ
РЯДАХ SE
2.
План5.1. Реакции SE для бензоидных
ароматических соединений
5.2. Ориентирующее
заместителей
влияние
5.3.
Реакции
SE
в
гетероциклических соединениях
3.
5.1. Реакции SEдля бензоидных
ароматических соединений
Электрофильное замещение
2
при атоме углерода в sp гибридизации наиболее
характерно для
ароматических соединений
4.
Соединения с двойнымисвязями неароматического
характера гораздо легче
вступают в реакции
электрофильного
присоединения, чем
замещения
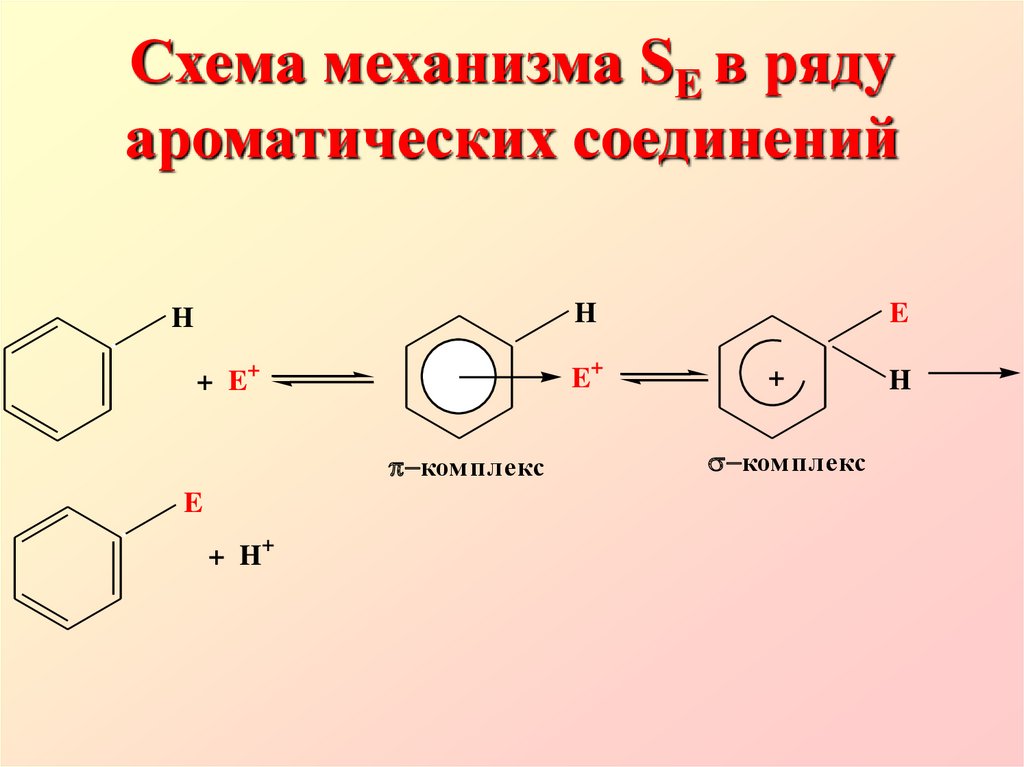
5. Схема механизма SE в ряду ароматических соединений
HH
E+
+ E+
ком плекс
E
+ H+
E
+
ком плекс
H
6.
Электрофильное замещение вароматическом ряду начинается с
атаки π-электронной системы
ароматического кольца
электрофильной частицей (для
этого нужны сильные
электрофилы, которые, как
правило, генерируются с
помощью катализатора)
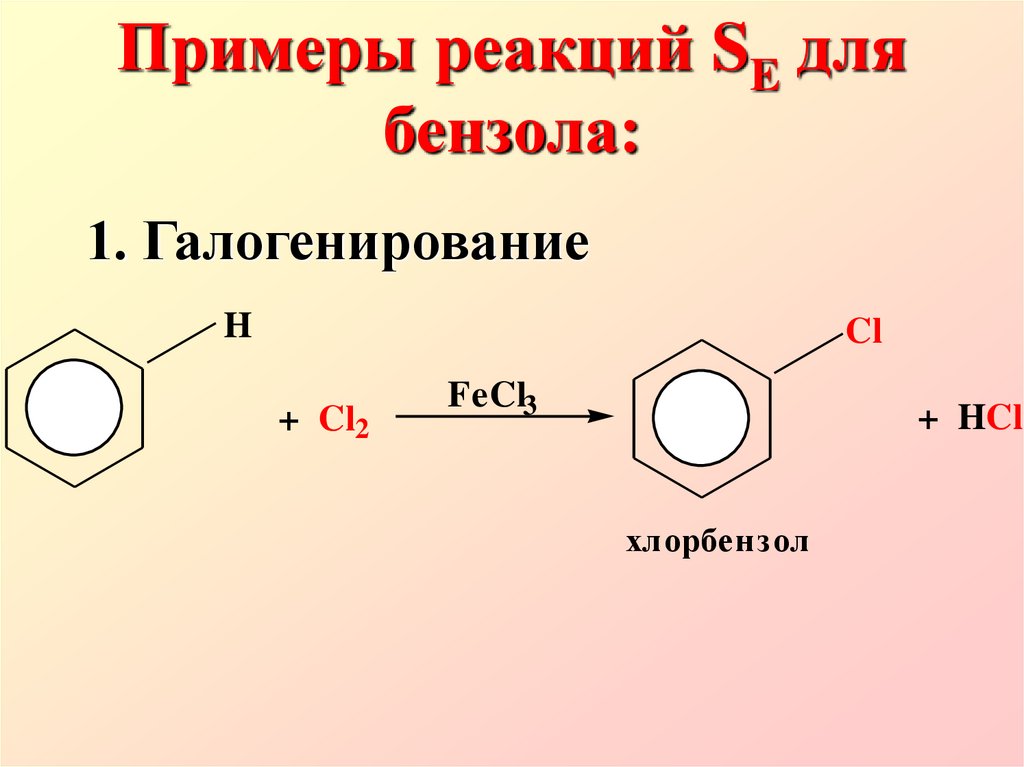
7. 1. Галогенирование
Примеры реакций SE длябензола:
1. Галогенирование
H
Cl
+ Cl2
FeCl3
+ HCl
хлорбензол
8.
В качестве электрофила выступаетлибо комплекс галогена с кислотой
Льюиса (FeCl3), либо катион,
образующийся в результате
диссоциации этого комплекса
Cl
Cl + FeCl 3
Cl
Cl...FeCl3
Cl
+
+ FeCl 4
электрофил
-
9.
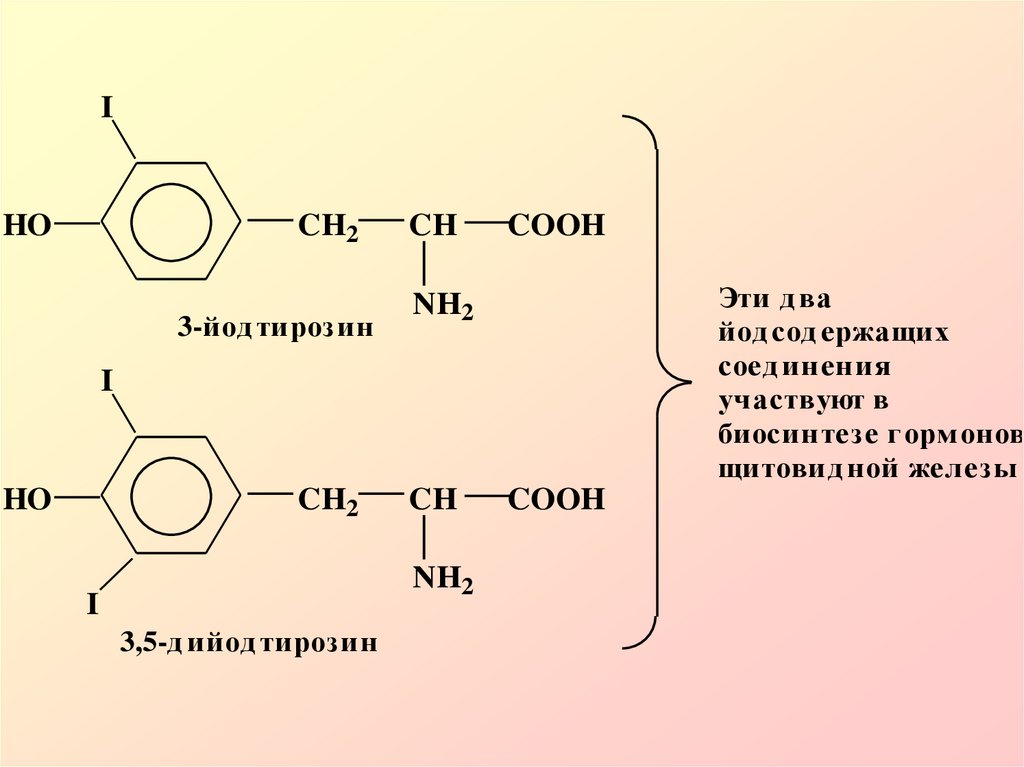
В организме по механизмуSЕ протекает очень важная
реакция иодирования.
Гормоны щитовидной
железы имеют в своем
составе иодпроизводное
одной из α-аминокислот –
тирозина
10.
IHO
CH2
3-йод тирозин
CH
COOH
Эти д ва
йод сод ержащих
соед инения
участвуют в
биосинтезе г орм онов
щитовид ной железы
NH2
I
HO
CH2
CH
NH2
I
3,5-д ийод тирозин
COOH
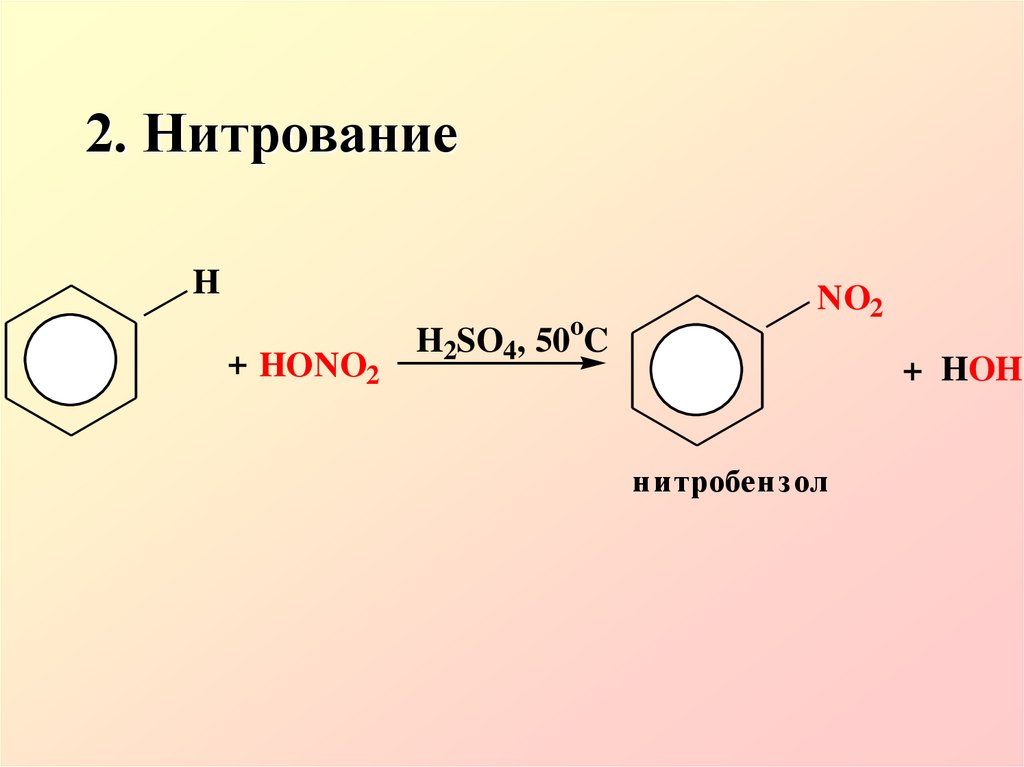
11. 2. Нитрование
H+ HONO2
H2SO4, 50oC
NO2
+ HOH
нитробензол
12. В общем виде:
H..
O
..
+
N
H
O
O
H
+
+H
..
O
..
+
O
..
+
N
H
O
O
+
H + O=N=O
нитроилкатион
В общем виде:
HNO3 + 2H2SO4
+
+
_
H3O + NO2 + 2HSO4
электрофил
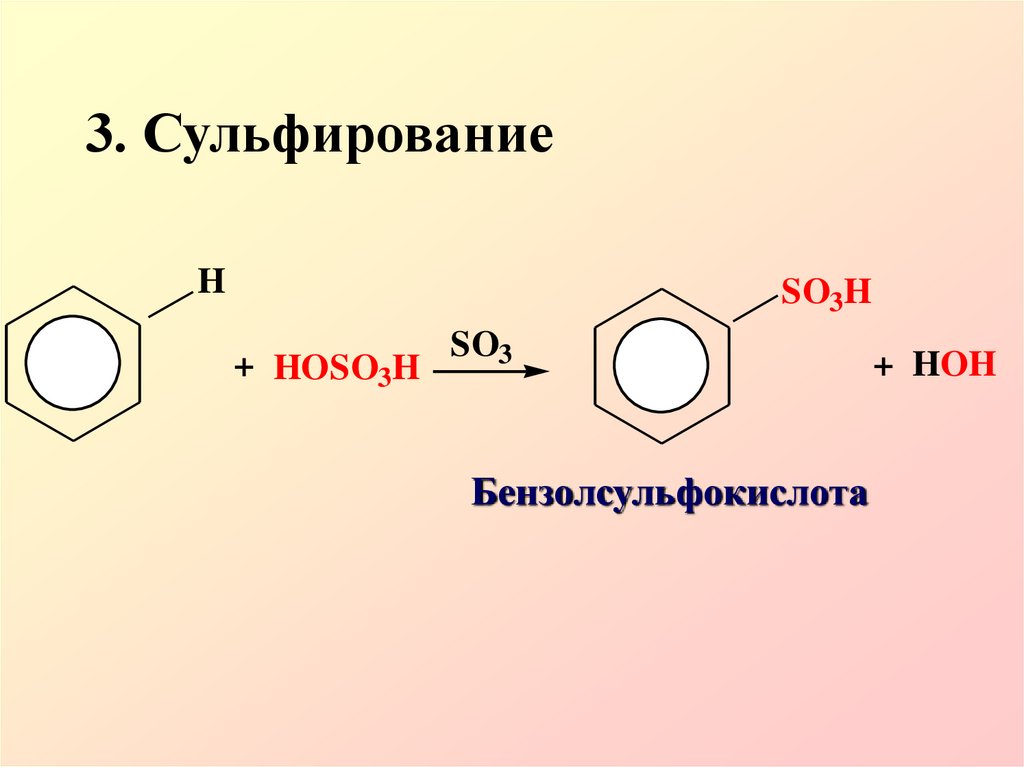
13. 3. Сульфирование
HSO3H
+ HOSO3H
SO3
Бензолсульфокислота
+ HOH
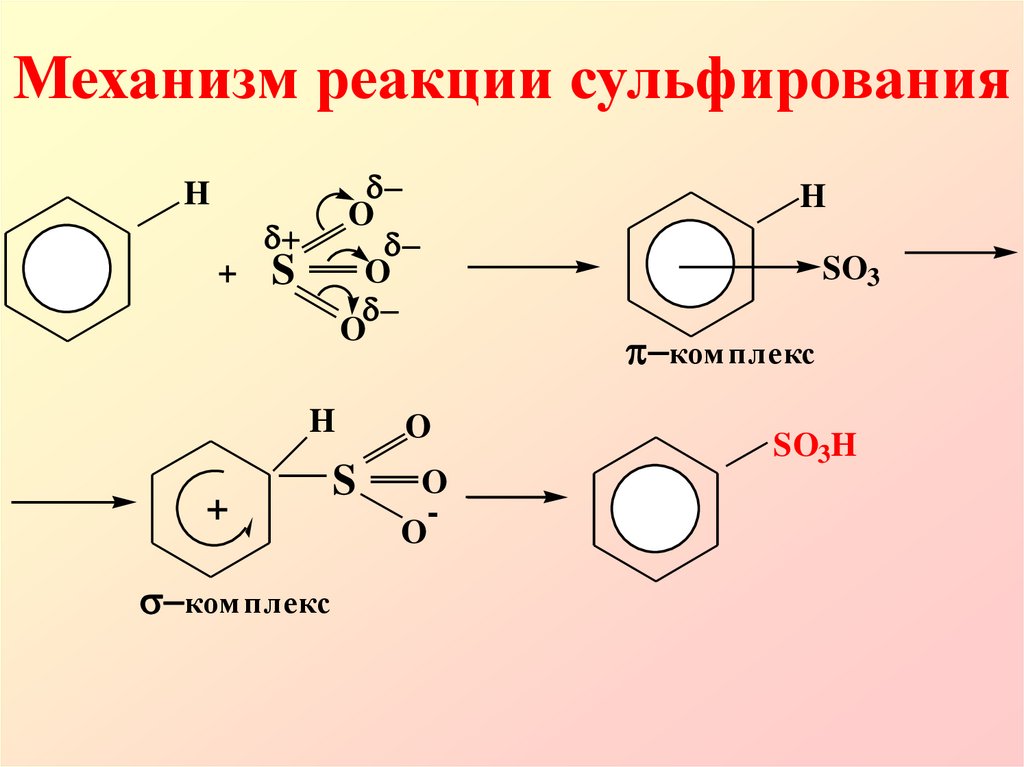
14. Механизм реакции сульфирования
OO
O
H
+
S
H
+
ком плекс
S
H
SO3
ком плекс
O
O
-
O
SO3H
15.
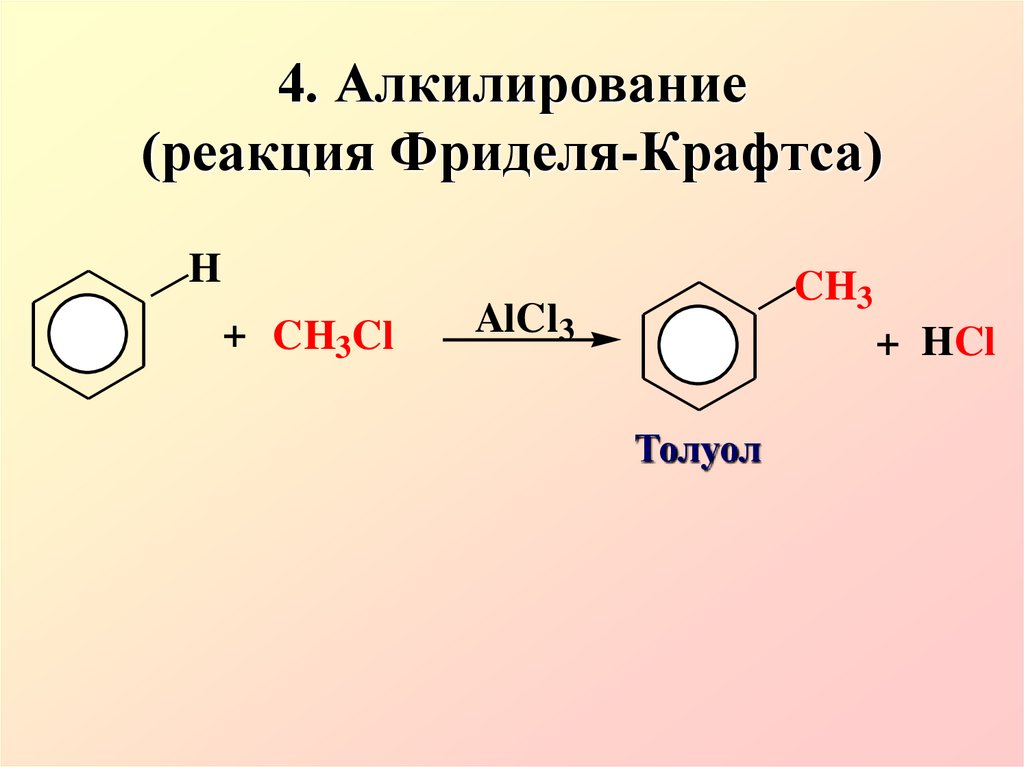
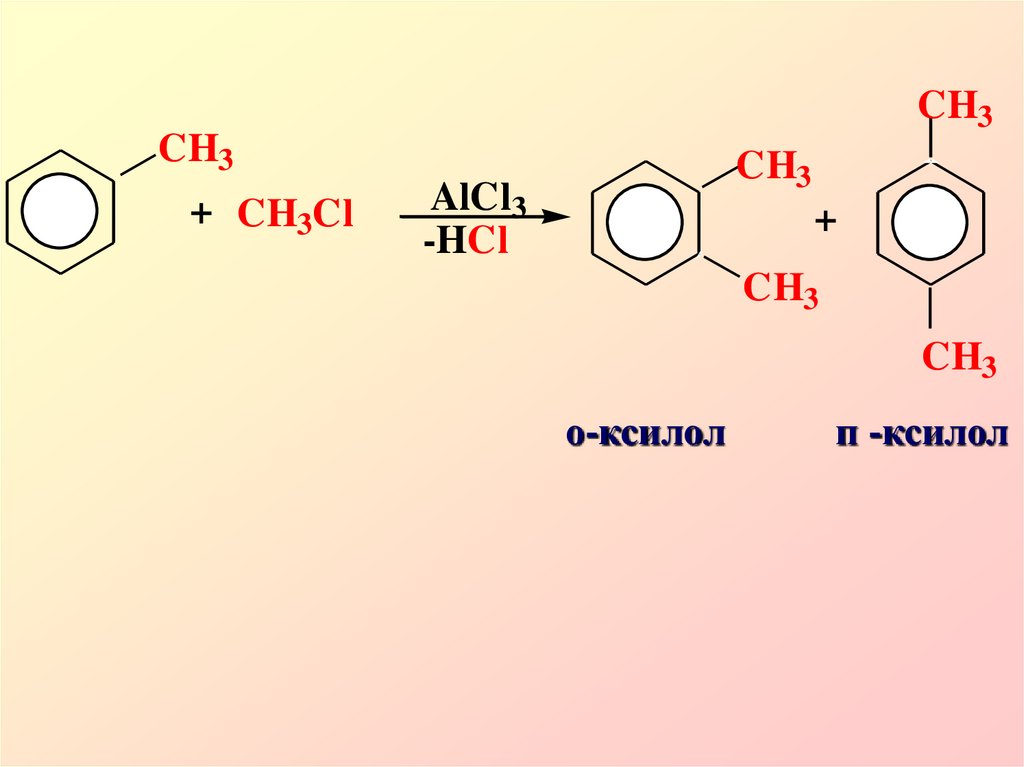
4. Алкилирование(реакция Фриделя-Крафтса)
H
+ CH3Cl
CH3
AlCl3
+ HCl
Толуол
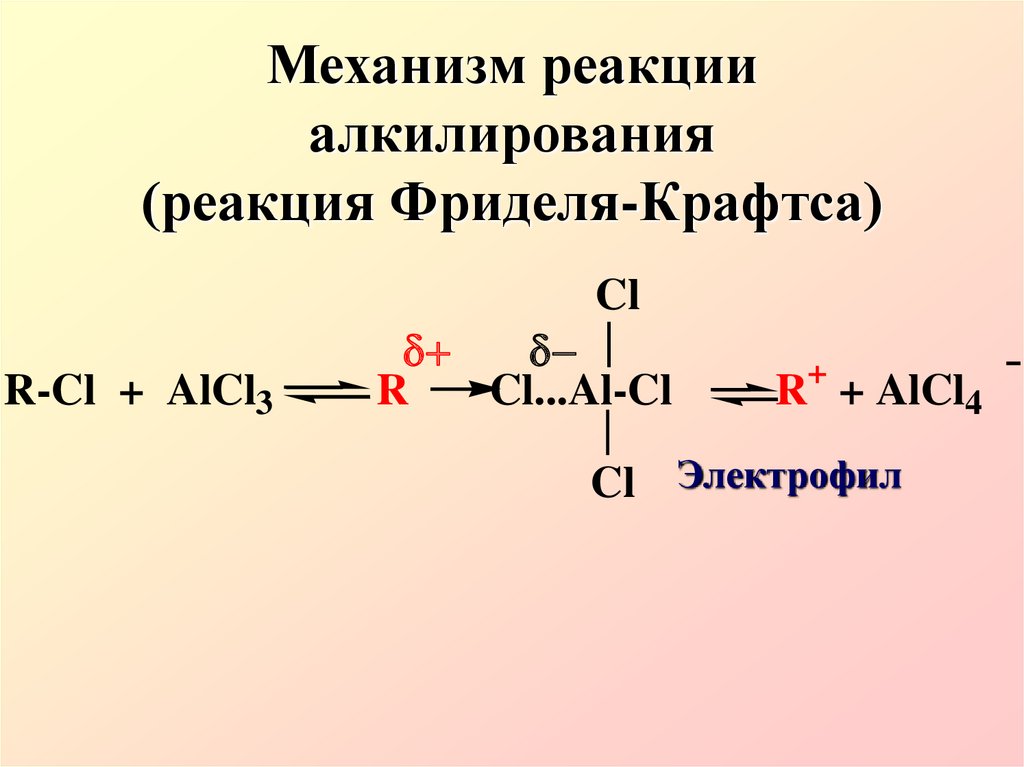
16. Механизм реакции алкилирования (реакция Фриделя-Крафтса)
ClR-Cl + AlCl3
R
Cl...Al-Cl
+
R + AlCl4
Cl Электрофил
-
17.
CH3CH3
+ CH3Cl
CH3
AlCl3
-HCl
+
CH3
CH3
о-ксилол
п -ксилол
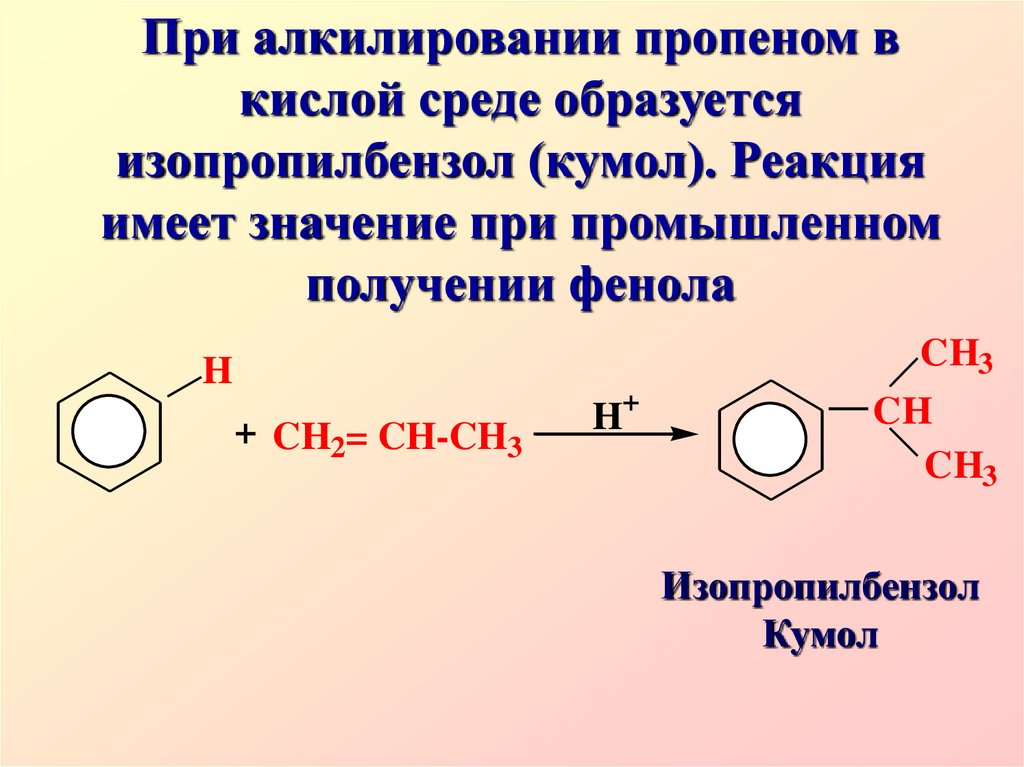
18.
При алкилировании пропеном вкислой среде образуется
изопропилбензол (кумол). Реакция
имеет значение при промышленном
получении фенола
CH3
H
+ CH2= CH-CH3
H+
CH
CH3
Изопропилбензол
Кумол
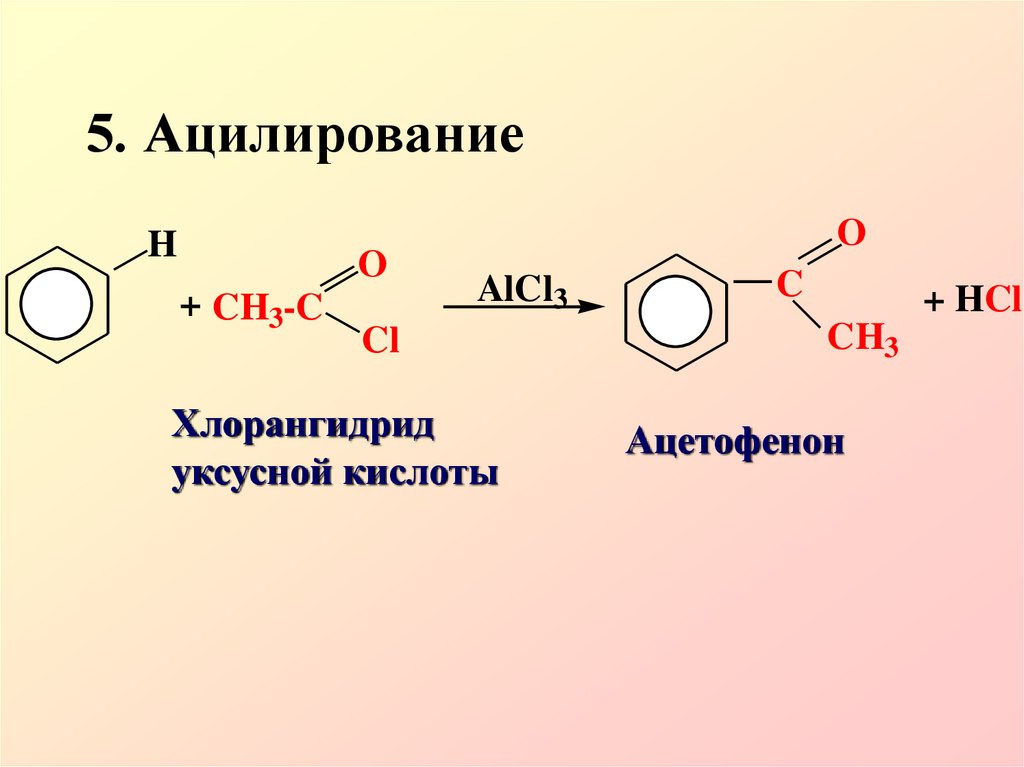
19. 5. Ацилирование
HO
+ CH3-C
O
AlCl3
Cl
Хлорангидрид
уксусной кислоты
C
+ HCl
CH3
Ацетофенон
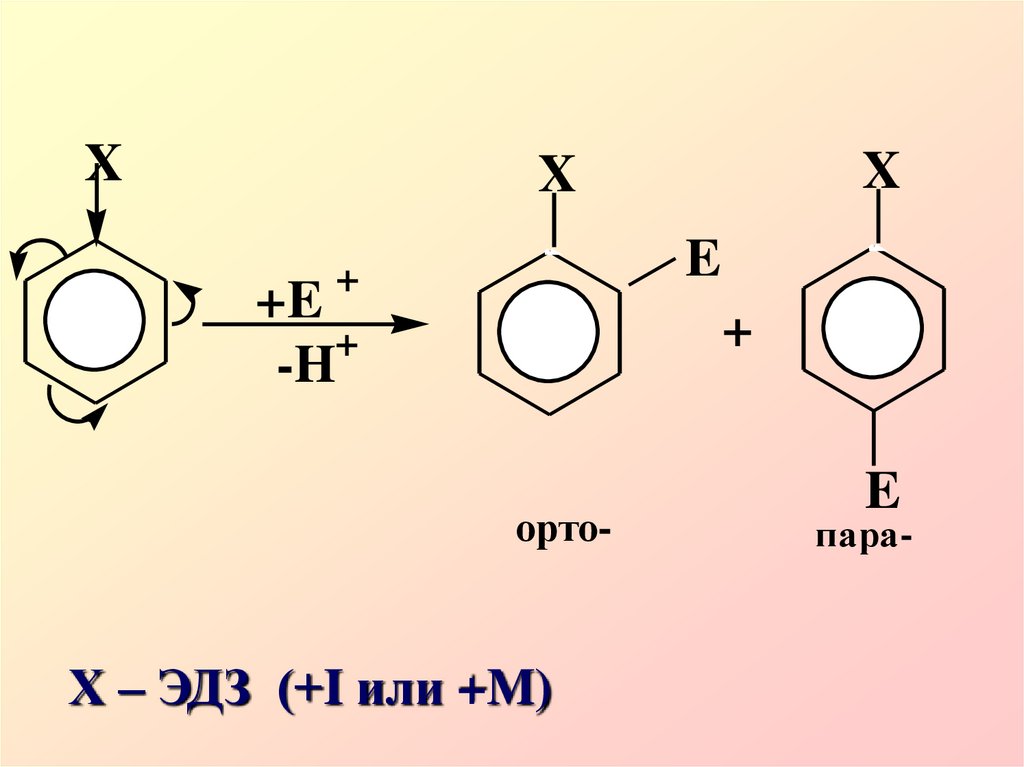
20. 5.2. Ориентирующее влияние заместителей
Заместители делят на две группы:21.
1. Ориентанты I-рода,электронодонорные
заместители
алкильные группы,
проявляющие
+I эффект и группы,
проявляющие +М эффект:
–ОН; –ОR; –NН2; –NR2
22. Заместители I рода облегчают электрофильное замещение по сравнению с незамещенным бензолом и направляют новые заместители в
орто- и параположения.23.
XX
X
E
+
+E
+
-H
+
орто-
Х – ЭДЗ (+I или +M)
E
пара-
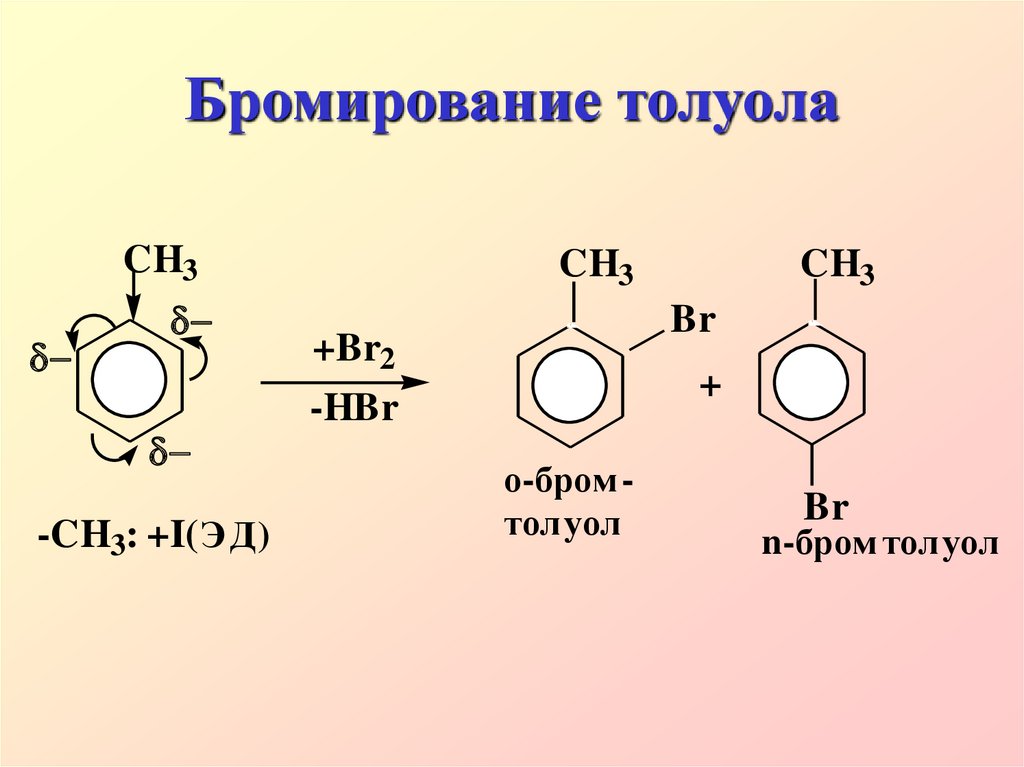
24. Бромирование толуола
CH3-CH3: +I( Э Д)
CH3
CH3
Br
+Br2
+
-HBr
о-бром толуол
Br
n-бром толуол
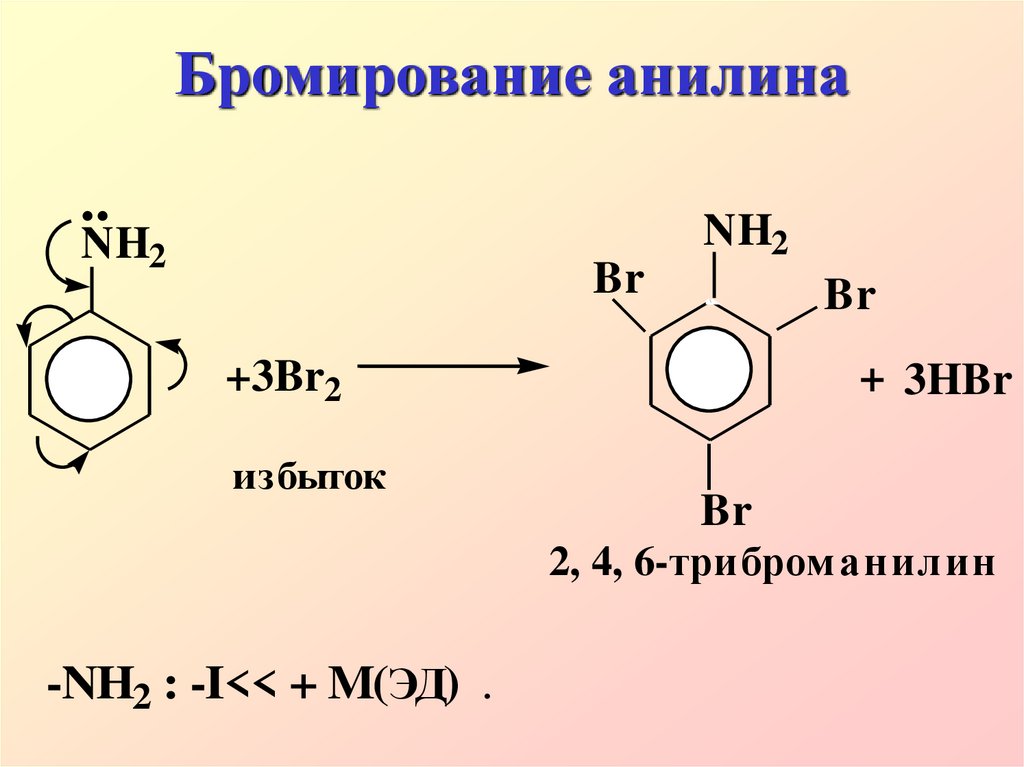
25. Бромирование анилина
..NH2
Br
NH2
Br
+3Br2
+ 3HBr
избыток
Br
2, 4, 6-трибром анилин
-NH2 : -I<< + M(ЭД)
.
26. 2.Ориентанты II рода, электроноакцепторные заместители проявляют –I и –М эффекты: –NO2; –SO3H; –CN; –CHO; –COOH
27.
Заместители II родазатрудняют реакции
электрофильного замещения
по сравнению с
незамещенным бензолом,
причем входящая группа
вступает в мета-положение
28.
YY
+
+E , t
+
-H
E
мета-
Y – ЭАЗ
(-I или -M)
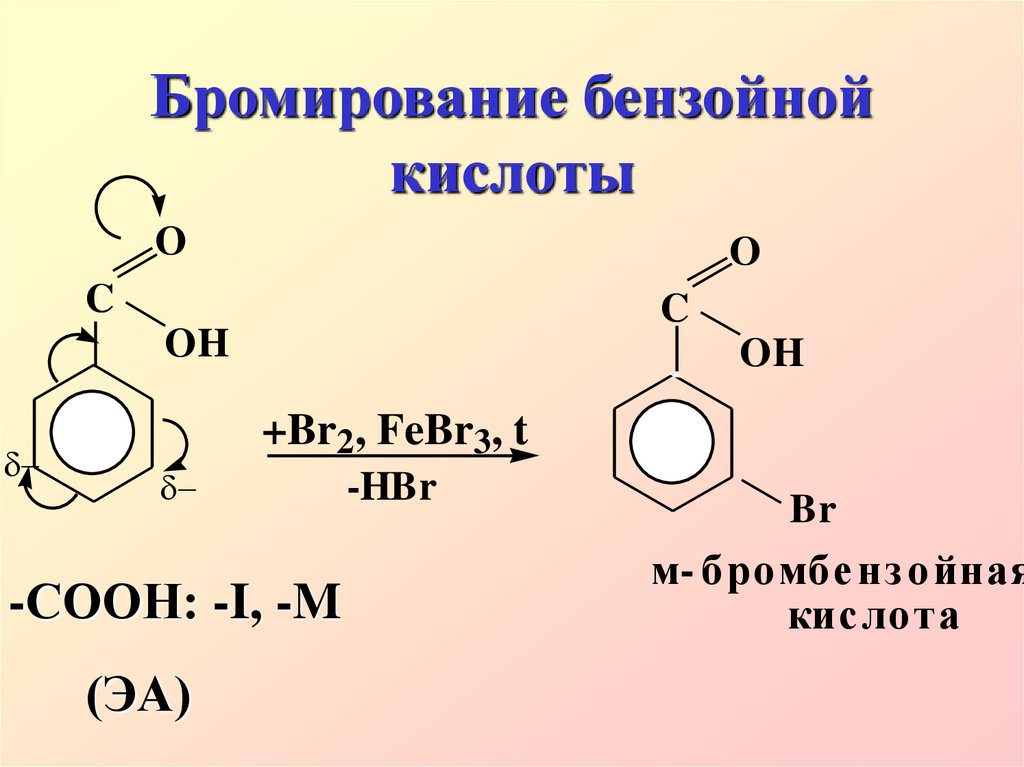
29. Бромирование бензойной кислоты
OO
C
C
OH
OH
+Br2, FeBr3, t
-СООН: -I, -M
(ЭА)
-HBr
Br
м- бромбе нз ойная
кис лота
30. Электрофильное замещение в конденсированных аренах
Галогенирование.
Cl
+ Cl2
FeCl3
+ HCl
нафталин
хлорнафталин
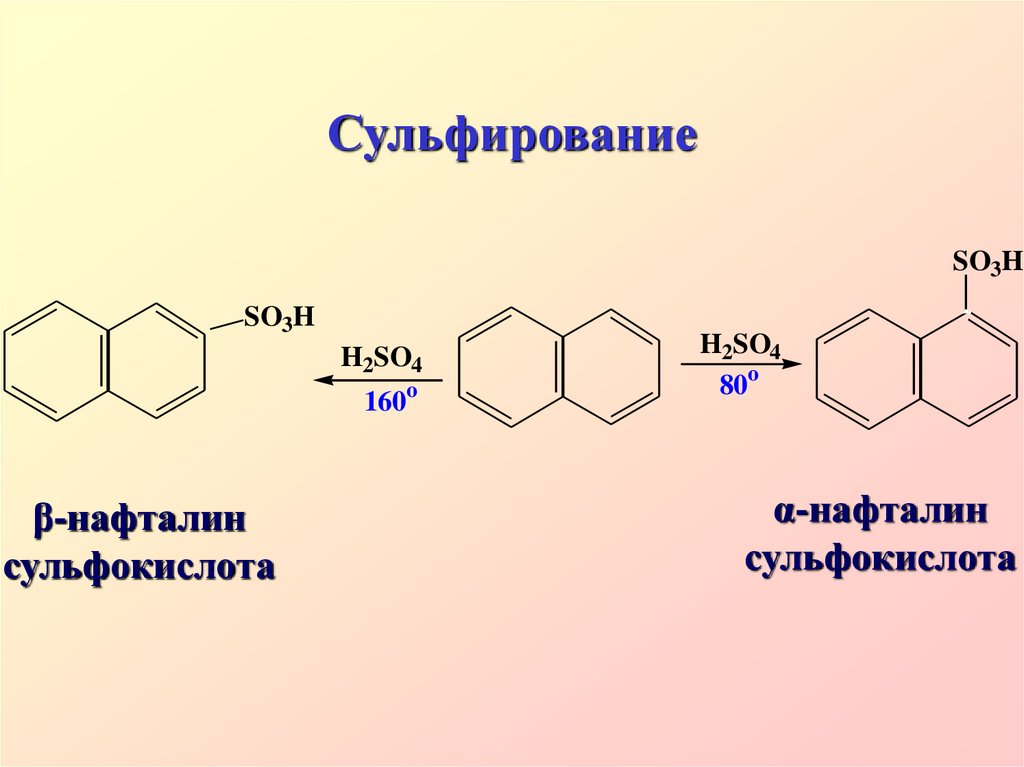
31. Сульфирование
SO3HSO3H
H2SO4
160o
β-нафталин
сульфокислота
H2SO4
80o
α-нафталин
сульфокислота
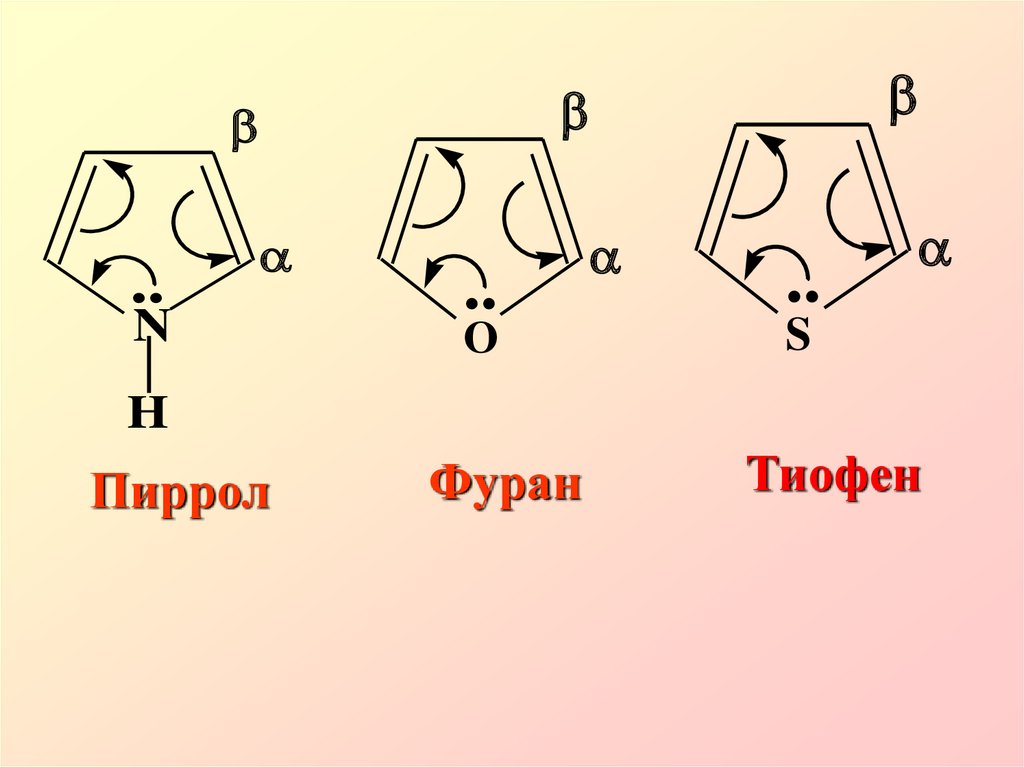
32. 5.3. Реакции SE в гетероциклических соединениях
Гетероатомы вароматических системах
могут оказывать
активирующее (пиррол,
фуран, тиофен ) и
дезактивирующее влияние
(пиридин)
.
33.
Пиррол, фуран и тиофен посравнению с бензолом являются πизбыточными (суперароматическими системами), следствием
этого является их более высокая
реакционная способность по
сравнению с бензолом в SЕреакциях, и они протекают
преимущественно в α-положении
34.
..N
+ C5H5N .SO3
..
O
o
90 C
..
S
H
Пиррол
Фуран
Тиофен
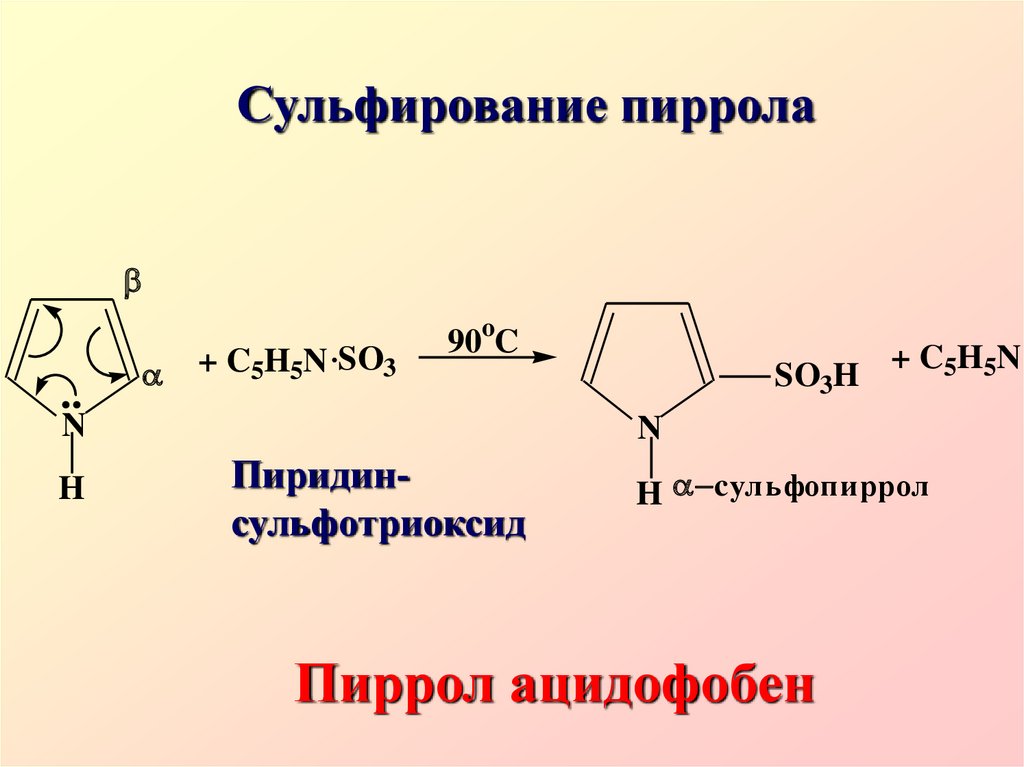
35. Сульфирование пиррола
..+ C5H5N .SO3
90oC
N
H
SO3H
+ C5H5N
N
Пиридинсульфотриоксид
H cульфопиррол
Пиррол ацидофобен
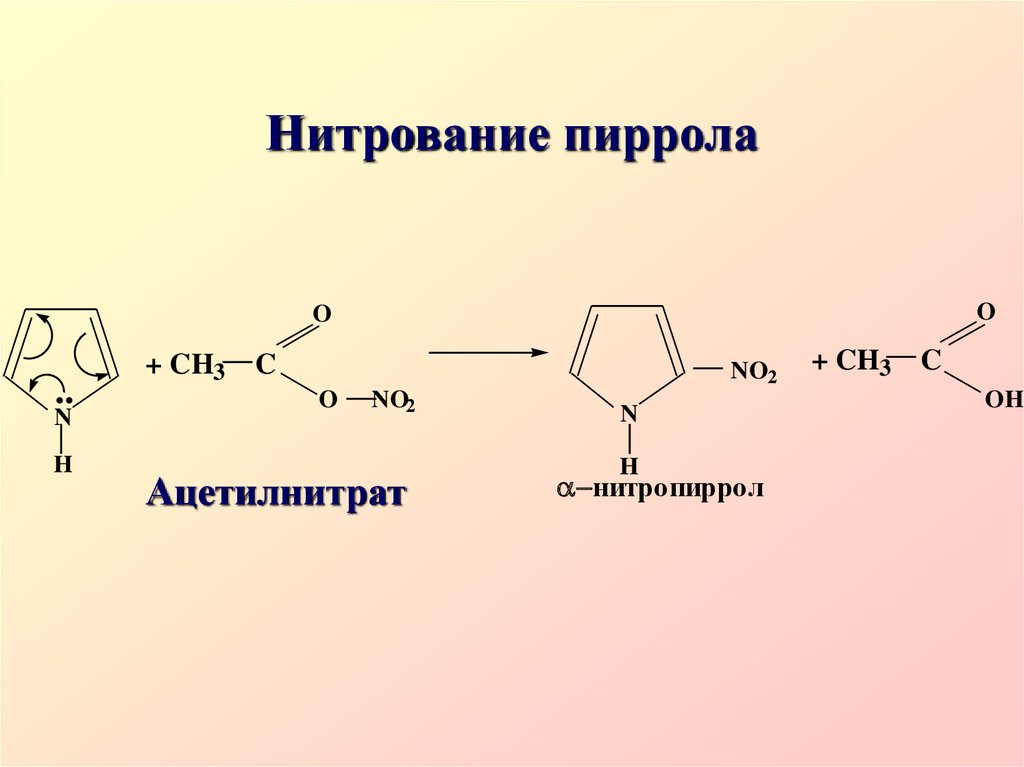
36. Нитрование пиррола
OO
..
N
H
+ CH3
C
NO2
O
NO2
Ацетилнитрат
N
H
нитропиррол
+ CH3
C
OH
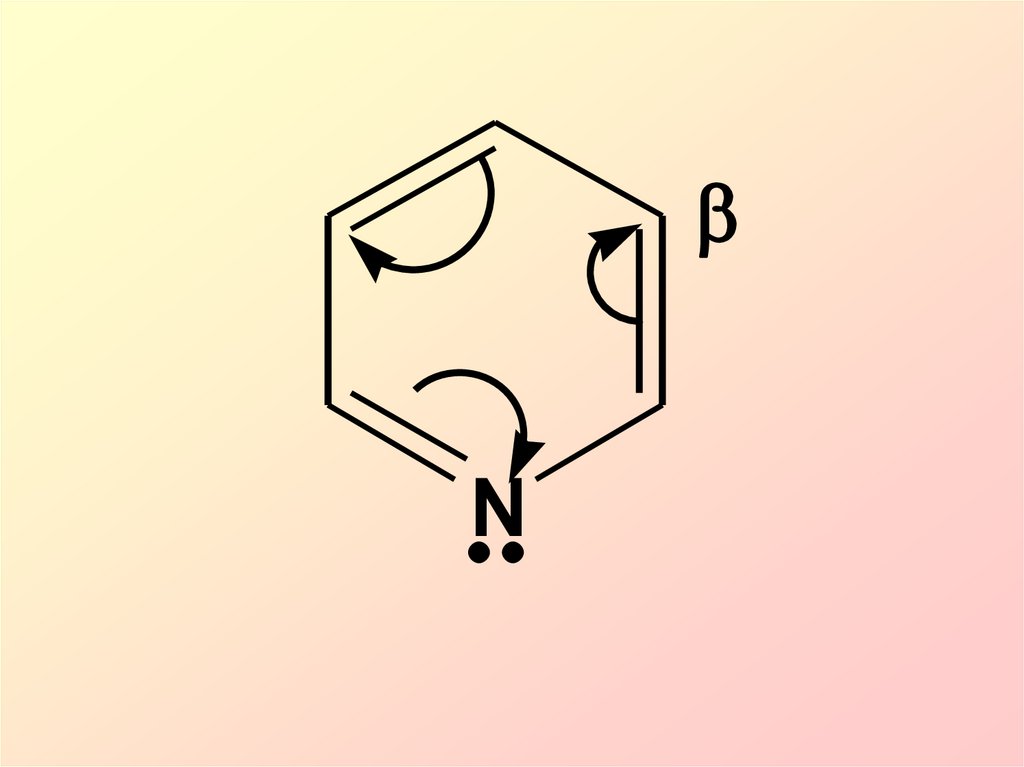
37.
Пиридин является πнедостаточной ароматическойсистемой. Общая электронная
плотность в ароматическом
кольце понижена по сравнению
с бензолом и смещена к азоту,
поэтому реакции SЕ затруднены
и протекают преимущественно в
β-положение
38.
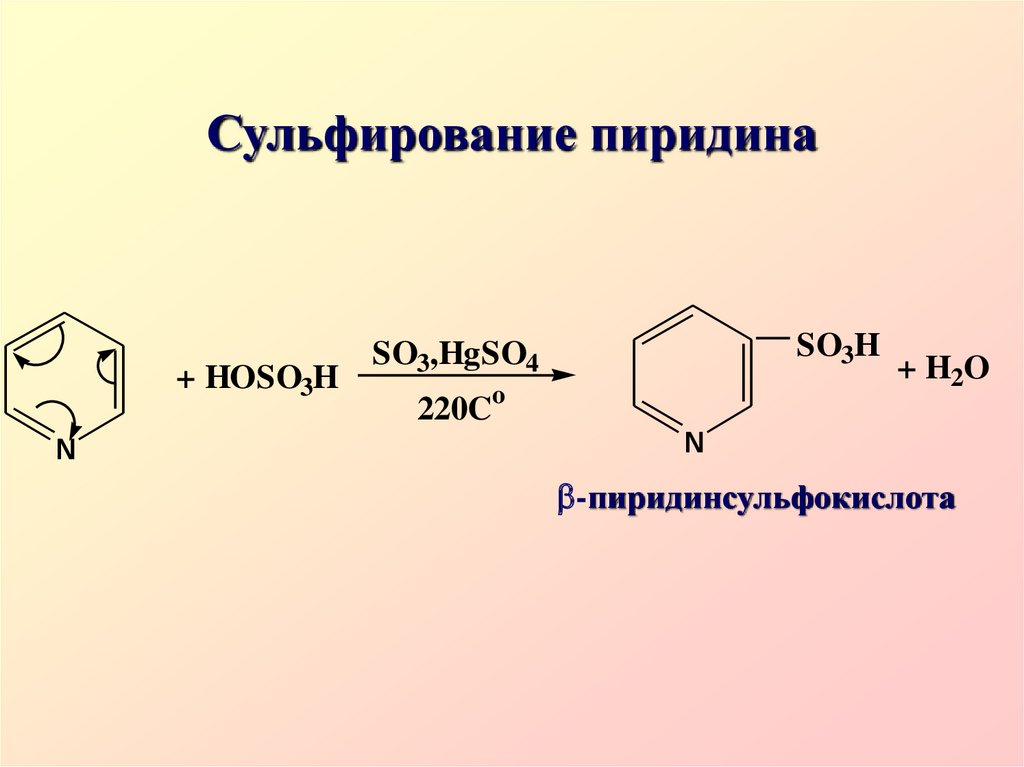
N39. Сульфирование пиридина
+ HOSO3HN
SO3H
SO3,HgSO4
220Co
+ H2O
N
-пиридинсульфокислота
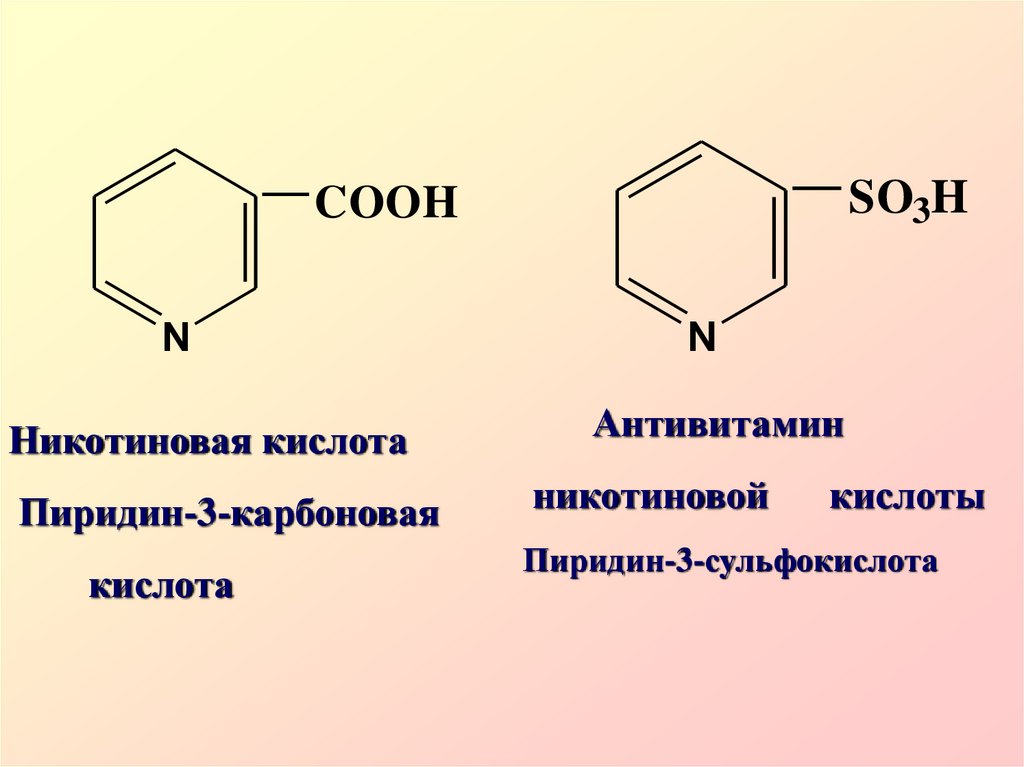
40.
SO3HCOOH
N
Никотиновая кислота
Пиридин-3-карбоновая
кислота
N
Антивитамин
никотиновой
кислоты
Пиридин-3-сульфокислота
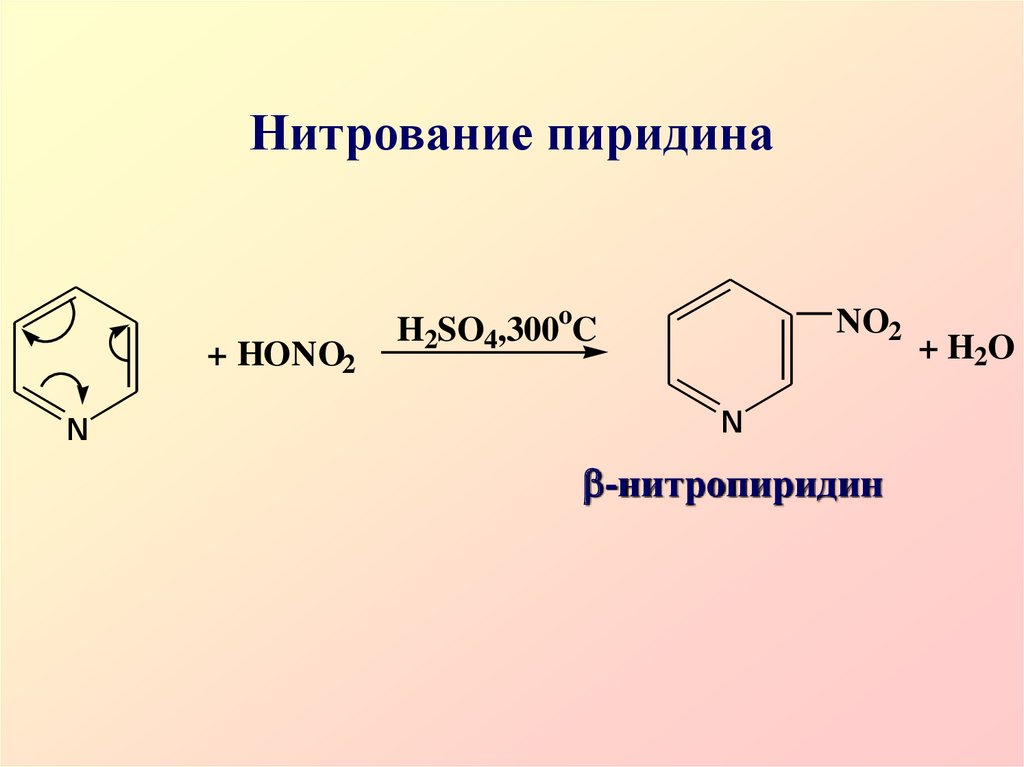
41. Нитрование пиридина
+ HONO2N
H2SO4,300oC
NO2
N
-нитропиридин
+ H2O
42.
Благодаримза внимание !



















 Биология
Биология Химия
Химия








