Похожие презентации:
Хлороводород и соляная кислота
1. Хлороводород и соляная кислота
2.
Физические свойстваХлороводород – бесцветный газ с резким
запахом, ядовитый, тяжелее воздуха. Легко
растворяется в воде (до 500 объёмов газа на один
объём воды) с образованием хлороводородной
(соляной) кислоты.
Соляная кислота – раствор хлороводорода в
воде; сильная одноосновная кислота.
Концентрированная соляная кислота – бесцветный
раствор,дымит во влажном воздухе,
с резким запахом хлороводорода.
Можно получить 40%-й раствор
соляной кислоты.
3.
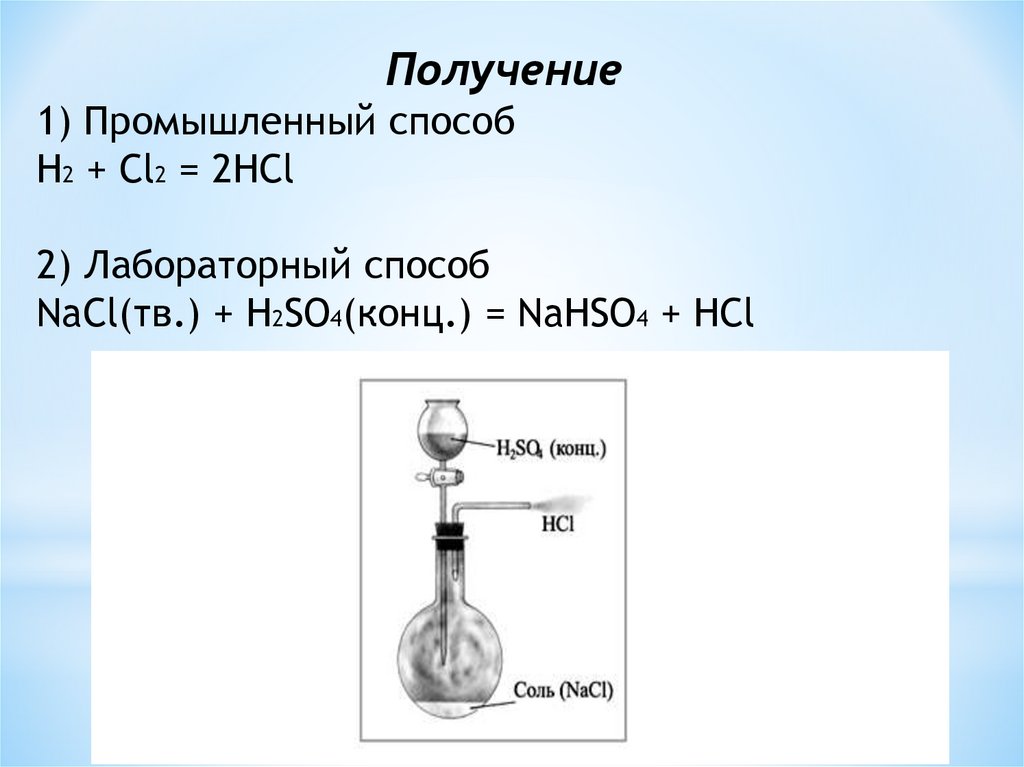
Получение1) Промышленный способ
H2 + Cl2 = 2HCl
2) Лабораторный способ
NaCl(тв.) + H2SO4(конц.) = NaHSO4 + HCl
4.
Химические свойства соляной кислоты+
-
1. Изменение окраски индикаторов. HCl→H + Cl
2. Взаимодействие с металлами, стоящими в ряду
активности до водорода.
2HCl + Zn → 2ZnCl2 + H2↑
3. Взаимодействие с основными и амфотерными
оксидами.
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. Взаимодействие с гидроксидами металлов.
HCl + NaOH → NaCl + H2O
5. Взаимодействие с солями, если образуется
осадок или газ.
2HCl + CaCO3 → CaCl2 + H2O + CO2↑
5.
Качественная реакция на хлорид-ионHCl + AgNO3 → AgCl↓ + HNO3
белый творожистый осадок
NaCl + AgNO3 → AgCl↓ + NaNO3
6.
Применение соляной кислоты1. Травление стали, перед покрытием стальных
изделий слоем защитного металла (лужение,
никелирование, хромирование). Перед этими
процессами необходимо удалить пленку
оксидов с поверхности изделия. Недостаток
этой операции заключается в том, что
кислота реагирует не только с оксидом
железа, но и с самим металлом. Чтобы
избежать реакции кислоты с металлом, в
кислоту добавляют специальные вещества –
ингибиторы, они замедляют нежелательную
реакцию.
7.
8.
2. Нейтрализации сточных вод.3. Очистка и дубление кожи.
4. Получение каучуков, анилина.
5. Получение лекарственных средств.
6. В геологии при обнаружении карбонатных пород
(мрамора).
7. В пищевой промышленности при получении
желатина, получении «кленового сиропа» из
кукурузного крахмала.







 Химия
Химия








