Похожие презентации:
Белки
1.
2.
Жизнь –это способ
существования
белковых тел.
Ф.Энгельс
3.
ВСПОМНИМ!!!!!• Что же нам известно о белках?
• Как наш организм получает белки?
• Что происходит с белками в кишечнике?
• Что происходит с аминокислотами?
4.
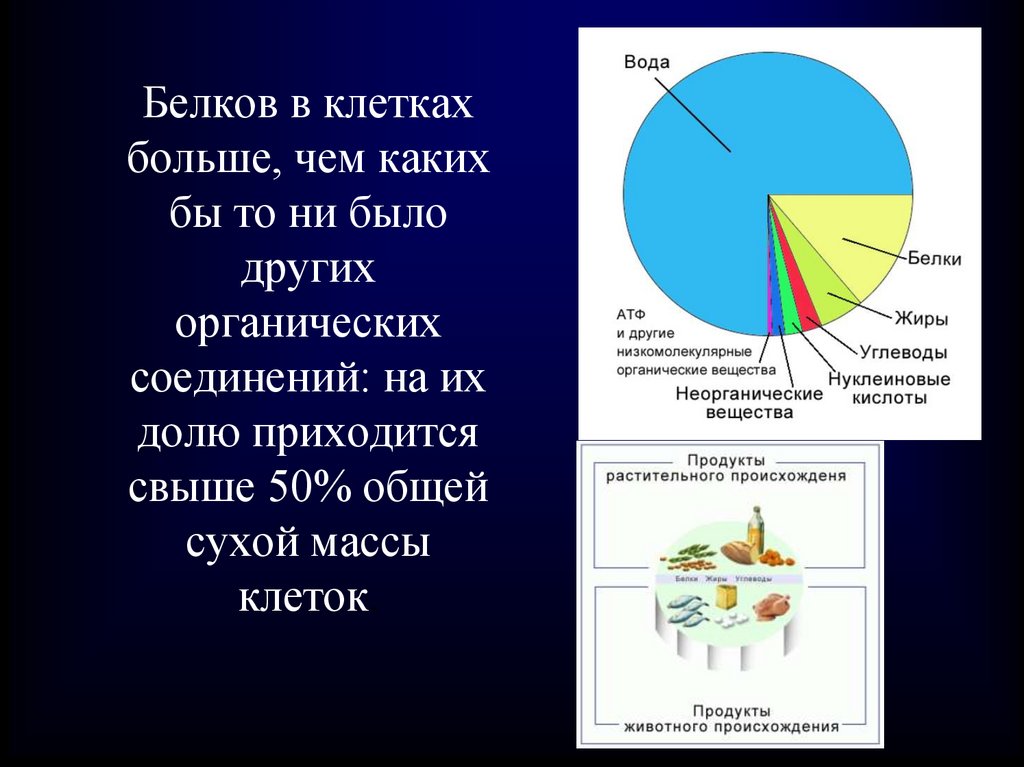
Белков в клеткахбольше, чем каких
бы то ни было
других
органических
соединений: на их
долю приходится
свыше 50% общей
сухой массы
клеток.
5.
– это сложныеорганические веществабиополимеры,
молекулы которых состоят
из мономеров –
аминокислот
6.
Строение белков:Аминокислоты (белки) состоят
из 4-х элементов:
C, H, O, N.
Кроме того, обычно
в их состав входят
S, P,
реже – Mg, Zn, Fe, Cl, и т.д.
7.
Из почти 200 аминокислот,встречающихся в природе,
в состав белков входят 20
8 аминокислот являются
незаменимыми для человека,
т.е. не могут синтезироваться
в организме и должны
поступать с пищей
8.
В состав белков входят 20 аминокислот.12 ЗАМЕНИМЫЕ
Синтезируются в
организме
8 НЕЗАМЕНИМЫЕ
Не синтезируются в
организме
9.
АминокислотыГлицин – Gly
Аланин – Ala
Валин – Val
Лейцин – Leu
Изолейцин – Ile
Цистеин – Cys
Метионин – Met
Фенилаланин – Phe
Тирозин – Tyr
Триптофан – Trp
Пролин – Pro
Серин – Ser
Треонин – Thr
Аспарагин – Asn
Глутамин – Gln
Аспарагиновая
кислота – Asp
Глутаминовая
кислота – Glu
Гистидин – His
Лизин – Lys
Аргинин – Arg
10.
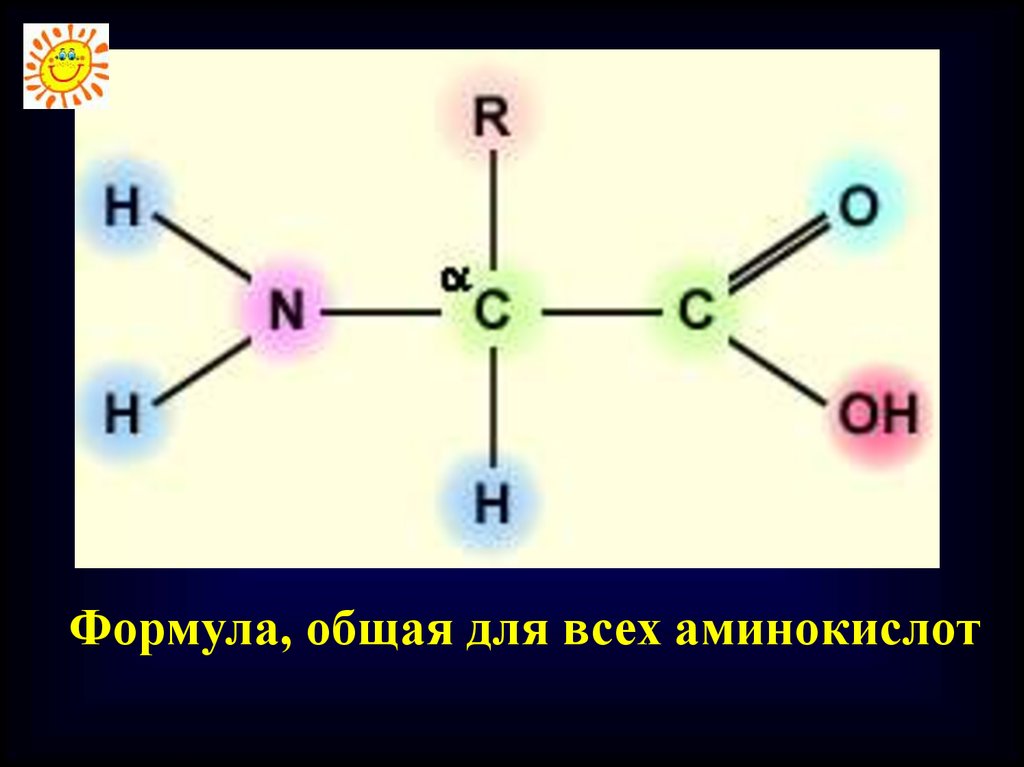
Строение молекул всехаминокислот
соответствует общей
формуле:
11.
Формула, общая для всех аминокислот12.
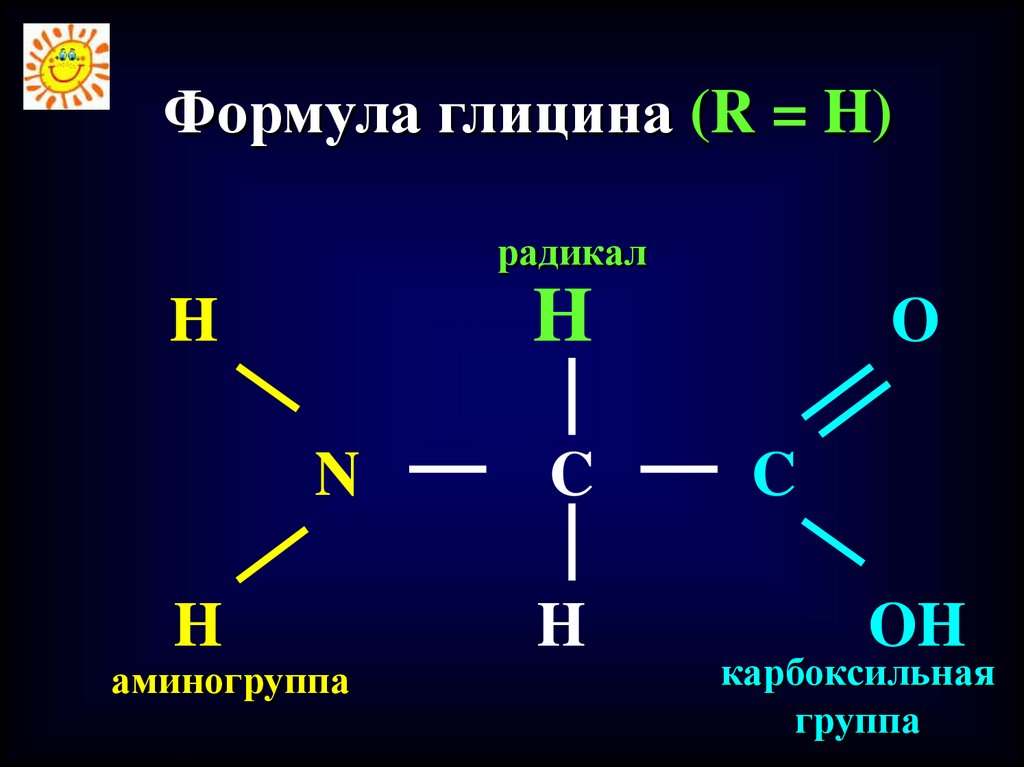
Формула глицина (R = H)радикал
H
H
N
H
аминогруппа
C
H
O
C
OH
карбоксильная
группа
13.
Радикалы (R)аминокислот
14.
Протеиногенные (стандартные) аминокислоты15.
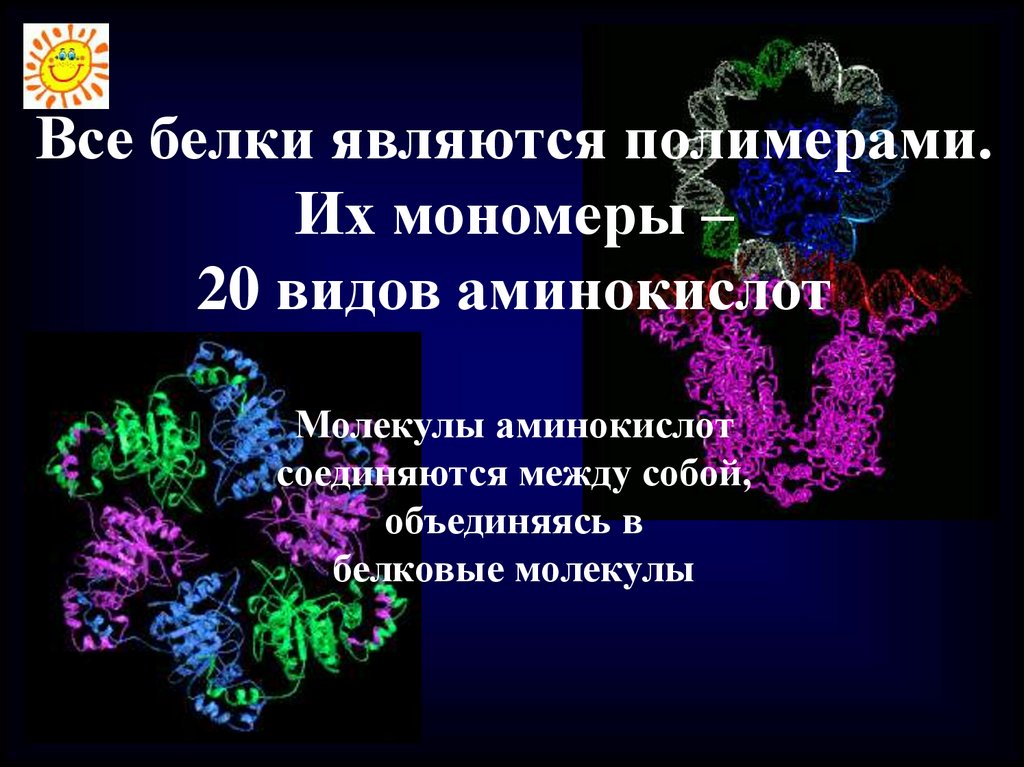
Все белки являются полимерами.Их мономеры –
20 видов аминокислот
Молекулы аминокислот
соединяются между собой,
объединяясь в
белковые молекулы
16.
20 аминокислот2 432 902 008 176 640 000
комбинаций белков
17.
Каждые две аминокислотысоединяются между собой при
помощи
пептидной связи,
поэтому белки
называются полипептидами
18.
Пептидная связь являетсяковалентной и образуется
между атомами С и N.
(«С» одной аминокислоты и «N» – другой)
При образовании пептидной связи
отщепляется молекула воды
19.
Белки различаютсяколичеством,
последовательностью,
разнообразием
входящих в их состав
аминокислот
20.
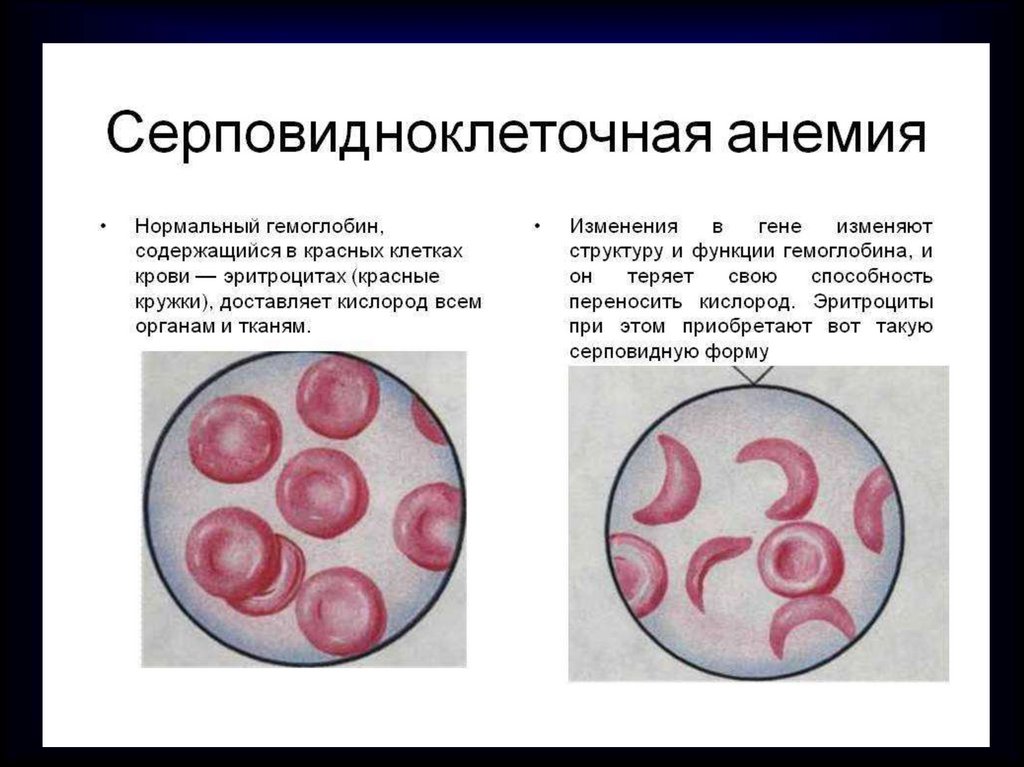
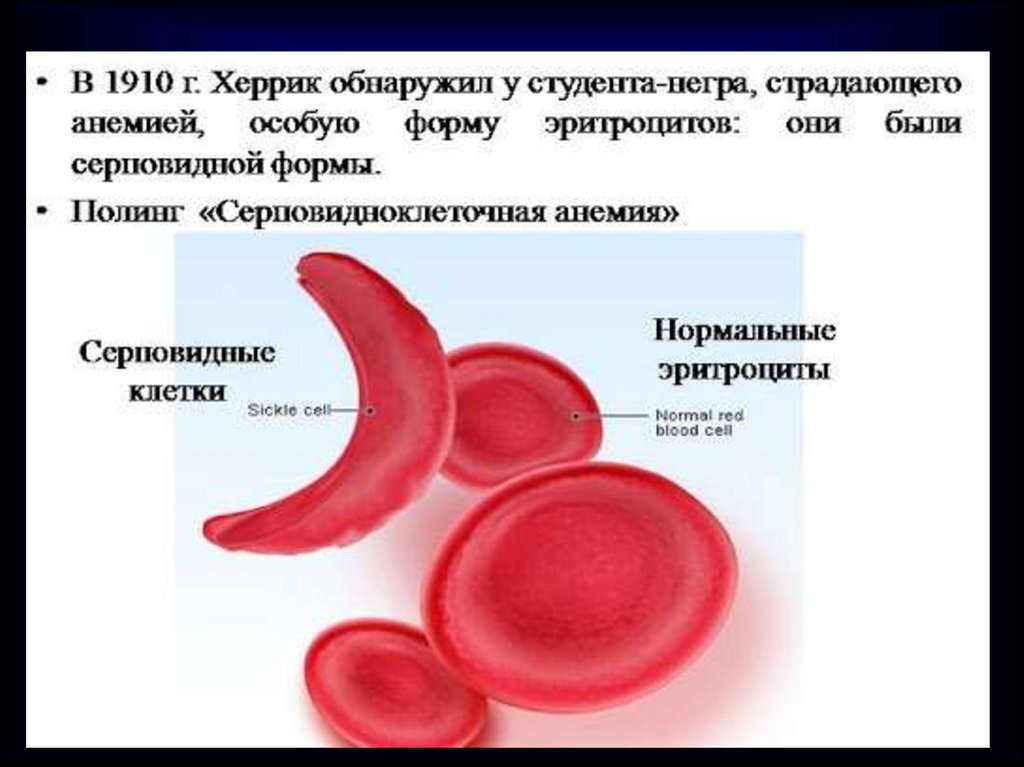
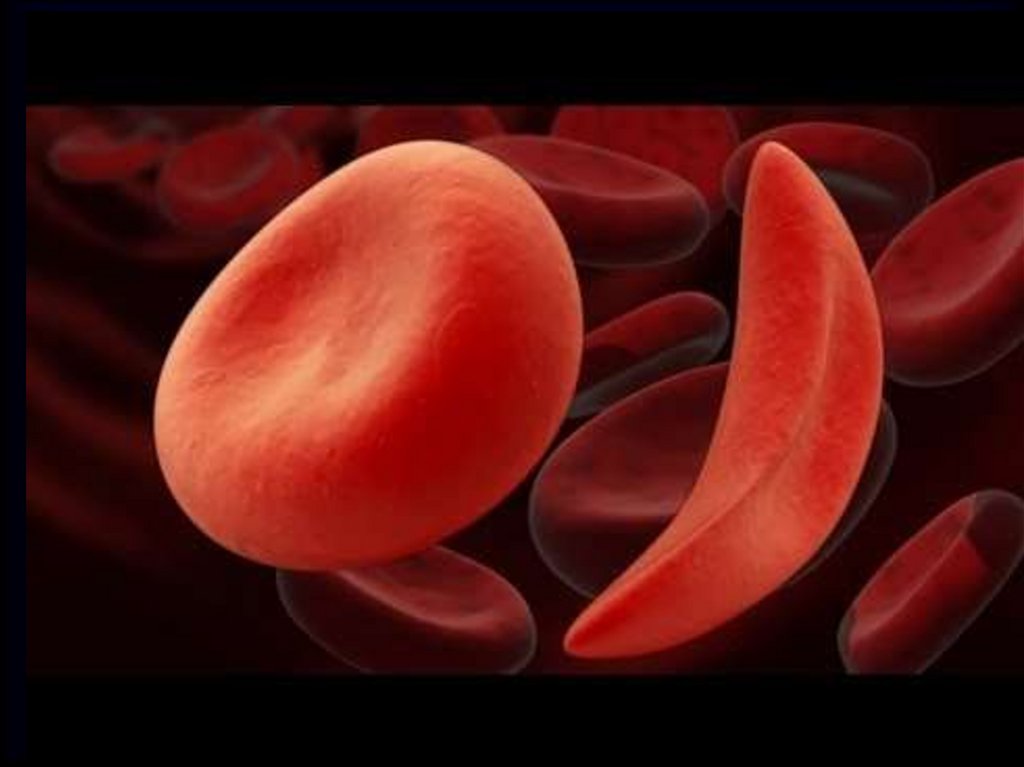
Очень важное значение имеетпоследовательность
аминокислот в молекуле белка.
Например, если в молекуле
гемоглобина заменить
одну аминокислоту,
у человека разовьется
тяжелое заболевание –
серповидно-клеточная
анемия
21.
22.
23.
24.
25.
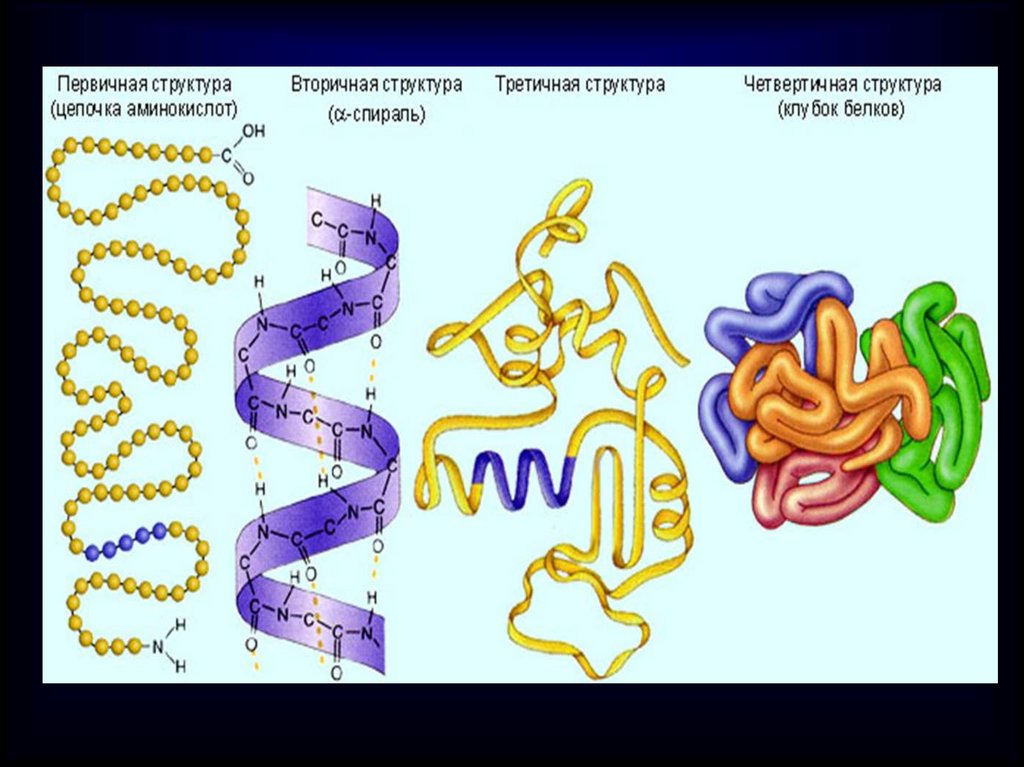
Уровни организации белковойМолекулы.
Молекулы белков могут принимать
различные пространственные формы- конформации, которые представляют
собой 4 уровня их организации, т.е. 4
структуры
26.
27.
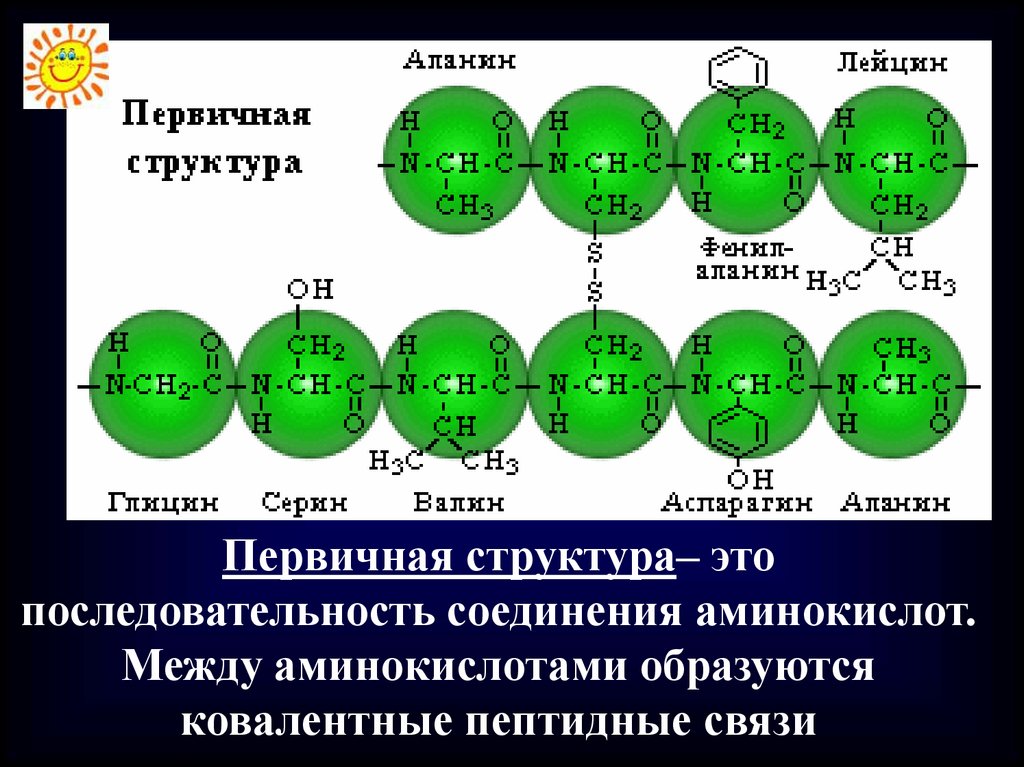
Первичная структура– этопоследовательность соединения аминокислот.
Между аминокислотами образуются
ковалентные пептидные связи
28.
Первичная структура уникальна длялюбого белка и определяет его
форму, свойства и его функцию.
Структура и свойства белковой молекулы
зависят от:
1) набора АК,
2) количества АК
3) последовательного расположения АК в
первичной структуре молекулы белка.
29.
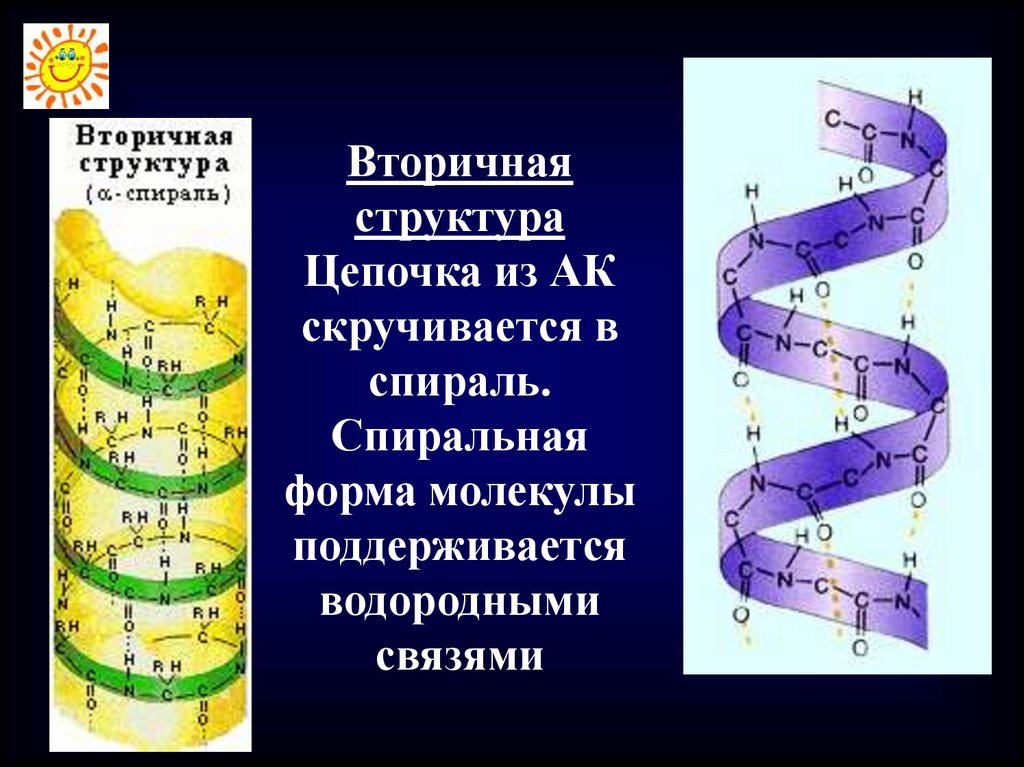
Вторичнаяструктура
Цепочка из АК
скручивается в
спираль.
Спиральная
форма молекулы
поддерживается
водородными
связями
30.
Спиральная нитьсворачивается в
клубочек –
глобулу,
образуя третичную
структуру.
Эту структуру
поддерживают
Водородные и
дисульфидные
связи S-S.
31.
Четвертичнаяструктура
белковой
молекулы –
комплекс глобул,
соединенных
водородными
и ковалентными
связями
32.
Первичную и вторичнуюструктуры
имеют все белковые молекулы,
третичную и четвертичную –
не все
33.
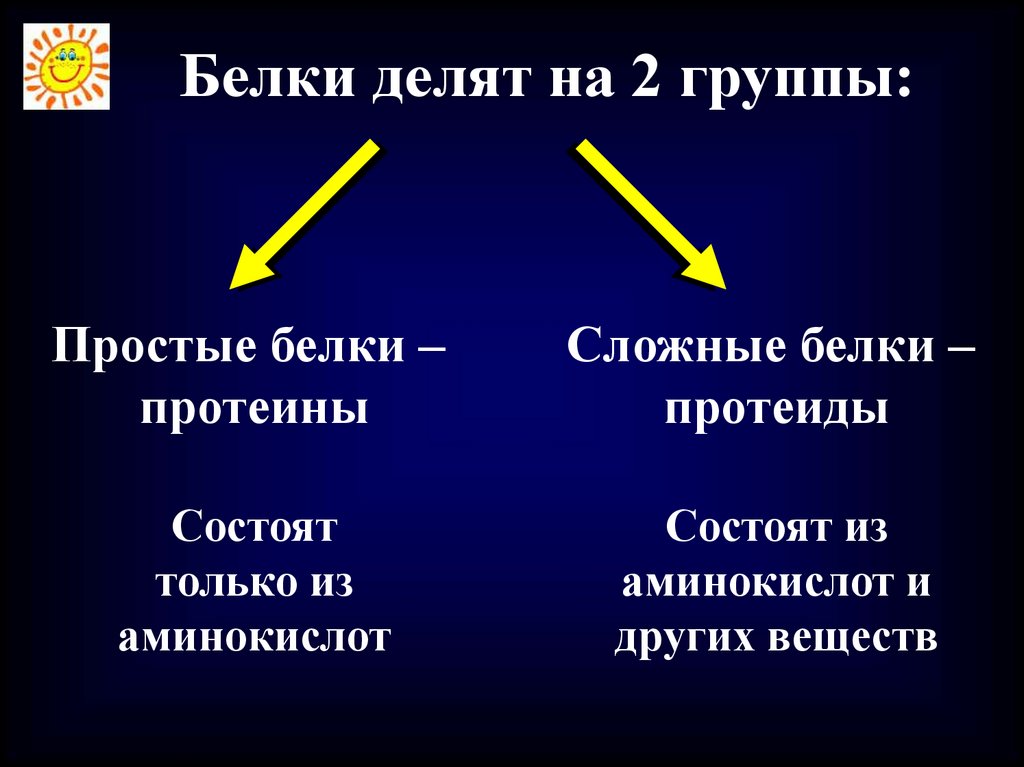
Белки делят на 2 группы:Простые белки –
протеины
Сложные белки –
протеиды
Состоят
только из
аминокислот
Состоят из
аминокислот и
других веществ
34. Сложные белки –протеиды:
- гликопротеиды – аминокислоты + углеводы- липопротеиды – аминокислоты + жиры
- нуклеопротеиды – аминокислоты +
нуклеиновая кислота
- металлопротеиды – аминокислоты +
металлы (гемоглобин)
34
35.
Например, альбумин –белок
куриного яйца –
является протеином
В состав
молекулы гемоглобина
входит катион железа.
Поэтому гемоглобин –
протеид
36.
Свойства белков1.Видоспецифичность.
У каждого вида живых организмов
свои, присущие только ему белки
37.
Например, гемоглобин есть у человекаи крупного рогатого скота.
Но последовательность аминокислот
в молекулах гемоглобина различна
38.
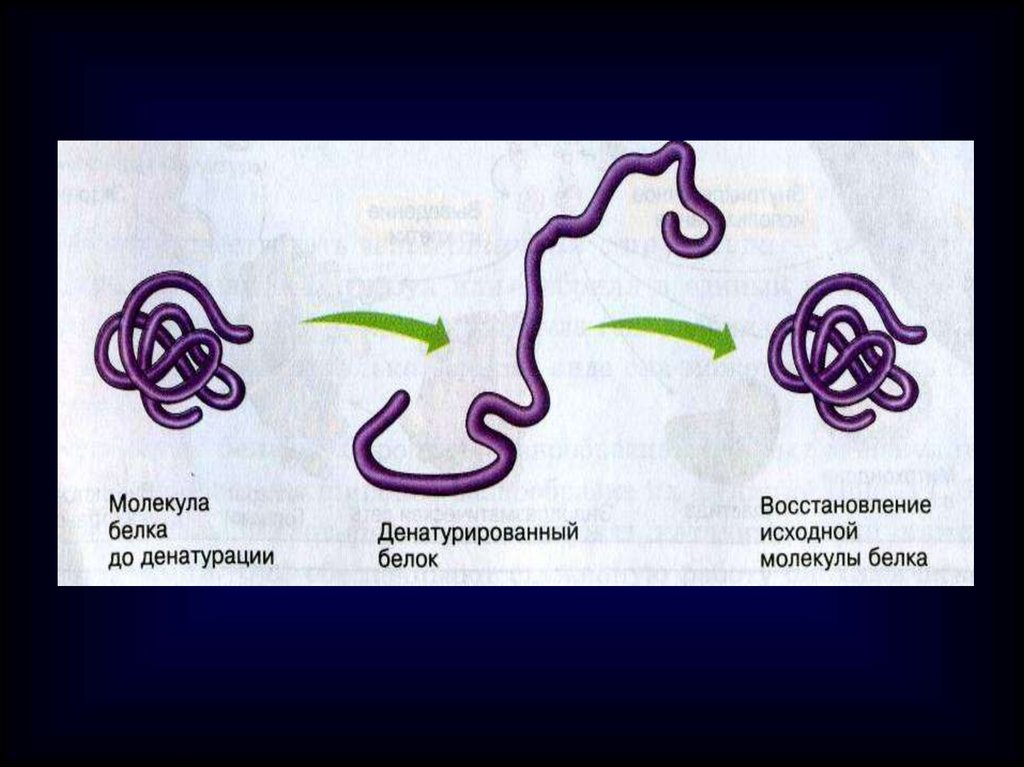
2. Денатурация. Это разрушениебелковой молекулы под воздействием
высокой или низкой температуры,
кислот, щелочей, солей тяжелых
металлов, ионизирующего излучения
39.
40.
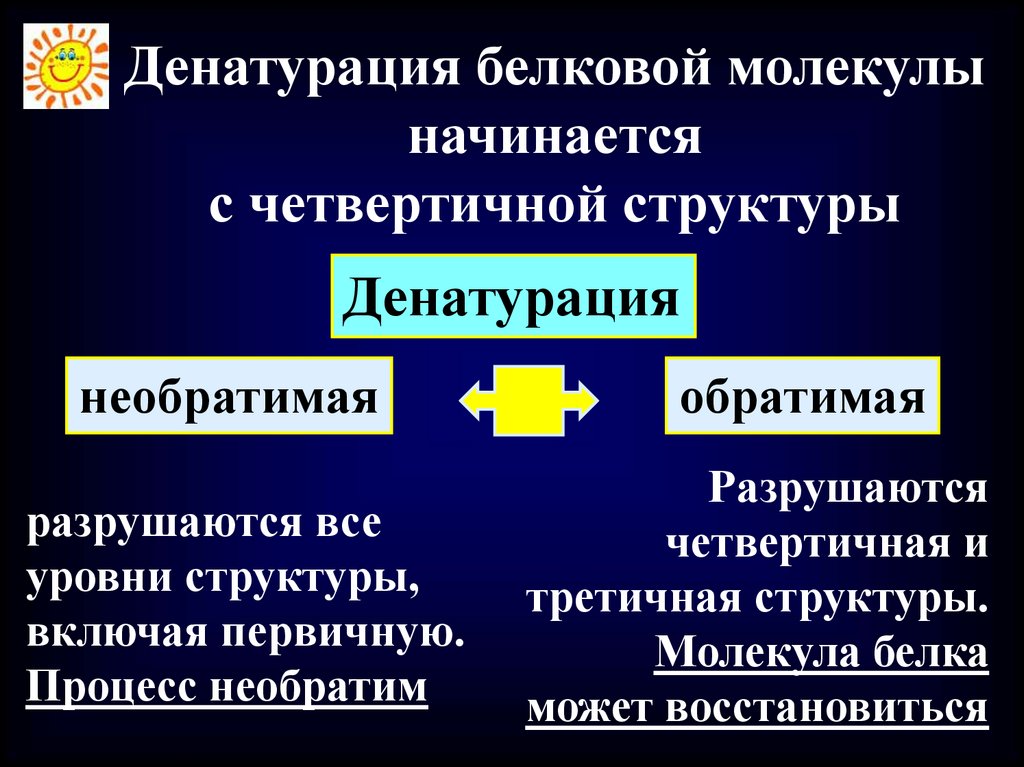
Денатурация белковой молекулыначинается
с четвертичной структуры
Денатурация
необратимая
разрушаются все
уровни структуры,
включая первичную.
Процесс необратим
обратимая
Разрушаются
четвертичная и
третичная структуры.
Молекула белка
может восстановиться
41.
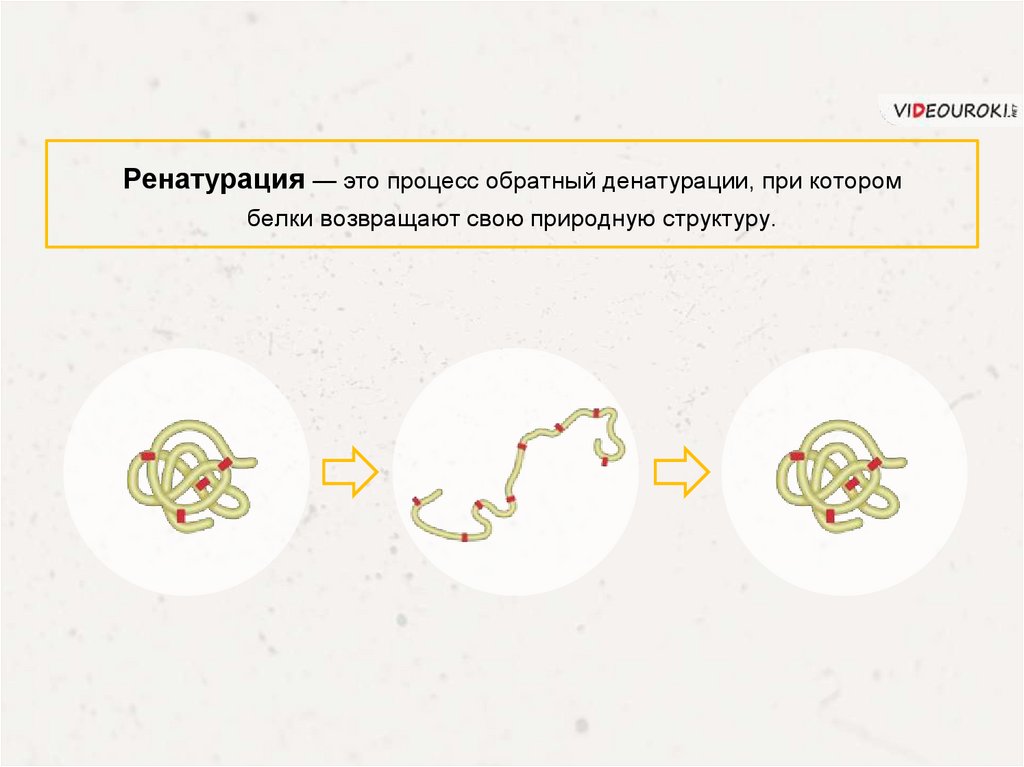
Ренатурация — это процесс обратный денатурации, при которомбелки возвращают свою природную структуру.
42.
Применение белков43.
44.
45.
лекарственныепрепараты
инсулин
46.
ферменты –белки, регулирующие
все химические реакции
в организме, например,
процесс пищеварения
47.
Функции белков1. Структурная
2. Ферментативная
3. Регуляторная
4. Защитная
5. Транспортная
6. Запасающая
7. Двигательная
8. Сигнальная
9. Энергетическая
48. ЗАДАНИЕ:
• Расчертить и заполнить таблицу.49. Функции белков.
ФункцииОпределение
Белок
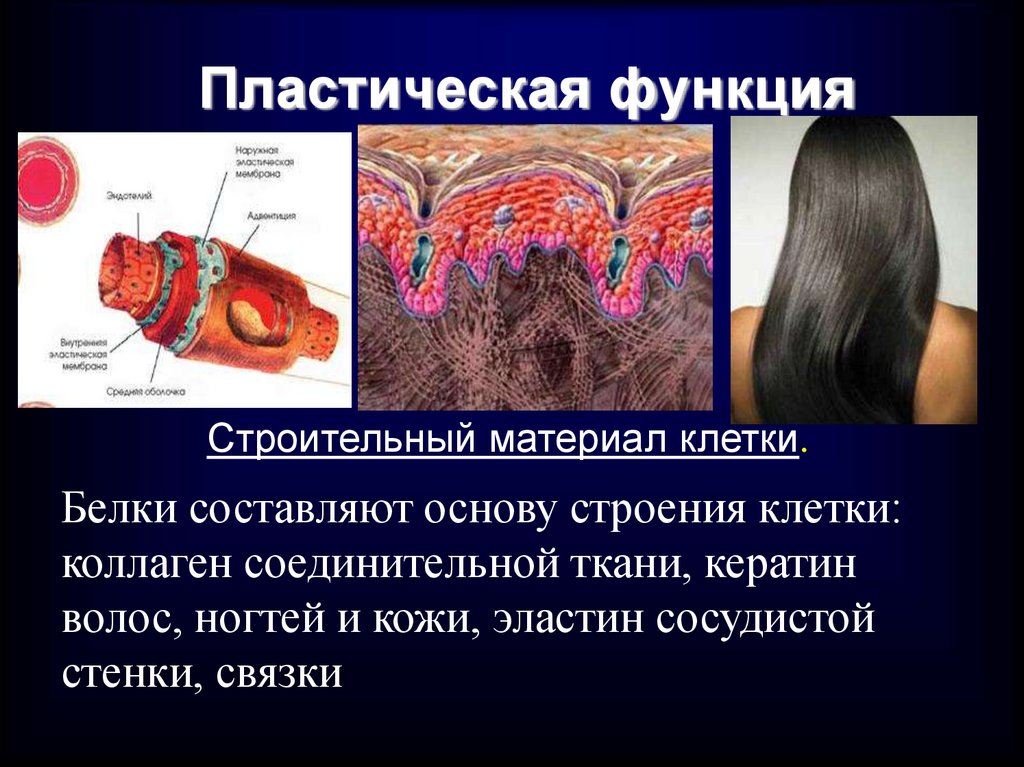
50. Пластическая функция
Строительный материал клетки.Белки составляют основу строения клетки:
коллаген соединительной ткани, кератин
волос, ногтей и кожи, эластин сосудистой
стенки, связки
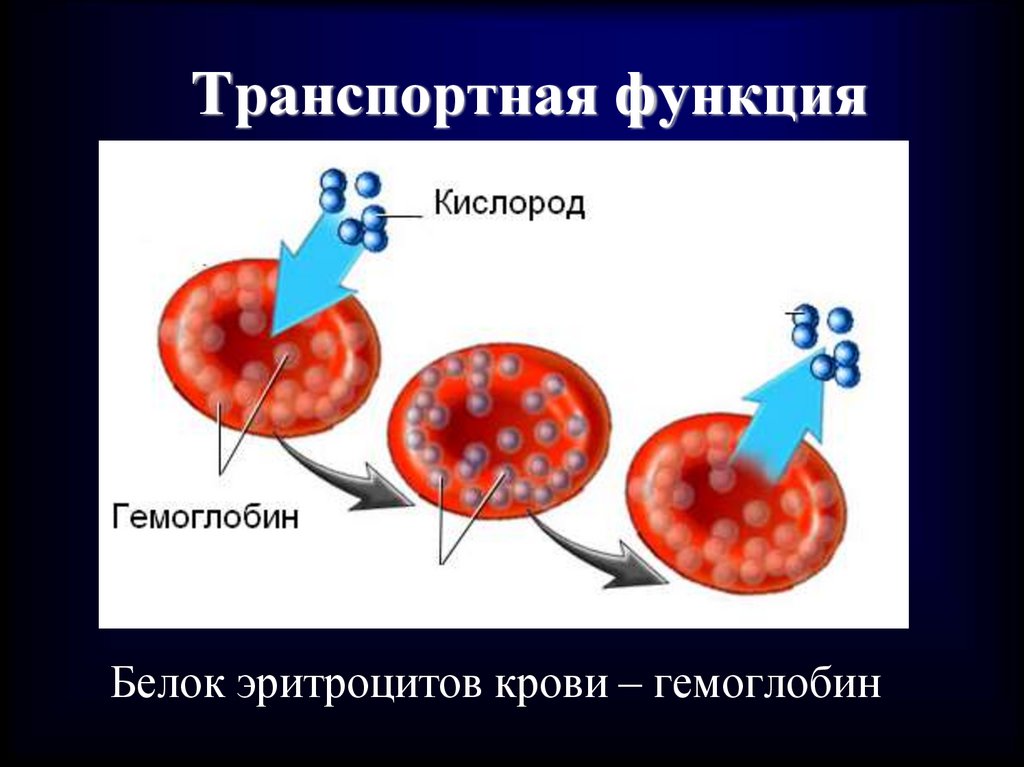
51. Транспортная функция
• При участии белков происходитсвязывание и доставка
(транспортировка) различных веществ от
одного органа к другому.
52. Транспортная функция
При участии белков происходитсвязывание и доставка (транспорт)
различных веществ от одного органа к
другому.
Белок эритроцитов крови – гемоглобин
53. Защитная функция
Белки иммуноглобулины (или антитела)обеспечивают связывание и обезвреживание
веществ, поступающих в организм или
появляющихся в результате
жизнедеятельности бактерий и вирусов.
54. Двигательная функция
Выполняют все виды движений, ккоторым способны клетки и организмы.
Сокращение и расслабление сердца, движение
других внутренних органов.
Сокращение мышц (сгибание, разгибание
конечностей). Белки актин и миозин.
Движение ресничек и жгутиков.
55. Регуляторная функция
Белки - регуляторы обмена веществ - гормоны,которые образуются в железах внутренней
секреции, некоторых органах и тканях
организма.
Пример таких белков - инсулин, который
регулирует концентрацию глюкозы в крови и
фактор некроза опухолей, и передаёт сигналы
воспаления между клетками организма.
56.
Энергетическая функцияПри расщеплении белков
выделяется 17,6 кДж
энергии.
57.
Ферментативная функцияФерменты — по своей
природе белки.
Ферменты катализируют
(ускоряют) реакции:
расщепления сложных
молекул (катаболизм) и их
синтеза (анаболизм);
например фермент пепсин,
расщепляют белки в
процессе пищеварения.
Белки ускоряют
протекание
химических
реакций в
организме.
58.
ЗАКРЕПЛЕНИЕпройденного материала





































 Биология
Биология








