Похожие презентации:
Білки, їхня біолгічна роль
1. Білки, їхня біологічна роль
2.
Які сполуки є мономерамибілків?
Чому білки є необхідним
компонентом харчування
людини?
Назвіть відомі вам білки,
які забезпечують процеси
життєдіяльності
організму людини.
3.
Поміж органічнихсполук провідну
роль відіграють
білки. Часто вони
переважають у
клітинах і кількісно.
У клітинах тварин
білки становлять
40 – 50 % сухої маси,
а в клітинах
рослин – 20 – 35 %.
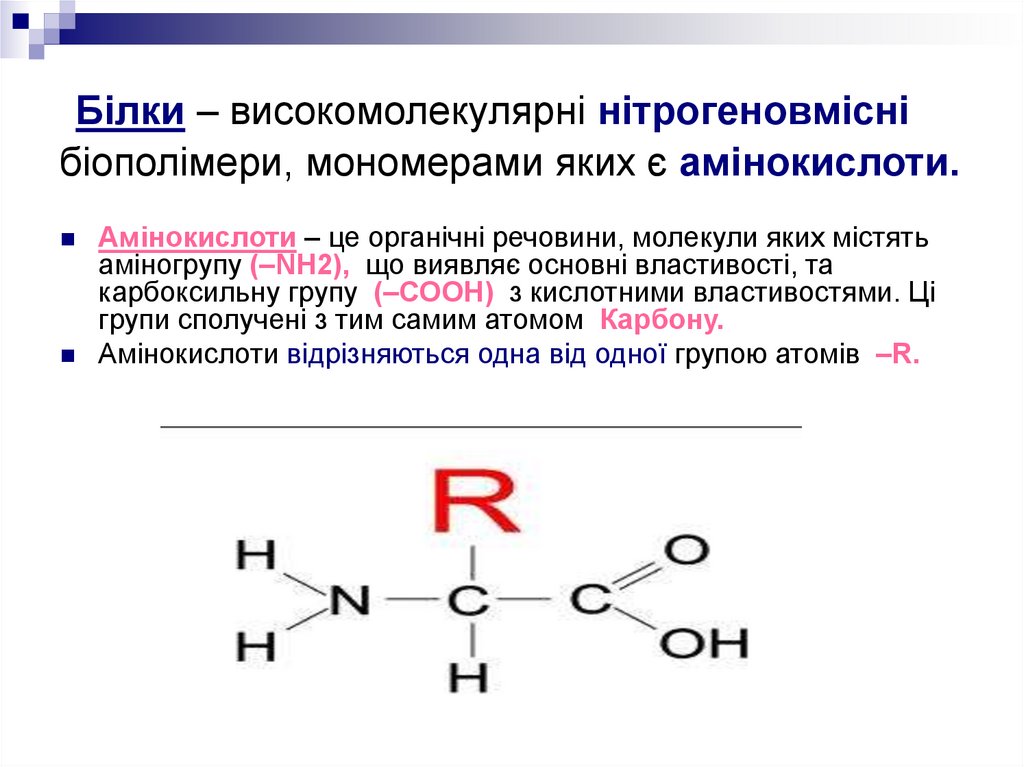
4. Білки – високомолекулярні нітрогеновмісні біополімери, мономерами яких є амінокислоти.
Амінокислоти – це органічні речовини, молекули яких містятьаміногрупу (–NH2), що виявляє основні властивості, та
карбоксильну групу (–СООН) з кислотними властивостями. Ці
групи сполучені з тим самим атомом Карбону.
Амінокислоти відрізняються одна від одної групою атомів –R.
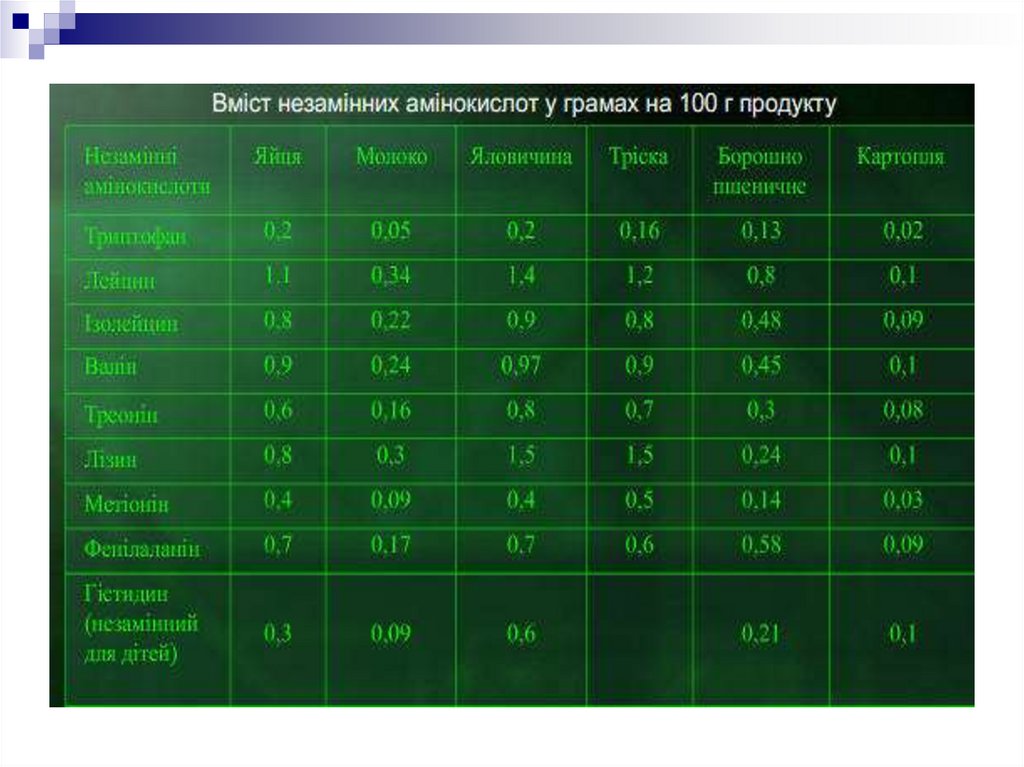
5. Нині відомо понад 100 амінокислот, але лише 20 з них входять до складу білків. Різні комбінації цих 20 амінокислот забезпечують
величезну різноманітність білкових молекул.Амінокислоти, які не синтезуються в
організмі людини, наприклад Ізолейцин,
Лейцин , Лізин, Метіонін, Фенілаланін,
Треонін , Триптофан , Валін називають
незамінними. Вони повинні постійно
надходити в організм у складі білків їжі.
Відсутність хоча б однієї з цих
амінокислот призводить до порушення
синтезу білків.
Замінні амінокислоти, наприклад Гліцин,
Серин та інші можуть синтезуватися в
організмі людини з інших амінокислот, що
надходять з їжею.
6.
7. Білки подляють на дві групи : прості - протеїни і складні – протеїди.
Протеїни – це білки, до складу яких входять лишезалишки амінокислот (альбуміни, глобуліни, гістони)
Протеїди – складні білки, молекули яких крім залишків
АК містять ще і інші компоненти – простетичні групи
(нуклеопротеїди, металопротеїди, глюкопротеїди,
фосфопротеїди і ліпопротеїди).
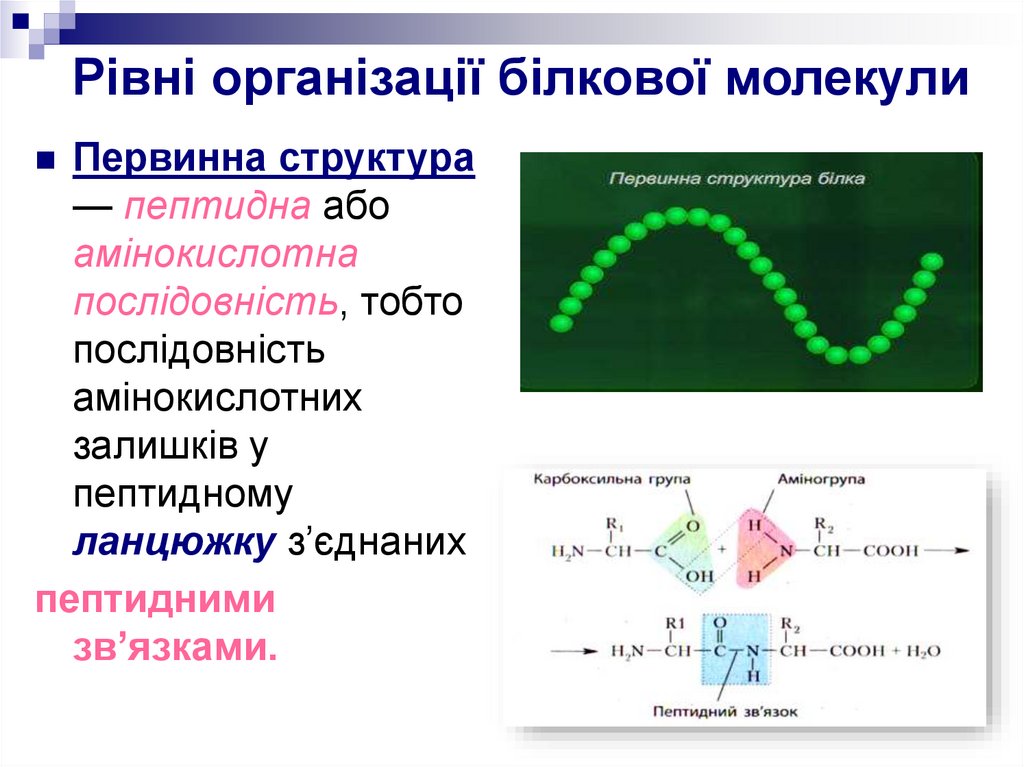
8. Рівні організації білкової молекули
Первинна структура— пептидна або
амінокислотна
послідовність, тобто
послідовність
амінокислотних
залишків у
пептидному
ланцюжку з’єднаних
пептидними
зв’язками.
9.
Вторинна структура -довгий поліпептидний
ланцюг скручується й
може укладатися
різними способами в
спіралі або складки.
Вторинна структура
білка стабілізується
слабкими водневими
зв’язками між
залишками
амінокислот.
10.
Третинна структура спіралі або складкивкладаються в
просторі в
різноманітні
глобули.
Цей рівень організації
білка стабілізується
слабкими
водневими,
гідрофобними та
дисульфідними
зв’язками
11.
Четвертиннаструктура
— структура, що виникає в
результаті взаємодії кількох
білкових молекул - глобул,
які
в
даному
контексті
називають
субодиницями.
Повна
структура
кількох
поєднаних субодиниць, що
разом
виконують
спільну
функцію,
називається
білковим комплексом.
Підтримується
різноманітними зв’язками.
12. Властивості білків
За певних умов (висока температура,дія кислот, лугів або йонів важких
металів, йонізуючого випромінювання
тощо) білкові молекули втрачають рівні
організації: четвертинні структури
розпадаються на окремі субодиниці,
третинні структури розгортаються до
рівня спіралей або складок, а ті, своєю
чергою,випрямляються до
поліпептидних ланцюжків. Такий
процес утрати білковими молекулами
природної структури називається
денатурацією.
Денатуровані білки не можуть
виконувати свої функції.
13.
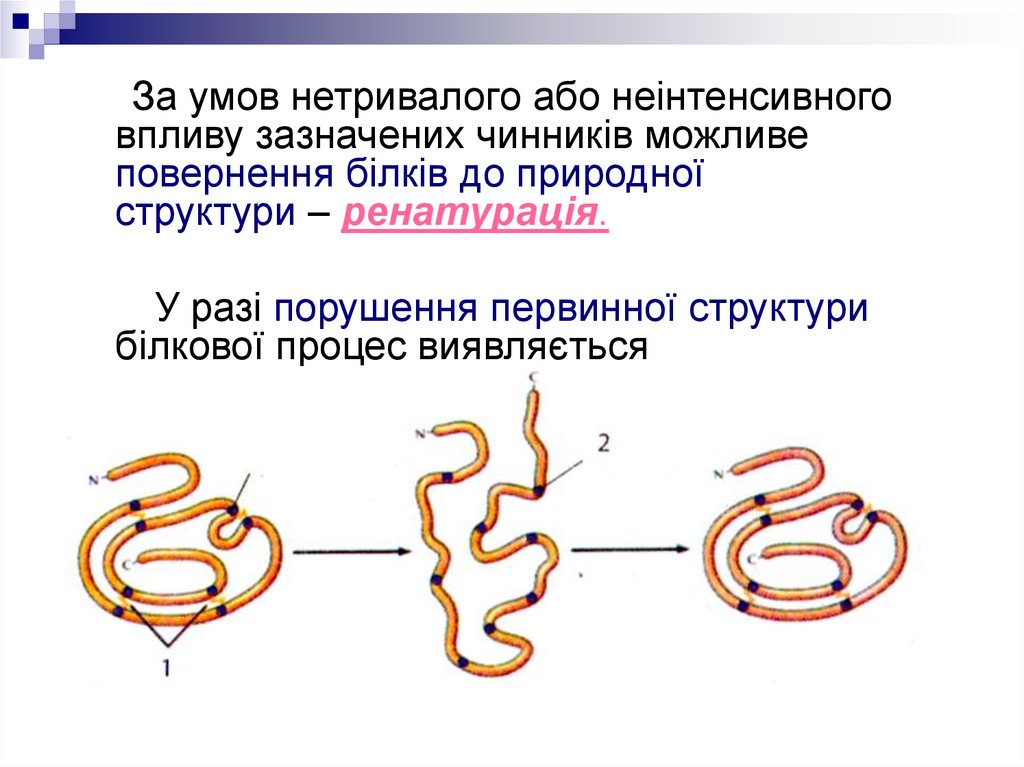
За умов нетривалого або неінтенсивноговпливу зазначених чинників можливе
повернення білків до природної
структури – ренатурація.
У разі порушення первинної структури
білкової процес виявляється
незворотним і називається
деструкцією.
14. Біологічна роль білків
-Будівельна:
є основою біологічних мембран;
складаються мікротрубочки та мікрониточки, які виконують
роль скелета в клітині;
скріплюють клітинні структури;
Містяться у хрящах і сухожиллях, у шкірі – колаген, у
зв’язках – еластин, у кістках – осеїн, волосся, нігті, пір’я –
кератин.
15.
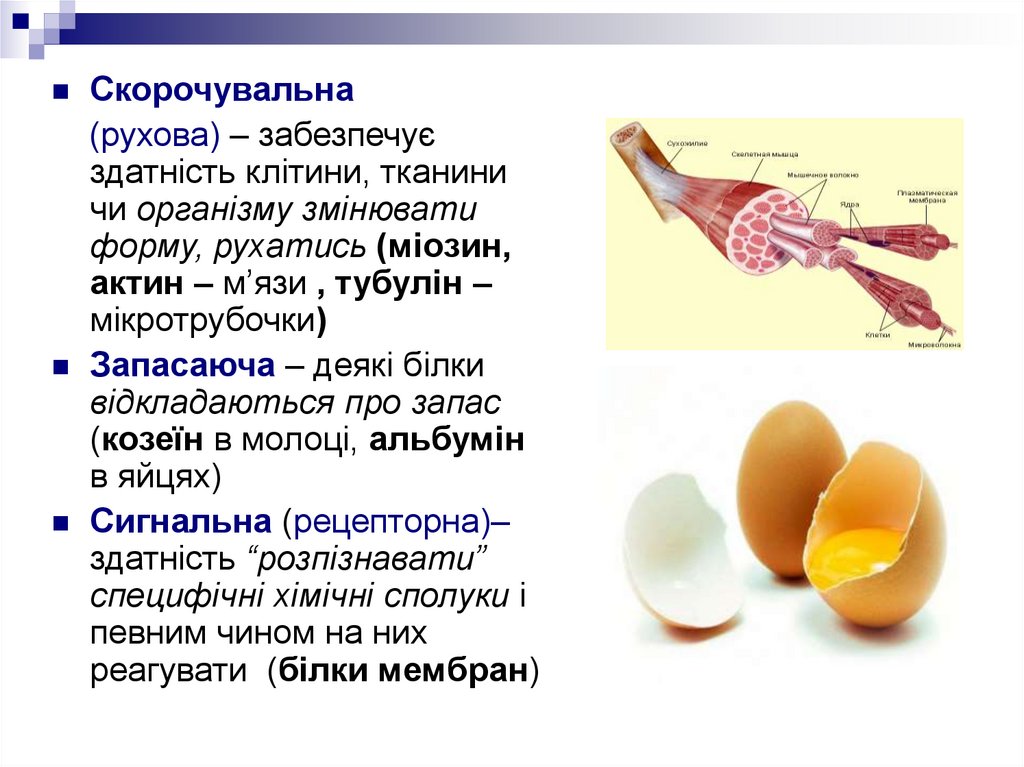
Скорочувальна(рухова) – забезпечує
здатність клітини, тканини
чи організму змінювати
форму, рухатись (міозин,
актин – м’язи , тубулін –
мікротрубочки)
Запасаюча – деякі білки
відкладаються про запас
(козеїн в молоці, альбумін
в яйцях)
Сигнальна (рецепторна)–
здатність “розпізнавати”
специфічні хімічні сполуки і
певним чином на них
реагувати (білки мембран)
16.
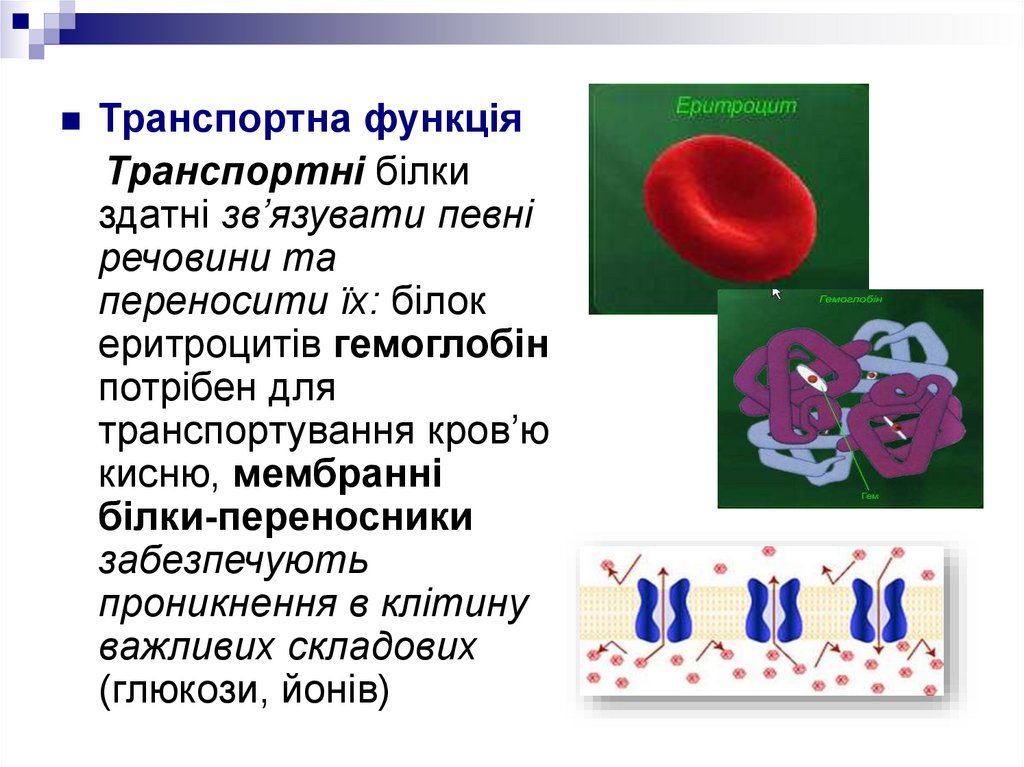
Транспортна функціяТранспортні білки
здатні зв’язувати певні
речовини та
переносити їх: білок
еритроцитів гемоглобін
потрібен для
транспортування кров’ю
кисню, мембранні
білки-переносники
забезпечують
проникнення в клітину
важливих складових
(глюкози, йонів)
17.
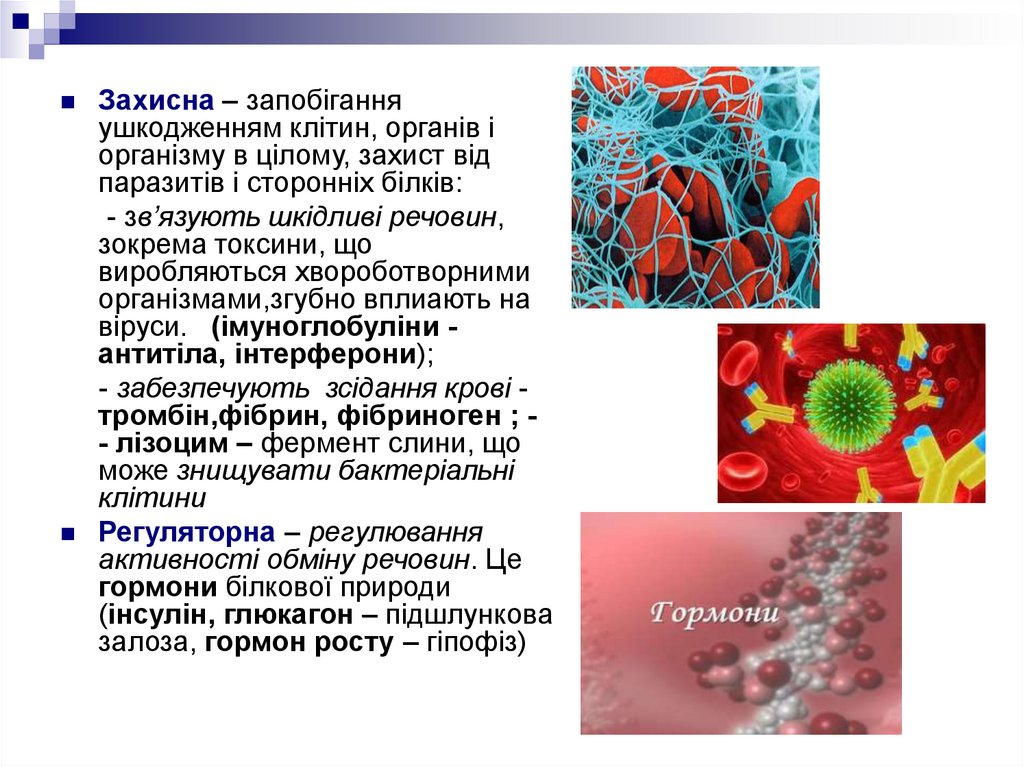
Захисна – запобіганняушкодженням клітин, органів і
організму в цілому, захист від
паразитів і сторонніх білків:
- зв’язують шкідливі речовин,
зокрема токсини, що
виробляються хвороботворними
організмами,згубно вплиають на
віруси. (імуноглобуліни антитіла, інтерферони);
- забезпечують зсідання крові тромбін,фібрин, фібриноген ; - лізоцим – фермент слини, що
може знищувати бактеріальні
клітини
Регуляторна – регулювання
активності обміну речовин. Це
гормони білкової природи
(інсулін, глюкагон – підшлункова
залоза, гормон росту – гіпофіз)
18.
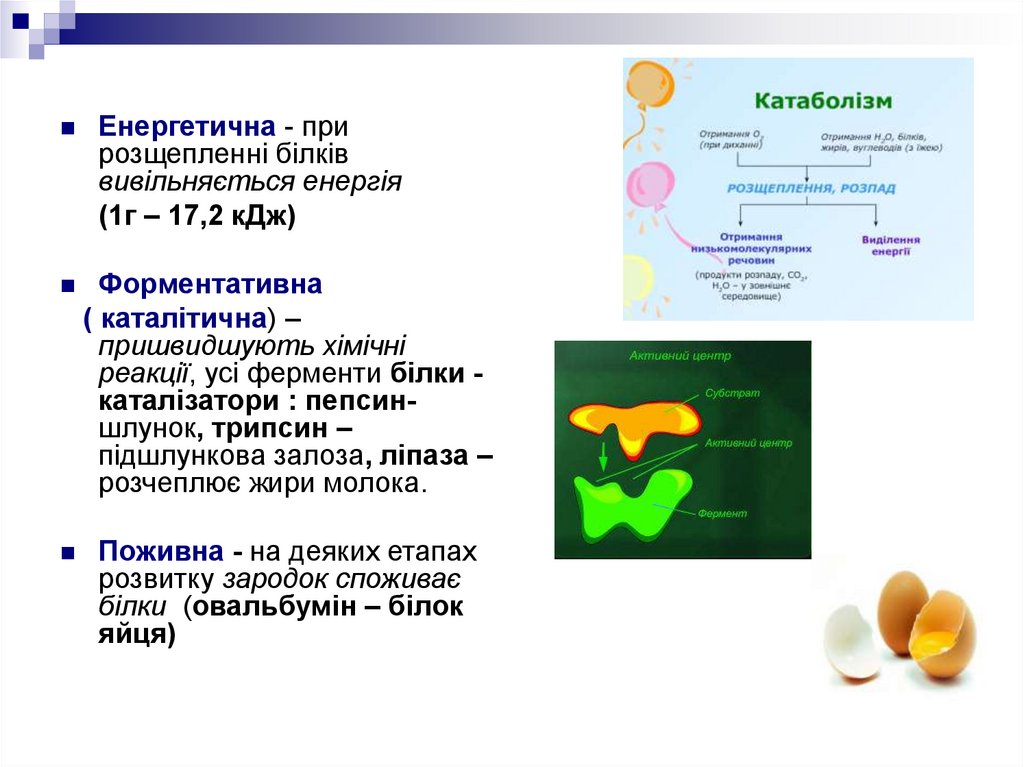
Енергетична - прирозщепленні білків
вивільняється енергія
(1г – 17,2 кДж)
Форментативна
( каталітична) –
пришвидшують хімічні
реакції, усі ферменти білки каталізатори : пепсиншлунок, трипсин –
підшлункова залоза, ліпаза –
розчеплює жири молока.
Поживна - на деяких етапах
розвитку зародок споживає
білки (овальбумін – білок
яйця)
19.
Узагальнення,систематизаціята контроль знань і вмінь
20. Складіть асоціативний кущ для поняття “ білок”
Білок21. Відірвіть зайві пелюстки
М’ясоБілки
Молоко
22. Дайте відповідь на тест
Вкажіть скільки амінокислот синтезують молекулу білка:А 20;
Б 21;
В 24;
Г 18.
Вкажіть як називається група атомів за якою амінокислоти різняться між собою:
А аміногрупа;
Б карбоксильна група;
В за кислотними властивостями;
Г радикалом
Вкажіть , які зв’язки лежать в основі утворення первинної структури білка:
А водневі;
Б пептидні;
В ковалентні;
Г дисульфідні.
Вкажіть як називається особливий захисний білок у хребетних:
А міозин;
Б гемоглобін;
В імуноглобулін;
Г тубулін.
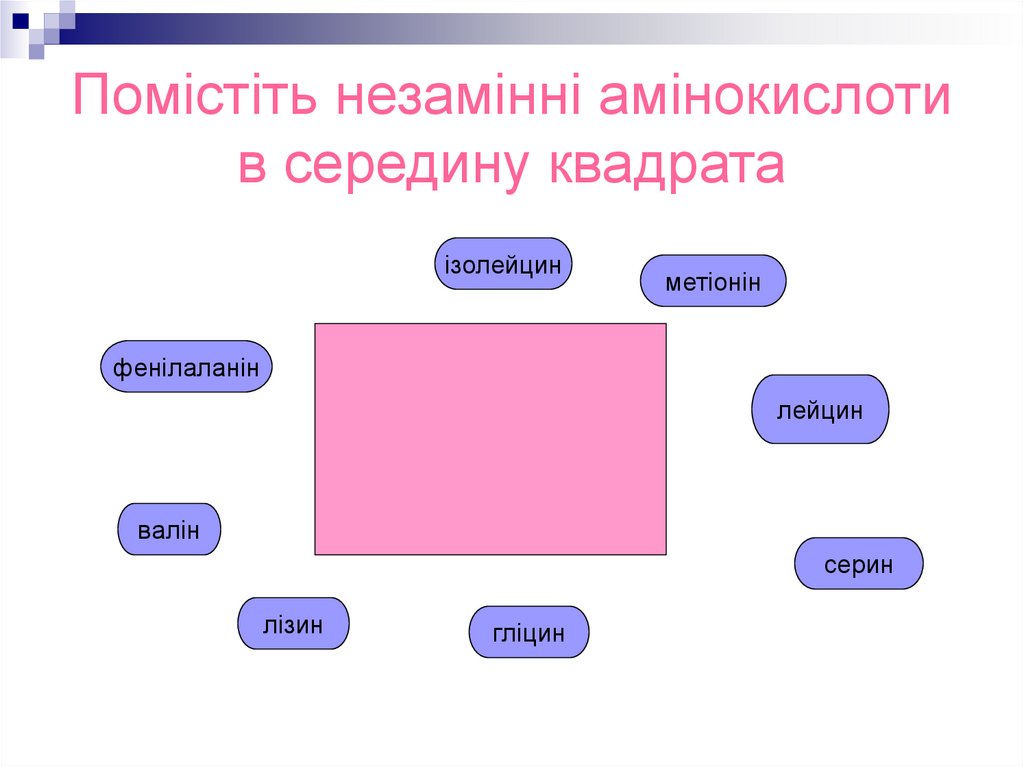
23. Помістіть незамінні амінокислоти в середину квадрата
ізолейцинметіонін
фенілаланін
лейцин
валін
серин
лізин
гліцин
24. Складіть сенкан
АЛГОРИТМ СКЛАДАННЯ СЕНКАНУ:1 РЯДОК – ІМЕННИК
( БІЛОК )
2 РЯДОК – ДВА ПРИКМЕТНИКИ
3 РЯДОК – ТРИ ДІЄСЛОВА
4 РЯДОК – РЕЧЕННЯ ІЗ 4 СЛІВ
5 РЯДОК – ІМЕННИК – СИНОНІМ
(
)
(
)
(
)
(
)
25. Розгляньте малюнок та поясніть, що на ньому зображено
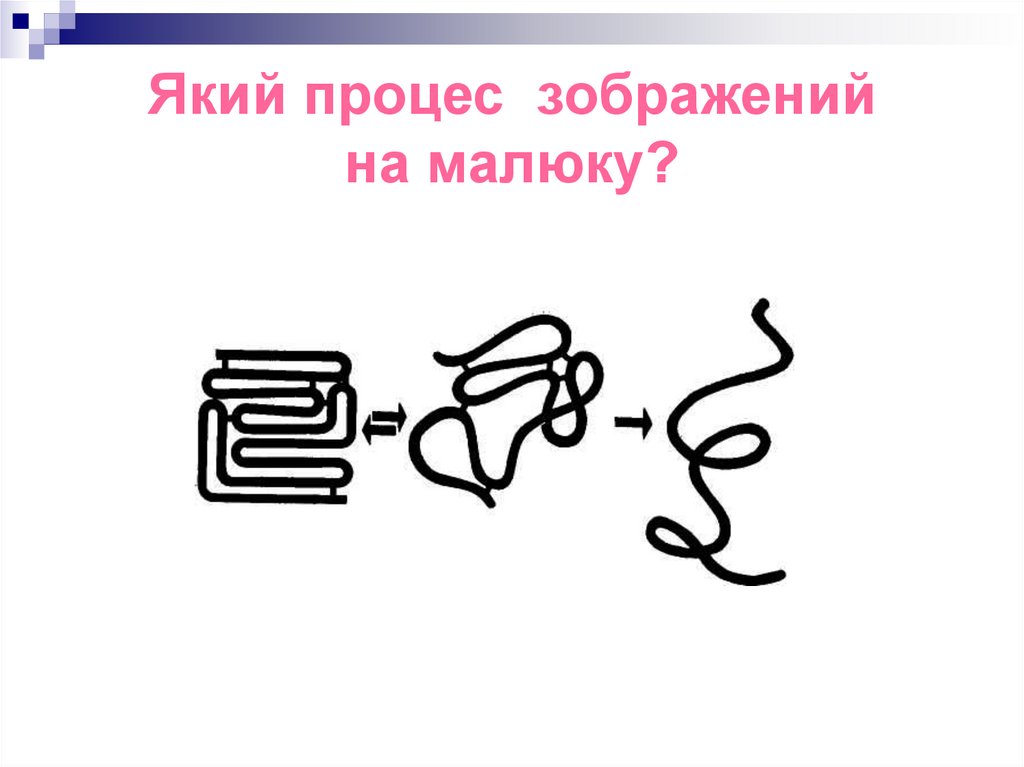
26. Який процес зображений на малюку?
27. Знайдіть пару
28. Гра “ Вірю не вірю”
Кератин формує основу волосся.Фібрин забезпечують м’язове скорочення.
Лізоцим – фермент слини, що може знищувати
бактеріальні клітини.
У горіхах міститься великий вміст білків.
Міозин забезпечує зсідання крові.
Інсулін – це білок.
Козеїн виконує структурну функцію.
Відновлення природної структури білка – це
ренарурація .
Третинна структура білка підтримується
дисульфідними зв’язками.
29. Метод “Мікрофон”
ШВИДКО ПО ЧЕРЗІ ДАЙТЕ ВІДПОВІ НА ЗАПИТАННЯЗАПИТАННЯ:
1. ЩО НАЗИВАЄТЬСЯ БІОПОЛІМЕРОМ?
2. ЩО ТАКЕ БІЛОК?
3. НАЗВІТЬ ГРУПИ АТОМІВ ОДНАКОВІ ДЛЯ УСІХ АМІНОКИСЛОТ?
4. ЯКИМИ ХІМІЧНИМИ З’ЯЗКАМИ ПІДТРИМУЄТЬСЯ ПЕРВИННА ТА
ВТОРИННА СТРУКТУРА БІЛКА?
5. ЯКУ КОНФІГУРАЦІЮ МАЄ ТРЕТИННА СТРУКТУРА БІЛКА?
6. ЩО ТАКЕ ДЕСТРУКЦІЯ ?
7. ЯКУ ФУНКЦІЮ ВИКОНУЄ ІНТЕРФЕРОН?
8. НАЗВІТЬ ТРАНСПОРТНИЙ БІЛОК.
9. СКІЛЬКИ ЕНЕРГІЇ ВИВІЛЬНЯЄТЬСЯ ПРИ РОЗЩЕПЛЕННІ 1Г БІЛКУ?
10. ЯКІ ВИ ЗНАЄТЕ СТРУКТУРНІ БІЛКИ?

















 Биология
Биология