Похожие презентации:
Білки
1. Білки
ПІДГОТУВАЛИ УЧЕНИЦІ 11 УКР. ФІЛ. КЛАСУВІТРЯЧЕНКО Н., ЖУРАВЛЬОВА Д., ЛЕОНТІЄВА І., ГАВАЗА Ю.
2. Вступ:
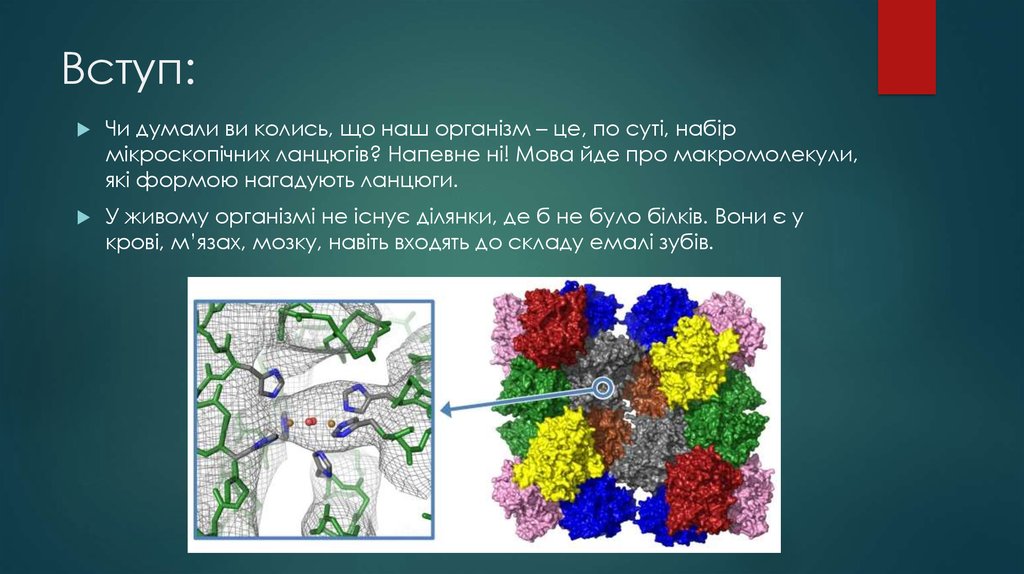
Чи думали ви колись, що наш організм – це, по суті, набірмікроскопічних ланцюгів? Напевне ні! Мова йде про макромолекули,
які формою нагадують ланцюги.
У живому організмі не існує ділянки, де б не було білків. Вони є у
крові, м’язах, мозку, навіть входять до складу емалі зубів.
3. Визначення:
Білки́ — складні високомолекулярні природні органічні речовини, щоскладаються з амінокислот, сполучених пептидними зв'язками.
(Пепти́дний зв'язок — хімічний зв'язок, що виникає між двома молекулами внаслідок реакції
конденсації між карбоксильною групою (-СООН) однієї і аміногрупою (-NH2) іншої, при
цьому виділяється одна молекула води (H2O).)
4. Формула:
5. Класифікація білків:
А. За складом:а) протеїни – прості білки, складаються лише із залишків
амінокислот;
б) протеїди – складні білки, крім залишків амінокислот містять
залишки речовин небілкової природи.
Б. За будовою:
а) глобулярні – молекули шаровидної форми (наприклад, у
яйцях, ікрі, злаках, картоплі, капусті та ін.);
б) фібрилярні – ниткоподібні, волокнисті (кератин шерсті, колаген
й еластин сполучних тканин м’яса).
В. За вмістом амінокислот:
а) повноцінні – містять всі незамінні амінокислоти;
б) неповноцінні – відсутня хоча б одна незамінна амінокислота.
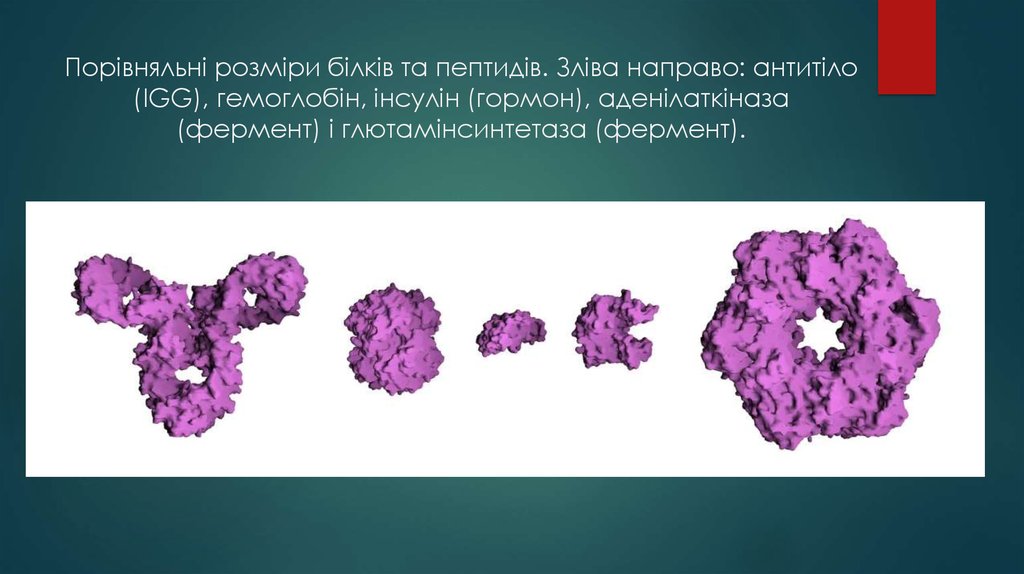
6. Порівняльні розміри білків та пептидів. Зліва направо: антитіло (IGG), гемоглобін, інсулін (гормон), аденілаткіназа (фермент) і глютамінсинтет
Порівняльні розміри білків та пептидів. Зліва направо: антитіло(IGG), гемоглобін, інсулін (гормон), аденілаткіназа
(фермент) і глютамінсинтетаза (фермент).
7. Структури білкової молекули:
Первинна – послідовність амінокислот у лінійномуполіпептидному ланцюзі. Зв’язок пептидний. Визначає
специфіку білків. Якщо хоч одну амінокислоту в гемоглобіні
крові замінити іншою, то виникає захворювання «серповидна
анемія».
Вторинна – просторова конфігурація білкової молекули, що
нагадує спіраль. Зв’язок між витками спіралі водневий СО–
NН.
Третинна – просторове розміщення спіралі зумовлює
функціональну активність білків. Зв’язки: дисульфідні місточки
S–S; естерні місточки СООН–ОН; солеві місточки СООН–NН2;
водневий.
Четвертинна – полімерне утворення білків, мономерами
яких є макромолекули. Наприклад, молекула гемоглобіну
складається з поліпептидних ланцюгів (первинна структура),
скручені у спіраль (вторинна структура), які в свою чергу
згорнуті у клубок (третинна структура) й об’єднані по чотири
(четвертинна структура).
8. Дослідження:
Білки були виділені в окремий клас біологічних молекул в 18 столітті в результаті робітфранцузького хіміка Антуан Франсуа де Фуркруа та інших учених, в яких було
відмічено властивість білків коагулювати при нагріванні або під дією кислот. Проте
вивченню білків перешкоджала складність їхнього виділення. Тому перші дослідження
білків проводилися з використанням тих поліпептидів, які могли бути очищені у великій
кількості, тобто білків крові, курячих яєць, різних токсинів і травних/метаболічних
ферментів, які можна було виділити в місцях забою худоби.
9. Хімічні властивості:
1. Гідроліз білків. Найважливішою властивістю білків єздатність їх до гідролізу. Гідроліз – розпад до амінокислот
під дією ферментів в живих організмах або при нагріванні
з розчинами кислот чи лугів.
2. Денатурація – порушення вторинної, третинної
структури білка під впливом деяких факторів: дії сильних
кислот й лугів, етанолу, солей важких металів, нагрівання,
радіації, механічного впливу тощо.
3. Розклад. При сильному нагріванні (горінні, гнитті)
відбувається повне руйнування білкових молекул й
виділення летких продуктів, які мають запах паленого пір’я.
4. Амфотерність – взаємодія з кислотами й лугами з
утворенням солей.
10. Значення білка в житті людини
Властивості білка залежать і від йогоскладу і від розташування амінокислот в
молекулі. Причому порядок амінокислот
в молекулі білка відіграє дуже важливу
роль у виконанні їхніх функцій. З їжею
обов'язково повинні надходити всі
незамінні амінокислоти, дефіцит хоча б
однієї з них може привести до загибелі
організму, так як кожна з них впливає на
певні його функції. Велике значення білків
не тільки в травленні, але і у всій
життєдіяльності людини. З білків
побудовані ферменти - біологічні
каталізатори, що прискорюють хід
хімічних реакцій, що протікають в
організмі.
11. Дефіцит білка
Білок бере участь у формуванні м'язової тканини, також бере участь убудівництві скелета. Дефіцит кальцію в організмі, спровокований
відмовою від тваринних білків, призводить до порушення ряду
фізіологічних функцій, зокрема знижується розумова і фізична
працездатність, у дітей гальмується утворення кісток, а у дорослих кістки
розсмоктуються.
12. Необхідність білка
Наш організм вимагає певної кількості білка щодня, білок необхідний дляобслуговування і відновлення клітин, в дитячому і юному віці забезпечує зростання
організму, вагітним жінкам потрібний для нормального розвитку плоду. Необхідна
кількість білка залежить від ваги і складає в середньому приблизно 45—50 гр. у день для
жінок і 55—60 гр. для чоловіків.
Вважається, що з м'ясними і молочними продуктами надходить білків більше, ніж з
рослинною їжею. Проте рослинні білки набагато корисніші, ніж тваринні. Непомірне
споживання з їжею тваринних білків може приводити до серцевих патології, підвищити
ризик ракових новоутворень.










 Биология
Биология