Похожие презентации:
Реакции окисления-восстановления в химическом анализе
1.
Реакции окисления-восстановления вхимическом анализе
2.
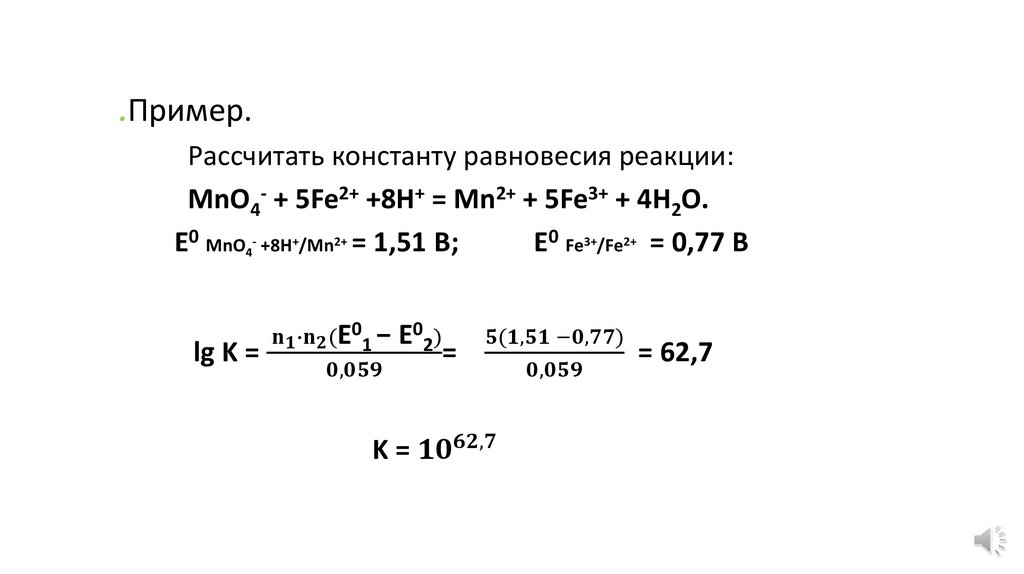
n2Ox1 + n1Red 2 = n2Red 1 + n1Ox2Ox1 + n1e = Red1
Red 2 - n2e = Ox2
Ox1/ Red 1-окислительно-восстановительная пара;
Ox2/ Red 2 - окислительно-восстановительная пара;
Реакция, показывающая изменения, происходящие с
каждым участником реакции, называется полуреакцией.
3.
Возможность протекания окислительно-восстановительной реакцииопределяется химической активностью пары, которая количественно
характеризуется величиной стандартного окислительновосстановительного потенциала Е0Оx/Red
Стандартный окислительно-восстановительный потенциал – это
потенциал окислительно-восстановительной пары, измеренный
относительно стандартного водородного электрода при t0= 250C и
ɑOx = ɑRed = 1 моль/л.
Чем больше значение стандартного окислительновосстановительного потенциала, тем сильнее выражены
окислительные свойства пары.
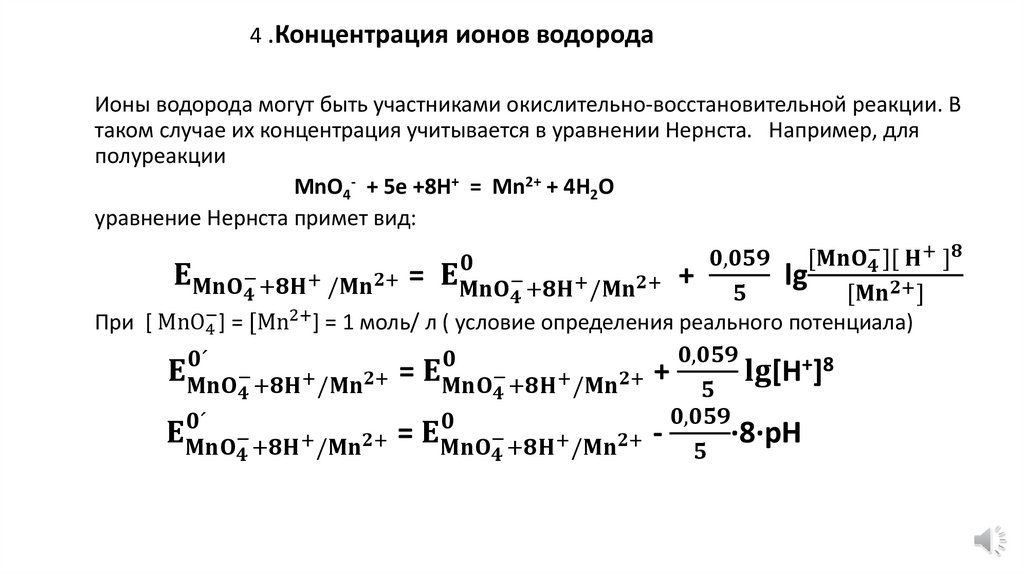
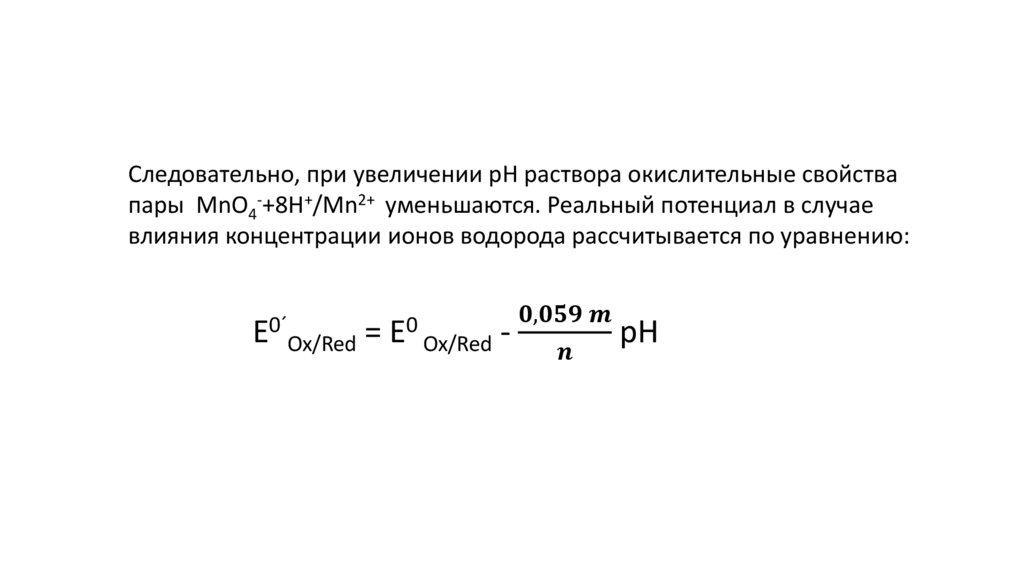
4.
Уравнение НернстаEOx/Red = E0Ox/Red
• E0Ox/Red
В;
• R
• Т
• n
• F






















 Химия
Химия








