Похожие презентации:
Классификация химических реакций
1. Классификация химических реакций
2.
Химическая реакция — это процесс, в результатекоторого из одних веществ (реагентов) образуются
другие вещества, отличающиеся от исходных по
составу и строению, а следовательно, и по свойствам.
3.
Признаками для разделения химическихреакций на группы могут быть:
– изменение числа и состава веществ
в ходе реакции;
– выделение или поглощение теплоты;
– изменение степеней окисления атомов;
– направление протекания реакции.
4.
5. Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями.
1.2.
3.
4.
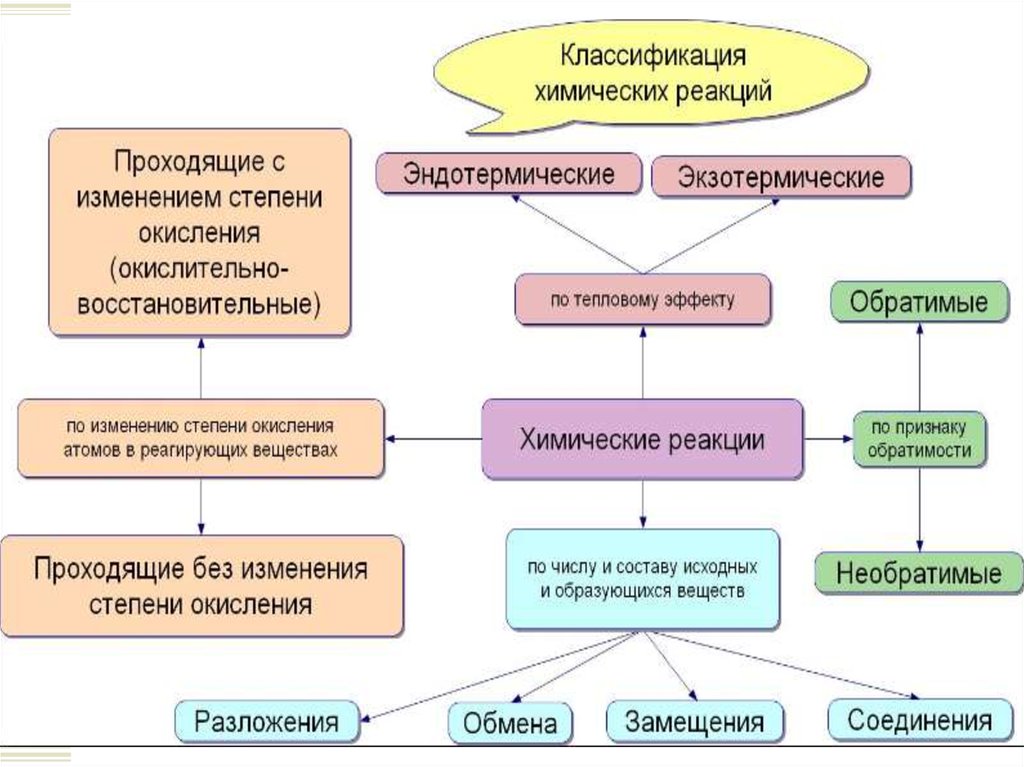
Признаки классификации химических реакций:
Соотношение исходных и конечных веществ.
Наличие окислительно-восстановительного
процесса.
Тепловой эффект.
Обратимость реакции.
6. Классификация по числу и составу реагентов и конечных веществ.
1. Реакции соединенияПри реакциях соединения из нескольких простых или
сложных веществ образуется одно более сложное:
A+B+C=D
Реакции соединения, протекающие между сложными
веществами, могут происходить как без изменения
валентности:
СаО + СО2 → ___________________
так и относиться к числу окислительновосстановительных:
2FеСl2 + Сl2 → _____________
7. Классификация по числу и составу реагентов и конечных веществ.
2. Реакции разложенияРеакции разложения приводят к образованию
нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как
простые, так и сложные вещества.
CaCO3 → ________________________
HgO → __________________________
8. Классификация по числу и составу реагентов и конечных веществ.
3. Реакции замещенияПри реакциях замещения атомы простого вещества
замещают атомы в сложном веществе:
А + ВС = АВ + С.
Эти реакции в подавляющем большинстве принадлежат к
окислительно-восстановительным:
Аl + Fe2O3 → ______________________
Zn + НСl → _______________________
9. Классификация по числу и составу реагентов и конечных веществ.
4. Реакции обменаРеакциями обмена называют реакции между двумя
соединениями, которые обмениваются между собой
своими составными частями:
АВ + СD = АD + СВ.
ZnO + Н2SО4 → _______________________
AgNО3 + КВr → _______________________
Частный случай этих реакций обмена - реакции
нейтрализации:
НСl + КОН → _______________________
10. Классификация реакций по тепловому эффекту.
Знак теплового эффекта разделяет все реакции на:экзотермические реакции, протекающие с экзо-эффектом
- выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом
- поглощением энергии в форме теплоты (Q<0, ∆H >0):
N2 +О2 = 2NО - Q.
Такие реакции относят к термохимическим. По ТХР
производят расчеты.
11. Классификация по наличию окислительно-восстановительного процесса.
Классификация по наличию окислительновосстановительного процесса.К таковым относят реакции, в которых реагирующие
вещества обмениваются электронами, изменяя при этом
степени окисления атомов элементов, входящих в состав
реагирующих веществ.
Zn0+2H+Cl =Zn+2Cl2+H20
Расставьте коэффициенты методом электронного баланса:
Zn + HNO3(конц.) → Zn (NO3)2 + NO2 + H2O
12. Обратимые и необратимые химические реакции.
Обратимыми называют такие химические процессы,продукты которых способны реагировать друг с другом в тех
же условиях, в которых они получены, с образованием
исходных веществ.
А + В АВ.
СН3СООН + С2Н5ОН
СН3СООС2Н5 + Н2О.
Необратимыми называют такие химические процессы,
продукты которых не способны реагировать друг с другом с
образованием исходных веществ. Примерами необратимых
реакций может служить разложение бертолетовой соли при
нагревании:
2КСlО3 → 2КСl + ЗО2↑.











 Химия
Химия








