Похожие презентации:
Кислород. Оксиды. Горение
1.
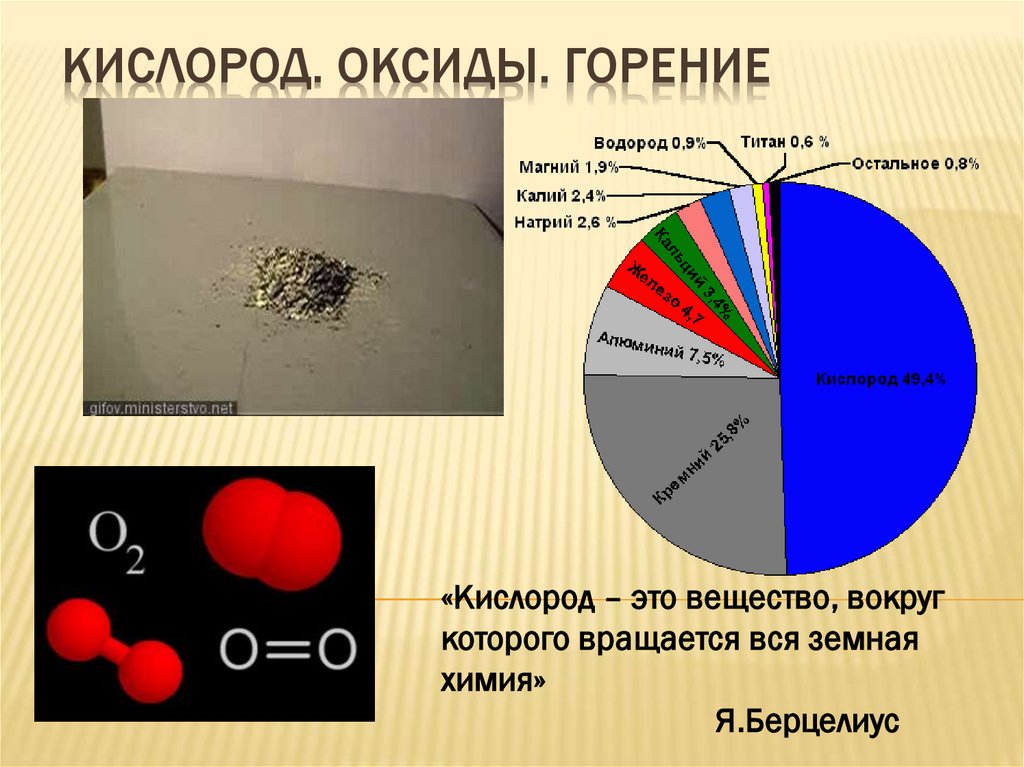
КИСЛОРОД. ОКСИДЫ. ГОРЕНИЕ«Кислород – это вещество, вокруг
которого вращается вся земная
химия»
Я.Берцелиус
2.
УПРАЖНЕНИЕ ДЛЯ САМОКОНТРОЛЯ.1.Из следующего перечня формул веществ выписать
только формулы оксидов:
NaCl, Al2O3, HNO3, KOH, P2 O5, CH4, H2SO4, CO2, Cu
(OH)2, Cl2O7,
Mg(NO3)2, Na2O, H3PO4
2.Составить формулы оксидов :
магния (II), железа (III), серы (IV), бора (III), хрома (VI).
3.Продолжить уравнения реакций : а) Zn + O2→ б) Al
+ O2→ в) H2S + O2→
4.Решить задачу:
Вычислить массу кислорода, прореагировавшего с
медью, если образовалось 40г оксида меди (II).
5.Осуществить превращения
H2O→X→CO2
3.
ПРОВЕРЬ СЕБЯ!1. Al2O3, P2 O5, CO2, Cl2O7, Na2O.
2. MgO, Fe2O3 ,SO2 ,B2O3,Cr O3.
3. a)2Zn+02 → 2Zn0,
б)4Al +302 → 2Al2O3
в)2H2S +3O2 → 2H20 +2SO2
4. 8г 02
5.2H2O → 2H2+O2
O2+C → CO2
4.
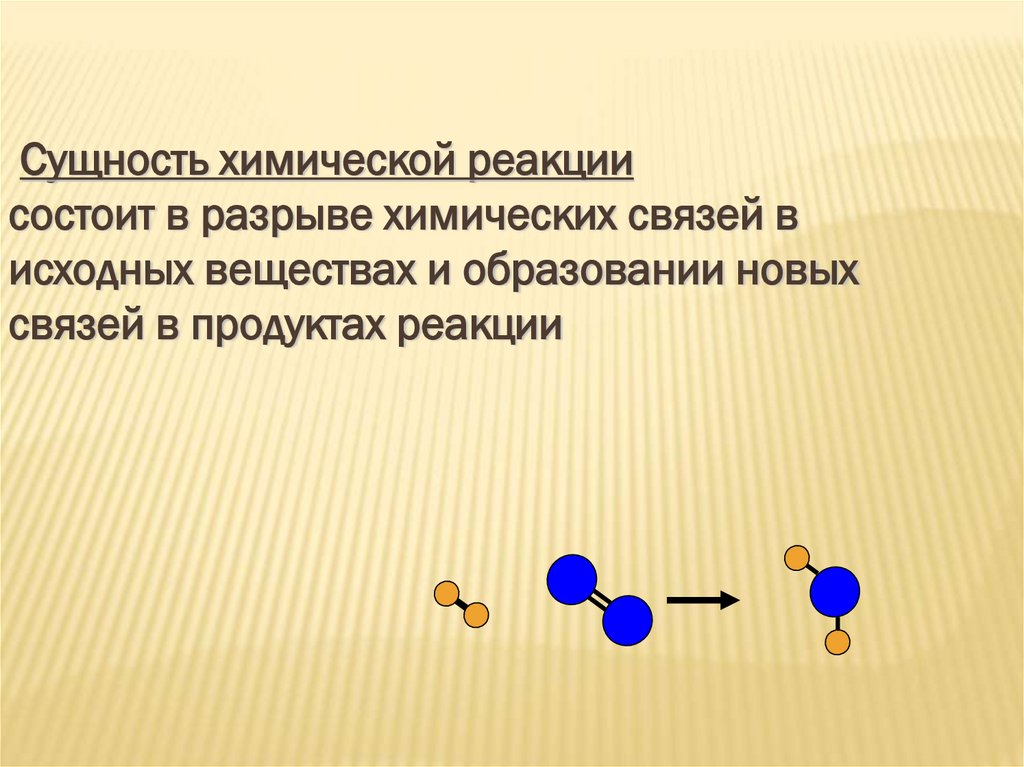
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ5.
Сущность химической реакциисостоит в разрыве химических связей в
исходных веществах и образовании новых
связей в продуктах реакции
6.
Разница между внутренней энергиейисходных веществ и продуктов реакции
выделяется в окружающую среду или
поглощается из нее.
Q = Eисх. - Eпрод.
7.
ПРИЧИНА ТЕПЛОВОГО ЭФФЕКТА– Разница между внутренней энергией
продуктов реакции и внутренней энергией
исходных веществ.
E исх. > E прод.
E исх. < E прод.
Q = Eисх. - Eпрод.
Q = Eисх. - Eпрод.
Q>0
Q<0
8.
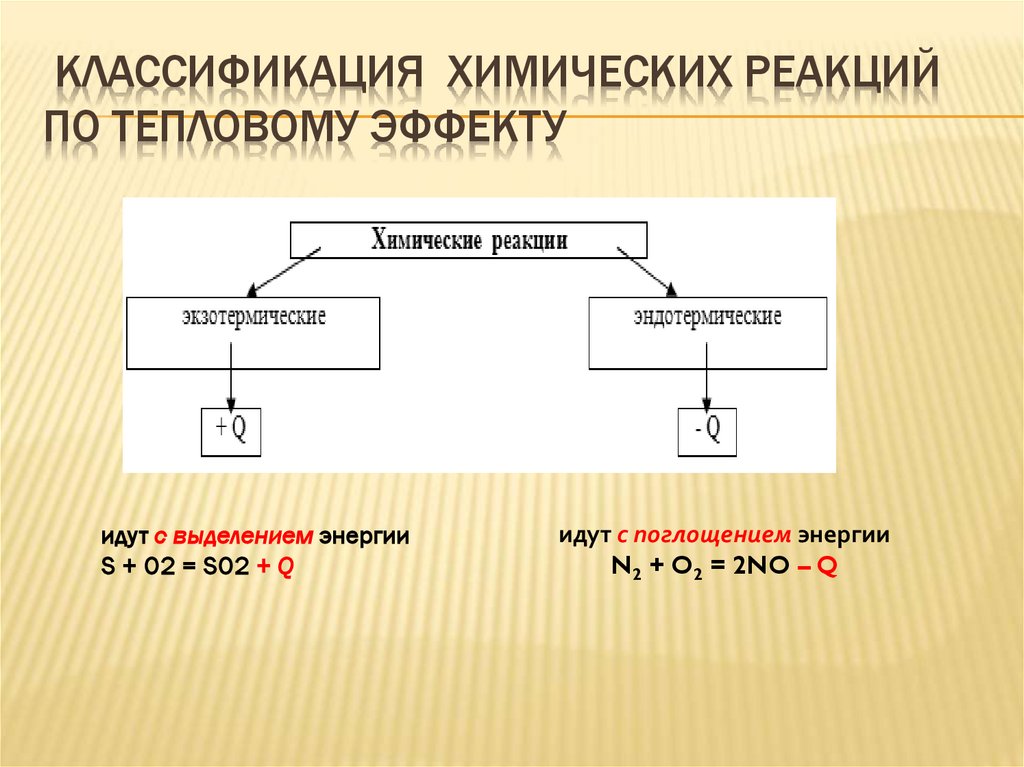
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙПО ТЕПЛОВОМУ ЭФФЕКТУ
идут с выделением энергии
S + O2 = SO2 + Q
идут с поглощением энергии
N2 + O2 = 2NO – Q
9.
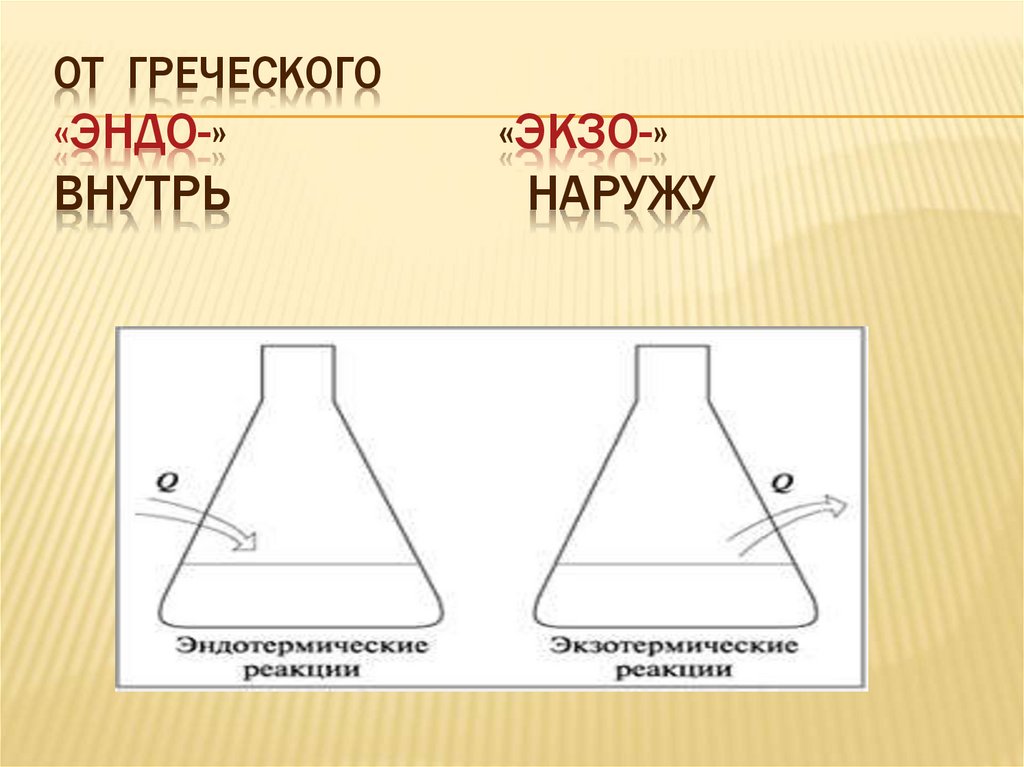
ОТ ГРЕЧЕСКОГО«ЭНДО-»
ВНУТРЬ
«ЭКЗО-»
НАРУЖУ
10.
ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ- это уравнение химической реакции, в
котором указан тепловой эффект в кДж.
2Н2 (г) + О2(г) → 2Н2О(ж) + 484 кДж
Тепловой эффект – это сумма энергии,
затраченной на разрыв химических связей и
энергии, которая выделяется при их
образовании.
11.
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПОТЕРМОХИМИЧЕСКИМ УРАВНЕНИЯМ РЕАКЦИЙ.
а) Прочитать внимательно задачу.
б) Составить термохимическое уравнение.
в) Перенести данные из условия в уравнение.
г) Найти по уравнению массу или количество
вещества.
д) Составить и решить пропорцию.
е) Записать ответ.
12.
Задача 1.Определите количество теплоты, которое выделится при образовании 120 г MgO врезультате реакции горения магния, с помощью термохимического уравнения.
2 Mg + O2 = 2MgO + 1204 кДж
Дано
m (Mg0) = 120г
Найти:
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества
вещества через массу.
n=m/M
n(MgO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моль MgO - 1204 кДж
По условию
3 моль MgO - Q1
Отсюда
3 моль* 1204кДж
Q1=----------------------------------------------= 1803 кДж
2моль
Ответ: при образовании 120г оксида магния выделится 1803 кДж энергии.
13.
РЕШИТЕ САМОСТОЯТЕЛЬНОЗадача :
По термохимическому уравнению реакции
H2+Cl2 →2HCl+ 184 кДж.
Определите, сколько теплоты выделится при
сгорании 4 граммов водорода в хлоре
Ответ:368 кДж
14.
Задача 2. В результате реакции, термохимическое уравнение которой2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось 652,5 кДж теплоты.
Определите массу сгоревшего ацетилена.
Дано:
Q1 = 652,5 кДж
Найти:
m(C2H2)-?
Решение:
Установим пропорциональные отношения между
количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2_---------- 2610 кДж
По условию
х моль
---------- 652,5
Решаем пропорцию
2 моль* 652,5кДж
х=--------------------------------------= 0,5 моль
2610 кДж
2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г.
Ответ: масса сгоревшего ацетилена 13 г.
15.
РЕШИТЕ САМОСТОЯТЕЛЬНОВычислите массу разложившегося мела
(CaCO3) , если известно , что на его
разложение затрачено 1570 кДж
Хг
CaCO3 → CaO + CO2
- 157 кДж
Ответ:разложилось 1000 грамм мела
16.
Задача 3. В результате горения 48 г метана выделилось 2406 кДж теплоты.Составьте термохимическое уравнение этой реакции.
Дано:
m(CH4)= 48г
Q1 = 2406 кДж
Найти:
Q -?
Решение:
1. Запишем уравнение реакции горения метана в общем виде
CH4+ 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
n=m/M
n(CH4) = 48г/ 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию
3моль CH4 - 2406 кДж
По уравнению
1 моль CH4 - Q
Решаем пропорцию
1 моль* 2406 кДж
х=--------------------------------= 802 кДж
3 моль
Ответ: термохимическое уравнение реакции горения метана
CH4+ 2O2 = CO2 +2H2O + 802 кДж
17.
РЕШИТЕ САМОСТОЯТЕЛЬНОПри сжигании 26 г. ацетилена выделилось
1299,2 кДж теплоты. Найдите тепловой
эффект реакции.
2С2H2+5O2 → 4CO2 + 2H2O + Q
Ответ: 2С2H2+5O2 → 4CO2 + 2H2O+2598,4 кДж
18.
РЕФЛЕКСИЯЧто происходит с энергией при химических реакциях?
Что происходит с энергией при разрыве химических связей?
Что происходит с энергией при образовании химических связей?
Что мы можем наблюдать при выделении энергии (теплоты)?
Как называются реакции, идущие с выделением теплоты?
Что мы можем наблюдать при поглощении энергии (теплоты)?
Как называются реакции, идущие с поглощением теплоты?
Как называется теплота (энергия) образующаяся при химических
реакциях?
Как записать в уравнение химической реакции выделяющуюся
теплоту? Поглощающуюся теплоту?
Для чего необходимо знать тепловой эффект химической реакции?
19.
V. ПОДВЕДЕНИЕ ИТОГОВ УРОКА. ДОМАШНЕЕЗАДАНИЕ.
§23 , вопросы 11-13 (устно),
задачи 1, 2 на стр.69.















 Химия
Химия








