Похожие презентации:
Фенолы. Историческая справка
1. ФЕНОЛЫ
2. Историческая справка
В 1834г. немецкий химикорганик ФридлибФердинанд Рунге
обнаружил в продуктах
перегонки
каменноугольной смолы
белое кристаллическое
вещество с характерным
запахом,но ему не
удалось определить
состав вещества.
3.
Шарль Фридерик Жерарсчитал полученное
вещество спиртом и
предложил называть
его фенолом. Затем
было установлено, что
целая группа веществ
обладает подобным
строением и
свойствами, поэтому
их назвали "фенолами".
4. Молекулярная формула первого
• представителя данного класса:C6H5OH – фенол.
Другое название –
карболовая кислота.
5. ФИЗИЧЕСКИЕ СВОЙСТВА ФЕНОЛА
1)Бесцветное кристаллическое вещество2)Легкоплавкость
3)Резкий характерный запах
4)Очень ядовит
5)При попадании на кожу вызывает сильный ожог
6)При комнатной температуре малораств.в воде (чем
больше температура, тем больше растворимость)
Раньше его использовали как дез.средство.
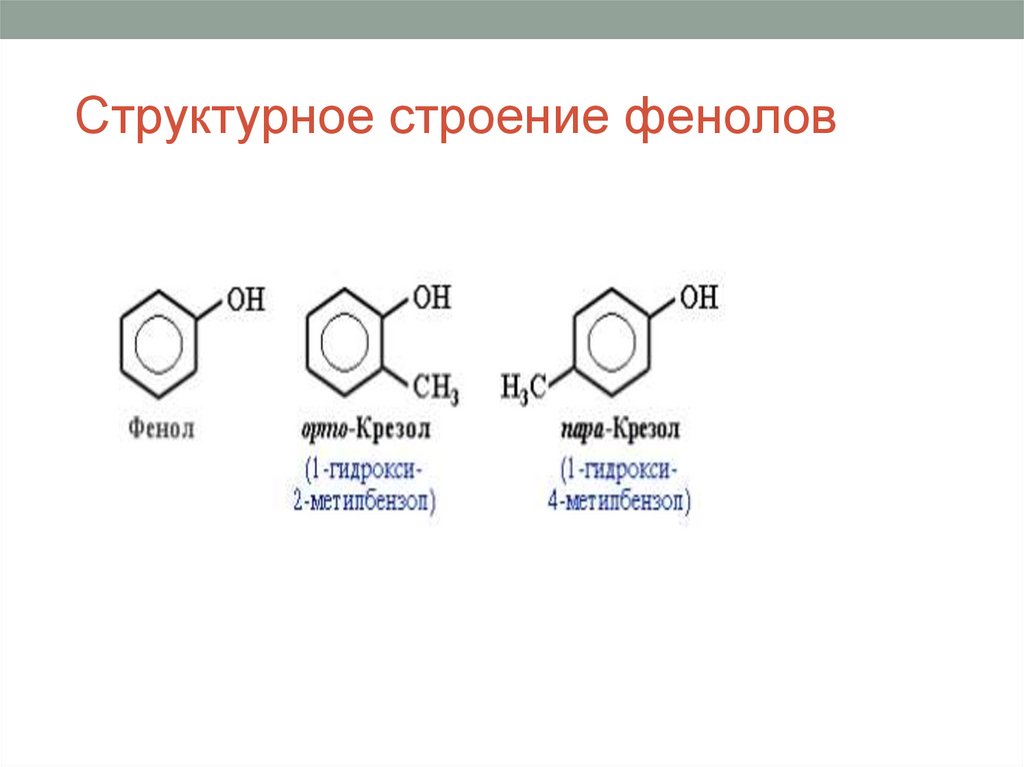
6. Структурное строение фенолов
7. Почему «ФЕНОЛ?»
•ароматический радикал фенил С6Н5-•непосредственно связан с
гидроксильной группой -ОН
•называют фенолами.
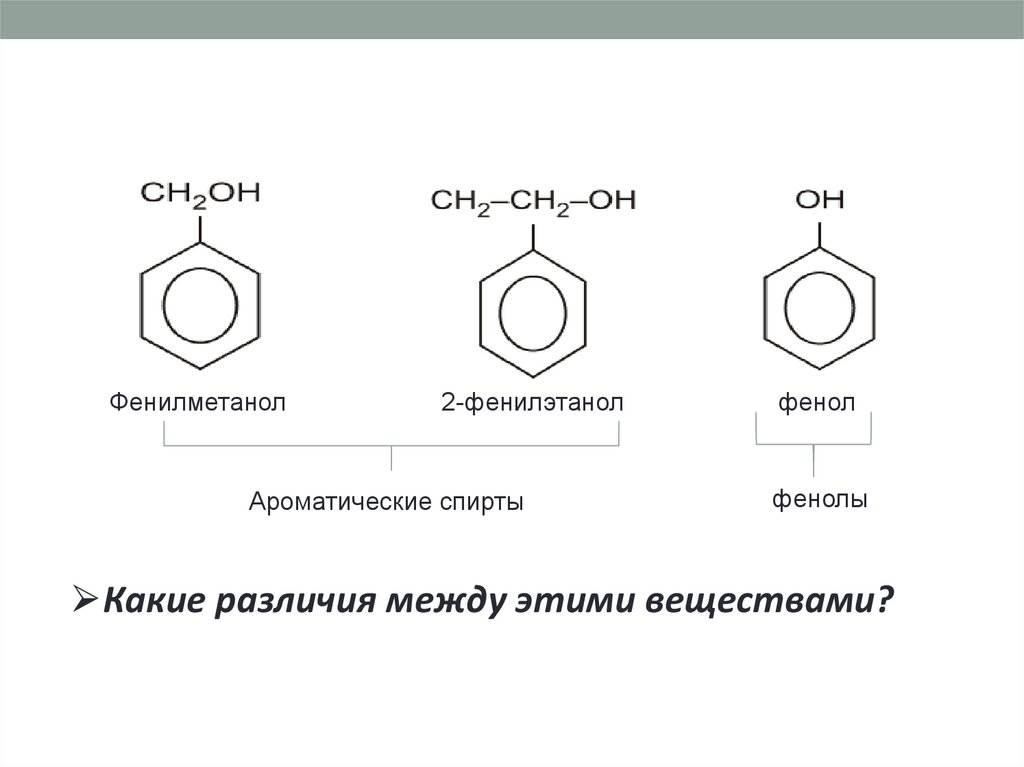
8.
Фенилметанол2-фенилэтанол
Ароматические спирты
фенол
фенолы
⮚Какие различия между этими веществами?
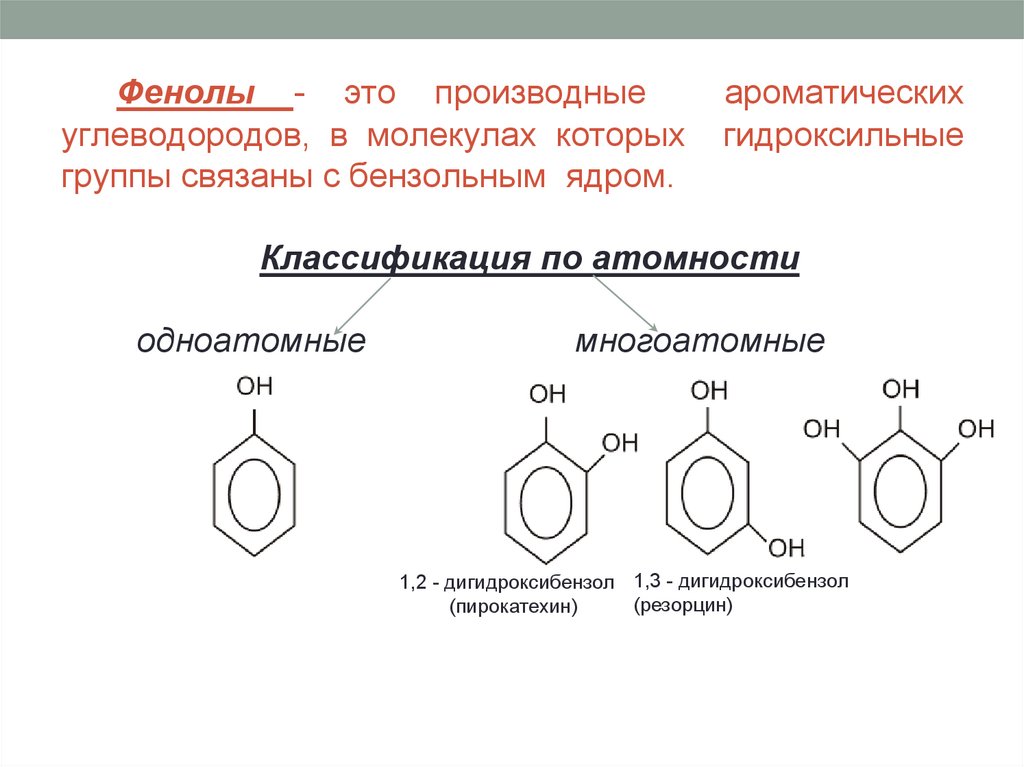
9.
Фенолы - это производныеуглеводородов, в молекулах которых
группы связаны с бензольным ядром.
ароматических
гидроксильные
Классификация по атомности
одноатомные
многоатомные
1,2 - дигидроксибензол 1,3 - дигидроксибензол
(резорцин)
(пирокатехин)
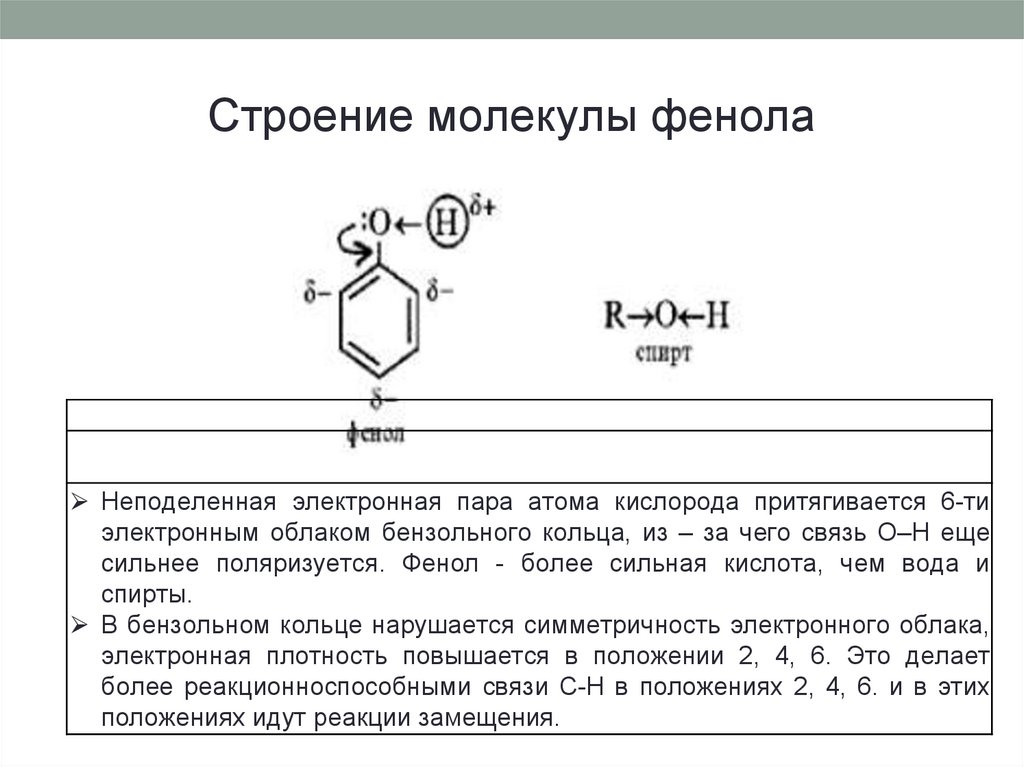
10. Строение молекулы фенола
⮚ Неподеленная электронная пара атома кислорода притягивается 6-тиэлектронным облаком бензольного кольца, из – за чего связь О–Н еще
сильнее поляризуется. Фенол - более сильная кислота, чем вода и
спирты.
⮚ В бензольном кольце нарушается симметричность электронного облака,
электронная плотность повышается в положении 2, 4, 6. Это делает
более реакционноспособными связи С-Н в положениях 2, 4, 6. и в этих
положениях идут реакции замещения.
11.
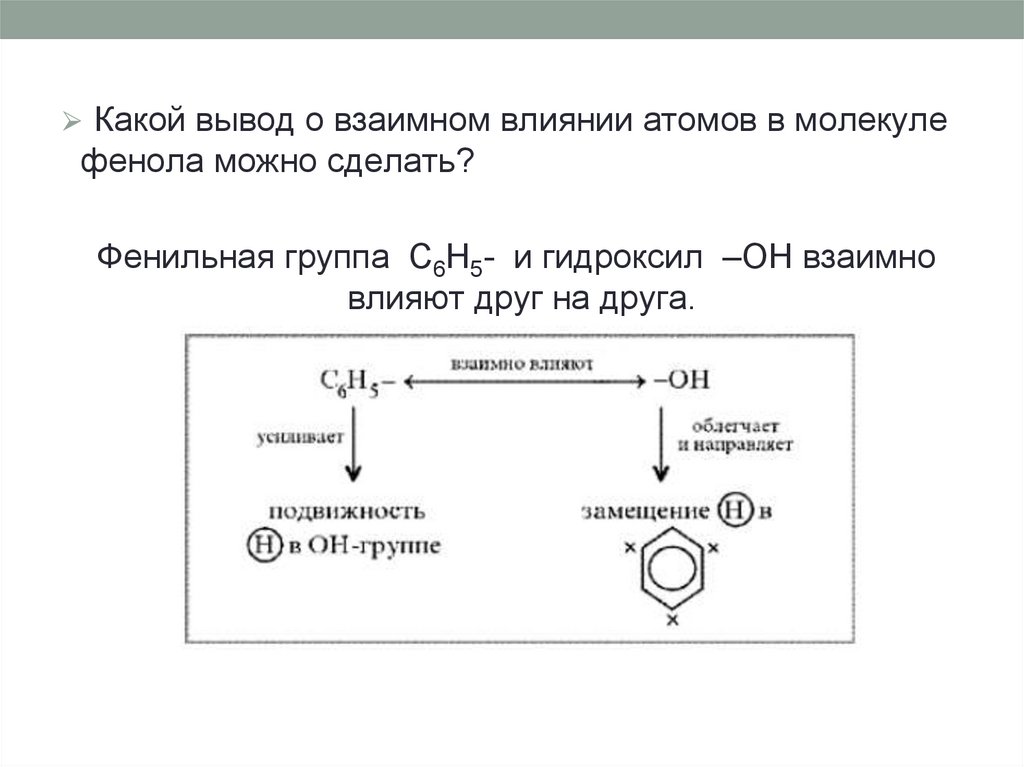
⮚ Какой вывод о взаимном влиянии атомов в молекулефенола можно сделать?
Фенильная группа C6H5- и гидроксил –OH взаимно
влияют друг на друга.
12. Химические свойства фенола
I) Кислотные свойства фенола: замещение атомаводорода в гидроксильной группе.
а)Взаимодействие с активными металлами
2C6H5OH + 2Na
2C6H5ONa + H2
б) Взаимодействие со щелочами
C6H5OH + NaOH
C6H5ONa + H2O
Кислотные свойства у фенолов выражены слабее,
чем у неорганических и карбоновых кислот, но сильнее
чем у спиртов.
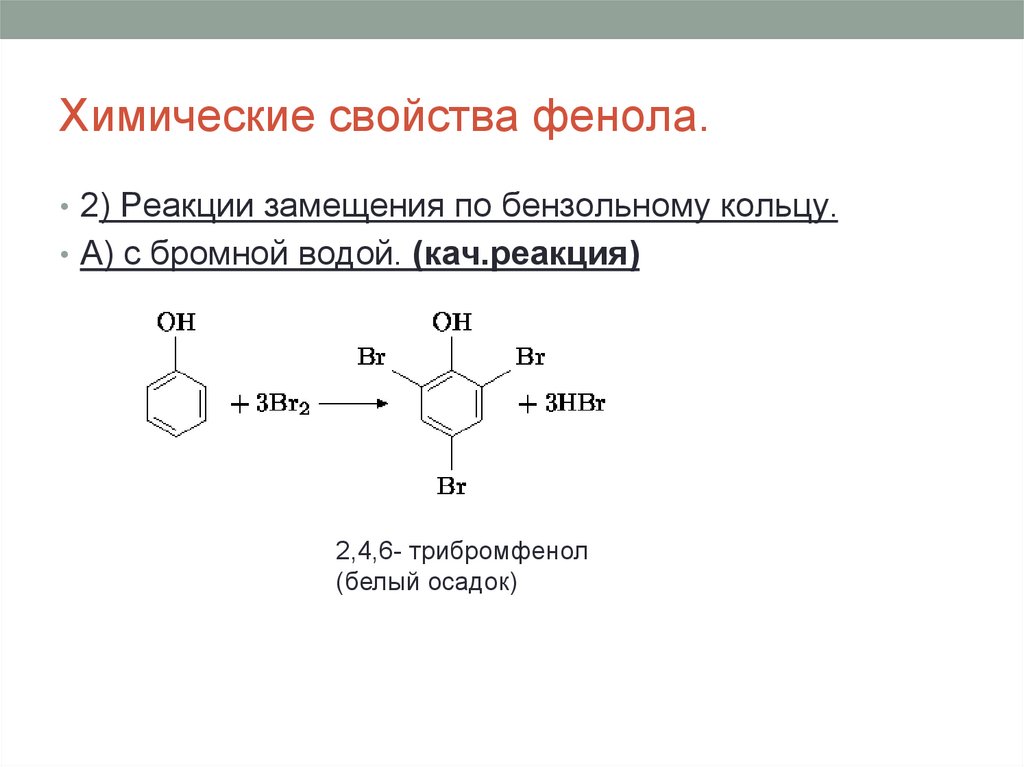
13. Химические свойства фенола.
• 2) Реакции замещения по бензольному кольцу.• А) с бромной водой. (кач.реакция)
2,4,6- трибромфенол
(белый осадок)
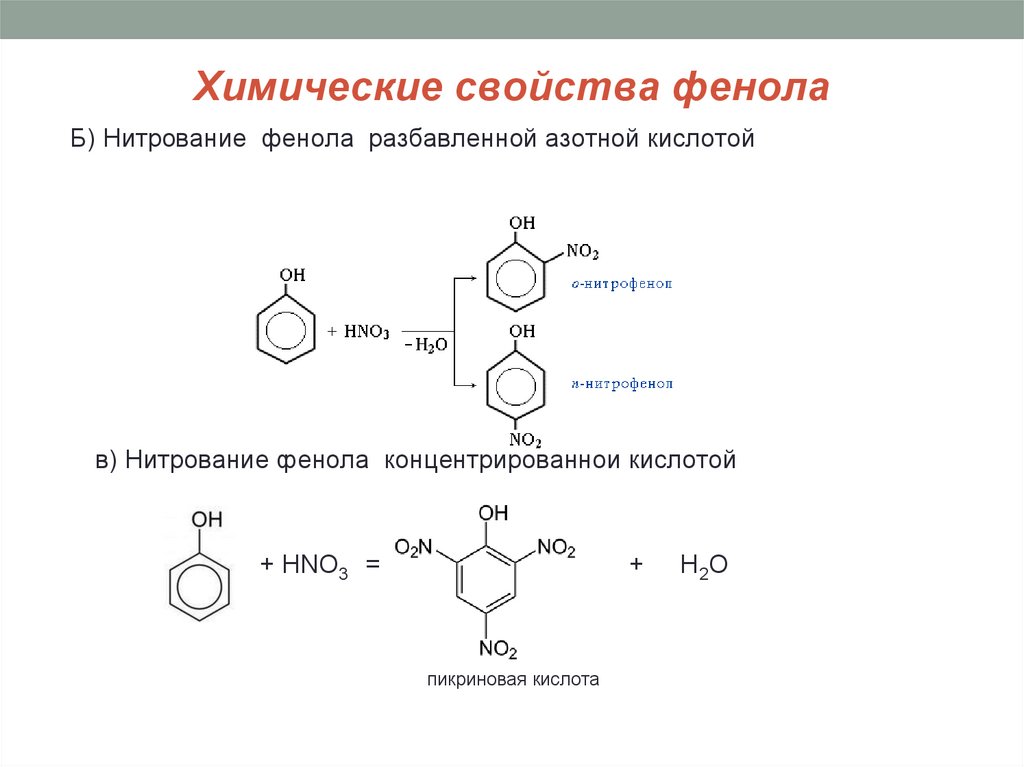
14. Химические свойства фенола
Б) Нитрование фенола разбавленной азотной кислотойв) Нитрование фенола концентрированной кислотой
+ HNO3 =
+
пикриновая кислота
H 2O
15. Химические свойства фенола.
• 3) Качественная реакция на фенол.3С6Н5ОН + FeCl3 —> (С6Н5О)3Fe + 3 НCl
фенол
фенолят
железа
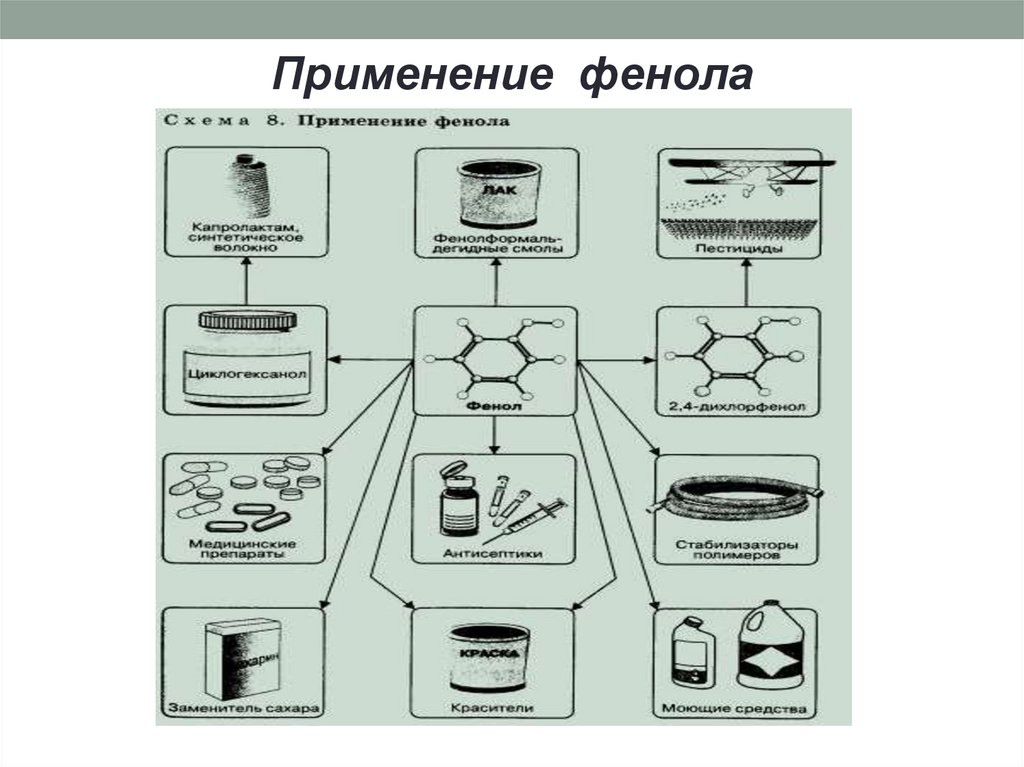
16. Применение фенола
17. Биологическая роль соединений фенола
Положительная∙
лекарственные препараты (пурген,
парацетамол)
Отрицательная (токсическое действие)
∙
∙
∙
∙
∙
антисептики (3-5 % раствор – карболовая
кислота)
эфирные масла (обладают сильными
бактерицидными и противовирусными
свойствами, стимулируют иммунную
систему, повышают артериальное
давление: - анетол в укропе, фенхеле,
анисе - карвакрол и тимол в чабреце эвгенол в гвоздике, базилике
Флавоноиды (способствуют удалению
радиоактивных элементов из организма)
∙
фенолформальдегидные смолы
пестициды, гербициды, инсектициды
загрязнение вод фенольными отходами









 Химия
Химия








