Похожие презентации:
Коррозия металлов и сплавов. Методы защиты металлов от коррозии
1.
ТЕМА 9: КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ.МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Рассматриваемые вопросы:
1. Основные виды и типы коррозии.
2. Химическая коррозия металлов.
3. Электрохимическая коррозия металлов.
4. Методы защиты металлов от коррозии
1
2.
1. Основные виды и типы коррозииКоррозия – самопроизвольный процесс разрушения
металлов под действием окружающей среды.
3 признака коррозии:
1) окислительно-восстановительный процесс.
2)
самопроизвольный
процесс,
возникающий
из-за
неустойчивости
термодинамической
системы
металл – компоненты окружающей среды.
3) развивается в основном на поверхности металла, однако
может проникнуть и вглубь металла.
2
3.
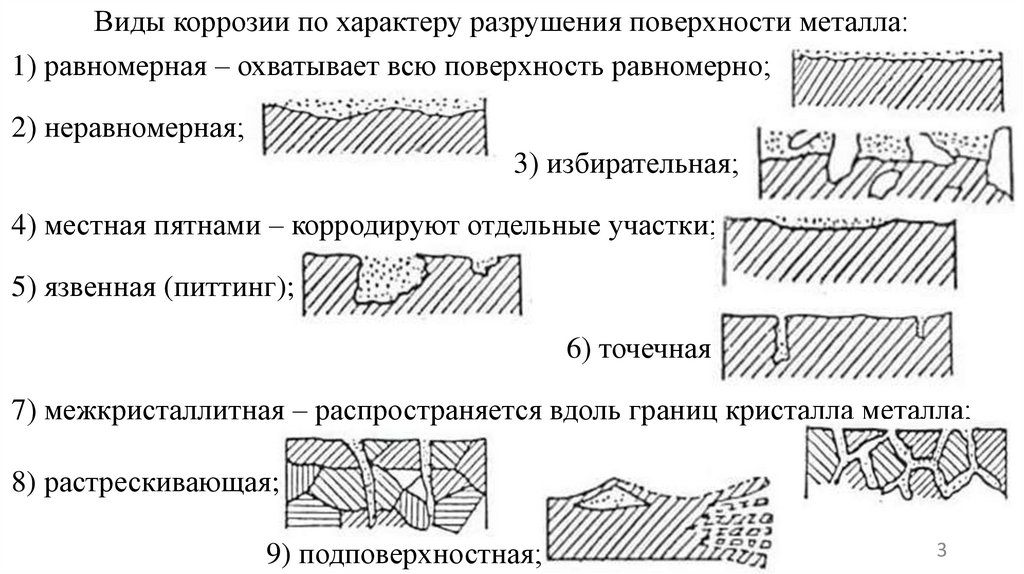
Виды коррозии по характеру разрушения поверхности металла:1) равномерная – охватывает всю поверхность равномерно;
2) неравномерная;
3) избирательная;
4) местная пятнами – корродируют отдельные участки;
5) язвенная (питтинг);
6) точечная;
7) межкристаллитная – распространяется вдоль границ кристалла металла;
8) растрескивающая;
9) подповерхностная;
3
4.
Виды коррозии по условиям протекания:1) атмосферная – связана с разрушением металлов в атмосфере
воздуха;
2) газовая – разрушение металла под воздействием газов при высоких
температурах;
3) жидкостная – коррозия металла в жидкой среде протекающая в
среде: электролитов и неэлектролитов;
4) почвенная – коррозия металла в грунтах и почвах;
5) биокоррозия – связана с разрушением под влиянием живых
микроорганизмов;
6) структурная – связана с неоднородностью структуры металлов;
7) коррозия блуждающими токами – электрохимическое разрушение
под воздействием блуждающих токов;
4
5.
8) внешним током – электрохимическое разрушение металла под влияниемтока от внешнего источника;
9) контактная коррозия – возникает при контакте разнородных металлов в
среде электролита;
10) щелевая коррозия – коррозионное разрушение в зазорах и щелях в
металле;
11) коррозия под напряжением – разрушение металла при одновременном
воздействии агрессивной среды и механических напряжений;
12) кавитация – разрушение металла при одновременном воздействии
ударного воздействия внешней среды и коррозионного процесса;
13) фреттинг-коррозия – возникает при колебательных перемещениях двух
поверхностей относительно друг друга в условиях коррозионной среды;
14) коррозия при трении (коррозионная эрозия) – происходит при
одновременном воздействии на металл трения и коррозионной среды
5
6.
Классификация по механизму коррозионного процесса:1) химическая;
2) электрохимическая.
Потери, связанные с коррозией.
1) Прямые:
а) стоимость потери деталей;
б) стоимость лакокрасочных материалов;
в) стоимость протекторных сплавов;
2) Косвенные:
а) простой оборудования;
б) потери готовой продукции;
в) потери мощности;
г) порча продуктов питания;
д) увеличение массы механизмов.
6
7.
Основные отрасли производства, страдающие от коррозионных потерь:1) военная техника;
2) сельское хозяйство;
3) коммунальные службы;
4) промышленность.
7
8.
2. Химическая коррозия металловХимическая коррозия – окисление металла в среде неэлектролита, не
проводящей электрический ток (газы, жидкие неэлектролиты). При этом
процессы окисления и восстановления не разделены друг от друга в
пространстве.
Виды химической коррозии:
1) Газовая коррозия – протекает в среде агрессивных газов (кислород,
диоксид серы, сероводород, пары воды, галогены) или паровых сред при
высоких температурах, при отсутствии конденсации влаги на поверхности
металла (ДВС, ракетные двигатели, топки печей). Приводит к полному
разрушению активного металла или на поверхности металла может
образоваться защитная пленка (алюминий, хром, цирконий).
Газовой коррозии подвергаются углеродистые стали, чугуны, которые
теряют прочность, твердость. При этом образовывается окалина – смесь
оксидов железа: Fe + O2 → FeO + Fe2O3 + Fe3O4
8
9.
2) Жидкостная коррозия – протекает в металлических резервуарах, вкоторых хранятся органические жидкости, являющиеся неэлектролитами,
(нефть, смазочные масла, керосин). При наличии даже небольшого
количества влаги коррозия может легко приобрести электрохимический
характер.
При
химической
коррозии
скорость
разрушения
металла
пропорциональна скорости химической реакции и скорости с которой
окислитель проникает сквозь пленку оксида металла, покрывающую его
поверхность. Оксидные пленки металлов могут проявлять или не
проявлять защитные свойства, что определяется сплошностью.
9
10.
3. Электрохимическая коррозия металловЭлектрохимическая коррозия – процесс разрушения металла в
среде электролита, сопровождающийся возникновением внутри
системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической
решетки в результате двух сопряженных процессов:
Анодного – металл в виде ионов переходит в раствор.
Катодного – образовавшиеся при анодном процессе электроны,
связываются деполяризатором (вещество – окислитель).
Процессы протекающие на катоде.
Деполяризация – процесс отвода электронов с катодных участков.
Распространены 2 вида деполяризации: водородная и
кислородная.
10
11.
1) Водородная деполяризацияВодородная
деполяризация
протекает
на
катоде
при
электрохимической коррозии в средах: кислой, нейтральной в
отсутствии кислорода:
а) 2H+ + 2ē = H2 (в кислых средах);
б) 2H2O + 2ē = H2 + 2OH– (в нейтральных средах).
2) Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при
электрохимической коррозии в средах: кислой и нейтральной в
присутствии кислорода:
а) O2 + 4H+ + 4ē = 2H2O (в кислых средах);
б) O2 + 2H2O + 4ē = 4OH– (в нейтральных средах).
11
12.
Процессы протекающие на аноде.На аноде происходит процесс растворения металла и переход его ионов в
раствор электролита:
Me0 – nē = Men+
Все металлы, по отношению к электрохимической коррозии, делятся на 4
группы, определяемые величинами стандартных электродных потенциалов:
1) Активные металлы (от щелочных металлов до Cd). Коррозия возможна в
нейтральных водных средах, в которых отсутствуют кислород или другие
окислители.
2) Металлы средней активности (от Cd до H2). В нейтральных средах, в
отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых
средах.
3) Малоактивные металлы (от H2 до Rh). Устойчивы к коррозии в
нейтральных и кислых средах, в отсутствии кислорода и других окислителей.
4) Благородные металлы (Au, Pt, Ir, Pd). Подвергатюся коррозии лишь в
кислых средах при наличии в них сильных окислителей.
12
13.
Виды электрохимической коррозииВ зависимости от характера среды выделяют виды
электрохимической коррозии:
1) Коррозия в растворах электролитов – в растворах кислот,
оснований, солей, в природной воде.
2) Атмосферная коррозия – в атмосферных условиях и в среде
любого влажного газа (самый распространенный вид коррозии).
Например, при взаимодействии железа с компонентами
окружающей среды, некоторые его участки служат анодом, где
происходит окисление железа, а другие – катодом, где происходит
восстановление кислорода:
А: Fe – 2ē = Fe2+
K: O2 + 4H+ + 4 ē = 2H2O
Катодом является та поверхность, где больше приток кислорода. 13
14.
4. Методы защиты металлов от коррозииСпособы защиты от коррозии металлов – создание защитных
покрытий – металлических, неметаллических или химических.
1) Металлические покрытия: наносятся на металл, который
нужно защитить от коррозии, слоем другого металла, устойчивого к
коррозии в тех же условиях. Выделяют 2 вида покрытий: анодное и
катодное.
Анодное покрытие: покрытие изготовлено из металла с более
отрицательным потенциалом, чем защищаемый металл.
Катодное покрытие: покрытие изготовлено из металла с более
положительным потенциалом, чем защищаемый металл.
14
15.
Пример: Коррозия оцинкованного железа в кислой среде (HCl).φ0Zn2+/Zn = – 0,76 В, φ0Fe2+/Fe = – 0,44 В, следовательно цинковое
покрытие выступает в качестве анода.
Схема коррозионного гальванического элемента:
(–) Zn │ НСl │ Fe (+).
На аноде протекает процесс окисления, а на катоде – процесс
восстановления (водородная деполяризация):
Продуктом коррозии является соль – хлорид цинка (II) – ZnСl2.
15
16.
Катодным покрытием для защиты Fe, может быть Cu или Ni. Принарушении целостности покрытия, разрушается защищаемый металл.
Пример: Коррозия луженого железа (покрытого Sn) в кислой среде HCl.
φ0Sn2+/Sn = – 0,14 В, φ0Fe2+/Fe = – 0,44 В, следовательно железная деталь
выступает в качестве анода.
Схема коррозионного гальванического элемента:
(–) Fe │ НСl │ Sn (+).
На аноде протекает процесс окисления, а на катоде – процесс
восстановления (водородная деполяризация):
Продуктом коррозии является соль – хлорид железа (II) – FeСl2.
16
17.
Электрохимическая защитаЭлектрохимическая защита подразделяется на катодную и
анодную защиту. Катодная защита подразделяется на защиту
1) внешним током;
2) протекторную защиту.
Механизм защиты внешним током сводится к тому, что за счет
внешней катодной поляризации защищаемому металлу навязывают
потенциал, при котором его коррозия замедляется. Защищаемую
конструкцию подсоединяют к отрицательному полюсу внешнего
источника постоянного тока, а к положительному полюсу –
металлический электрод (отрезок стальной трубы, рельсы
17
18.
Протекторная защита: к защищаемой конструкции подсоединяютметалл или сплав, φ0 которого более электроотрицателен, чем φ0 металла
защищаемой конструкции. В качестве протекторов обычно используют Zn
или сплавы Zn с Al, сплавы на основе Mg. Протекторы применяют для
защиты металлических конструкций от коррозии в морской воде, других
нейтральных коррозионных средах, а также в почве.
Например: защита стального корпуса корабля от коррозии в морской воде,
содержащей NaCl, с помощью цинкового протектора.
Схема коррозионного микроэлемента:
(–) Zn | NaCl + H2O | Fe (+).
Реакции на электродах:
Анод Zn : Zn0 – 2ē = Zn2+ .
Катод Fe: 2H2O + O2 + 4ē = 4OH–.
Анодная защита внешним током используется только для особых случаев.
18
19.
Неметаллические покрытияПокрытия: неорганические (цементный раствор, стекловидная масса)
органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
Защищаемый металл подвергают химической обработке с целью
образования на поверхности пленки его соединения, устойчивой к
коррозии:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2,
Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с
органическими веществами;
цементация – получение на поверхности металла его соединения с
углеродом.
19
20.
Изменение состава технического металла и коррозионной средыИзменение состава технического металла: в металл вводят такие
соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды: введение ингибиторов
коррозии или удаление примесей из окружающей среды.
20



















 Химия
Химия








